- 7. Basler Demenzforum 2019
Zum 7. Mal fand Mitte November 2019 das Basler Demenzforum statt. Diese Fortbildungsplattform zog zum wiederholten Male zahlreiche Fachleute an, die sich zum Stand der Forschung in Diagnostik und Therapie informieren wollten. Auf unterhaltsame Weise brachte das«Hirntheater» den inte-ressierten Teilnehmern die Thematik der Differenzialdiagnosen einer Demenz näher.
Update Diagnostik
Die Diagnostik der Alzheimer Demenz stützt sich heute auf vier Säulen: kognitive Tests, medizinische Untersuchung, bildgebende Diagnostik (MRT ist Standard, PET wird nur bei ca. 10% der Patienten durchgeführt) und in Einzelfällen die Untersuchung von Biomarkern im Liquor.
In einigen Jahren wird der MoCA (Montreal Cognitive Assessment; www.mocatest.ch) den heute noch gebräuchlichen MMSE (Mini-Mental State Examination) als kognitiven Test ablösen. In diesem Zusammenhang wies Prof. Dr. phil. Andreas Monsch, Universitäre Altersmedizin FELIX PLATTER Basel, darauf hin, dass man in der Lage sein sollte, die Ergebnisse dieser beiden Tests miteinander zu vergleichen. Tatsächlich zeigt sich, dass bei einem Basler Patientenkollektiv ein bestimmter MoCA einem bestimmten Wert beim MMSE zugeordnet werden kann und diese Transformation sowohl mit vier weiteren Studien vergleichbar, als auch für andere Ätiologien möglich ist (1).
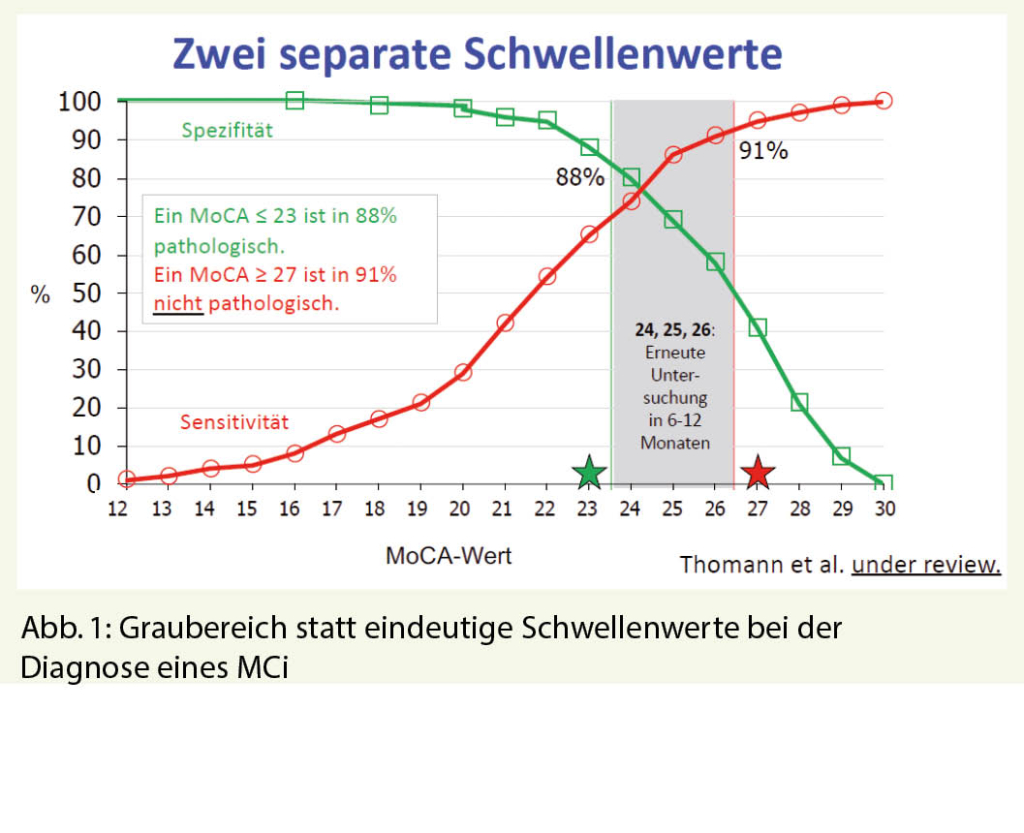
Für Diskussionsstoff sorgt noch immer ein Cutoff-Wert von < 26/30 im MoCA, welcher bei 30% der Personen einer Normpopulation zur Diagnose eines MCI (Mild Cognitive Impairment) führen würde. Eine Lösung könnte sein, bei Patienten mit MoCA-Werten zwischen 24 und 26 anstelle eines Cutoffs einen Graubereich zu definieren (siehe Abb. 1). Diese Patienten werden in 6-12 Monaten ein zweites Mal untersucht und erst dann würde man gegebenenfalls eine Diagnose stellen. Patienten die einen MoCA-Wert ≥ 27 aufweisen haben mit 91% Wahrscheinlichkeit keinen pathologischen Befund, wohingegen Patienten mit einem Wert ≤ 23 mit 88%iger Wahrscheinlichkeit von einer Hirnleistungsstörung betroffen sind (2).
Neue Entwicklungen bei diagnostischen Tests
Neurokognitive Störungen wie Alzheimer Demenz, vaskuläre Demenz, Lewy-Körper-Demenz u.a. zeichnen sich durch Beeinträchtigungen in den Bereichen Sprache, Lernen und Gedächtnis, soziale Kognition, komplexe Aufmerksamkeit, exekutive Funktionen und visuokonstruktiv-perzeptuelle Fähigkeiten aus. Wünschenswert wäre es, so Prof. Dr. Monsch, neue kultur- und sprachunabhängige Tests zu entwickeln und diese durch zumindest einige der Patienten an einem iPad selbst durchführen zu lassen. Dadurch könnten Neuropsychologen wesentlich effizienter aussagekräftige Aussagen über die Hirnleistungen ihrer Patienten machen.
Ein Beispiel für einen automatisierten Test, der vom Patienten auch in Abwesenheit einer Fachperson durchgeführt werden kann, ist der Cog-Check. Bei dieser Tablet-basierten Applikation setzt sich der Patient z.B. mit visuellen Wiedererkennungsaufgaben, dem Lernen einer Serie von Bildern und dem Erinnern von Bildern und Zahlenfolgen auseinander. Mit diesem bereits normierten Test ist es möglich, ein kognitives Leistungsprofil zu erstellen. Die Entwicklungsarbeiten zu diesem Test sind noch nicht abgeschlossen.
Von der kortikalen Tau-Pathologie ist in frühen Stadien der Erkrankung besonders der mediale perirhinale Kortex betroffen. Dieser Hirnbereich befindet sich am Ende des visuellen Stroms und hat die Aufgabe, einzelne Elemente einer Figur zu einem Gesamtbild zusammenzusetzen. Basierend auf dieser Beobachtung hat die Memory Clinic der Universitären Altersmedizin FELIX PLATTER neue Tests entwickelt, von denen besonders jene zur semantischen Flüssigkeit und zur Unterscheidung von Figuren eine hohe Trennschärfe aufwiesen. In der Memory Clinic ist der Test zur semantischen Flüssigkeit bereits implementiert.
Zur biologischen Definition der Alzheimer Erkrankung konnte ein Rahmenwerk zur Diagnose entwickelt werden. Dieses stützt sich unter anderem auf PET-Daten und damit nicht erst auf die klinischen Folgen der Krankheit (Symptome) (3). In einer anderen Studie konnte eine Korrelation von abnorm gefaltetem Amyloid-Proteinen im Blut bis zu 14 Jahren vor der Diagnose der Alzheimer Erkrankung gezeigt werden (4). Diese neuen Entwicklungen dienen nicht nur einer besseren und einfacheren Diagnostik, sondern auch Therapiestudien können aussagekäftiger werden, weil dann die Patienten viel besser charakterisiert werden können und man so weniger «Rauschen», dafür aber ein stärkeres Signal haben wird.
Erfreuliche Entwicklung für die kausale Therapie
Prof. Dr. med. Thomas Leyhe, Universitäre Altersmedizin FELIX PLATTER und Universitäre Psychiatrische Kliniken Basel, stellte erfreut die wahrscheinlich wichtigste Nachricht an den Anfang seiner Ausführungen: Nach zunächst enttäuschenden Ergebnissen der Futility Analyse der beiden Aducanumab Studien EMERGE und ENGAGE (5, 6) soll nun nach Reanalyse der Daten die Zulassung beantragt werden. Sollte das Medikament zugelassen werden, wäre dies ein Meilenstein, eine erste kausale Therapie zur Behandlung der Alzheimer Erkrankung.
Aducanumab ist ein monoklonaler Antikörper (mAb), welcher lösliches und unlösliches β-Amyloid im Gehirn bindet und dort zu einer signifikanten Reduktion des neurotoxischen Peptids führt. Dies konnte auch mit anderen mAb gezeigt werden, jedoch ist Aducanumab der einzige mAb, bei dem die Reduktion des Peptids mit einer Verbesserung der neurokognitiven Funktion assoziiert ist. Im Frühjahr 2019 sah es noch ganz anders aus: Ende März wurden die beiden Studien nach einer Futility-Analyse abgebrochen. Eine Reanalyse der Daten der EMERGE Studie hat jedoch nun gezeigt, dass bei dem Kollektiv, das eine höhere Dosierung (10mg/kg Körpergewicht) des mAb erhalten hatte, tatsächlich eine Verbesserung der kognitiven Funktion nachweisbar war. Bei geringerer Dosierung war der Effekt nicht signifikant. Schliesslich hat eine erneute Analyse der Daten der ENGAGE Studie gezeigt, dass auch die Patienten dieser Studie, die 10mg/kg mAb und mindestens 10 Dosen erhielten, eine Verbesserung der kognitiven Funktion aufwiesen. Bei guten Sicherheitsdaten wird nun gespannt auf die Entscheidung der FDA gewartet, ob Aducanumab die Zulassung für die Therapie der Alzheimer Demenz erhalten wird.
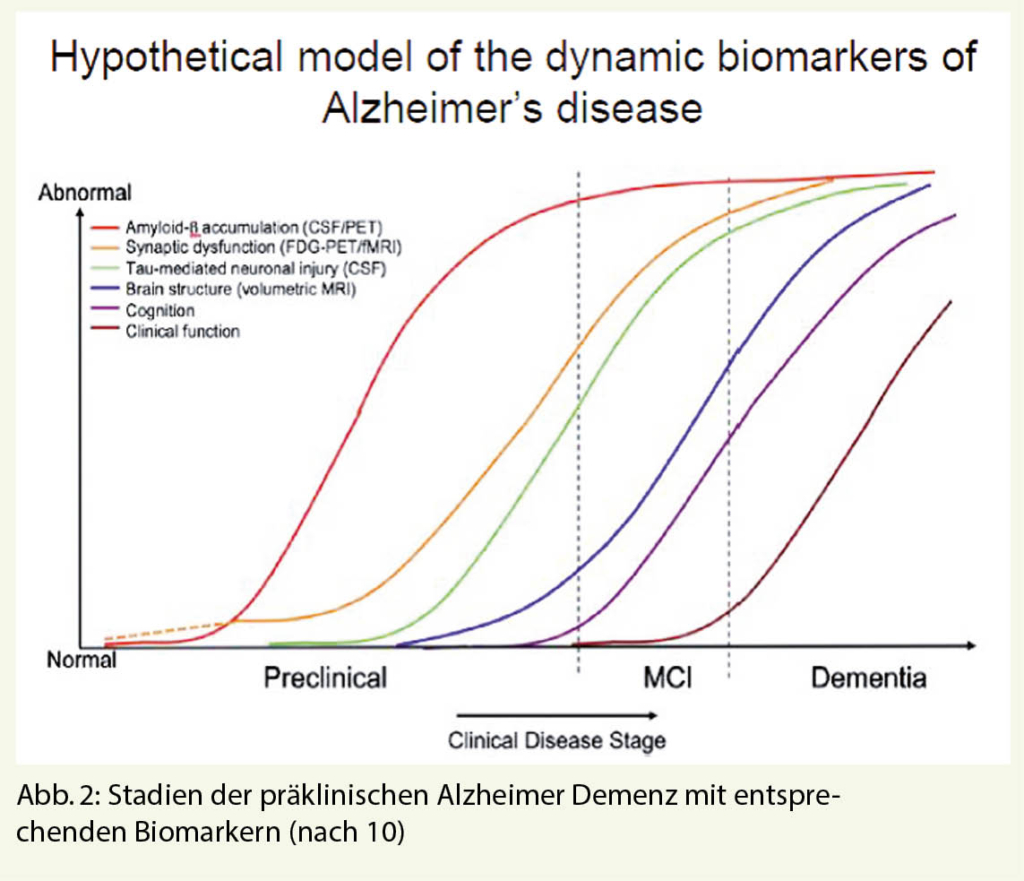
Eine Herausforderung der Therapie bleibt weiterhin, dass die pathologischen Prozesse schon 10-15 Jahre vor dem Einsetzen von Symptomen beginnen (siehe Abb. 2). An Risikogruppen z. B. Patienten mit autosomal dominant vererbter Alzheimer Erkrankung, welche im Alter zwischen 30 und 50 Jahren erkranken, werden mAb (Solanezumab, Gantenerumab) schon 15 Jahre vor Ausbrechen der Erkrankung eingesetzt (7). Eine andere Risikogruppe stellen Patienten dar, welche bei einem Screening Hinweise auf eine Amyloid-Pathologie zeigten. Bei dieser Gruppe wird der Einsatz von Solanezumab untersucht (8). Die Ergebnisse stehen noch aus. Substanzen, welche die Plaquebildung unterbinden sollten, indem sie ein Enzym hemmen, das an der Entstehung von Amyloid Plaques beteiligt ist, haben teilweise sogar zu einer Verschlechterung der kognitiven Fähigkeiten geführt. Auch die neurofibrillären Bündel stehen als Target schon im Fokus für die Anwendung von mAb. Es muss sich zeigen, ob ein Eingreifen in die Tau-bedingten neuronalen Schädigungen noch rechtzeitig genug ist, um kognitive Einschränkungen zu verhindern, so Prof. Leyhe. Der Grossteil, der im Moment untersuchten Substanzen sind krankheitsmodifizierende Wirkstoffe (61%). Aber auch symptomatisch einzusetzende Substanzen (neuropsychiatrisch, kognitiv) werden untersucht (9). Ein interessanter Weg wird in einer chinesischen Untersuchung beschritten, bei dem die Dysbiose der Darmflora rekonditioniert werden soll, um damit eine Reduktion der Entzündungs-Botenstoffe, die ins Gehirn gelangen, zu erreichen.
Abschliessend wies der Referent auf die Notwendigkeit der Prävention einer Alzheimer Erkrankung hin. 1/3 der Risikofaktoren wie Hörverlust, Hypertonus, soziale Isolation und die gerade auch oft als Demenz verkannte Altersdepression sind beeinflussbar.
Bei kognitiven Störungen Differenzialdiagnosen beachten
Im Anschluss an die eher theoretischen Überlegungen zur Demenz hat das Hirntheater unter der Leitung von Franziska Maria von Arb in verschiedenen Szenen unterschiedliche Formen der Demenz aufgegriffen, die es differenzialdiagnostisch zu analysieren gilt. Nachdem das Publikum eine Hypothese zur möglichen Diagnose gestellt hatte, wurden die Szenen von Fachleuten aus Basel kommentiert: Prof. Dr. med. Peter Fuhr, Neurologie Universitätsspital Basel referierte kurz zur Parkinson Erkrankung, Prof. Dr. med. Thomas Leyhe zur Altersdepression, PD Dr. Marc Sollberger, Universitäre Altersmedizin FELIX PLATTER und Neurologie Universitätsspital Basel zur frontotemporalen Demenz und Prof. Dr. phil Andreas Monsch zur Alzheimer Krankheit und speziell zur Durchführung des MoCA-Tests. Mutige Teilnehmer konnten sich der Herausforderung stellen, die Diagnose-Szenen in der Praxis in positvere Bahnen zu lenken, um für Patienten und Angehörige zu einem günstigeren Ergebnis zu kommen.
Ein Beitrag zum Vortrag von Prof. Dr. med. Derfuss, Neurologie Universitätsspital Basel zur Multiplen Sklerose im Alter, der ebenfalls im Rahmen des Demenzforums präsentiert wurde, wird in einer späteren Ausgabe folgen.
Quelle: 7. Basler Demenzforum, Theater Basel, 14.11.2019
1. Fasnacht J et al. in Vorbereitung
2. Thomann AE et al, under review
3. Jack Jr., CA. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement, 14: 535–562
4. Stocker H et al. Prediction of Alzheimer’s disease diagnosis within 14 years through Aβ misfolding in blood plasma compared to APOE4 status, and other risk factors. Alzheimers Dement 2019; S1552-5260
5. ClinicalTrials.gov. NCT02484547
6. ClinicalTrials.gov. NCT02477800
7. ClinicalTrials.gov: NCT01760005
8. ClinicalTrials.gov: NCT02008357
9. Cummings J et al. Alzheimer’s disease drug development pipeline. 2019;5:272–293
10. Sperling RA et al. Alzheimer´s and Dementia 2011;7: 280–292