- Aujourd’ hui, demain ou jamais ?
Des preuves toujours plus évidentes montrent qu’ avec un programme de dépistage précoce du cancer pulmonaire, à l’ aide d’ une computertomographie à faible dose (LDCT), permet de réduire la mortalité au sein d’ une population à risque de manière significative. De nouvelles données démontrent qu’ une stricte sélection des participant-e-s dans un programme de dépistage par LDCT et une mesure volumétrique des nodules pulmonaires réduit la fréquence des faux positifs. Le « groupe suisse d’ implémentation du dépistage du cancer du poumon » (CH – LSIG), une communauté de travail multidisciplinaire de groupes d’ intérêt et d’ expert-e-s, soutient la mise en place d’ un programme suisse de dépistage du cancer du poumon. Le présent article traite du dépistage du cancer pulmonaire, qui est par ailleurs un des projets de démarrage de la « commission d’ experts pour la détection précoce du cancer » mis en œuvre en 2018, dans le cadre du projet pilote de la stratégie nationale de lutte contre le cancer.
Le cancer pulmonaire, avec 3 200 décès par année, est la cause la plus fréquente de décès associée à un cancer en Suisse (1). Chaque année, 4 300 nouveaux cas de cancer pulmonaire sont diagnostiqués (4 363 en 2015, 4 252 en 2014, 4 293 en 2013). Le principal facteur de risque pour le cancer du poumon est le tabagisme, avec un laps de temps de 20 à 30 ans entre l’ incidence et la mortalité. Ceci explique aussi pourquoi, en Suisse, la mortalité chez les patient-e-s du cancer du poumon baisse chez les hommes, mais augmente encore chez les femmes.
Grâce à la computertomographie à faible dose, il est possible de dépister précocement un cancer du poumon
Le cancer pulmonaire a une phase préclinique de plusieurs années, durant laquelle il est détectable, mais souvent asymptomatique ; pendant cette période, un traitement chirurgical efficace et curatif est une option. C’ est pourquoi diverses méthodes de dépistage précoce ont été étudiées ces 20 dernières années. La computertomographie à faible dose (LDCT) est un procédé d’ imagerie sensible qui permet de détecter le cancer pulmonaire à un stade précoce. Aujourd’ hui, de plus en plus de preuves démontrent qu’ une stratégie de diagnostic et thérapeutique adéquate peut faire baisser le taux de mortalité, non seulement pour le cancer pulmonaire mais la mortalité de manière générale. L’ étude américaine du National Lung Screening Trial (NLST) a pu abaisser la mortalité liée au cancer du poumon de 20 % (réduction du risque relatif), ce qui correspond à un «number needed-to-screen» d’ environ 320 pour prévenir un décès par cancer pulmonaire (2). A la conférence mondiale du cancer pulmonaire en 2018, les résultats de l’ étude NELSON – menée en Hollande et en Belgique – avaient été présentés pour la première fois. Il avait été démontré que la mortalité liée au cancer pulmonaire pouvait baisser de 26 % (3). Au sein d’ un sous-groupe de femmes, le dépistage par LDCT avait même pu permettre de faire baisser le taux de mortalité de 50 %. L’ étude NELSON est importante, car elle analyse les nodules pulmonaires suspects avec la volumétrie, ce qui permet de réduire significativement les faux positifs, en comparaison avec le NLST. L’ étude italienne MILD et l’ étude allemande LUSI, publiées récemment, ont pu démontrer sur une période de 8-10 ans l’ avantage d’ un dépistage précoce par LDCT, avec 36 à 39 % de réduction du risque relatif de mortalité du cancer pulmonaire et une réduction du risque relatif de la mortalité générale de 20 % (4, 5). Il devient ainsi évident qu’ un dépistage précoce peut permettre de sauver des vies.
En outre, une étude de micro-simulation, publiée il y a peu, a pu démontrer qu’ en Suisse cela serait fort probablement une intervention efficiente au niveau des coûts (environ 30 000 francs suisse par année de vie sauvée) (6). Les États-Unis, la Grande Bretagne et la Pologne sont pour l’ instant les seuls pays où un programme de dépistage par LDCT est mené ou en préparation sur le conseil de plusieurs communautés d’ experts. En Europe, de nombreux pays attendent la publication de l’ étude NELSON et le renouvellement de l’ évaluation des technologies de santé, sur laquelle sera basée l’ introduction d’ un programme de dépistage du cancer pulmonaire. Cette hésitation est en partie imputable au taux de résultats d’ analyses faussement positifs du NSLT, avec de potentiels effets secondaires dû à un diagnostic invasif, des examens ou traitements supplémentaires. Bien que le dépistage par LDCT sera fort probablement efficace au niveau des coûts (cela reste relatif), il faut prendre en compte des surcoûts substantiels (soit des coûts absolus) : avec un taux de participation au dépistage de 10 % sur la population potentiellement à risque, on peut chiffrer une surcharge de 16 millions de francs par année en Suisse.
Le dépistage précoce par LDCT est déjà proposé depuis de nombreuses années à des personnes asymptomatiques par des prestataires suisses, notamment une fondation (http://www.lungendiagnostik.ch), avec des hôpitaux privés associés.
Aujourd’ hui, il existe en Suisse un vide pour le dépistage du cancer pulmonaire. Pour une mise en œuvre et un financement durable d’ un programme de dépistage par LDCT de haute qualité, il sera nécessaire de prendre en compte, dans la stratégie future, divers groupes d’ intérêts, des potentiel-le-s participant-e-s aux prestataires de service en passant par divers acteurs du domaine de la santé.
Données actuelles et preuves
Il a été tenté de calculer l’ impact, l’ efficience des coûts, la viabilité et le financement du dépistage par LDCT en Suisse. Comme déjà mentionné, une étude de modélisation a pu montrer que le dépistage par LDCT du cancer du poumon pourrait réduire la mortalité en Suisse à un rapport acceptable entre le risque et les coûts– sachant que le pays a un haut taux de fumeurs. Bien que la viabilité n’ ait pas été systématiquement étudiée pour l’ instant, des premières expériences à l’ hôpital universitaire de Zürich montrent que pour intégrer un programme de dépistage dans l’ actuelle routine clinique, il faut prendre en compte des ressources de personnel substantielles, une adaptation du processus ainsi que des infrastructures adaptées. Ainsi, pour répondre aux exigences d’ un programme de dépistage par LDCT du cancer du poumon, il est nécessaire d’ avoir une équipe spécifique au sein de radiologie, pneumologie et chirurgie thoracique (Pr T. Frauenfelder, communication orale). En outre, ces adaptations ne concernent que les personnes souhaitant vraiment se soumettre à un dépistage (probablement environ 10-20 %). Il n’ existe encore aucune structure pour être informé au sujet d’ un programme de dépistage et du processus de prise de décision. Dans d’ autre pays, comme la Pologne, ce premier pas se fait auprès du médecin de famille, alors qu’ en Suisse, on pourrait imaginer que cela se fasse autant auprès du médecin de famille qu’ auprès d’ une organisation de la santé, comme par exemple la Ligue Pulmonaire.
Le CH-LSIG (Lung Cancer Screening Implementation Group ou groupe suisse d’ implémentation du dépistage du cancer du poumon) a publié un communiqué au sujet du dépistage par LDCT du cancer du poumon dans lequel il établit les exigences de bases pour un futur programme de dépistage précoce (7). Dans ce communiqué, un groupe cible à risque de 300 000 femmes et hommes est défini comme potentiellement qualifié pour faire recours à un dépistage par LDCT. Le groupe d’ expert-e-s conclut qu’ un programme de dépistage dans tout le pays serait faisable, grâce à la répartition géographique des centres de santé et des prestataires de service qui peuvent proposer un dépistage, ainsi qu’ à la nature sélective de l’ examen.
Les données concernant le financement d’ un programme de dépistage du cancer du poumon sont pour l’ instant incomplètes. Bien que l’ étude de modélisation mentionnée plus haut suppose qu’ un tel programme de dépistage précoce pourrait selon toute probabilité être mis en œuvre avec un rapport coût-bénéfice acceptable de moins de 100 000 francs suisses par année de vie sauvée, certains points concernant les coûts absolus et la répartition entre les potentiels porteurs de coûts (assurances maladies, patient-e-s ayant recours au programme de dépistage et des organisations à but non-lucratif comme la Ligue Pulmonaire) restent à éclaircir.
L’ Office fédéral de la santé publique (OFSP) a repoussé l’ évaluation et la décision de l’ établissement d’ un programme national de dépistage du cancer du poumon jusqu’ à la publication des données de l’ étude NELSON.
Les données disponibles à ce jour sont également insuffisantes en ce qui concerne la volonté des participant-e-s potentiel-le-s au programme de dépistage de prendre en charge une partie des coûts ou la possibilité que les prestataires de services prennent en charge les coûts pour les ressources nécessaires en personnel et l’adaptation de l’infrastructure.
A l’ occasion de la conférence mondiale du cancer pulmonaire en septembre 2018, les résultats de l’ étude NELSON ont été présentés, montrant une réduction relative du risque de 26% auprès des hommes – ce qui a provoqué un large soutien au niveau international des société médicales pour la mise en place de programmes de dépistage nationaux (3). Cette idée s’ était déjà propagée à la publication de 2017 du «European position statement on lung cancer screening» (8). A l’ heure actuelle, un programme de dépistage est démarré en Pologne et au Royaume Uni, le NHS est en train d’étendre le programme pilote existant. La société européenne pour les images thoraciques (European Society for Thoracic Imaging, ESTI) est en train d’ établir un processus de certification des radiologues pour le dépistage du cancer du poumon. Cette action est soutenue par les sociétés européennes pour la radiologie et se base sur des webinars ainsi que des cours sur le diagnostic de nodules pulmonaires et l’ utilisation de l’ aide au diagnostic médical (computer-aided diagnosis, CAD).
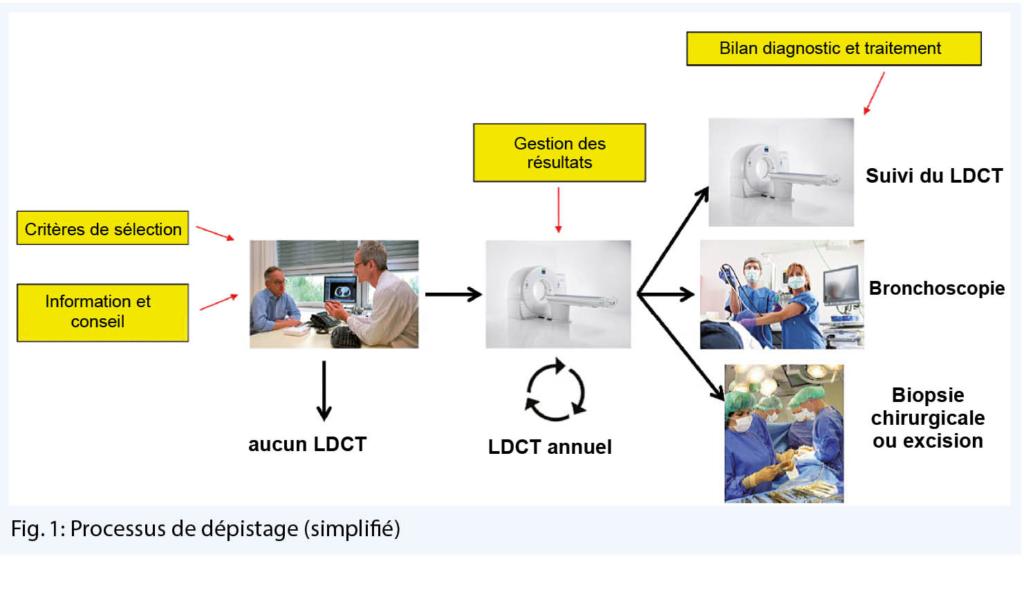
Il reste, malgré tout, plusieurs questions fondamentales sans réponses jusqu’ ici, ce qui pourra être illustré par le processus de dépistage (schéma 1). Un aspect important est le fait que le dépistage du cancer du poumon est bien plus complexe que la réalisation d’un seul test de dépistage. Le processus commence par l’ information des participant-e-s issu-e-s de la population à risque (par exemple catégorie d’ âge de 60 à 80 ans et au moins 30 paquets par année ou des critères supplémentaires/autres). Le but est que les participant-e-s du programme de dépistage puissent prendre une décision informée de se soumettre ou non à un dépistage par LDCT. Une consultation a lieu après le premier LDCT, afin de discuter des résultats de l’ examination, des facteurs de risque et de décider quels examens encore mener. Dans le cas de lésions suspectes, cela pourrait signifier une procédure de diagnostic ou d’ autres contrôles par la suite. Ce processus de dépistage peut aussi mener à un traitement, qui comprend également un monitoring spécifique.
Il existe de plus en plus de preuves scientifiques en faveur de chaque étape de la procédure du dépistage. Les études NSLT, MILD, LUSI et NELSON, ainsi que l’ étude de modélisation de Tomonaga et al. vont permettre une évaluation future détaillée du processus par son utilité, les effets secondaires et les coûts.
Pertinence du dépistage du cancer pulmonaire dans le contexte suisse
En Suisse et en Europe, le cancer pulmonaire présente le taux de mortalité associé au carcinome le plus élevé, surtout en raison d’un diagnostic tardif à un stade avancé, qui ne permet plus une approche thérapeutique curative. Plusieurs études sur le dépistage du cancer du poumon avec le LDCT montrent clairement une réduction significative de la mortalité liée au cancer du poumon.
Aujourd’ hui, des programmes de dépistage du cancer du poumon sont mis en place aux États-Unis, et plusieurs pays européens en font de même. En Suisse, un débat politique a lieu en ce moment à propos des coûts des soins de la santé, avec des critiques envers les mesures de prévention mises en place, comme le programme de dépistage du cancer du sein. C’ est pourquoi la future prévention du cancer pulmonaire nécessitera l’établissement d’un programme de dépistage fondé sur des données probantes, ainsi que l’ implication active des groupes de personnes concernées.
Le CH-LSIG soutient donc un programme coordonné au niveau national pour la collecte et l’évaluation scientifique des données et des résultats. Le CH-LSIG ne recommande pas de dépistage « opportuniste », mené en dehors d’un programme. Toutefois, si les patient-e-s souhaitent tout de même subir un examen par LDCT, ils/elles doivent être informé-e-s à l’avance des risques et des bénéfices.
Un futur programme suisse devrait être établi avec une approche « bottom-up », incluant les différentes parties prenantes et accompagné scientifiquement par une analyse de la mise en œuvre – l’ objectif principal étant de réduire la mortalité liée au cancer du poumon et les résultats faussement positifs.
Une stratégie aussi large et inclusive vise à intégrer toutes les parties prenantes au cours du processus de mise en œuvre, ce qui constitue une approche novatrice tant au niveau national qu’international. La Suisse peut donc jouer un rôle important dans l’introduction d’un programme de dépistage du cancer du poumon par LDCT, basé sur les meilleures preuves disponibles et utilisant les forces du système de santé suisse.
Questions ouvertes sur la faisabilité
- Quelles organisations sont en contact avec les participant-e-s potentiel-le-s à un dépistage, issu-e-s de la population à risque ?
- Quels critères définissent la population à risque, pour établir un «number needed to screen» et un «number harmed» ?
- Quels aspects entravent et quels sont ceux qui simplifient la mise en place durable d’un programme de dépistage par LDCT pour les prestataires de soins de santé ?
- Quels prestataires de soins de santé mettent en place des équipes interdisciplinaires et fournissent l’infrastructure nécessaire pour offrir un programme de dépistage par LDCT ?
- Comment intègre-t-on le sevrage tabagique dans le programme de dépistage par LDCT afin atteindre le nombre maximum de fumeurs et fumeuses ?
- Quel régime de dépistage la Suisse devrait-elle utiliser, quels sont les détails du programme de dépistage par LDCT ?
- Comment et par qui les nodules sont-ils détectés, analysés et signalés, quel algorithme est mis en œuvre pour la gestion ?
- Quelles sont les possibilités de collecte de données, de registre et de programme de d’accompagnement de qualité en Suisse ?
Questions ouvertes sur le financement et la durabilité :
- Comment sont financées l’information, les consultations et la spirométrie avant le LDCT ? Les participant-e-s seraient-ils/elles prêt-e-s à assumer eux-mêmes une partie des coûts ?
- Est-ce qu’ une taxe supplémentaire sur le tabac pourrait financer une partie du programme de dépistage par LDCT ?
- A quelle hauteur l’ assurance maladie obligatoire devrait-elle contribuer pour assurer une mise en place durable d’un programme de dépistage par LDCT ?
- Comment les prestataires de service de la santé financent-ils les ressources humaines, les équipements techniques, la formation et les infrastructures supplémentaires, indépendamment du remboursement par les caisses d’assurance maladie ?
- Comment sont financés la collecte de données, les registres et les programmes de qualité ?
- Comment sont traitées les découvertes fortuites (par exemple, les maladies cardiovasculaires) pour éviter des coûts élevés et inutiles pour le système de santé ?
Le CH-LSIG (Lung Cancer Screening Implementation Group)
J. Plojoux (Hôpitaux Universitaires de Genève), A. Azzola (Luzerner Kantonsspital), J. Bremerich (Universitätsspital Basel), U. Bürgi (Luzerner Kantonsspital), M. Brutsche (Kantonsspital St. Gallen), A. Christe (Insel- spital und Tiefenauspital), L. Ebner (Inselspital), C. Eich (Zürich), D. Franzen (Universitätsspital Zürich), A. Flatz (Krebsliga Schweiz), Ph. Giroud (Lungenliga Schweiz), J. Heverhagen (Inselspital), N. Horwarth (Clinique des Grangettes), M. Kohler (Universitätsspital Zürich), A. Lovis (Centre Hospitalier Universitaire Vaudois), R. Meuli (Centre Hospitalier Universitaire Vaudois), M. Menig (BAG), X. Montet (Hôpitaux Universitaires de Genève), L. Nicod (Centre Hospitalier Universitaire Vaudois), T. Niemann (Kantonsspital Baden), H.-B. Ris (Centre Hospitalier Universitaire Vaudois), D. Schneiter (Universitätsspital Zürich), S. Stöhr (SUVA), P. Vock (BAG), W. Weder (Universitätsspital Zürich)
Prof. Dr. méd. Paola Gasche-Soccal, Service de Pneumologie, Hôpitaux Universitaires de Genève, Genève
Dr. méd. Catherine Beigelmann-Aubry, Service de Radiodiagnostic et Radiologie Interventionnelle, Centre Hospitalier Universitaire Vaudois, Lausanne
Prof. Dr. méd. Thomas Frauenfelder, Institut für diagnostische und interventionelle Radiologie, Universitätsspital Zürich, Zürich
Prof. Dr. méd. Oliver Gautschi, Medizinische Onkologie, Luzerner Kantonsspital, Luzern
Prof. Dr. méd. Isabelle Schmitt-Opitz, Klinik für Thoraxchirurgie, Universitätsspital Zürich, Zürich
Dr. méd. Yuki Tomonaga, Institut für Epidemiologie, Biostatistik und Prävention, Universität Zürich, Zürich
Prof. Dr. méd. Stefan Neuner-Jehle, Kollegium f. Hausarztmedizin, Zürich
Prof. Dr. méd. Oliver Senn, Institut für Hausarztmedizin, Universität Zürich, Zürich
Dr. méd. Alexander Turk, Klinik für Innere Medizin, See-Spital, Horgen und Kilchberg
Prof. Dr. méd. Milo Puhan, Institut für Epidemiologie, Biostatistik und Prävention Institute, Universität Zürich, Zürich
Article traduit de «onkologie » 05_2019.
Centre Hospitalier Universitaire Vaudois
Lausanne
christophe.von-garnier@chuv.ch
1. Specific causes of death. https://www.bfs.admin.ch/bfs/en/home/statistics/health/ state-health/mortality-causes-death/specific.html (accessed April 24, 2019).
2. Aberle DR, Adams AM, Berg CD, Black WC, et al. Reduced lungcancer morta- lity with lowdose computed tomographic screening. N Engl J Med. 2011 Aug 4;365(5):395-409.
3. De Koning H, Van Der Aalst C, Ten Haaf K, Oudkerk M. PL02.05 Effects of Volu- me CT Lung Cancer Screening: Mortality Results of the NELSON Randomised- Controlled Population Based Trial. J Thorac Oncol 2018; 13: S185.
4. Pastorino U, Silva M, Sestini S, et al. Prolonged Lung Cancer Screening Redu- ced 10-year Mortality in the MILD Trial. Ann Oncol 2019; published online April 1. DOI:10.1093/annonc/mdz117.
5. Becker N, Motsch E, Trotter A, Heussel CP, et al. Lung cancer mortality reduction by LDCT screening-Results from the randomized German LUSI trial. Int J Cancer. 2019 Jun 4. doi: 10.1002/ijc.32486.
6. Tomonaga Y, ten Haaf K, Frauenfelder T, et al. Costeffectiveness of low-do-se CT screening for lung cancer in a European country with high preva-lence of smoking—A modelling study. Lung Cancer 2018. DOI:10.1016/j.lung- can.2018.05.008.
7. Frauenfelder T, Puhan MA, Lazor R, et al. Early detection of lung cancer: A statement from an expert panel of the swiss university hospitals on lung cancer screening. Respiration 2014; 87: 254–64.
8. Oudkerk M, Devaraj A, Vliegenthart R, et al. European position statement on lung cancer screening. Lancet Oncol. 2017. DOI:10.1016/S1470-2045(17)30861-6.
la gazette médicale
- Vol. 9
- Ausgabe 2
- April 2020