- Constipation
Le terme constipation décrit une défécation subjectivement perçue comme insatisfaisante. Les symptômes typiques sont, outre une évacuation trop peu fréquente (< 3 défécations/semaine) et une consistance trop dure des selles, qui nécessite souvent une forte pression, l’ incapacité à déféquer malgré l’ envie de déféquer (envie « improductive » de déféquer, sensation de blocage), la sensation de défécation incomplète ou le recours aux manipulations digitales d’ évacuation (extraction des selles ou soutien du plancher pelvien). L’ article résume les considérations de diagnostic différentiel et présente les options de traitement actuelles.
Si ces trois derniers problèmes sont au premier plan, il y a lieu de soupçonner un trouble obstructif de l’ évacuation anorectale, et il faut envisager un diagnostic fonctionnel anorectal par manométrie anale (y compris la mesure des seuils de perception) et défécographie par IRM. Si des douleurs abdominales et des flatulences qui s’ améliorent après la défécation s’ ajoutent à cela, on peut supposer qu’ il s’ agit d’ un syndrome du côlon irritable (SCI-C / IBS-C) avec prédominance de constipation. Une autre forme particulière est la constipation induite par les opiacés.
Diagnostic
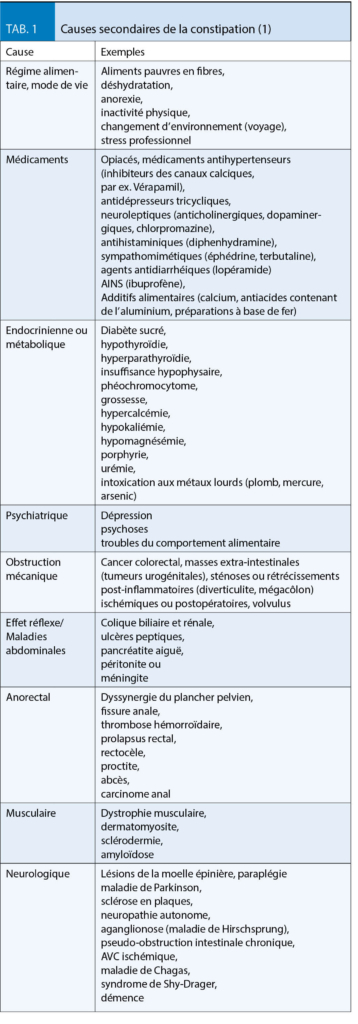
Pour une thérapie différenciée, il est important d’ identifier l’ étiologie sous-jacente de la constipation, d’ exclure les causes secondaires de la constipation (tab. 1) et, surtout, d’ arrêter la médication provoquant l’ obstruction. En particulier en cas d’ une nouvelle constipation soudaine liée à une anamnèse familiale positive de carcinome colorectal, à des signes d’ alarme ou à l’ âge de plus de 50 ans, une coloscopie est nécessaire pour exclure un cancer du côlon ou une diverticulite. En cas d’ absence de réponse au traitement standard (voir ci-dessous), il convient d’ envisager un diagnostic fonctionnel anorectal et une défécographie par IRM. Ainsi, il est possible de distinguer une obstruction anorectale mécanique, par ex. causée par une rectocèle antérieure, d’ une obstruction fonctionnelle causée par des forces de propulsion insuffisantes, par ex. par un manque de relaxation de la boucle puborectale ou une contraction paradoxale du sphincter pendant la défécation.
Thérapie différenciée et fondée sur des preuves
Tout traitement repose sur des mesures générales et sur l’ influence du mode de vie, comme le rétablissement d’ un rythme de défécation fixe par le recours au réflexe gastrocolique, une activité physique suffisante et une augmentation de la quantité de selles grâce à une alimentation riche en fibres (environ 20 à 30 g/j).
Pour y parvenir, il est souvent nécessaire de prendre des agents gonflants inertes tels que les coques de psyllium (Plantago ovata ; par exemple Metamucil®, Mukofalk®) ou la gomme Sterculia (Colosan mite®, Normacol®), avec une quantité abondante de liquide. Cependant, il faut s’ attendre – notamment dans le cas des fibres alimentaires à base de céréales comme les graines de lin et le son de blé –, au météorisme comme effet secondaire, de sorte qu’ il faut administrer les doses en les augmentant peu à peu, et à ce que ces mesures peuvent également être contre-productives dans le cas de l’ IBS-C ou de l’ IBS-A. Souvent, les patients ne demandent une aide médicale que lorsque ces mesures ne sont pas suffisantes. Ensuite, les laxatifs classiques sont généralement administrés.
La meilleure preuve est l’ utilisation de polyéthylène glycol ou de macrogol (par ex. Movicol® 10-40g/j) et de lactulose. Ces substances sont osmotiquement actives, augmentent la fréquence des selles, réduisent la pression nécessaire à la défécation et donnent des selles plus molles. Les gaz produits lors de la fermentation bactérienne du lactulose dans le côlon sont responsables des effets secondaires (météorisme), de sorte qu’ en cas de plaintes correspondantes, la préférence doit être donnée au polyéthylène glycol non métabolisable.
Si ces mesures n’ aboutissent pas, des laxatifs stimulants tels que le bisacodyl (Dulcolax®) ou les dérivés d’ anthraquinone (Folia Sennae) sont ensuite utilisés. Ils déploient leur effet 6 à 10 heures après l’ ingestion par le biais d’ une modification du transport des électrolytes dans la muqueuse intestinale et stimulent la motilité. Contrairement aux effets secondaires fréquemment signalés, l’ utilisation à long terme de ces préparations est également considérée comme sûre aujourd’ hui. Dans l’ intervalle, l’ efficacité du Dulcolax®, qui a été utilisé à des fins thérapeutiques depuis les années 1950 comme médicament « de secours » dans de nombreuses études, a également été prouvée dans une étude randomisée en double aveugle contrôlée par placebo.
Constipation réfractaire au traitement
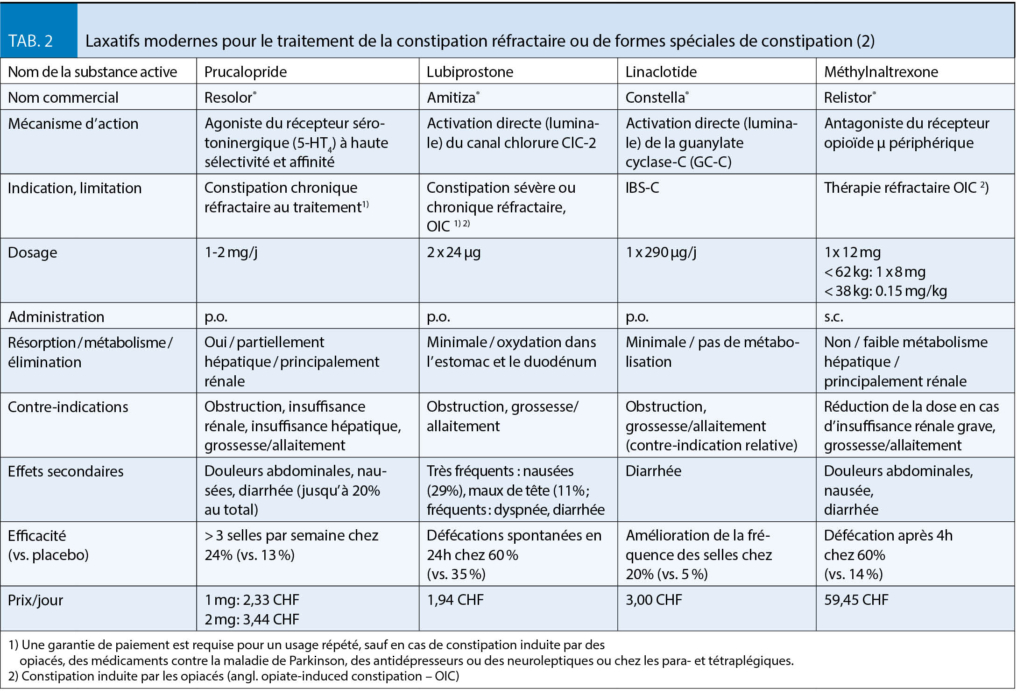
S’ il n’ y a pas de réponse après un traitement avec au moins deux laxatifs de classes différentes sur une période d’ au moins 9 mois, un nouvel examen critique de l’ étiologie (obstruction mécanique ou carcinome ? Trouble de l’ évacuation anorectale avec indication de diagnostics fonctionnels ? Des causes secondaires ? Des médicaments/opiacés constipants ?), une thérapie avec les laxatifs les plus récents et environ 2 à 3 fois plus chers tels que le lubiprostone (Amitiza®) ou le prucalopride (Resolor®) est indiquée (tab. 2).
Le lubiprostone est un métabolite de la prostaglandine E1, qui active es canaux chlorure de type 2 dans la membrane apicale des cellules épithéliales intestinales. Cela conduit à une sécrétion de liquide intestinal riche en chlorure et à un passage plus facile des selles. Après l’ administration orale d’ un comprimé de lubiprostone 24 µg deux fois par jour avec un repas, 60% des patients ont une évacuation intestinale et une fréquence des selles spontanées dans les 24 heures et les symptômes associés à l’ obstruction s’ améliorent. Les facteurs limitants sont les maux de tête (12 %) et les nausées (32 % !) en fonction de la dose, qui peuvent être quelque peu soulagés en prenant le médicament avec un repas, mais qui peuvent entraîner l’ arrêt de la thérapie chez 5 % des patients.
Le prucalopride est un agoniste hautement sélectif du récepteur sérotoninergique (5-HT4) qui entraîne une augmentation de la sécrétion de la muqueuse et de la motilité du côlon par la libération d’ acétylcholine. En raison de la grande sélectivité des récepteurs, les effets secondaires cardiaques observés avec d’ autres agonistes des récepteurs 5-HT4 tels que le cisapride ou le tégasérode ne se produisent pas. La dose initiale recommandée est de 1 mg une fois par jour par voie orale et peut être portée à 2 mg une fois par jour. Le prucalopride entraîne une augmentation de la fréquence des selles chez environ deux tiers des patients et une réduction des symptômes associés tels que le météorisme et l’ inconfort abdominal. Au total, jusqu’ à 20 % des patients peuvent ressentir des effets secondaires sous forme de maux de tête, de nausées ou de diarrhées. Cette substance est un excellent complément aux possibilités thérapeutiques, en particulier dans les cas où le temps de transit du côlon est très retardé. Le fabricant spécifie 12 semaines comme durée maximale de la thérapie. Une garantie de paiement est requise pour une thérapie répétée.
Forme particulière de constipation induite par les opiacés
Pour le traitement des patients gravement malades souffrant de constipation induite par les opiacés et qui n’ ont pas répondu à une thérapie laxative combinée consistant en laxatifs osmotiques et stimulants ou en lubiprostone, la méthylnaltrexone (Relistor®), un antagoniste des récepteurs opioïdes μ à action périphérique, est disponible. Il ne s’ agit pas d’ une thérapie à long terme avec un intervalle de dose fixe, mais elle est utilisée selon les besoins, lorsque d’ autres mesures thérapeutiques ont échoué. Il est administré par voie sous-cutanée à une dose maximale de 12 mg toutes les 48 heures, à une dose adaptée (8 mg) pour un poids corporel inférieur à 62 kg. Comme la substance ne peut pas traverser la barrière hémato-encéphalique, l’ effet analgésique des opiacés sur le système nerveux central est préservé. Cependant, pour des raisons inconnues, seule la moitié environ des patients y répondent. Les effets secondaires les plus fréquemment observés sont les flatulences et les douleurs abdominales. La durée de la thérapie dans les études d’ approbation était de 4 mois au maximum. La dose doit être réduite de moitié en cas d’ insuffisance rénale grave (clairance de la créatinine < 30 ml/min). En cas de constipation idiopathique chronique primaire, la substance n’ est pas efficace (tab. 2).
Forme particulière du syndrome du côlon irritable à prédominance de constipation (IBS-C)
Le linaclotide (Constella®) est disponible depuis plusieurs années pour le traitement du syndrome du côlon irritable à prédominance de constipation. Le peptide composé de 14 acides aminés provoque une augmentation locale de la concentration en cGMP par activation directe de la guanylate cyclase C (GC-C) présente dans l’ épithélium intestinal, ce qui entraîne la sécrétion de chlorure, de bicarbonate et d’ eau dans la lumière intestinale par activation d’ un canal ionique de chlorure. En outre, la substance aurait des propriétés analgésiques résultant d’ une influence sur l’ hypersensibilité viscérale, qui à son tour joue un rôle physiopathologique important dans le syndrome du côlon irritable. Pour l’ IBS-C, 290 µg/j de linaclotide p.o. sont administrés une fois par jour 30 minutes avant le repas (de midi) pour une durée maximale de 3 mois. Dans l’ étude d’ approbation portant sur un total de 1276 patients, 20% des patients ont connu une augmentation significative de la fréquence des selles, contre seulement 5% dans le groupe placebo. Un tiers des patients ont également rapporté une diminution des flatulences et des douleurs abdominales. Un avantage cliniquement pertinent par rapport aux laxatifs classiques est l’ effet viscéral-analgésique, qui ne s’ installe toutefois qu’ après plusieurs semaines de thérapie (tab. 2).
Principes de thérapie pour les troubles de l’ évacuation anorectale
Pour le traitement des troubles fonctionnels de l’ évacuation anorectale dus à une contraction paradoxale du sphincter ou à un manque de relaxation de la boucle puborectale pendant la pression (anisme), la physiothérapie anorectale spécifique ainsi que le biofeedback pour optimiser la pression abdominale et améliorer la coordination et la perception anorectale constituent les méthodes de choix. La pression du sphincter pendant la défécation est visualisée pour le patient à l’ aide de divers capteurs, de sorte que les contractions inadéquates des muscles du plancher pelvien et du sphincter peuvent être modifiées. L’ efficacité de plusieurs séances de biofeedback est bien documentée et dépasse celle de la thérapie laxative.
Dans le cas de maladies anorectales structurelles, par exemple une rectocèle ou une invagination cliniquement pertinente, une procédure chirurgicale peut également être indiquée chez certains patients (par ex. une résection rectale transanale à la pince mécanique), idéalement après une discussion interdisciplinaire dans un centre du plancher pelvien certifié.
Cet article est une traduction de « der informierte arzt » 01_2020
Zentrum für Gastroenterologie und Hepatologie
Vulkanplatz 8
8048 Zürich
fruehauf@zgh.ch
L’ auteur a déclaré n’ avoir aucun conflit d’ intérêts en relation avec cet article.
- Pour un traitement différencié de la constipation, il est important de connaître l’ étiologie sous-jacente et d’ exclure les causes secondaires, en particulier les médicaments et le carcinome du côlon.
- Outre les mesures générales et les agents gonflants, les laxatifs osmotiques tels que le Macrogol ou le lactulose, éventuellement en combinaison avec le bisacodyl (Dulcolax®), constituent la meilleure thérapie.
- Si la thérapie standard ne conduit pas à une réponse clinique, l’ utilisation de lubiprostone (Amitiza®) ou de prucalopride (Resolor®) peut être envisagée.
- Dans le cas du syndrome du côlon irritable à prédominance constipante, le linaclotide (Constella®) est un médicament disponible. En plus de son effet laxatif cet agent a un effet viscéral-analgésique, bien que celui-ci ne s’ installe qu’ après plusieurs semaines de traitement.
- En l’ absence de réponse à la thérapie standard, le diagnostic fonctionnel anorectal et la défécographie par IRM peuvent fournir des informations complémentaires pertinentes pour la thérapie.
1. Fried M, Frühauf H: Obstipation. In: Siegenthalers Differenzialdiagnose, 21. Auflage. Battegay E (ed.), Kapitel 12: 386-94, Thieme-Verlag: Stuttgart 2017
2. Sauter M, Frühauf H: Neue Therapien der Obstipation. Leading Opinions Innere Medizin 2013; 66-69
3. M Camilleri: New treatment options for chronic constipation: Mechanisms, efficacy and safety. Can J Gastroenterol 2011; 25(Suppl B): 29B-35B.
4. Tack J, Müller-Lissner S, Stanghellini V, Boeckxstaens G, Kamm MA, Simren M, Galmiche JP, Fried M: Diagnosis and treatment of chronic constipation – a European perspective. Neurogastroenterol Motil 2011; 23: 697-710.
5. Frühauf H: Herausforderung Obstipation: Strukturierte Diagnostik, individualisierte Behandlung. Hausarzt Praxis 2009; 4: 9-13
6. Fruehauf H, Fox M: Obstipation. Gastroenterologe 2008; 3: 488-496.
7. Rao SS (2007) Constipation: evaluation and treatment of colonic and anorectal motility disorders. Gastroenterol Clin North Am 36: 687–711. Laxatifs stimulants de type diphénylméthane
8. Kamm MA, Mueller-Lissner S, Wald A, Richter E, Swallow R, Gessner U: Oral bisacodyl is effective and well-tolerated in patients with chronic constipation. Clin Gastroenterol Hepatol 2011; 9: 577-583.
9. Mueller-Lissner S, Kamm MA, Wald A, Hinkel U, Koehler U, Richter E, Bubeck J: Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. Am J Gastroenterol 2010; 105: 897-903.
Prucalopride
10. Camilleri M, Kerstens R, Rykx A, Vandeplassche L: A placebo-controlled trial of prucalopride for severe chronic constipation. N Engl J Med 2008; 358: 2344-2354.
11. Quigley EM, Vandeplassche L, Kerstens R, Ausma J: Clinical trial: the efficacy, impact on quality of life, and safety and tolerability of prucalopride in severe chronic constipation – a 12-week, randomized, double-blind, placebo-controlled study. Aliment Pharmacol Ther 2009; 29: 315-328.
12. Tack J, van Outryve M, Beyens G, Kerstens R, Vandeplassche L: Prucalopride (Resolor) in the treatment of severe chronic constipation in patients dissatisfied with laxatives. Gut 2009; 58: 357-365. Lubiprostone
13. Johanson JF, Morton D, Geenen J, Ueno R: Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of lubiprostone, a locally-acting type-2 chloride channel activator, in patients with chronic constipation. Am J Gastroenterol 2008; 103: 170-177.
14. Bassil AK, Borman RA, Jarvie EM, McArthur-Wilson RJ, Thangiah R, Sung EZ, Lee K, Sanger GJ: Activation of prostaglandin EP receptors by lubiprostone in rat and human stomach and colon. Br J Pharmacol 2008; 154: 126-135. Linaclotide
15. Lembo AJ, Kurtz CB, Macdougall JE, Lavins BJ, Currie MG, Fitch DA, Jeglinski BI, Johnston JM: Efficacy of linaclotide for patients with chronic constipation. Gastroenterology 2010; 138: 886-895. Constipation induite par les opiacés
16. Camilleri M. Opioid-induced constipation: challenges and therapeutic Opportunities. Am J Gastroenterol 2011; 106: 835-842.
la gazette médicale
- Vol. 9
- Ausgabe 2
- April 2020