- Gastrointestinale Stromatumore
Gastrointestinale Stromatumore (GIST) sind seltene Tumore des Abdomens, an denen in der Schweiz ungefähr 80 Patienten jährlich erkranken. Seit 20 Jahren besteht grosses Interesse an GIST bei Onkologen und multidisziplinären Teams weltweit, weil mit der Aufklärung der pathogenetischen Mechnismen und der Verfügbarkeit zielgerichteter Therapien wirksame Behandlungen auch bei fortgeschrittener Erkrankung möglich sind, neben der kurativen Chirurgie lokalisierter GIST. Der sequentielle Einsatz der Tyrosinkinase-Inhibitoren Imatinib, Sunitinib und Regorafenib hat bei metastasierten Patienten das Gesamtüberleben von 18 auf mehr als 60 Monate verlängert. Neue Substanzen wie Ripretinib und Avapritinib werden diese Zahlen weiter erhöhen. Avapritinib erlaubt neu die Behandlung von GIST mit PDGFRA Exon 18 D842V Mutation, die bisher als resistent galt.
Les tumeurs stromales gastro-intestinales (GIST) sont des tumeurs rares de l’abdomen qui touchent environ 80 patients en Suisse chaque année. Depuis 20 ans, les GIST suscitent un grand intérêt parmi les oncologues et les équipes multidisciplinaires du monde entier, car l’élucidation des mécanismes pathogéniques et la disponibilité de thérapies ciblées ont rendu possible un traitement efficace même dans les maladies avancées, en plus de la chirurgie curative des GIST localisées. L’utilisation séquentielle des inhibiteurs de la tyrosine kinase imatinib, sunitinib et regorafenib a permis de prolonger la survie globale de 18 à plus de 60 mois chez les patients atteints de métastases. De nouveaux composés tels que le ripretinib et l’avapritinib vont encore augmenter ces chiffres. L’avapritinib permet désormais de traiter les GIST avec la mutation D842V de l’exon 18 du PDGFRA, qui était auparavant considérée comme résistante.
Klinik
Zwei Drittel der Patienten mit GIST werden erstmals wegen Symptomen wie Schluckstörungen, Völlegefühl, gastrointestinalen Blutungen oder Unterleibsschmerzen etc. diagnostiziert. Zunehmend werden GIST bei Routine-Kontrollen (z.B. Anämie) bzw. endoskopischen, radiologischen oder chirurgischen Untersuchungen und Behandlungen gefunden. Immer häufiger werden asymptomatische GIST < 2cm entdeckt, die molekular identisch mit grösseren GIST sind. Diese kleinen GIST müssen (endosonographisch) verfolgt, aber nur bei Grössenprogredienz zwingend reseziert werden (1, 2)
Pathologie und molekulare Biologie
Die pathologische Diagnose erfolgt anhand typischer morphologischer Merkmale und der Immunhistochemie. GIST werden als Spindelzelltyp (70%), Epitheloidzelltyp (20%) oder gemischtzelliger Typ (10%) klassifiziert und sind in 95% der Fälle positiv für CD117 («KIT»).Pathogenetisch sind für 85% aller GIST Mutationen in den Rezeptoren KIT und PDGFRA verantwortlich. Diese « gain-of-function » Mutationen (3) führen zu einer dauerhaften, onkogenen Aktivierung der defekten Rezeptoren KIT oder PDGFRA.(4) Die Mutationsanalyse sollte regelmässig erfolgen, da sie von prognostischer und prädiktiver Bedeutung ist. 10-15% sind sogenannte wild-type GIST und weisen keine dieser Mutationen auf, sondern u.a. BRAF-Mutationen, Mutationen der Gene für den Succinat Dehydrogenase Enzym Komplex (5, 6) auf oder andere (7). Die meisten GIST treten sporadisch auf, selten im Rahmen von Syndromen oder als Rarität familiär-vererbbar (6).
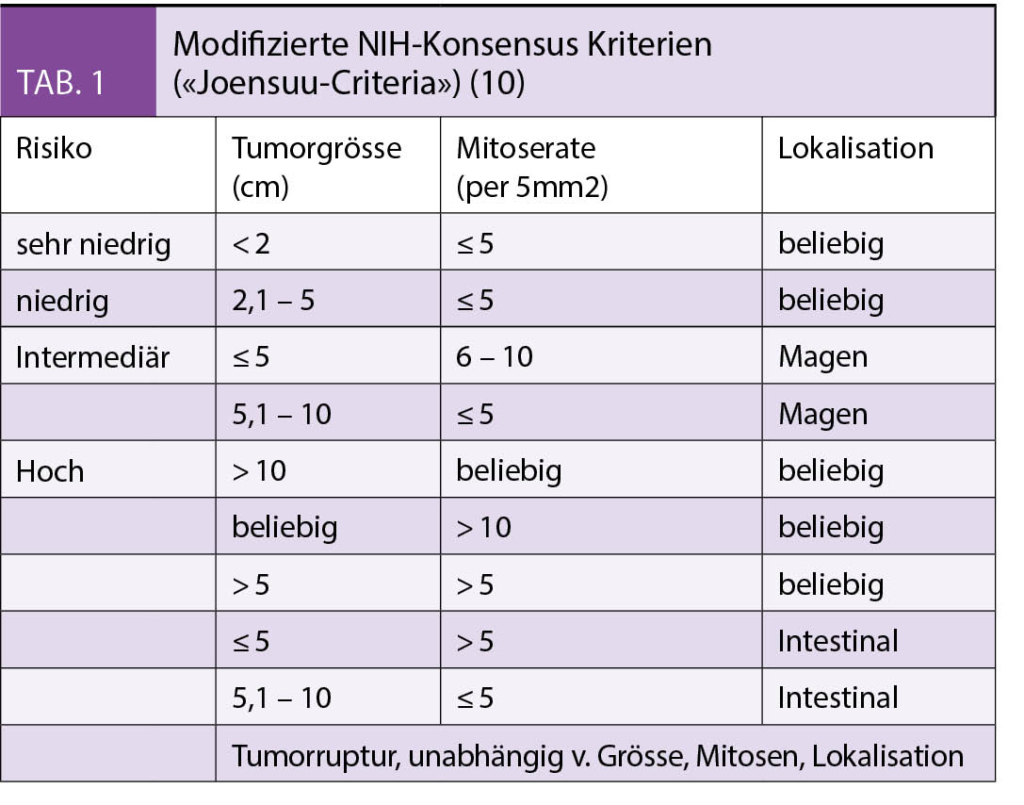
Wichtig für die Risikoabschätzung ist neben der Tumorgrösse und Lokalisation die Mitoserate (8), die als Mitosezahl/5mm2 der aktivsten Region angegeben wird (1).
Ausbreitungsdiagnostik und Erfolgsbeurteilung
Die Computertomographie (CT) gilt als Standard der Ausbreitungsdiagnostik, kann aber durch die Kernspintomographie und die Positronen-Emissionstomographie ersetzt beziehungsweise ergänzt werden. Das radiologische Stadium entscheidet wesentlich die initiale Therapiemodalität.
Bei fehlenden extraabdominalen Metastasen in der Erstdiagnostik und ausbleibender Progression können die Nachsorgeuntersuchungen oder Therapiekontrollen auf das Abdomen beschränkt werden. Die Erfolgsbeurteilung unter Therapie erfolgt sowohl anhand RECIST als auch der CHOI-Kriterien, die Änderungen der Tumorgrösse und der Dichte berücksichtigt. Unter Therapie mit TKI erfolgen Verlaufskontrollen im Abstand von 3 Monaten, bei Tumorblutung, oder -ruptur und Tumoren in ungünstiger Lokalisation, insbesondere zu Beginn auch engmaschiger.
Resezierte GIST werden risiko-adaptiert nachgesorgt. Tumore sehr geringen Risikos bedürfen keiner Nachsorge, Hochrisiko-GIST sollten in den ersten drei Jahren 2-4x pro Jahr ein abdominales CT oder MRT erhalten (1).
Resezierbare Erkrankung
Die komplette chirurgische Entfernung aller sichtbaren Tumoranteile gilt als kurative Standardbehandlung lokalisierter, resezierbarer GIST (1, 2).
Adjuvante Therapie
Das Risiko eines Rückfalls hängt von der Grösse und Lokalisation des Primärtumors und wesentlich von der Mitoserate ab (8). Die sogenannten «Contourmaps» (9) erlauben eine kontinuierlichere Risikoabschätzung, besonders hilfreich bei grenzwertigen und intermediären Risikogruppen. Wichtig ist die Identifizierung der Hoch-Risikogruppe (9, 10), für die eine adjuvante Behandlung mit Imatinib einen signifikanten Überlebensvorteil gezeigt hat (11). (Tabelle 1) Die Dauer der adjuvanten Therapie sollte mindestens drei Jahre, wenn nicht lebenslang betragen (1, 2, 12).
Metastasierte Erkrankung
Bei metastasierter Erkrankung erfolgt eine systemische Therapie mit den zugelassenen Tyrosinkinase-Inhibitoren Imatinib, Sunitinib und Regorafenib, die das mediane Gesamtüberleben dieser Patienten von vormals 18 auf mehr als 60 Monate erhöht haben (4).
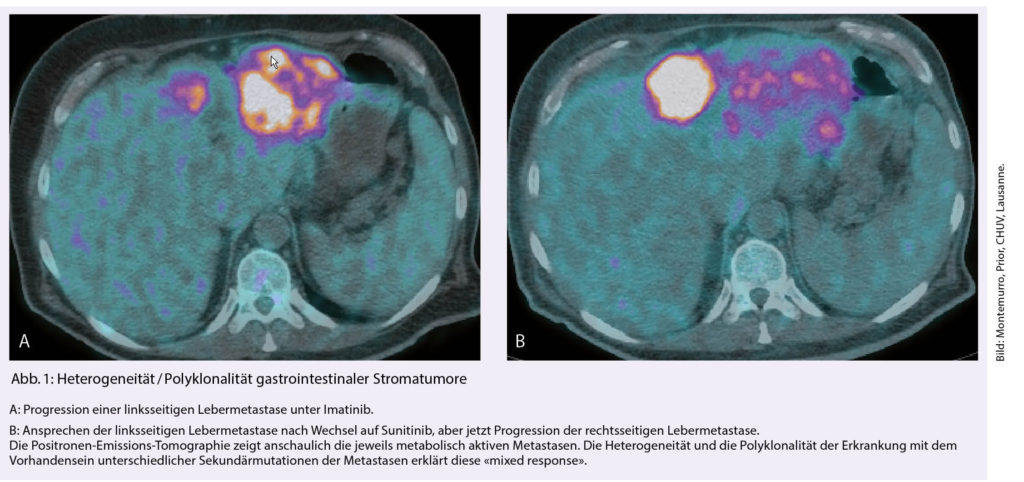
In der Erstlinie wird Imatinib verabreicht, 400mg/Tag bei allen sensitiven Mutationen und 2x400mg/Tag im Falle einer Mutation KIT Exon 9. Die objektiven Ansprechraten betragen zwischen 35-75% je nach Mutation. Molekulare Techniken zeigen, dass bereits bei Initialdiagnose eine oder mehrere Sekundärmutationen vorliegen können, die im Verlauf bei den meisten Patienten das Therapieversagen verursachen (Abb. 1).
In der zweiten Therapielinie wird Sunitinib eingesetzt. Die Standarddosierung ist 50 mg/Tag über vier Wochen, mit anschliessender zweiwöchiger Therapiepause. Viele Patienten wechseln auf die alternative Dosierung von 37,5 mg/Tag wegen der besseren Verträglichkeit.
Bei einer erneuten Progression kommt Regorafenib zum Einsatz. Die wenigsten Patienten werden dauerhaft mit der zugelassenen Standard-Dosierung von 160 mg/Tag über 3 Wochen behandelt, gefolgt von einer Woche Pause, sondern mit reduzierten Dosen (13). Der sequentielle Einsatz von Imatinib, Sunitinib und Regorafenib führt zu medianen Überlebenszeiten von mindestens 5 Jahren (1, 2).
Pharmakokinetik
Allen Tyrosinkinaseinhibitoren ist gemeinsam, dass Unterschiede in der Pharmakokinetik eine individuelle Anpassung der Dosierung erfordern. Für Imatinib gibt es Hinweise, dass niedrige Plasmaspiegel mit schlechteren Ergebnissen einher gehen (14). Die Compliance spielt bei den GIST eine wesentliche Rolle beim Therapieerfolg.
Präoperative Therapie
GIST können aufgrund ihrer Grösse oder Tumorlokalisation, nicht immer einfach reseziert werden, weswegen ausgewählte Patienten mit Imatinib präoperativ behandelt werden, obwohl evidenz-basierte Daten hierzu fehlen. Die Entscheidung sollte immer in einem multidisziplinären Team getroffen werden. Bei hepatischen Metastasen und Therapieansprechen kann eine präoperative Therapie eine kurative Resektion ermöglichen (1, 2, 15).
Blutung und Tumorruptur
Gastrointestinale Stromatumore neigen sowohl zu intraabdominalen, als auch intraluminalen Blutungen, die eine multidisziplinäre Therapieentscheidung verlangen. Liegt eine auf Imatinib-sensitive Mutation vor, kann unter engmaschiger Überwachung eine präoperative Therapie mit Imatinib erfolgen, worunter es häufig zu einer raschen Tumorkontrolle kommt. Lebensbedrohliche Blutungen erfordern ein rasches chirurgisches oder interventionelles Handeln.
Die spontane oder intraoperative Tumorruptur in den Bauchraum oder intraperitoneal verschlechtert die Prognose und ist mit einer metastasierten Erkrankung gleichzusetzen, weswegen selbst bei ansonsten erfolgreicher Resektion eine dauerhafte adjuvante Therapie erforderlich ist (1, 2, 15).
Neue Substanzen
Vor wenigen Tagen hat Avapritinib die Zulassung der amerikanischen FDA für die Behandlung aller PDGFRA Mutationen erhalten, inklusive der bisher primär resistenten PDGFRA Exon 18 D842V Mutation. Tumore mit Sekundärmutationen in KIT Exon 13 V654A und KIT Exon 14 T670I sprechen nicht auf Avapritinib an, aber auf Sunitinib. Bei allen anderen Mutationen hat Avapritinib (Blu-285) in der vierten Linie zu einer objektiven Tumorreduktion bei 22% der Patienten geführt (16).
Ripretinib (DCC-2618) ist eine weitere Substanz, die in einer kleineren Studie bei vorbehandelten Patienten, hohe Wirksamkeit gezeigt hat (17). Beide Substanzen sind in der Schweiz noch nicht zugelassen, werden aber aktuell in Studien eingesetzt und untersucht.
Immuntherapie und Liquid Biopsy
Die Immuntherapie mittels Checkpoint-Inhibitoren (18) in der Monotherapie spielt zur Zeit keine Rolle, was sich aber sicher ändern wird (19, 20).
GIST können mittels «Liquid Biopsy» diagnostiert bzw. nachverfolgt werden, aktuell aber nur im Rahmen von Studien oder Forschungsfragen (21).
Fazit
Gastrointestinale Stromatumore sollten in einem multidisziplinären Team stadiengerecht behandelt werden. Das Zusammenspiel aller Disziplinen sichert den langfristigen Behandlungserfolg. Das Stadium und der molekulare Mutationsstatus bestimmen das Vorgehen und die Prognose. Die Tyrosinkinase-Inhibitoren Imatinib, Sunitinib, Regorafenib und die neueren Substanzen haben die Prognose der erkrankten Patienten erheblich verbessert und ermöglichen heute auch die erfolgreiche Behandlung der bisher als primär resistent geltenden PDGFRA Exon 18 D842V Mutation. Patienten finden Information bei der GIST-Gruppe Schweiz (www.gist.ch).
Oncologie médicale
CHUV Centre Hospitalier Universitaire Vaudois
Rue du Bugnon 46
1011 Lausanne
Michael.montemurro@chuv.ch
Aufwandsentschädigungen und Kongresszuschüsse von Bayer, Lilly, PharmaMar, Pfizer, Roche, Servier.
- GIST werden multidisziplinär behandelt
- Lokalisierte GIST werden kurativ chirurgisch reseziert.
- Hochrisiko-GIST* werden adjuvant nachbehandelt (*Grösse, Lokalisation, Mitoserate)
- Die Mutationsanalyse hat hohe therapeutische Relevanz
- Bei metastasierten Patienten haben die TKIs das Überleben deutlich verlängert.
Messages à retenir
- Les GIST sont traitées de manière multidisciplinaire
- Les GIST localisées sont réséquées chirurgicalement de manière curative.
- Les GIST* à haut risque sont traités de manière adjuvante (*taille, localisation, taux de mitose)
- L’analyse des mutations a une grande pertinence thérapeutique
- Chez les patients métastatiques, les inhibiteurs de la tyrosinkinase ont prolongé de manière significative la survie.
1 Casali PG, Abecassis N, Aro HT, Bauer S, Biagini R, Bielack S, et al. Gastrointestinal stromal tumours: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology : official journal of the European Society for Medical Oncology. 2018;29(Suppl 4):iv267.
2. Etherington MS, DeMatteo RP. Tailored management of primary gastrointestinal stromal tumors. Cancer. 2019.
3. Hirota S. Gain-of-Function Mutations of c-kit in Human Gastrointestinal Stromal
Tumors. Science. 1998;279(5350):577-80.
4. Cioffi A, Maki RG. GI Stromal Tumors: 15 Years of Lessons From a Rare Cancer. Journal of clinical oncology : official journal of the American Society of Clinical
Oncology. 2015;33(16):1849-54.
5. Boikos SA, Pappo AS, Killian JK, LaQuaglia MP, Weldon CB, George S, et al.
Molecular Subtypes of KIT/PDGFRA Wild-Type Gastrointestinal Stromal Tumors:
A Report From the National Institutes of Health Gastrointestinal Stromal Tumor
Clinic. JAMA oncology. 2016;2(7):922-8.
6. Neppala P, Banerjee S, Fanta PT, Yerba M, Porras KA, Burgoyne AM, et al. Current management of succinate dehydrogenase-deficient gastrointestinal stromal tumors. Cancer metastasis reviews. 2019;38(3):525-35.
7. Nannini M, Urbini M, Astolfi A, Biasco G, Pantaleo MA. The progressive fragmentation of the KIT/PDGFRA wild-type (WT) gastrointestinal stromal tumors (GIST).
Journal of translational medicine. 2017;15(1):113.
8. Joensuu H, Eriksson M, Hall KS, Hartmann JT, Pink D, Schutte J, et al. Risk factors for gastrointestinal stromal tumor recurrence in patients treated with adjuvant imatinib. Cancer. 2014;120(15):2325-33.
9. Joensuu H, Vehtari A, Riihimaki J, Nishida T, Steigen SE, Brabec P, et al. Risk of
recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts. The Lancet Oncology. 2012;13(3):265-74.
10. Rutkowski P, Bylina E, Wozniak A, Nowecki ZI, Osuch C, Matlok M, et al. Validation of the Joensuu risk criteria for primary resectable gastrointestinal stromal tumour – the impact of tumour rupture on patient outcomes. European journal of surgical
oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 2011;37(10):890-6.
11. Joensuu H, Eriksson M, Sundby Hall K, Reichardt A, Hartmann JT, Pink D, et al. Adjuvant Imatinib for High-Risk GI Stromal Tumor: Analysis of a Randomized Trial. Journal of clinical oncology : official journal of the American Society of Clinical
Oncology. 2016;34(3):244-50.
12. Joensuu H, Eriksson M, Sundby Hall K, Hartmann JT, Pink D, Schutte J, et al.
One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. Jama. 2012;307(12):1265-72.
13. Nannini M, Nigro MC, Vincenzi B, Fumagalli E, Grignani G, D’Ambrosio L, et al. Personalization of regorafenib treatment in metastatic gastrointestinal stromal
tumours in real-life clinical practice. Therapeutic advances in medical oncology. 2017;9(12):731-9.
14. Demetri GD, Wang Y, Wehrle E, Racine A, Nikolova Z, Blanke CD, et al. Imatinib plasma levels are correlated with clinical benefit in patients with unresectable/
metastatic gastrointestinal stromal tumors. Journal of clinical oncology: official
journal of the American Society of Clinical Oncology. 2009;27(19):3141-7.
15. Hohenberger P, Montemurro M, Raut CP, Rutkowski P. Gastrointestinal Stromal
Tumors. Visceral medicine. 2018;34(5):376-9.
16. Heinrich MC, Jones RL, Mehren Mv, Bauer S, Kang Y-K, Schoffski P, et al. Clinical activity of avapritinib in ≥ fourth-line (4L+) and PDGFRA Exon 18 gastrointestinal stromal tumors (GIST). JCO. 2019;37(15_suppl):11022-.
17. George S, Heinrich MC, Abdul Razak AR, Chi P, Gordon MS, Ganjoo KN, et al. Mutation profile of drug resistant gastrointestinal stromal tumor (GIST) patients (pts) enrolled in the phase 1 study of DCC-2618. JCO. 2018;36(15_suppl):11511-.
18. Toulmonde M, Penel N, Adam J, Chevreau C, Blay JY, Le Cesne A, et al. Use of PD-1 Targeting, Macrophage Infiltration, and IDO Pathway Activation in Sarcomas: A Phase 2 Clinical Trial. JAMA oncology. 2018;4(1):93-7.
19. Pantaleo MA, Tarantino G, Agostinelli C, Urbini M, Nannini M, Saponara M, et al. Immune microenvironment profiling of gastrointestinal stromal tumors (GIST) shows gene expression patterns associated to immune checkpoint inhibitors response. Oncoimmunology. 2019;8(9):e1617588.
20. Vitiello GA, Bowler TG, Liu M, Medina BD, Zhang JQ, Param NJ, et al. Differential immune profiles distinguish the mutational subtypes of gastrointestinal stromal tumor. The Journal of clinical investigation. 2019;129(5):1863-77.
21. Jilg S, Rassner M, Maier J, Waldeck S, Kehl V, Follo M, et al. Circulating cKIT and PDGFRA DNA indicates disease activity in Gastrointestinal Stromal Tumor (GIST). International journal of cancer. 2019;145(8):2292-303.
info@onco-suisse
- Vol. 10
- Ausgabe 2
- April 2020