- Immuntherapiekombinationen als Standard in der Erstlinie
Das Nierenzellkarzinom gehört zu den häufigeren malignen Tumoren des Erwachsenen und macht 85% aller malignen Nierentumoren aus. Zunehmend werden Nierenzellkarzinome inzidentiell im Rahmen abdomineller Diagnostik detektiert. Histologisch dominiert das klarzellige neben dem papillären und chromophoben Nierenzellkarzinom. Dieser Beitrag gibt einen Überblick über die derzeitigen therapeutischen Möglichkeiten und deren klinische Resultate im metastasierten Krankheitsstadium.
Le carcinome rénal est l’une des tumeurs malignes les plus courantes chez l’adulte et représente 85 % de toutes les tumeurs rénales malignes. De plus en plus, les carcinomes des cellules rénales sont détectés accidentellement dans le cadre du diagnostic abdominal. Histologiquement, le carcinome à cellules claires domine aux côtés du carcinome papillaire et du carcinome chromophobe des cellules rénales. Cet article donne un aperçu des options thérapeutiques actuelles et de leurs résultats cliniques au stade métastatique de la maladie.
Die Zahl der Neuerkrankungen an Nierenzellkarzinomen beträgt in der Schweiz etwa 1000 pro Jahr. Männer sind dabei häufiger als Frauen betroffen. Das mittlere Erkrankungsalter liegt bei etwa 70 Jahren. Ungefähr 300 Patienten versterben an ihrer Erkrankung. (1) Häufig werden Nierenzellkarzinome zufällig im Rahmen bildgebender abdomineller Untersuchungsverfahren (Sonographie, CT, MRI) detektiert.
Als Risikofaktoren für die Entwicklung eines Nierenzellkarzinoms gelten neben hereditären Syndromen erworbene Faktoren wie arterielle Hypertonie, chronische Niereninsuffizienz, Übergewicht und Nikotinabusus (2).
Histologisch sind etwa 80% der Tumoren klarzellig. Daneben finden sich in etwa 15% die papillären Karzinome Typ 1 und Typ 2 und in 5% chromophobe Tumoren. Eine sarkomatoide Differenzierung kann bei allen drei Subtypen auftreten und ist mit einer schlechteren Prognose assoziiert (3). Klinisch unterscheidet man prinzipiell das lokale und das metastasierte Nierenzellkarzinom.
Im lokalen Stadium ist die Operation die Methode der Wahl. Neben der radikalen kommt die partielle Tumornephrektomie zum Einsatz, entweder offen oder endoskopisch. Daneben spielen auch minimal-invasive, ablative Verfahren in selektionierten Patienten eine Rolle (4). Bislang konnte die adjuvante TKI Therapie im lokal begrenzten Stadium keinen signifikanten OS Vorteil zeigen und ist nicht zugelassen (5). Im Folgenden wird näher auf das metastasierte Tumorstadium eingegangen.
Risikofaktoren des metastasierten Nierenzellkarzinoms
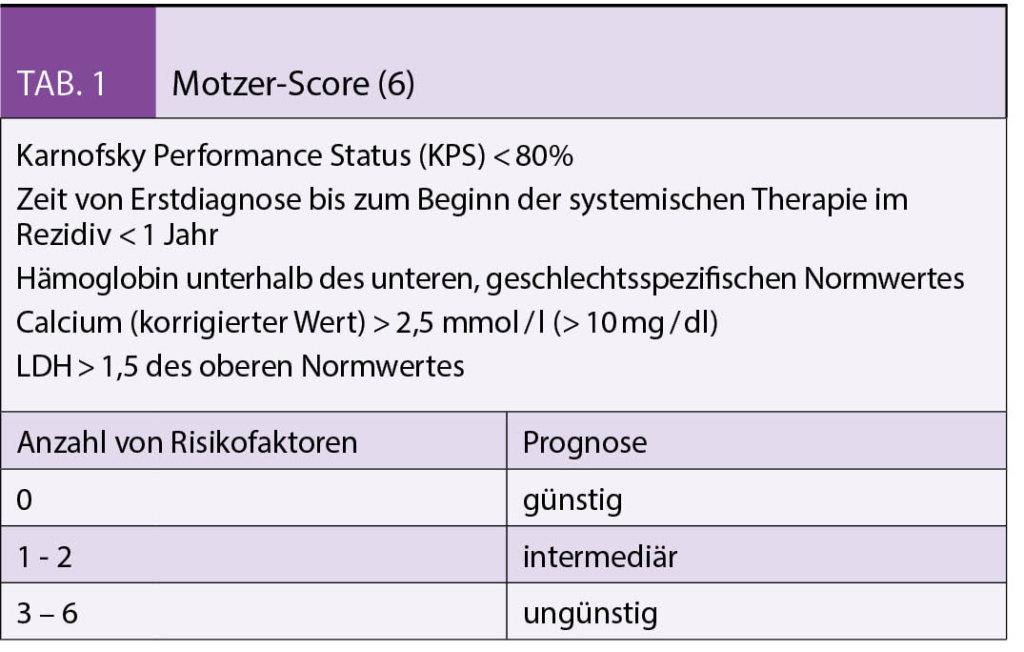
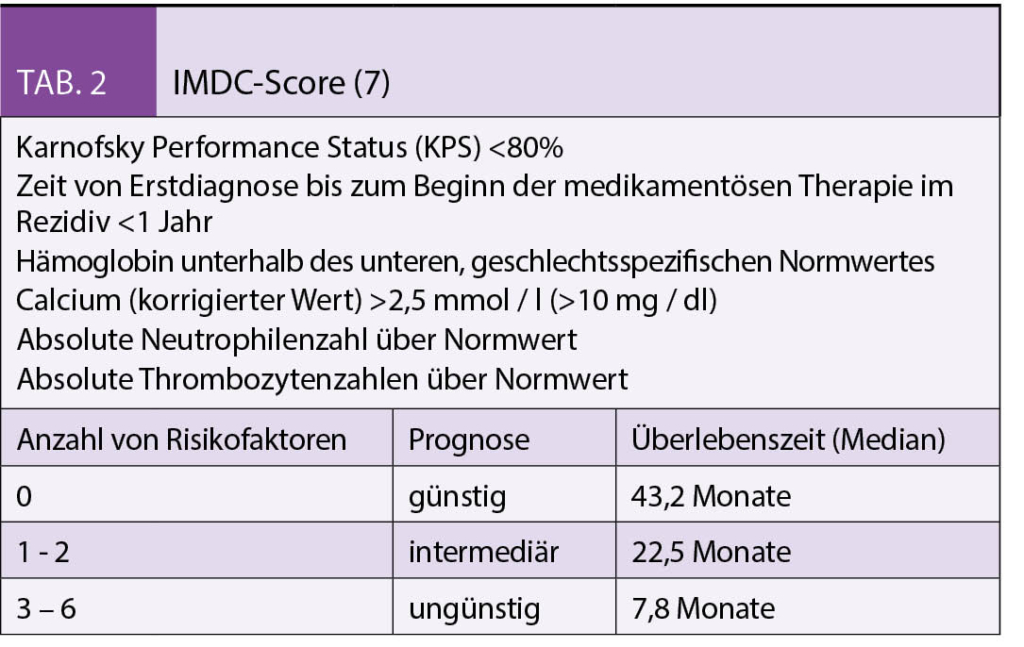
Die metastasierten Tumorstadien werden in die Risikogruppen niedriges, intermediäres und hohes Risiko anhand definierter prognostischer Faktoren eingeteilt. Jedem Risikofaktor wird ein Punkt gegeben. Neben dem Motzer-Score (Tab. 1) wird aktuell vorwiegend der International Metastatic Renal-Cell Carcinoma Database Consortium (IMDC) (Tab. 2) Score zur Einteilung angewendet (6-7).
Rolle der Tumornephrektomie
In der Vergangenheit galt die Nephrektomie vor Systemtherapie als obligater Standard, begründet durch positive prospektive und retrospektive Studienergebnisse (8-9). Die Daten aus der in 2018 veröffentlichten CARMENA Studie (prospektive Nicht-Unterlegenheitsstudie bei Patienten mit intermediärem und hohem Risiko) zeigten hingegen, dass die alleinige TKI Therapie mit Sunitinib der Tumornephrektomie plus Sunitinib nicht unterlegen war. (10) Diese Ergebnisse decken sich mit den Daten der SURTIME Studie. (11) Aktuell erfolgt die palliative Tumornephrektomie nur noch bei selektionierten Patienten. Eine frühzeitige interdisziplinäre Vorstellung ist notwendig (Tab. 3).
Oligometastasierung
In der oligometastatischen Situation (≤ 5 Metastasen) kann durch alleinige Resektion des Primarius und der Metastasen bzw. stereotaktische Radiatio der Metastasen versucht werden, den Start einer Systemtherapie hinauszuzögern. Gleiches gilt für Patienten mit niedriger Tumorlast, fehlender/diskreter Progression ohne klinische Symptome. Eine watchful waiting Strategie unter engmaschiger bildgebender und klinischer Kontrolle ist ebenfalls möglich (12).
Erstlinientherapie des meta-stasierten Nierenzellkarzinoms
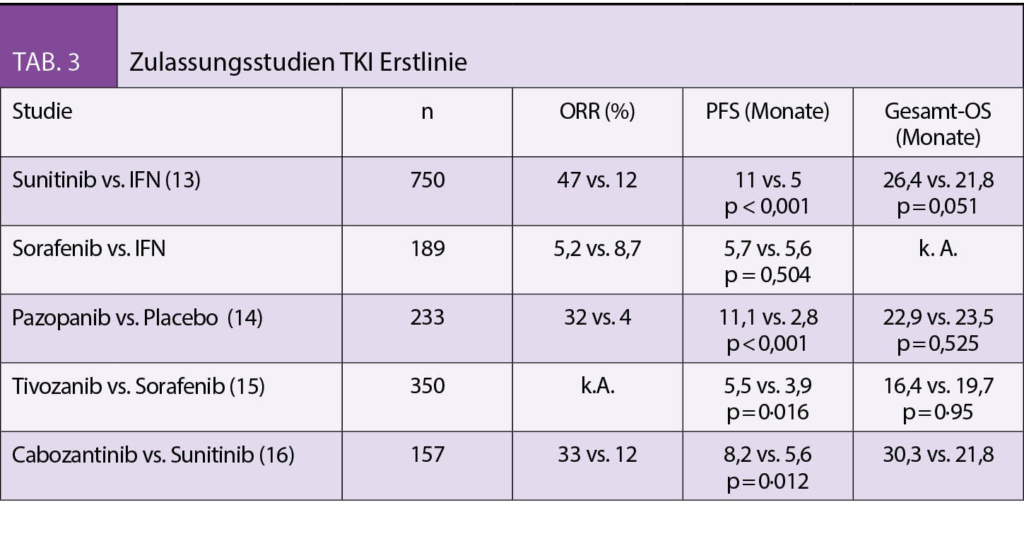
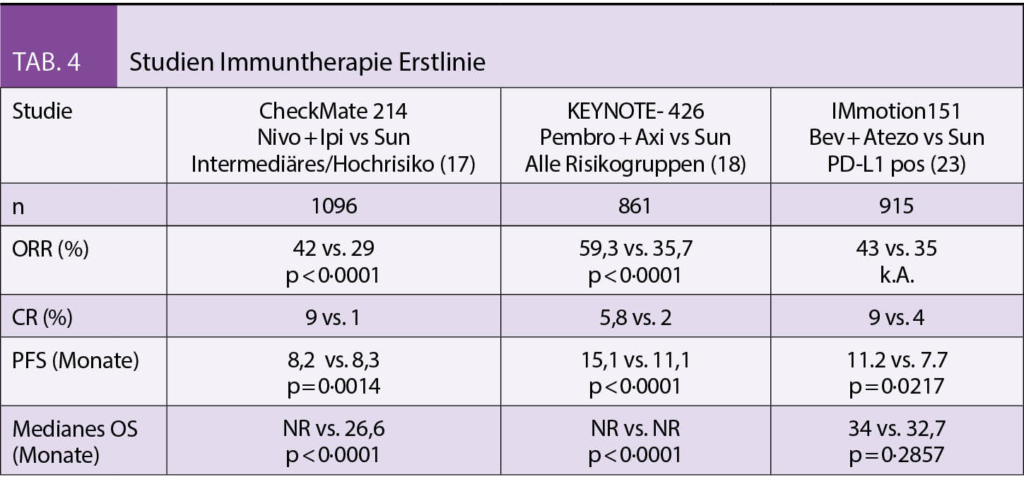
In den letzten Jahren wurden viele neue Substanzen zugelassen. Die TKIs Sunitinib, Pazopanib und Tivozanib zeigten dabei einen signifikanten Vorteil im PFS, jedoch nicht im OS (13-15). Die Substanzen wurden in den Studien mit dem damaligen Standard Interferon-alpha bzw. Placebo verglichen. Eine publizierte Phase-II Studie verglich Cabozantinib mit Sunitinib und konnte für die intermediären und Hochrisikopatienten einen signifikanten PFS Benefit sowie einen Trend zu einem besseren OS zeigen (16). Die alleinige Therapie mit einem TKI in der Erstlinie ist seit den positiven Studienergebnissen mit Immuncheckpointinhibitoren nicht mehr erste Wahl. Prospektive randomisierte Studien mit Nivolumab, einem anti-PD-1 Antikörper in Kombination mit Ipilimumab, einem anti-CTLA-4 Antikörper (CheckMate 214) sowie mit Pembrolizumab, einem Anti-PD-1 Antikörper und dem TKI Axitinib (KEYNOTE-426) – jeweils gegen Sunitinib randomisiert – zeigten in beiden Fällen einen signifikanten Vorteil sowohl im Tumoransprechen, im PFS und auch im OS. Nivolumab/Ipilimumab zeigte diesen im Gegensatz zu Pemprolizumab/Axitinib nur für die intermediären und Hochrisikopatienten (17-18). In der Schweiz können Patienten derzeit in eine klinische Phase II Studie (SAKK 07-17), die eine sequentielle Therapie mit Nivolumab und Ipilimumab in der Erstlinie untersucht, eingeschlossen werden. Mehrere Zentren in der Schweiz nehmen teil (Tab. 4).
Zweitlinientherapie des metastasierten Nierenzellkarzinoms
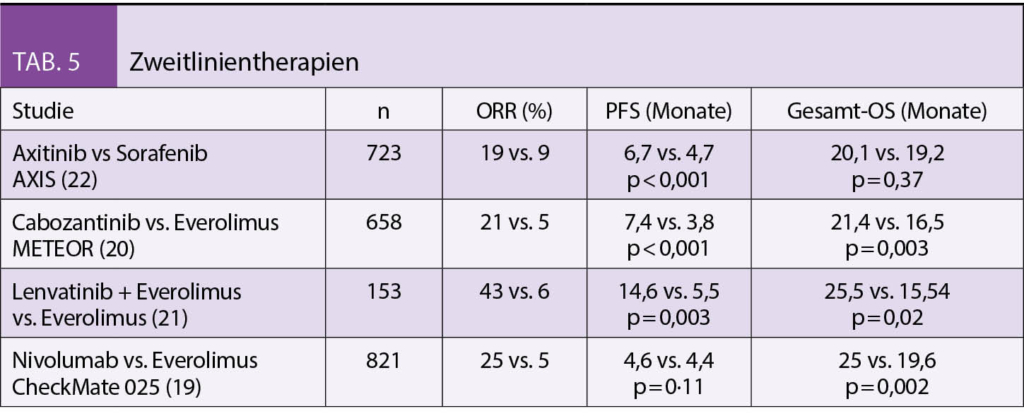
Viele Medikamente der Erstlinie sind auch in der Zweitlinie wirksam. Der Einsatz der Medikamente ist abhängig von der Art der Vorbehandlung und dem Allgemeinzustand des Patienten. Hat ein Patient in der Erstlinie ein TKI kann in der Zweitlinie entweder eine Monotherapie mit dem Immuncheckpointinhibitor Nivolumab (CHECKMATE- 025) oder eine erneute Therapie mit einem anderen TKI, z.B. mit Cabozantinib (METEOR Studie) überlegt werden (19-20). Beide Substanzen hatten in den Zulassungsstudien gegenüber dem damaligen Standard Everolimus, einem mTOR-Inhibitor, einen signifikanten PFS und OS Vorteil gezeigt. Eine weitere Alternative mit einem signifikanten Vorteil im Tumoransprechen und PFS ist die in einer Phase-II Studie getestete Kombination mit dem TKI Lenvatinib in Kombination mit Everolimus. (21) Auch Axitinib ist für die Zweitlinie bei nachgewiesenem signifikantem PFS Vorteil gegenüber dem TKI Sorafenib zugelassen (22). Eine TKI Therapie sollte in jedem Fall bei Patienten eingesetzt werden, die initial mittels einer Immuncheckpointkombination behandelt wurden. Auch bei Patienten, die zunächst mit der Kombination aus Axitinib/Pembrolizumab therapiert wurden ist der Einsatz von Cabozantinib, einem anderen TKI oder der Kombination Lenvatinib/Everolimus indiziert. Eine Kombinationstherapie mit Nivolumab/Ipilimumab kann prinzipiell als Zweitlinientherapie evaluiert werden sofern nicht bereits in der Erstlinie appliziert. Daten zu diesem Vorgehen gibt es derzeit jedoch nicht (Tab. 5).
Folgetherapien/Sequenztherapie
In der Erst- und Zweitlinie nicht eingesetzte Substanzen können weiter in den Folgelinien gegeben werden. Die Identifizierung einer optimalen Sequenz gibt es bislang nicht. Der Einsatz richtet sich in der Regel nach der Vortherapie, dem AZ und des zu erwartenden Nebenwirkungsprofils bzw. der Verträglichkeit.
Therapie des nicht-klarzelligen Nierenzellkarzinoms
Nicht-klarzellige Nierenzellkarzinome sind selten, häufig in den Zulassungsstudien nicht inkludiert, und somit besteht wenig Evidenz, insbesondere bezüglich der Therapie mit Immuncheckpointinhibitoren. Wenn möglich sollten Patienten daher in aktuell laufende Therapiestudien eingeschlossen werden.
Patienten mit sarkomatoider Differenzierung
Sie kann prinzipiell bei allen histologischen Subtypen auftreten. Klinisch weisen die Patienten häufig ein rasches Tumorwachstum auf und zeigen nur eine geringe und kurz anhaltende Ansprechrate auf herkömmliche TKI-Therapien. Diese Tumoren weisen häufig eine hohe Expression des PD-1 und PD-L1 Liganden auf. In Subgruppenanalysen der Studien mit einer Kombinationsimmuntherapie (Nivolumab/Ipilimumab) oder einer Immuntherapie kombiniert mit einer TKI-Therapie (Pembrolizumab/Axitinib) sowie in der Phase III IMmotion 151 Studie (Kombination des VEGF Inhibitors Bevacizumab mit Atezolizumab, einem Anti-PD-L1 Antikörper) waren die ORR, das PFS und das OS der TKI Gabe der alleinigen TKI Therapie mit Sunitinib überlegen (17) (18) (23). Unabhängig von der Risikogruppe sollten daher alle Patienten mit einer sarkomatoiden Differenzierung eine Immunkombinationstherapie erhalten.
Cerebrale Metastasierung
Die Inzidenz für eine cerebrale Metastasierung beträgt etwa 10%. Die optimale Sequenz von chirurgischer und/oder strahlentherapeutischer Behandlung und einer Systemtherapie ist unklar. Zwei kleinere Phase II Studien, die erste mit einer Nivolumab Monotherapie, die zweite mit einer Kombination Nivolumab/Ipilimumab zeigten ein objektives intrakranielles Tumoransprechen (ORR) von 12% bzw. 29%. Der Grossteil der Patienten erhielt additiv eine Lokaltherapie (Radiatio oder Resektion) (24-25).
Rolle der Radiotherapie
Eine strahlentherapeutische Behandlung kommt in aller Regel bei schmerzhaften oder frakturgefährdeten Knochenmetastasen entweder simultan oder konsekutiv zur Systemtherapie sowie bei Vorliegen cerebraler Metastasen zum Einsatz (stereotaktisch, Ganzhirn).
Universitätsspital Zürich
Klinik für Medizinische Onkologie und Hämatologie
Rämistrasse 100
8091 Zürich
anja.lorch@usz.ch
Honorare für Advisory Board: BMS, Ipsen, Janssen, MSD, Novartis.
- Frühzeitige Vorstellung der Patienten in einem interdisziplinären Tumorboard
- Palliative Tumornephrektomie nur noch in selektionierten Patienten
- Klarzellige Nierenzellkarzinome sind am häufigsten
- Es gibt drei Risikogruppen: niedrig, intermediär, hoch
- Immuntherapiekombinationen sind derzeitiger Therapiestandard in der Erstlinie mit signifikant besserem ORR, PFS und OS im Vergleich zu alleiniger TKI-Therapie
- Verfügbare Kombinationen sind Nivolumab/Ipilimumab (gute und intermediäre Risikogruppe) und Pembrolizumab/Axitinib (alle Gruppen)
- In der Zweitlinientherapie kommen Cabozantinib, Nivolumab mono oder die Kombination Lenvatinib/Everolimus als Optionen in Frage
- Patienten mit sarkomatoiden Anteilen sollten Immuntherapiekombinationen unabhängig von der Risikogruppe erhalten
- Nicht-klarzellige Nierenzellkarzinome sollten nach Möglichkeit in Therapiestudien eingeschlossen werden
Messages à retenir
- La présentation précoce des patients dans un conseil interdisciplinaire sur les tumeurs
- La néphrectomie palliative de la tumeur seulement chez certains patients
- Les carcinomes à cellules claires des cellules rénales sont les plus courants
- Il existe trois groupes de risque : faible, moyen, élevé
- Les combinaisons d’immunothérapie sont la norme de soins actuelle en première ligne, avec un ORR, un PFS et un OS significativement meilleurs que le traitement par TKI seul
- Les combinaisons disponibles sont le nivolumab/pilimumab (groupe à risque bon et intermédiaire) et le pembrolizumab/axitinib (tous les groupes)
- Le cabozantinib, le nivolumab mono ou l’association lenvatinib/évérolimus sont des options de traitement de deuxième intention
- Les patients ayant des composants sarcomatoïdes doivent recevoir des associations d’immunothérapie, quel que soit le groupe de risque
- Les carcinomes rénaux à cellules non claires doivent être inclus dans les études thérapeutiques dans la mesure du possible
1. Nationales Institut für Krebsepidemiologie und -Registrierung NICER 2011 – 2015
2. Cho E, Adami HO, Lindblad P: Epidemiology of renal cell cancer. Hematol Oncol Clin North Am 25:651-665, 2011. DOI:10.1016/j.hoc.2011.04.002
3. Moch H, Humphrey PA, Ulbright TM, Reuter VE: WHO Classification of Tumours of the Urinary System and Male Genital Organs. Fourth edition. IARC. Lyon 2016
4. Ljungberg B, Bensalah K, Canfield S et al.: EAU Guidelines on renal cell carcinoma: 2014 update. Eur Urol 67:913-924, 2010. DOI:10.1016/j.eururo.2015.01.005
5. Bamias A, Escudier B, Sternberg CN et al.: Current Clinical Practice Guidelines for the Treatment of Renal Cell Carcinoma: A Systematic Review and Critical Evaluation. Oncologist 22:667-679, 2017. DOI:10.1634/theoncologist.2016-0435
6. Motzer RJ, Bacik J, Murphy BA et al.: Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 20:289-96, 2002. DOI:10.1200/JCO.20.1.289
7. Heng DYC, Xie W, Regan MM, et al.: External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol 14:141-148, 2013. DOI:10.1016/S1470-2045(12)70559-4
8. Flanigan RC, Salmon SE, Blumenstein BA, Bearman SI, Roy V, McGrath PC, Caton JR Jr, Munshi N, Crawford ED. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. N Engl J Med. 2001 Dec 6;345(23):1655-9.
9. Mickisch GH, Garin A, van Poppel H, de Prijck L, Sylvester R; European Organisation for Research and Treatment of Cancer (EORTC) Genitourinary Group. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet. 2001 Sep 22;358(9286):966-70
10. Méjean A, Ravaud A, Thezenas S, et al. Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. N Engl J Med. 2018 Aug 2;379(5):417-42. DOI:10.1056/NEJMoa1803675
11. Bex A, Mulders P, Jewett M, Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients with Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial.JAMA Oncol. 2018 Dec 13. DOI:10.1001/jamaoncol.2018.5543
12. Curr Opin Urol. 2016 Nov;26(6):566-72. doi: 10.1097/MOU.0000000000000330. Metastasis therapies for renal cancer. Dabestani S1, Marconi L, Bex A.
13. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. Motzer RJ, Hutson TE, Tomczak P, Michaelson MD, Bukowski RM, Rixe O, Oudard S, Negrier S, Szczylik C, Kim ST, Chen I, Bycott PW, Baum CM, Figlin RA. N Engl J Med. 2007 Jan 11;356(2):115-24
14. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. Motzer RJ, Hutson TE, Cella D, Reeves J, Hawkins R, Guo J, Nathan P, Staehler M, de Souza P, Merchan JR, Boleti E, Fife K, Jin J, Jones R, Uemura H, De Giorgi U, Harmenberg U, Wang J, Sternberg CN, Deen K, McCann L, Hackshaw MD, Crescenzo R, Pandite LN, Choueiri TK. N Engl J Med. 2013 Aug 22;369(8):722-31. doi: 10.1056/NEJMoa1303989
15. Tivozanib versus sorafenib in patients with advanced renal cell carcinoma (TIVO-3): a phase 3, multicentre, randomised, controlled, open-label study. Rini BI, Pal SK, Escudier BJ, Atkins MB, Hutson TE, Porta C, Verzoni E, Needle MN, McDermott DF. Lancet Oncol. 2020 Jan;21(1):95-104. doi: 10.1016/S1470-2045(19)30735-1. Epub 2019 Dec 3.
16. Choueiri TK, Halabi S, Sanford BL et al.: Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 CABOSUN Trial. J Clin Oncol 35:591-597, 2017. DOI:10.1200/JCO.2016.70.7398
17. Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med. 2018 Apr 5;378(14):1277-1290. DOI:10.1056/NEJMoa1712126
18. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. Rini BI, Plimack ER, Stus V, Gafanov R, Hawkins R, Nosov D, Pouliot F, Alekseev B, Soulières D, Melichar B, Vynnychenko I, Kryzhanivska A, Bondarenko I, Azevedo SJ, Borchiellini D, Szczylik C, Markus M, McDermott RS, Bedke J, Tartas S, Chang YH, Tamada S, Shou Q, Perini RF, Chen M, Atkins MB, Powles T; KEYNOTE-426 Investigators. N Engl J Med. 2019 Mar 21;380(12):1116-1127. doi: 10.1056/NEJMoa1816714. Epub 2019 Feb 16.
19. Motzer RJ, Escudier B, McDermott DF et al.: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 373:1803-1813, 2015. DOI:10.1056/NEJMoa1510665
20. Choueiri TK, Escudier B, Powles T et al.: Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. Lancet Oncol 17:917-927, 2016. DOI:10.1016/S1470-2045(16)30107-3
21. Motzer RJ, Hutson TE, Glen H, et al: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 16:1473-1482, 2015. DOI:10.1016/S1470-2045(15)00290-9
22. Rini BI, Escudier B, Tomczak P, Kaprin A, Szczylik C, Hutson TE, Michaelson MD, Gorbunova VA, Gore ME, Rusakov IG, Negrier S, Ou YC, Castellano D, Lim HY, Uemura H, Tarazi J, Cella D, Chen C, Rosbrook B, Kim S, Motzer RJ. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet. 2011 Dec 3;378(9807):1931-9. doi: 10.1016/S0140-6736(11)61613-9. Epub 2011 Nov 4. Erratum in: Lancet. 2012 Nov 24;380(9856):1818.
23. Rini BI1, Powles T2, Atkins MB3, Escudier B4, McDermott DF5, Suarez C6, Bracarda S7, Stadler WM8, Donskov F9, Lee JL10, Hawkins R11, Ravaud A12, Alekseev B13, Staehler M14, Uemura M15, De Giorgi U16, Mellado B17, Porta C18, Melichar B19, Gurney H20, Bedke J21, Choueiri TK22, Parnis F23, Khaznadar T24, Thobhani A25, Li S26, Piault-Louis E26, Frantz G26, Huseni M26, Schiff C26, Green MC26, Motzer RJ27; IMmotion151 Study Group. Atezolizumab plus bevacizumab versus sunitinib in patients with previously untreated metastatic renal cell carcinoma (IMmotion151): a multicentre, open-label, phase 3, randomised controlled trial. Lancet. 2019 Jun 15;393(10189):2404-2415. doi: 10.1016/S0140-6736(19)30723-8. Epub 2019 May 9.
24. Borchiellini D, Gravis G, Négrier S, Chevreau C, Joly F, Geoffrois L, Ladoire S, Mahammedi H, Rolland F, Gross-Goupil M, Deluche E, Priou F, Laramas M, Barthélémy P, Narciso B, HouedéN, Culine S, Oudard S, Chenot M, Tantot F, Chabaud S, Escudier B, Albiges LSafety and Efficacy of Nivolumab in Brain Metastases From Renal Cell Carcinoma: Results of the GETUG-AFU 26 NIVOREN Multicenter Phase II Study. Flippot R, Dalban CLaguerre B, J Clin Oncol. 2019;37(23):2008. Epub 2019 Jun 13.
25. Emamekhoo H, Olsen M, Curtis Carthon B, Drakaki A, Safety and efficacy of nivolumab plus ipilimumab (NIVO+IPI) in patients with advanced renal cell carcinoma (aRCC) with brain metastases: Interim analysis of CheckMate 920. J Clin Oncol. 2019;37S
info@onco-suisse
- Vol. 10
- Ausgabe 2
- April 2020