- Bronchuskarzinom – NSCLC ohne Treibermutationen
In den letzten Jahren hat die therapeutische Anwendung von Checkpoint Inhibitoren die Therapie des NSCLC revolutioniert. Unter Berücksichtigung der Evidenz aus fünf zwischenzeitlich publizierten randomisierten Phase III Studien – IMPOWER 130 (1), KEYNOTE 189 (2), KEYNOTE 042 (3) IMPOWER 150 (4), KEYNOTE 407 (5) – veröffentlichte die ASCO zusammen mit dem Ontario Cancer Care Center im Januar 2020 ein Update der ASCO Guidelines zur Behandlung des metastasierten Nicht Kleinzelligen Bronchialkarzinoms (NSCLC) ohne Vorliegen einer behandelbaren Treibermutation und ohne programmed death ligand 1 (PD-L1) Vorselektion (6). Die Literaturrecherche umfasste dabei den Zeitraum von Dezember 2015 bis August 2018. Die Ergebnisse der später publizierten CHECKMATE 227 Studie (7) werden in einem zusätzlichen Kommentar diskutiert, führen aber nicht zur Änderung der Empfehlungen und werden hier daher nicht erläutert. Die Empfehlungen zur alleinigen Chemotherapie, zur Zweitlinientherapie und zu weiteren Therapie-linien haben sich nicht geändert, so dass dieser Artikel allein die neuen Empfehlungen zur Erstlinientherapie diskutiert.
Ces dernières années, l’ utilisation thérapeutique des inhibiteurs du checkpoint a révolutionné la thérapie du CPNPC. En tenant compte des résultats de cinq études randomisées de phase III publiées entre-temps – IMPOWER 130 (1), KEYNOTE 189 (2), KEYNOTE 042 (3) IMPOWER 150 (4), NOTA CLÉ 407 (5) – En janvier 2020, l’ ASCO et l’ Ontario Cancer Care Center ont publié une mise à jour des lignes directrices de l’ ASCO pour le traitement du cancer du poumon non à petites cellules (CPNPC) métastatique sans mutation traitable du conducteur et sans présélection du ligand de mort programmé 1 (PD-L1) (6). La recherche documentaire a porté sur la période allant de décembre 2015 à août 2018. Les résultats de l’ étude CHECKMATE 227 (7), publiée ultérieurement, sont examinés dans un commentaire supplémentaire mais n’ entraînent pas de modification des recommandations et ne sont donc pas expliqués ici. Les recommandations pour la chimiothérapie seule, la thérapie de deuxième ligne et les autres lignes de thérapie n’ ont pas changé, de sorte que cet article traite uniquement des nouvelles recommandations pour la thérapie de première ligne.
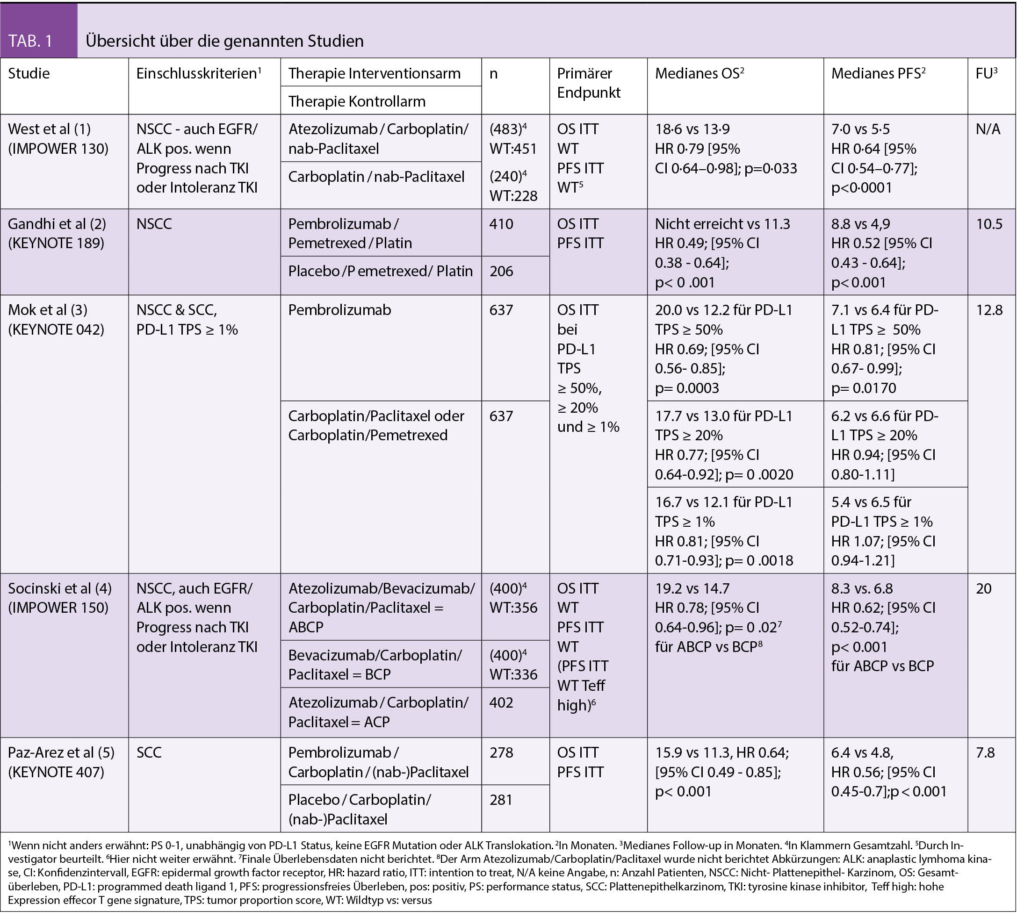
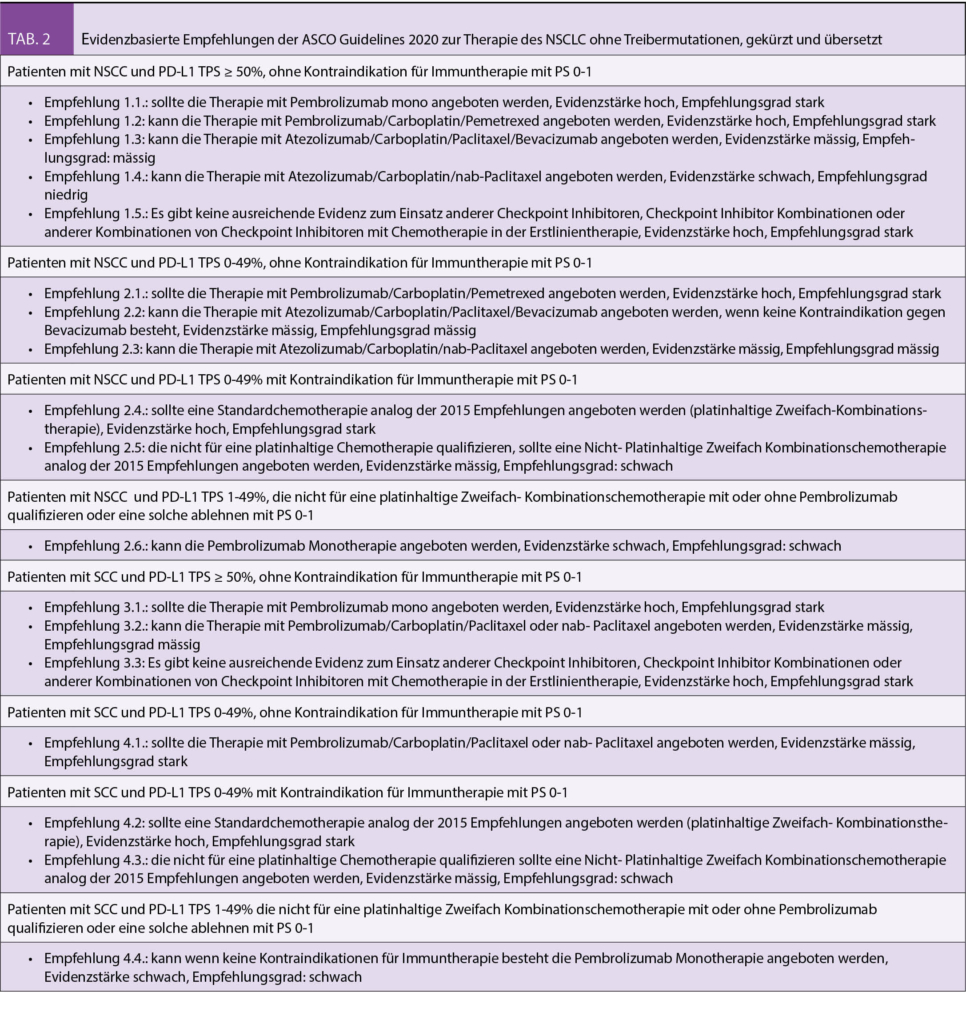
Die Autoren erarbeiten in den Guidelines nacheinander die Empfehlungen für die Erstlinientherapie des Nicht-Plattenepithel (NSCC) – und Plattenepithelkarzinoms (SCC) entsprechend der PD-L1 Expression am Tumorgewebe (PD-L1 tumour proportion score – TPS) und analysieren hierfür in den fünf als praxisrelevant beurteilten Phase III Studien das Outcome (progressionsfreies Überleben – PFS, Gesamtüberleben – OS) für die Subgruppen mit PD-L1 TPS ≥ 50%, PD-L1 TPS 1-49% bzw. PD-L1 TPS < 1%. Der Empfehlungsgrad wird aus den jeweiligen Subgruppenanalysen abgeleitet. Tabelle 1 gibt eine Übersicht über die genannten Studien. Tabelle 2 enthält die jeweiligen Empfehlungen im Original. In diesem Übersichtsartikel werden die Empfehlungen zu Themenblöcken zusammengefasst.
Alleinige Therapie mit einem Checkpoint-Inhibitor
Unverändert zu 2017 gilt die alleinige Therapie mit dem Checkpoint-Inhibitor Pembrolizumab als Erstlinien-Therapie der Wahl bei Patienten ohne Kontraindikation für Immuntherapie mit NSCC und SCC, einem PS von 0 -1 und einem PD-L1 TPS von ≥ 50%. Die 2017 Empfehlung bezieht sich auf die Daten der KEYNOTE 024 Studie (8), das 2020 Update betrachtet darüber hinaus das Outcome der Patienten mit PD-L1 ≥ 50% der Patienten in der KEYNOTE 042 Studie. In der KEYNOTE 042 Studie wurden 1274 Patienten mit SCC und NSCC und einer PD-L1 Expression ≥ 1% 1:1 randomisiert zwischen platinhaltiger Chemotherapie und Pembrolizumab Monotherapie. Der primäre Endpunkt war das OS in der Population mit PD-L1 ≥ 50%, ≥ 20% und ≥ 1%, für alle drei Populationen war das OS signifikant länger im Pembrolizumab-Arm. Für die Gesamtpopulation der Patienten mit PD-L1≥ 50% (599 Patienten) ergab sich ein OS Benefit mit einer hazard ratio (HR) von 0.69 (95% CI, 0.56 to 0.85; p = .0003). Eine explorative Analyse für die Subgruppe der Patienten mit einer PD-L1 Expression von 1-49% zeigt allerdings, dass diese Patienten keinen signifikanten Überlebensvorteil durch die Pembrolizumab Monotherapie erfahren (HR 0.92, 95% CI 0.77- 1.11), und somit der Überlebensvorteil in der Gesamtpopulation durch die Subgruppe mit einem PD-L1 TPS ≥ 50% getragen wird. Entsprechend wird die Pembrolizumab Monotherapie für Patienten mit einer PD-L1 TPS 1-49% in den ASCO Guidelines als Möglichkeit im Einzelfall (Patienten, welche nicht für eine Chemotherapie qualifizieren oder diese ablehnen) mit allerdings schwacher Evidenz diskutiert. Wir denken, dass die Empfehlung so unterstützt werden kann und würden ebenfalls von einer unselektionierten Anwendung von Pembrolizumab in der Gruppe der Patienten mit einem PD-L1 TPS 1-49% warnen, insbesondere auch bei Patienten, bei welchen ein rasches Ansprechen erreicht werden sollte. Zudem wäre bei diesen Patienten zuerst eine Kostengutsprache einzuholen, da Pembrolizumab bei einer PD-L1 Expression < 50% in der Schweiz in der Erstlinientherapie nicht zugelassen ist.
Zum Zeitpunkt der Literaturrecherche gibt es keine ausreichende Evidenz zur alleinigen Immuntherapie mit anderen Checkpoint Inhibitoren bei Patienten mit hoher PD-L1 Expression (Daten der IMPOWER 110 Studie nicht berücksichtigt).
Checkpoint Inhibitor und Platinhaltige Kombina-tionschemotherapie bei PD-L1 TPS von 0% -49%
Für Patienten ohne Kontraindikation für eine Immuntherapie mit NSCC und SCC, PD-L1 TPS von 0% -49% sowie einem PS von 0 -1 wird in der ersten Therapielinie die Therapie mit Checkpoint Inhibitor plus platinhaltiger Kombinationschemotherapie empfohlen. Hierfür stehen mittlerweile verschiedene Behandlungsschemata zur Verfügung, welche im Folgenden kurz erörtert werden.
Beim NSCC wird die Therapie mit Carboplatin/Pemetrexed und Pembrolizumab analog der KEYNOTE 189 Studie als bevorzugte Behandlungsoption empfohlen. In der KEYNOTE 189 Studie wurden 616 Patienten mit NSCC unabhängig von der PD-L1 Expression 2:1 randomisiert und erhielten Cis-bzw. Carboplatin/Pemetrexed und Pembrolizumab für vier Zyklen mit anschliessender Erhaltungstherapie mit Pemetrexed und Pembrolizumab (bis zu 35 Zyklen) oder alleinige Chemotherapie. Das Gesamtüberleben war im Interventionsarm signifikant besser und die 12- Monats-Überlebensrate betrug 69 % mit der Pembrolizumab- Kombination versus 49% mit alleiniger Chemotherapie (HR 0,49; 95% CI 0.38-0.64, p < 0.001). Der Benefit war unabhängig von der PD-L1 Expression statistisch signifikant. Auch Patienten mit einer PD-L1 Expression < 1% profitierten von der zusätzlichen Pembrolizumabtherapie (geplante Subgruppenanalyse für PD-L1 <1%, 1-49%, > 50%, Stratifikationsfaktor PD-L1 < 1%, > 1%). Der grösste relative Benefit war bei einer PD-L1 Expression ≥ 50% zu beobachten.
Als weitere Therapieoptionen beim NSCC werden Carboplatin/Paclitaxel/Bevacizumab und Atezolizumab (IMPOWER 150 Studie) und Carboplatin/Nab-Paclitaxel und Atezolizumab (IMPOWER 130 Studie) diskutiert. Auch diese beiden Studien schlossen Patienten unabhängig vom PD-L1 Status ein. Die IMPOWER 150 Studie zeigt einen Vorteil im progressionsfreien Überleben mit Atezolizumab/Carboplatin/Paclitaxel und Bevacizumab im Vergleich zur Therapie mit Carboplatin/Paclitaxel und Bevacizumab, auch der berichtete Überlebensvorteil zum Zeitpunkt der publizierten Interimsanalyse ist statistisch signifikant mit einem medianen OS von 19.2 Monaten mit der Vierfach-Kombination versus 14.7 Monate ohne Atezolizumab (HR 0.78; 95% CI 0.64-0.96, p = 0.02). Neben den fehlenden finalen Überlebensdaten ist einschränkend zu erwähnen, dass in dieser dreiarmigen Studie nur zwei der Arme berichtet wurden – die Resultate des Armes Atezolizumab/Carboplatin und Paclitaxel sind nicht bekannt, so dass der Benefit der Bevacizumabaddition zu Atezolizumab unklar bleibt. Auch entspricht das Testverfahren für PD-L1 mit dem Ventana SP142 nicht dem aktuellen Antikörper, da die Sensitivität gegenüber anderen Verfahren zur PD-L1 Detektion eingeschränkt ist. Die IMPOWER 130 Studie zeigt einen signifikanten Überlebensvorteil für die Kombinationstherapie mit Atezolizumab/Carboplatin und (nab-)Paclitaxel gegenüber alleiniger Chemotherapie bei Patienten mit einem NSSC mit einem medianen OS von 18,6 Monaten im Interventionsarm versus 13.9 Monaten im Chemotherapie Arm HR 0,79 (95% CI 0.64-0.98, p =0.033). Auch hier wird der PD-L1 Status mit dem Ventana SP142 Testverfahren erhoben.
Patienten mit SCC, einer PD-L1 Expression von 0% -49% sowie PS von 0 -1 sollen in der ersten Therapielinie analog zum Vorgehen in der KEYNOTE-407 mit Pembrolizumab/Carboplatin/Paclitaxel oder nab-Paclitaxel behandelt werden. Im Vergleich zur alleinigen Chemotherapie zeigt sich für die Gesamtpopulation hier ein signifikanter Überlebensvorteil mit einem medianen OS von 15.9 Monaten mit der zusätzlichen Pembrolizumabgabe versus 11.3. Monaten im Kontrollarm (HR 0.64, 95% CI 0.49-0.85, p< 0.001) und alle Subgruppen profitierten.
Während die Resultate der KEYNOTE 407 Studie auch in der Schweiz zur Zulassung beim metastasierten SCC geführt haben, ist beim NSCC weder die Kombination mit Atezolizumab, Bevacizumab, Carboplatin/Paclitaxel (IMPOWER 150) noch die Therapie mit Carboplatin /(nab-) Paclitaxel plus Atezolizumab zugelassen. Ersteres Regime wird aktuell in einer in der Schweiz offenen ETOP Studie bei Patienten nach Entwicklung einer EGFR-TKI Resistenz (ETOP ABC Studie) geprüft, da eine Subgruppenanalyse der IMPOWER 150 Studie einen Effekt der Quadruplettherapie bei EGFR- und ALK positiven Patienten nach TKI Resistenz suggeriert.
Das Regime der IMPOWER 130 Studie kann nach vorgängiger Kostengutsprache bei Patienten mit Kontraindikationen gegen Alimta erwogen werden.
Checkpoint Inhibitor und platinhaltige Kombinationschemotherapie bei PD-L1 TPS ≥ 50%
Aktuell gibt es keine vergleichenden Studien, die zeigen ob Patienten mit einer hohen PD-L1 Expression von einer zusätzlichen Chemotherapie im Vergleich zur alleinigen Pembrolizumabtherapie profitieren. In den ASCO Guidelines wird bei Patienten mit einem PD-L1 TPS ≥ 50% die Therapie mit Checkpoint Inhibitor plus platinhaltiger Kombinationschemotherapie als eine mögliche Behandlungsoption genannt, es wird jedoch betont, dass da sowohl Kosten als auch Toxizität der Dreifachtherapie deutlich höher sind, in den meisten Fällen die Pembrolizumab Monotherapie die Therapie der Wahl ist. Als mögliche Situationen, in denen eine Dreierkombination bevorzugt werden könnte, werden unbekannte PD-L1 Expression oder hohe Tumorlast genannt. Die Empfehlung zur Wahl des jeweiligen Therapieregimes entspricht den genannten Empfehlungen für Patienten mit einer PD-L1 Expression von 0%-49%.
In der Schweiz sind beide Optionen prinzipiell zugelassen. Ein Bevorzugen der Kombinations-Immun-Chemotherapie bei hochsymptomatischer Erkrankung eines ansonsten fitten Patienten macht aufgrund der tendenziell höheren Ansprechraten prinzipiell Sinn.
Diskussion
Die Ableitung des Empfehlungsgrades allein aus Subgruppenanalysen von zwar für Lungentumorpatienten eher grossen Phase 3 Studien ist grundsätzlich nicht unproblematisch. Solche Subgruppenanalysen stellen jedoch in der Medizin oft die einzige Evidenz dar, wenn prospektive randomisierte Studien zu einer spezifischen Fragestellung fehlen. Insgesamt können die Empfehlungen der ASCO Guidelines 2020 aus Schweizer Sicht jedoch gut mitgetragen werden und entsprechen der gängigen Praxis, wobei die etwas anderen Zulassungs- und Rückvergütungsbedingungen als in den USA gut berücksichtigt werden sollten. Dies ist im klinischen Alltag aufgrund der zunehmenden Kosten nicht irrelevant, besonders auch dann wenn ein rascher Therapiebeginn notwendig ist. Zumindest formal muss bei jeder der genannten Therapieoptionen eine Kostengutsprache eingeholt werden.
Hervorzuheben ist hier nochmals die Einstufung der Pembrolizumab Monotherapie als Therapie der Wahl bei Patienten mit hoher PD-L1 Expression: solange vergleichende Studien ausstehen, ist dies ein pragmatischer und kostengünstigerer Ansatz. Zu erwähnen ist hier auch, dass uns mit dieser Behandlung längere Follow-up Daten aus der KEYNOTE 024 (25.2 Monate) (9) und KEYNOTE 001 Studie (5 Jahre) (10) vorliegen, während die Langzeitdaten der initialen Chemo-Immunokombinationsbehandlung noch fehlen. Abhängig von der individuellen Situation scheint jedoch bei im indirekten Vergleich etwas höherer Ansprechrate auch der primäre Einsatz der Dreierkombination gerechtfertigt. Verschiedene Studien aus unterschiedlichen Gesundheitssystemen haben quality adjusted life years (QALYs) der Dreier- oder sogar Viererkombinationen berechnet und die fehlende Kosteneffizienz nachgewiesen. Dies gilt es zukünftig bei knapper werdenden Ressourcen im Gesundheitssystem bei der Therapiewahl mitzuberücksichtigen. Für die Schweiz sind solche Analysen zurzeit noch ausstehend bzw. noch nicht publiziert.
Ein wichtiger praktischer Punkt bei der Wahl der Therapie ist neben der PD-L1 Expression auch der Ausschluss behandelbarer Treibermutationen vor Therapiebeginn. Leider führt das Abwarten der molekularen Analysen nicht selten zur Zeitverzögerung – Zeit, die man im klinischen Alltag bei symptomatischen Patienten nicht hat. Das Vorhandensein von genügend Tumorgewebe sowie das umgehende Einleiten (zum Beispiel Reflextesting) der molekularen Analyse und der PD-L1 Bestimmung ist deshalb entscheidend geworden. Ein «blindes» Beginnen einer Immuntherapie bei einem Patienten, bei welchem «im Nachhinein» eine EGFR Mutation detektiert wird, muss aufgrund der Datenlage mit klar eingeschränkter Wirksamkeit einer Immuntherapie bei diesen Patienten als inkorrekte Therapie beurteilt werden.
Abschliessend gilt festzuhalten, dass der Einsatz der Immuntherapie die Langzeitbehandlungsergebnisse eines kleineren Anteils der Patienten mit NSCLC revolutioniert hat und die Immuntherapie fester Bestandteil in der Erstlinienbehandlung geworden ist. Insbesondere die ersten Daten zum 5-Jahres-Überleben der KEYNOTE 001 Studie, welche Überlebensraten von knapp 30% bei Patienten mit PD-L1 TPS ≥ 50% mit Pembrolizumab in der Erstlinientherapie zeigen sind eindeutig besser, als wir dies von historischen Daten kennen. Diese Resultate werfen die Frage auf, ob wir sogar allenfalls eine kleine, bisher noch ungenügend definierte Subgruppe von Patienten langfristig als «geheilt» betrachtet können. Ob diese Langzeitresultate mit einer initialen Chemo-/Immuntherapie oder einer Immunkombinationstherapie noch weiter verbessert werden können bleibt jedoch noch abzuwarten, da die Beobachtungszeiten dieser Studien noch zu kurz sind.
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
MF: Research Grants from BMS, ASTRA ZENECA fees to institution,
Advisor: BMS; MSD; ASTRA; Bl; ROCHE; TAKEDA fees to institution
SW: Sponsored travel: ROCHE, Merck fees to institution
- Um die optimale Therapie des NSCLC im Stadium IV festzulegen, muss initial beim NSCC das Vorliegen einer primär behandelbaren Treibermutation ausgeschlossen werden und unabhängig von der Histologie der PD-L1 Status bestimmt werden.
- Alle Patienten mit PS 0-1 ohne Kontraindikationen für eine Immuntherapie sollten heute in der Erstlinientherapie einen Checkpointinhibitor erhalten
- Bei einer PD-L1 Expression von 0% und 1-49% sollte der Patient in der Erstlinientherapie eine Kombination aus Checkpointinhibitor und platinhaltiger Kombinationschemotherapie erhalten.
- Bei einer PD-L1 Expression ≥ 50% kann sowohl die alleinige Pembrolizumab Therapie als auch eine Kombination aus Checkpoint-Inhibitor und Chemotherapie eingesetzt werden. Vergleichende Studien gibt es nicht – Pembrolizumab alleine ist deutlich weniger toxisch und kostengünstiger, bei hoher Tumorlast oder unbekanntem PD-L1 Status stellt die Kombinationstherapie aber eine sinnvolle Alternative dar.
Messages à retenir
- Afin de déterminer la thérapie optimale pour le CPNPC de stade IV, la présence d’ une mutation conductrice primaire traitable doit être exclue initialement dans le NSCC et le statut PD-L1 doit être déterminé indépendamment de l’ histologie.
- Tous les patients présentant une PS 0-1 sans contre-indication à l’ immunothérapie devraient recevoir aujourd’ hui un inhibiteur checkpoint dans le cadre d’ un traitement de première intention
- Avec une expression PD-L1 de 0 % et de 1 à 49 %, le patient doit recevoir une combinaison d’ inhibiteur de checkpoint et de chimiothérapie combinée contenant du platine en première intention.
- Dans le cas d’ une expression PD-L1 ≥ 50%, on peut utiliser à la fois la thérapie au pembrolizumab seul et une combinaison d’ inhibiteur du checkpoint et de chimiothérapie. Il n’ existe pas d’ études comparatives – le pembrolizumab seul est nettement moins toxique et moins cher, mais en cas de charge tumorale élevée ou de statut PD-L1 inconnu, la thérapie combinée est une alternative raisonnable.
1. West H, McCleod M, Hussein M et al: Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20: 924-937.
2. Gandhi L, Rodríguez-Abreu D, Gadgeel S et al: Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med 2018; 378: 2078-2092.
3. Mok TSK, Wu Y-L, Kudaba I et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019; 393: 1819-1830.
4. Socinski MA, Jotte RM, Cappuzzo F et al: Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med 2018; 378: 2288-2301
5 Paz-Ares L, Luft A, Vicente D et al: Pembrolizumab plus Chemotherapy for Squamous Non–Small-Cell Lung Cancer. N Engl J Med 2018; 379: 2040-2051
6. Hanna NH, Schneider BJ, Temin S et al: Therapy for Stage IV Non–Small-Cell Lung Cancer Without Driver Alterations: ASCO and OH (CCO) Joint Guideline Update. J Clin Oncol 38.
7. Hellmann MD, Ciuleanu TE, Pluzanski A et al: Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden. N Engl J Med 2018; 378:2093-2104
8. Reck M, Rodrıguez-Abreu D, Robinson AG et al: Pembrolizumab versus Chemotherapy for PD-L1aPositive Non–Small-Cell Lung Cancer N Engl J Med 2016;375:1823-33.
9. Reck M, Rodrıguez-Abreu D, Robinson AG et al: Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non–Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater, J Clin Oncol 37:537-54
10. Garon EB, Hellman MD, Rizvi NA,et al: Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study, J Clin Oncol 37:2518-2527
info@onco-suisse
- Vol. 10
- Ausgabe 3
- Juni 2020