- Hirnmetastasen: Take Home Messages 2020
Das Interesse an einem differenzierten Management von Hirnmetastasen ist gross, zum einen dank Fortschritten der therapeutischen Disziplinen, zum anderen der Grundlagenforscher, welche unser pathophysiologisches Verständnis laufend erweitern. Beides kommt der zunehmenden Zahl betroffener Patienten zugute, die sich durch längeres Überleben mit Hirnmetastasen (BM) konfrontiert sehen. Besonders drei Tumorentitäten haben ein hohes kumulatives Risiko für BM.
La gestion différenciée des métastases cérébrales suscite un grand intérêt, grâce d’une part aux progrès des disciplines thérapeutiques, et d’autre part aux chercheurs de base qui élargissent constamment notre compréhension physiopathologique. Les deux sont bébéfiques pour le nombre croissant de patients atteints de métastases cérébrales (BM) en raison d’une survie plus longue. Trois entités tumorales en particulier présentent un risque cumulé élevé pour des BM.
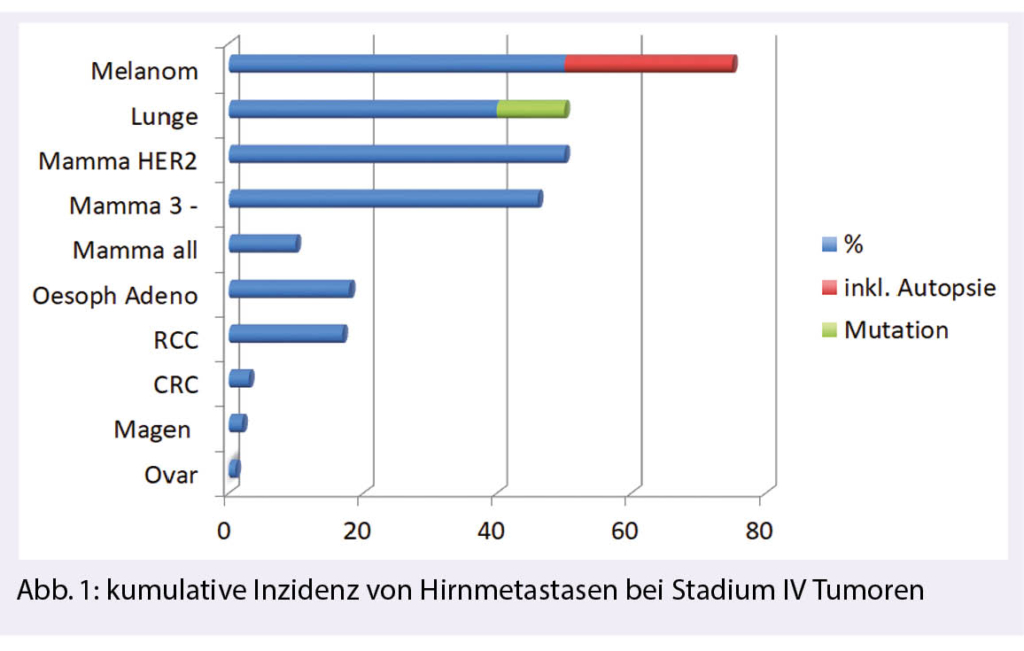
Beim metastasierten Melanom geht man von einer kumulativen Inzidenz von bis zu 80% aus, für das kleinzellige Bronchuskarzinom ist sie 50-60%, Adenokarzinome der Lunge mit einer Driver-Mutation erreichen 50-70% und beim Her2-positiven metastasierten Mammakarzinom ist sie um die 50% (Abb.1). Wir verstehen heute besser, wie sich BM molekular vom Primärtumor unterscheiden, wie wichtig das ZNS–«Microenvironment» für das Entstehen von BM ist, das sich in Zukunft vielleicht für eine Prävention nutzen lässt. BM sind in klinischen Studien nicht mehr automatisch ein «exclusion criterion», was positive Beobachtungen hinsichtlich Wirksamkeit vieler neuer Substanzen im Gehirn erst möglich macht. Der Mythos einer exklusiven Bluthirnschranke für Systemtherapien ist Vergangenheit.
Das Therapieangebot hängt von der Prognose ab und umgekehrt
Eine Datenbank der RTOG (Radiation Therapy Oncology Group) mit knapp 4000 Patienten ist die Grundlage für einen Prognose-Score, der seit Jahren für die häufigsten Tumoren mit hohem BM- Risiko vorliegt. Der DS-GPA-Score (Diagnosis-Specific Graded Prognostic Assessment) wird mit molekularen Daten laufend angereichert, die neueste Version finden Sie im Internet unter
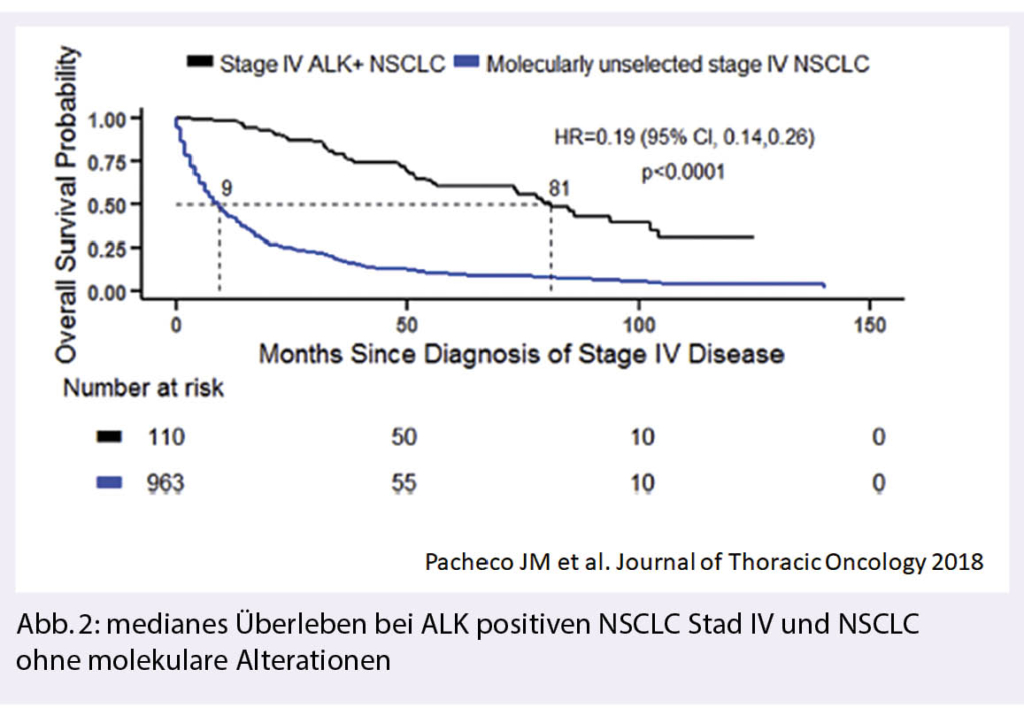
http://brainmetgpa.com (1). Prognosen variieren von einer Tumor(sub)-entität zur anderen und werden durch molekulare und klinische Faktoren beeinflusst. Klinisch spielen das Alter, der Karnofsky-Performance Status sowie das Ausmass der extrakraniellen Erkrankung eine Rolle. Die Anzahl der BM scheint bei zielgerichteten Therapiemöglichkeiten (ALK, EGFR) eher eine untergeordnete Rolle zu spielen (2). Beim ALK-positiven NSCLC mit BM wird heutzutage ein medianes Überleben von mehr als 6 Jahren erreicht unter Einsatz aller zugänglichen ALK-Inhibitoren, wohingegen bei NSCLC ohne angehbare molekulare Alterationen das mediane Überleben erst knapp über einem Jahr liegt (Abb. 2) (3).
«verzweigte Evolution» und ein Gliom-ähnliches Wachstumsmuster von gewissen Hirnmetastasen
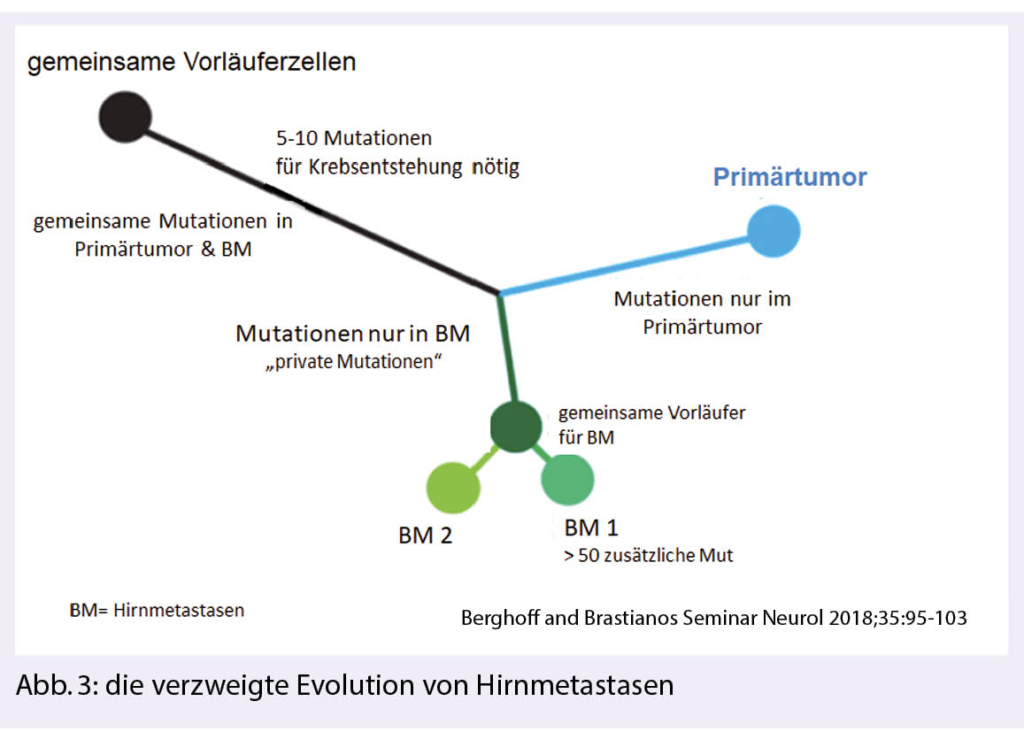
Ein Primärtumor und seine zugehörigen Hirnmetastasen (BM) zeigen unterschiedliche molekulare Alterationen, die im Verlauf der Erkrankung separat erworben werden (sogenannte «branched evolution»), diese müssen nicht identisch sein mit Metastasen in der Peripherie, welche besser zugänglich wären, um mögliche therapeutische Targets zu finden (Abb. 3) (4). Die Konkordanz von therapierbaren Driver-Mutationen im Primärtumor und den zugehörigen Hirnmetastasen ist höher bei BRAF-mutierten Melanomen, bei ALK- positiven NSCLC und etwas weniger zuverlässig bei EGFRmut NSCLC und bei Hormonrezeptor – positiven oder Her2 – amplifizierten Mammakarzinomen.
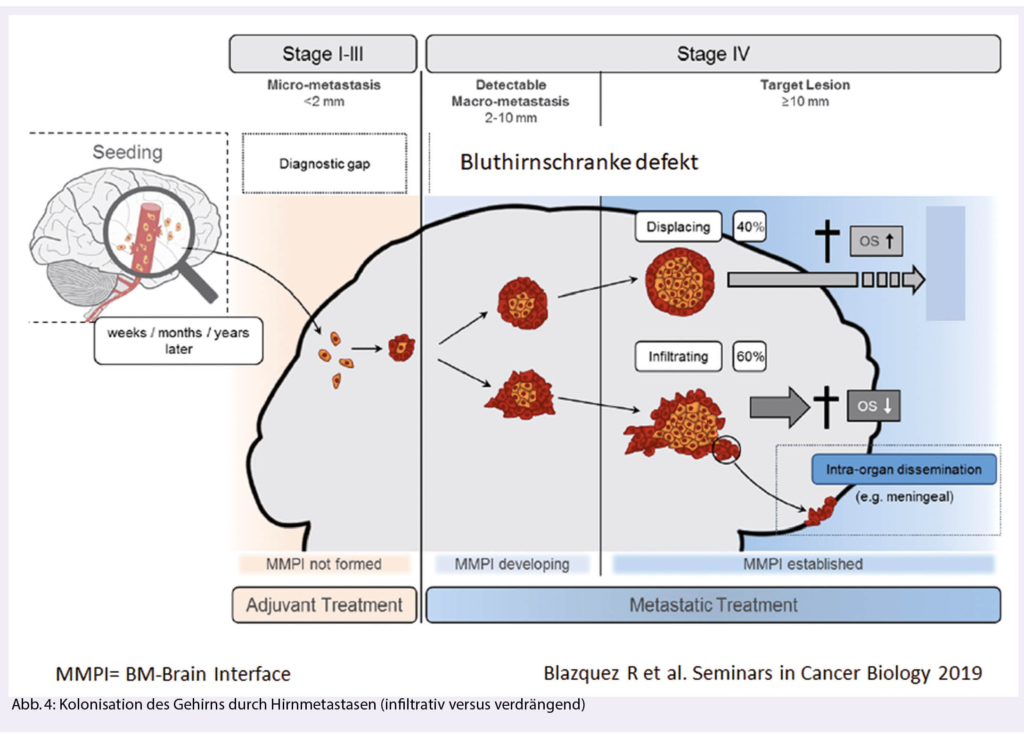
Etwa 50% der BM zeigen ein infiltratives Wachstum («glioma-like»), was sowohl die lokale Tumorkontrolle (Operation und stereotaktische Radiotherapie, SRT) als auch die Wirksamkeit der Systemtherapie beeinträchtigt (Abb. 4) (5). Infiltrierende Tumorzellen «verstecken» sich hinter einer intakten Bluthirnschranke und sind damit einer Systemtherapie weniger gut zugänglich. Eine infiltrierende Umgebungskolonisation ist typisch für Bronchialkarzinome (SCLC, NSCLC), triple negative Mammakarzinome und Melanome (6).
Ausserhalb von Studien werden Metastasen radiologisch nach dem grössten Diameter ausgemessen, die Vollständigkeit einer Metastasenresektion (EOR, extent of resection) ist aber vom Tumorvolumen abhängig und wird deshalb häufig überschätzt (7).
Entitätsspezifische Therapiemöglichkeiten & Grenzen
1. Lunge
Die kumulative Inzidenz von BM für EGFRmut NSCLC Stadium IIIB/IV beträgt nach 3 Jahren über 45% und für ALK-translozierte Tumoren über die Jahre bis zu 70%. Diese Zahlen sind deutlich höher als für nicht molekular alterierten NSCLC, wo sich die Inzidenz für BM zwischen 20-30% bewegt (Abb. 1) (8). Neben der Lokaltherapie bestehen für molekular alterierte NSCLC-Subtypen sequentielle Systemtherapie- Optionen. Neuere Proteinkinase-Hemmer (meist Tyrosinkinase-Hemmer, TKI) sind mehrheitlich aktiv im ZNS und lassen ein Ansprechen wie in der Peripherie erwarten. Die Frage, ob bei guter Remission auf eine SRT verzichtet werden darf, kann man heute wie folgt beantworten: eine Kombination von SRT und TKI ergibt insgesamt bessere Ergebnisse als die alleinige TKI-Therapie (9), der ideale Zeitpunkt der SRT (upfront versus früh versus spät) bleibt durch weitere Studienergebnisse zu belegen und dürfte durch Krankheitsdynamik und Ansprechen auf Systemtherapie mitbestimmt sein. Bei fehlenden molekularen Alterationen ist auch eine konventionelle Chemotherapie bei manifesten BM wirksam, da diese nicht durch eine intakte Bluthirnschranke geschützt sind, die Präparate-Wahl richtet sich nach der Empfindlichkeit extrakranieller Tumormanifestationen und berücksichtigt Vorbehandlungen.
1.1. Immuntherapie bei Bronchuskarzinomen
überwinden, über virtuelle perivaskuläre Räume (im Bereich postkapillärer Hirnvenulen), via arachnoidale Granulationen und über den Choroidplexus findet immunologische Kommunikation zu den zervikalen und lumbalen Lymphknoten statt (10).
Eine erste Phase II Studie, publiziert 2016 (11), mit Pembrolizumab bei therapie-naiven BM ergab eine intrakranielle ORR von 29.4% und ein medianes OS von 8.9 Monaten bei PDL-1 positiven NSCLC. Daten zu Nivolumab nach erfolgter Chemotherapie und eine Subgruppen Analyse der OAK Studie mit Atezolizumab zeigen unabhängig vom PDL-1 Status eine vergleichbare Wirksamkeit im ZNS wie in der Peripherie und ein ähnliches Nebenwirkungsprofil (12, 13). Die Evaluation der Tumorantwort nach Immuntherapie ist für den Neuroradiologen herausfordernd. Um eine Vereinheitlichung zu ermöglichen, hat die RANO Expertengruppe (RANO: Response Assessment in Neuro-Oncology) RANO-Kriterien für Hirnmetastasen (7) und iRANO Kriterien für Hirnmetastasen unter Immuntherapie definiert. Wichtig sind dabei neben radiologischen auch klinische Parameter, wie der neurologische Zustand und der Steroidbedarf. Die Gruppe empfiehlt bei fehlender neurologischer Verschlechterung eine MR Kontrolluntersuchung nach 3 Monaten (14). iRANO Kriterien sind auf intraaxiale Raumforderungen beschränkt, leptomeningealer Befall und Schädelknochenmetastasen sind schwierig zu objektivieren. Zwischen SRT und Immuntherapie scheint es eine Synergie zu geben, wenn beide Optionen innerhalb von 4 Wochen stattfinden, das lässt eine Metaanalyse mit 534 Patienten vermuten (15). Ob damit auch die Häufigkeit von Radionekrosen zunimmt, bleibt zu beobachten (16).
2. Mammakarzinom
Die kumulative Inzidenz für BM ist mit knapp 50% am höchsten beim Her2-positiven und Hormonrezeptor (HR)-negativen Mammakarzinom Stadium IV (17). Das mediane Überleben mit BM erreicht bei Her2-positiven und HR-positiven Tumoren über zwei Jahre und ist damit besser als für die anderen Subgruppen (18, http://brainmetgpa.com). Zwischen dem Primärtumor und den zugehörigen Hirnmetastasen können Diskordanzen für den Her2- und/oder HR-Status bestehen, was gelegentlich eine erneute Bestimmung dieser Marker am Metastasengewebe rechtfertigt, sofern eine Resektion klinisch indiziert ist. So waren in einer grösseren Serie die Hormon-Rezeptoren (HR, ER oder PR) bei BM in 40/160 (25%) nachweisbar bei sonst HR-negativem Primärtumoren. Her2 war in 22/173 (13%) positiv bei Her2-negativem Primärtumor (19).
Von den neueren Her2-gerichteten TKI war Neratinib (plus Capecitabine) zwar im Hirn gut wirksam, aber mit deutlicher Toxizität verbunden (Diarrhoe Grad 2 und 3), das mag an der zusätzlichen Hemmung des EGFR liegen (20). Tucatinib, ist ein Her2-spezifischer TKI mit deutlich weniger Nebenwirkungen. In einer Phase I
erreicht Tucatinib in der Doppelblockade mit Trastuzumab und Capecitabine bei vorbehandeltem Mammakarzinom im ZNS eine Responserate von 42%. Der primären Endpunkt PFS in der nachfolgenden Placebo-kontrollierten Phase III Studie ergab für die ganze Kohorte (mit und ohne BM) für die Kombination Tucatinib mit Trastuzumab und Capecitabine einen Vorteil mit einen HR von 0.54 (95% CI 0.42-0,71) gegenüber Trastzumab und Capecitabine. In den beiden Armen wiesen 46 % respektive 48% der Patientinnen BM auf (21). Eine erste Interimsanalyse für die BM- Kohorte konnte den PFS Vorteil für die Tucatinib-Kombination bestätigen, das mediane PFS lag bei 7.6 Monaten.
Für CDK 4/6 Inhibitoren liegen erst präliminäre Resultate vor für das Ansprechen von BM auf Abemaciclib und zwar für HR-positive, Her2-negative Tumoren (unpublished). Für triple negative Mammakarzinome gibt es kaum neue und auf Studien gestützte Empfehlungen, Capecitabine, Eribulin, Taxane sind Optionen.
3. Melanom
Zwanzig bis 25% der Patienten mit einem metastasierten Melanom weisen bereits bei Diagnose BM auf. Im Verlauf der Erkrankung erhöht sich die Inzidenz auf 40-60% und in Autopsien findet man bis zu 80% BM. Die prinzipielle Wirksamkeit von Immuntherapie (IO) im Gehirn wurde bereits weiter vorne beschrieben. Erste Phase II Daten für Ipilimumab (CTLA-4 AK) wurden 2012 publiziert (22). Ipilimumab war besser wirksam, wenn die BM asymptomatisch und nicht steroidbedürftig waren. Pembrolizumab zeigt 2016 bei unbehandelten BM ohne Steroidbedarf ebenfalls Wirksamkeit in einer Phase II Studie (11). Es folgten Phase II Kombinationsstudien mit Ipilimumab und Nivolumab (23) und hier war die ORR mit 54 % (davon 29 % CR) erfreulich hoch, unabhängig vom PDL-1 Status und auch dauerhaft (Plateau). Wenn keine Steroide für die BM benötigt wurden, war das Ansprechen im ZNS vergleichbar mit dem in der Peripherie. Zu ähnlichen Ergebnissen kommt die randomisierte Phase II ABC Studie, sie vergleicht die Kombination Ipilimumab und Nivolumab versus Nivolumab-Monotherapie. In dieser Studie konnte zusätzlich gezeigt werden, dass die Ergebnisse mit Immuntherapie ohne vorgängige TKI-Therapie etwas besser ausfielen. Dies könnte Einfluss haben auf die Wahl der Therapie-Sequenz, sind doch beide Therapiestrategien bei BRAFmut Melanomen bezüglich initialem Ansprechen ähnlich. Eine CR (bis 30% in der IO Kombination) scheint einen günstigen, längerfristigen Outcome vorauszusagen (24).
Da sich ein Steroidbedarf aufgrund von BM ungünstig auf die IO Wirkung auswirkt stellt sich die Frage, ob Bevacizumab als Steroidersatz eingesetzt werden könnte, dies wird in Rahmen von Studien untersucht.
Bei BRAFmut Melanomen wirkt die Kombination von BRAF- und MEK-Inhibitoren gleich schnell und gut wie in der Peripherie, allerdings etwas weniger lang (COMBI-MB Studie, 25). Aktuelle Studien prüfen bereits eine Triple Therapie mit BRAF- und MEK-Inhibitoren kombiniert mit IO, eine weitere Erhöhung der Remissionsraten ist zu erwarten, aber auch vermehrt höhergradige Toxizitäten.
Toxizitäten (auch finanzielle) bleiben ein sehr wichtiges Thema. Dosis-Beschränkung von Ipilimumab in der Induktion auf 1mg/ kg anstelle von 3mg/kg (wie in den bisherigen Studien) oder Kombinationen mit besser verträglichen Antikörpern werden geprüft
Universitätsspital Zürich
Institut für Pathologie und Molekularpathologie
Schmelzbergstrasse 12
8091 Zürich
silvia.hofer@usz.ch
Die Autorin deklariert keine Interessenskonflikte für diesen Beitrag
- Die Prognose von Patienten mit Hirnmetastasen (BM) ist abhängig von der Klinik, der Tumorentität und von molekularen Subgruppen. Jahrelange Verläufe mit guter Lebensqualität sind bei molekular alterierten Entitäten durchaus möglich.
- Seit dem Einschluss von Patienten mit BM in klinische Studien wissen wir, dass die neueren onkologischen Therapien (TKI und Immuntherapien) eine vergleichbare Wirkung im ZNS aufweisen wie in der Peripherie.
- Immuntherapien sind auch im Gehirn wirksam, das Gehirn ist nicht immun-isoliert.
- Der Stellenwert der Lokaltherapien bei BM, die Resektion und die stereotaktische Radiotherapie, ist etabliert und abhängig vom Ausmass und der Anzahl der Raumforderungen. Die Ganzhirnbestrahlung hingegen ist heute weitgehend verlassen, Ausnahmen bleiben die prophylaktische Hirnbestrahlung beim SCLC, ein diffuser leptomeningealer Tumorbefall und seltener palliative Gründe.
Messages à retenir
- Le pronostic des patients atteints de métastases cérébrales (BM) dépend de la clinique, de l’entité tumorale et des sous-groupes moléculaires. Des années de progression avec une bonne qualité de vie sont tout à fait possibles dans les entités altérées au niveau moléculaire.
- Depuis l’inclusion des patients atteints de BM dans les études cliniques, nous savons que les nouvelles thérapies oncologiques (IKT et thérapies immunitaires) ont un effet comparable dans le SNC comme dans la périphérie.
- Les immunothérapies sont également efficaces dans le cerveau ; le cerveau n’est pas immuno-isolé.
- L’importance des thérapies locales en BM, résection et radiothérapie stéréotaxique, est établie et dépend de l’étendue et du nombre de demandes spatiales. La radiation du cerveau entier, en revanche, est aujourd’hui largement abandonnée, les exceptions restant la radiation prophylactique du cerveau dans le cas du SCLC, une attaque tumorale leptoméningée diffuse et, plus rarement, des raisons palliatives.
1. Albert, M.R. and M.A. Weinstock, Keratinocyte carcinoma. CA Cancer J Clin, 2003. 53(5): p. 292-302.
2. Alam, M. and D. Ratner, Cutaneous squamous-cell carcinoma. N Engl J Med, 2001. 344(13): p. 975-83.
3. Nagarajan, P., et al., Keratinocyte Carcinomas: Current Concepts and Future Research Priorities. Clin Cancer Res, 2019. 25(8): p. 2379-2391.
4. Que, S.K.T., F.O. Zwald, and C.D. Schmults, Cutaneous squamous cell carcinoma: Incidence, risk factors, diagnosis, and staging. J Am Acad Dermatol, 2018. 78(2): p. 237-247.
5. Pickering, C.R., et al., Mutational landscape of aggressive cutaneous squamous cell carcinoma. Clin Cancer Res, 2014. 20(24): p. 6582-92.
6. Eigentler, T.K., et al., Survival of Patients with Cutaneous Squamous Cell Carcinoma: Results of a Prospective Cohort Study. J Invest Dermatol, 2017. 137(11): p. 2309-2315.
7. Lansbury, L., et al., Interventions for non-metastatic squamous cell carcinoma of the skin: systematic review and pooled analysis of observational studies. BMJ, 2013. 347: p. f6153.
8. Cowey, L.e.a., Treatment patterns and outcomes among patients with advanced cutaneous squamous cell carcinoma (CSCC) in a US community oncology setting. J Clin Oncol, 2019. 37(no. 15_suppl).
9. Hillen, U., et al., Advanced cutaneous squamous cell carcinoma: A retrospective analysis of patient profiles and treatment patterns-Results of a non-interventional study of the DeCOG. Eur J Cancer, 2018. 96: p. 34-43.
10. Petersen, E.T., et al., Review of systemic agents in the treatment of advanced cutaneous squamous cell carcinoma. Future Oncol, 2019. 15(27): p. 3171-3184.
11. Borradori, L., et al., Rescue therapy with anti-programmed cell death protein 1 inhibitors of advanced cutaneous squamous cell carcinoma and basosquamous carcinoma: preliminary experience in five cases. Br J Dermatol, 2016. 175(6): p. 1382-1386.
12. Falchook, G.S., et al., Responses of metastatic basal cell and cutaneous squamous cell carcinomas to anti-PD1 monoclonal antibody REGN2810. J Immunother Cancer, 2016. 4: p. 70.
13. Migden, M.R., et al., PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med, 2018. 379(4): p. 341-351.
14. Guminski, A., Phase 2 study of cemiplimab, a human monclonal anti-PD-1 antibody, in patients witih metastatic cutaneous squamous cell carcinomal (mCSCC; Group 1) 12-month follow-up. J Clin Oncol, 2019. 37(suppl):9526.
15. Migden, M.R., et al., Cemiplimab in locally advanced cutaneous squamous cell carcinoma: results from an open-label, phase 2, single-arm trial. Lancet Oncol, 2020. 21(2): p. 294-305.
info@onco-suisse
- Vol. 10
- Ausgabe 5
- Mai 2020