- Contrôle des symptômes non douloureux en médecine palliative
Les patients souffrant d’ un cancer à un stade avancé présentent en moyenne 11 symptômes. Parmi ces symptômes, la douleur est l’ un des plus fréquent, mais elle est de loin le seul qui puisse être soulagé avec des médicaments ou des approches non médicamenteuses. Cette revue établit un aperçu global de la prise en charge de six autres symptômes fréquemment rencontrés en fin de vie : la dyspnée, les nausées/vomissements, la fatigue, l’ anorexie, l’ état confusionnel et les râles du mourant.
Les soins palliatifs ont comme objectif principal l’ amélioration de la qualité de vie des personnes qui sont atteintes d’ une maladie évolutive terminale. Un moyen pour améliorer cette qualité de vie réside dans le contrôle des multiples symptômes dont les patients souffrent. Une évaluation systématique de ces symptômes avec l’ échelle Edmonton Symptom Assessment Scale (ESAS) permet de dépister et de quantifier neuf d’ entre eux. Cette échelle d’ auto-évaluation a été adaptée et validée en version française et peut constituer un outil facile à mettre en place pour suivre l’ évolution des symptômes (1).
La dyspnée
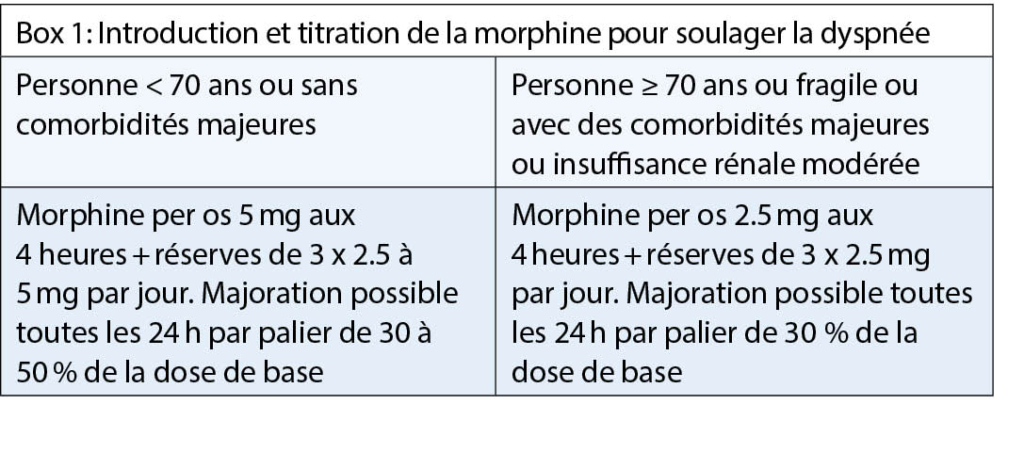
La dyspnée, définie comme une sensation subjective d’ un inconfort respiratoire, fait partie des symptômes les plus fréquemment exprimés par le patient. Elle est souvent accompagnée d’ angoisses et de peur de suffocation. Des prévalences jusqu’ à 75 % sont décrites chez des personnes en fin de vie (2). La prise en charge la plus efficace reste l’ optimisation du traitement de la maladie responsable de la sensation de dyspnée. A ce titre, les traitements de l’ insuffisance cardiaque et de la bronchopneumonie chronique obstructive (BPCO) sont maintenus le plus longtemps possible, même en approchant la fin de vie. En terme de traitement à visée symptomatique, la molécule qui s’ est avérée la plus efficace est la morphine (3). Son mode d’ action n’ est pas encore entièrement élucidé, mais des récepteurs µ ont été trouvés dans l’ arbre bronchique. Il s’ agit donc probablement d’ un effet lié à cette classe de médicaments, ce qui ouvre la possibilité d’ utiliser aussi les autres opiacés, malgré l’ absence d’ études bien menées. La crainte d’ une détresse respiratoire est infondée si la voie d’ administration est orale, le dosage adapté et la titration faite progressivement (Box 1) (4).
Comme autre alternative, on peut proposer au patient de diriger un ventilateur sur son visage lors des moments de dyspnée. Cette thérapeutique est désormais aussi efficace que l’ oxygénothérapie (5). Or aucune étude n’ a, jusqu’ à present, démontré l’ efficacité de cette dernière contre un placebo, en l’ absence d’ hypoxémie (6).
Les benzodiazépines sont souvent associées aux opiacés en cas de dyspnée chronique même en l’ absence de preuve scientifique (7). La prudence est pourtant nécessaire en raison d’ effets secondaires qui se multiplient avec les opiacés. L’ indication principale doit rester la prise en charge de l’ anxiété qui peut accompagner la sensation de dyspnée. Une titration progressive en commençant avec des petites doses est recommandée.
Les nausées et vomissements
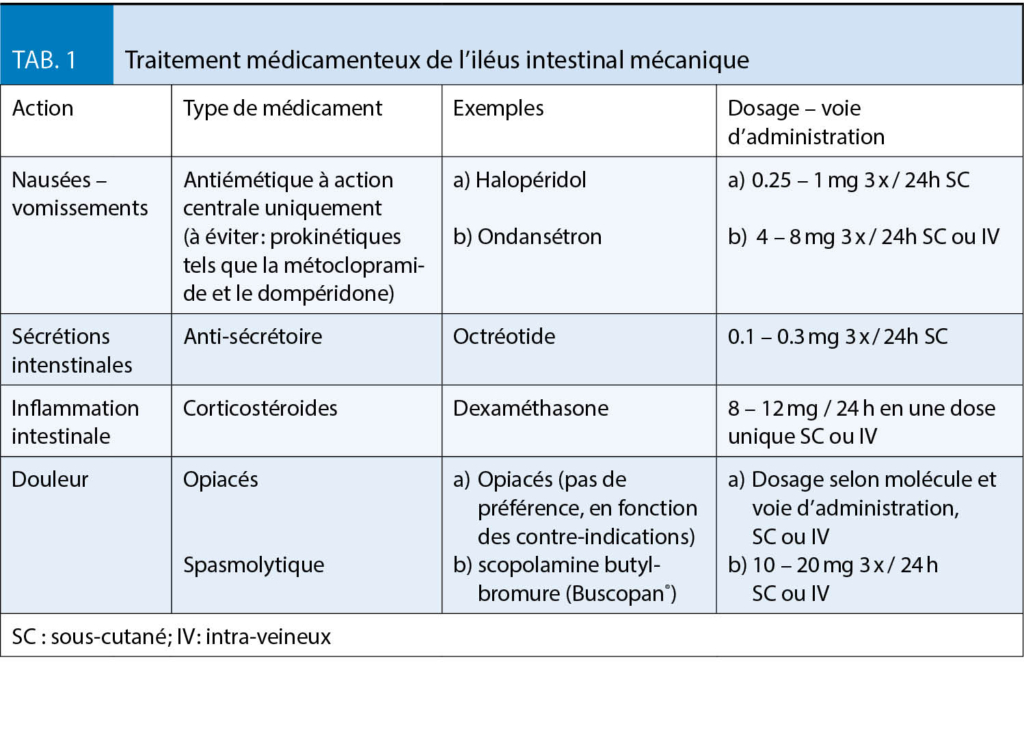
Les nausées et vomissements (n/v) en soins palliatifs sont relativement fréquents. En cas de cancer jusqu’ à 70 % des patients sont concernés (8). Cependant, les autres maladies terminales telles que l’ insuffisance cardiaque ou rénale et la BPCO provoquent également des n/v chez 50 % des malades (2). Certaines causes spécifiques, telles que la chimio- ou radiothérapie, le traitement par opiacés, une atteinte gastro-intestinale, des troubles métaboliques ou une atteinte intracérébrale (métastases, hypertension intra-crânienne) peuvent être identifiées et traitées; mais la plupart du temps aucune cause ou au contraire une origine multifactorielle est rencontrée chez ces patients (9). La métoclopramide est la molécule de première intention pour les n/v induites par les opiacés et les troubles métaboliques. La réponse est dose-dépendante et nécessite parfois une titration jusqu’ à 80mg/j (10). En cas de n/v induits par chimio- ou radiothérapie l’ ondansétron s’ est avéré très efficace (11). Les corticostéroides sont indiqués lors d’ hypertension intracrânienne, mais peuvent également être prescrits comme adjuvant à d’ autres antiémétiques (12). Finalement, l’ halopéridol est indiqué en cas de contrôle insuffisant par les autres antiémétiques, et lors d’ un iléus intestinal mécanique (13). L’ iléus se manifeste chez 3-15 % des patients avec un cancer, et principalement chez ceux atteints de cancers ovariens (20-50 %) et coliques (10-29 %)(14). Selon l’ endroit, l’ origine de l’ obstruction, les souhaits du patient et son état général, une intervention chirurgicale peut être envisagée, voire la pose d’ un stent ou d’ une gastrostomie de décharge. Pourtant, la plupart du temps, une prise en charge symptomatique est indiquée (15). Sur un plan médicamenteux, on peut agir sur trois axes : 1) les nausées ; 2) la sécrétion et l’ inflammation intestinale ; 3) la douleur (16). Les détails du traitement médicamenteux se trouvent dans le tableau 1.
La fatigue
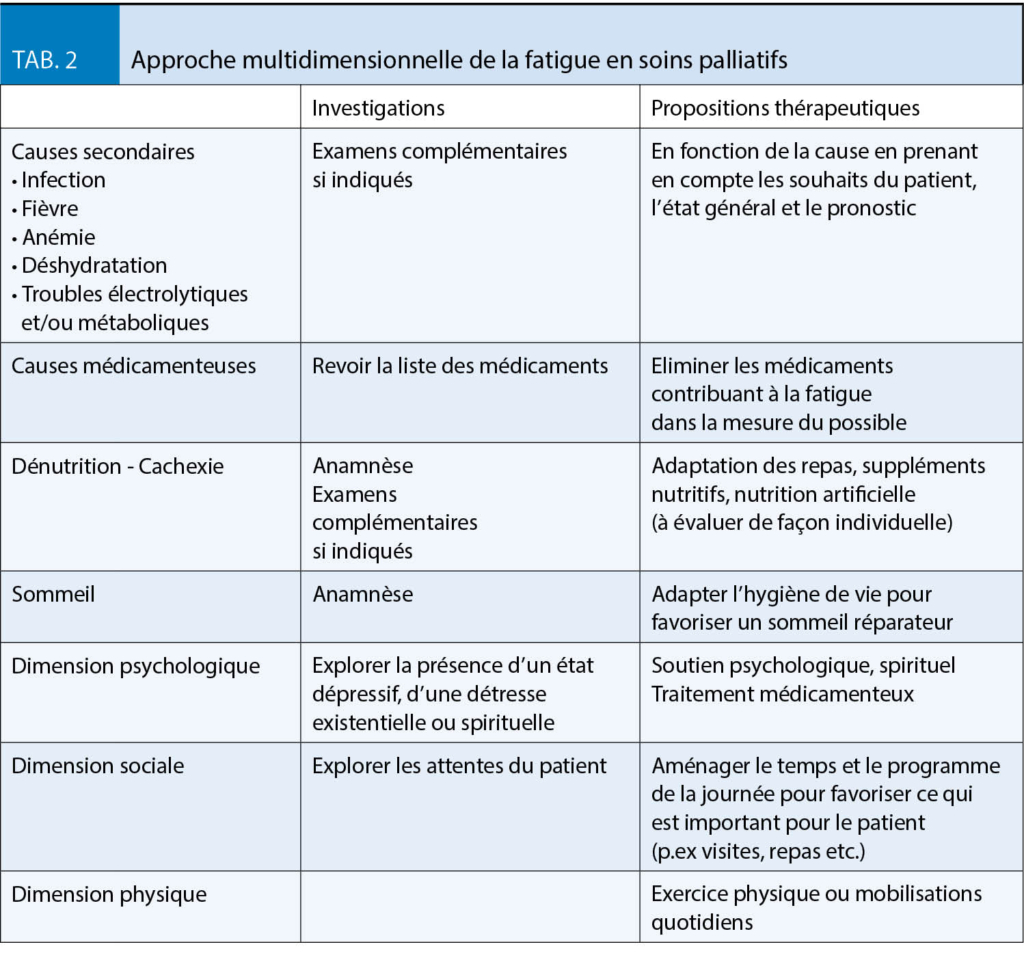
La fatigue peut être perçue comme un symptôme habituel auquel on ne porte que très peu d’ attention. Pourtant, elle peut avoir un impact majeur sur la qualité de vie. Sa prévalence se situe en moyenne aux alentours de 60 %, toutes maladies confondues, avec nettement plus de patients sous traitement de chimio- ou radiothérapie (17). Pour dépister une fatigue, l’ European Association of Palliative Care propose la question simple « Vous sentez-vous inhabituellement fatigué ou faible ? » avant de quantifier la fatigue avec l’ ESAS (17). Certaines causes secondaires telles que les infections, les troubles métaboliques et endocriniens, l’ anémie, pour n’ en nommer que quelques-uns, sont à explorer et à traiter dans la mesure du possible et du raisonnable. Une approche multidimensionnelle s’ impose (Tab. 2). Les traitements médicamenteux sont plutôt décevants et c’ est surtout l’ exercice physique qui a démontré une certaine efficacité (18). Toutefois, un essai par corticostéroides (p.ex déxaméthasone 4-8 mg par jour) pendant 5 jours peut être effectué. S’ il est concluant, on peut continuer le traitement pendant un maximum de deux semaines; au-delà l’ effet s’ estompe. D’ autres études chez des patients jeunes atteints de cancer montrent de bons résultats sous méthylphenidate. Cependant son profil d’ effets secondaires invite à la prudence chez les patients âgés.
L’ anorexie
L’ anorexie est définie comme un manque d’ appétit ou une réduction des apports nutritifs. Elle est très fréquente dans la phase terminale des maladies oncologiques (85 % (19)), mais aussi dans les insuffisances cardiaques, rénales ou pulmonaires (50 % (20)). Souvent, l’ anorexie est une des préoccupations principales de l’ entourage et une source d’ inquiétude. Sa prise en charge se fait donc de façon individuelle après une évaluation approfondie qui comprend non seulement l’ anamnèse des habitudes alimentaires, la présence de facteurs favorisant l’ anorexie (Box 2), mais aussi la représentation de l’ alimentation et les attentes du patient et de son entourage. Les facteurs favorisant l’ anorexie sont à traiter dans la mesure du possible. A un stade précoce de la maladie, une nutrition artificielle peut être envisagée. Au stade avancé (espérance de vie < 3 mois) une alimentation plaisir est à privilégier. Souvent une adaptation des portions, leur fréquence, la texture, mais aussi du contenu s’ avèrent nécessaire. L’ aide d’ une diététicienne peut être bénéfique. Des suppléments nutritifs oraux sont parfois indiqués. Comme médication qui stimule l’ appétit, on peut proposer une cure par corticostéroïdes (prednisone 0.5mg/kg/j ou dexaméthasone 0.1 mg / kg/j) dont l’ efficacité est déjà perceptible après 5 jours, mais qui s’ estompe au-delà de 2 semaines (21).
L’ état confusionnel
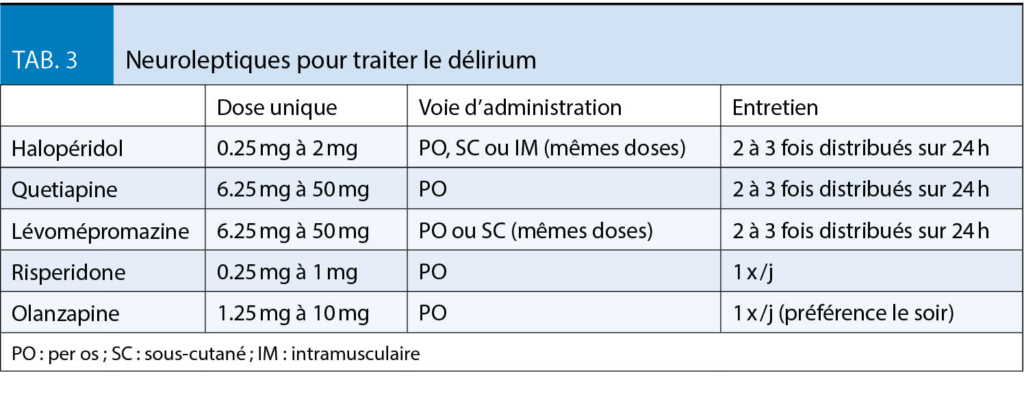
L’ état confusionnel est présent chez 13-88 % des patients avec une incidence qui augmente vers la toute fin de vie (22). Chez 30-50 %, l’ état confusionnel est précipité par des causes réversibles (infection, fécalome/constipation, rétention urinaire, troubles électrolytiques, médicaments). En fonction de l’ état de santé du patient et le pronostic, on peut envisager de chercher et traiter ces causes tout en proposant un traitement symptomatique en parallèle. Cependant, une étude récente a démontré, en comparant l’ halopéridol et la risperidone à des mesures non-pharmacologiques, que ces dernières étaient plus efficaces pour soulager les patients que les neuroleptiques (23). Une approche non pharmacologique est donc à privilégier. Bien entendu que si la souffrance, notamment en cas d’ état confusionnel hyperactif, est importante, l’ administration de neuroleptique est indispensable. Les molécules et dosages se trouvent dans le tableau 3.
Les râles du mourant
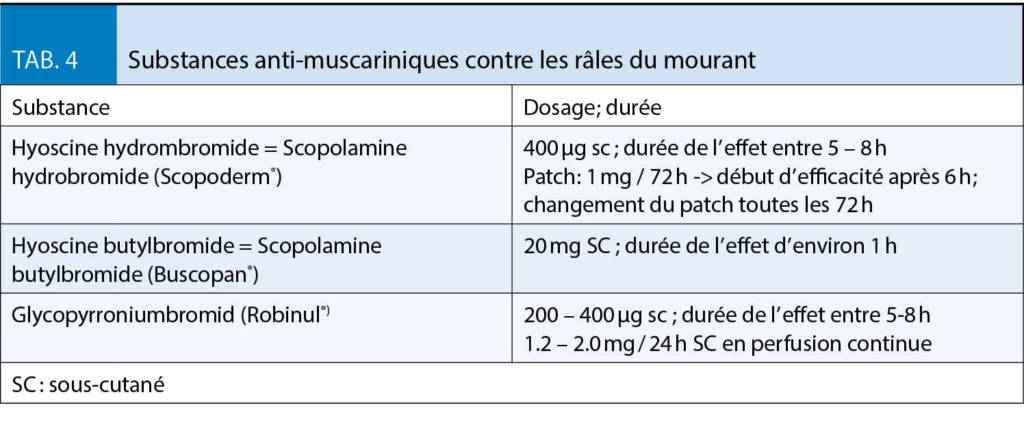
L’ encombrement bronchique haut qui porte aussi le nom « râles du mourant » se manifeste les derniers jours de vie, voire les heures précédant le décès. Jusqu’ à 92 % des personnes le présentent. Lors de troubles de la conscience, le réflexe de la déglutition est diminué, laissant les sécrétions s’ accumuler dans la trachée et les bronches. L’ air passant crée ainsi des vibrations oscillatoires perçues comme râles. Cet encombrement n’ est pas à confondre avec celui provoqué par une congestion alvéolaire due à une infection pulmonaire ou une décompensation cardiaque. Même si ce bruit peut être très gênant pour les proches, il n’ y a aucune évidence que ces râles engendrent une gêne quelconque au patient. Une prise en charge médicamenteuse ne s’ impose donc pas nécessairement (24). En premier lieu, il est important de chercher le contact et la communication avec les proches pour les rassurer. Toutefois, si une diminution de ces sécrétions est souhaitée, un essai de traitement médicamenteux anti-muscarinique peut être tenté, même si l’ effet de ces substances n’ a jamais été démontré contre un placebo (25). En Suisse, trois substances sont disponibles (tab. 4). Une autre option est l’ aspiration mécanique qui devrait être utilisée avec parcimonie, car à risque d’ être traumatique en cas d’ utilisation répétée.
Conclusion
Afin de rendre la fin de vie des patients confortable, le médecin a plusieurs substances médicamenteuses à disposition pour contrôler un certain nombre de symptômes. Toutefois, l’ écoute, le soutien relationnel et l’ accompagnement des proches ont également leur place dans la prise en charge globale d’ une personne avec une maladie évolutive terminale.
Copyright Aerzteverlag medinfo AG
Hôpitaux Universitaires de Genève
Hôpital de Bellerive
Service de médecine palliative
11 chemin de la Savonnière
1245 Collonge-Bellerive
petra.vayne-bossert@hcuge.ch
L’ auteur a déclaré n’ avoir aucun conflit d’ intérêts en relation avec cet article.
- L’ évaluation régulière des symptômes peut se faire facilement avec l’ échelle ESAS.
- La dyspnée répond bien à des petites doses de morphine.
- Plusieurs molécules sont à disposition pour gérer les nausées et vomissements en soins palliatifs, dont la métoclopramide, l’ ondansétron et l’ halopéridol.
- La fatigue est un symptôme insidieux auquel on ne porte que peu d’ attention. Un essai par corticoïde peut apporter une certaine amélioration.
- L’ état confusionnel est très fréquent en toute fin de vie. Une approche non-pharmacologique est à privilégier, mais parfois des petites doses de neuroleptiques s’ avèrent nécessaires.
1. Pautex S, Vayne-Bossert P, Bernard M, Beauverd M, Cantin B, Mazzocato C, et al. Validation of the French Version of the Edmonton Symptom Assessment System. Journal of pain and symptom management. 2017;54(5):721-6 e1.
2. Solano JP, Gomes B, Higginson IJ. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease. Journal of pain and symptom management. 2006;31(1):58-69.
3. Abernethy AP, Currow DC, Frith P, Fazekas B. Prescribing palliative oxygen: a clinician survey of expected benefit and patterns of use. Palliative medicine. 2005;19(2):168-70.
4. Pattinson KT. Opioids and the control of respiration. British journal of anaesthesia. 2008;100(6):747-58.
5. Abernethy AP, McDonald CF, Frith PA, Clark K, Herndon JE, 2nd, Marcello J, et al. Effect of palliative oxygen versus room air in relief of breathlessness in patients with refractory dyspnoea: a double-blind, randomised controlled trial. Lancet. 2010;376(9743):784-93.
6. Uronis HE, Currow DC, McCrory DC, Samsa GP, Abernethy AP. Oxygen for relief of dyspnoea in mildly- or non-hypoxaemic patients with cancer: a systematic review and meta-analysis. British journal of cancer. 2008;98(2):294-9.
7. Simon ST, Higginson IJ, Booth S, Harding R, Weingartner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. The Cochrane database of systematic reviews. 2016;10:CD007354.
8. Harris DG. Nausea and vomiting in advanced cancer. Br Med Bull. 2010;96:175-85.
9. Fainsinger R, Miller MJ, Bruera E, Hanson J, Maceachern J. Symptom control during the last week of life on a palliative care unit. Journal of palliative care. 1991;7(1):5-11.
10. Bruera E, Belzile M, Neumann C, Harsanyi Z, Babul N, Darke A. A double-blind, crossover study of controlled-release metoclopramide and placebo for the chronic nausea and dyspepsia of advanced cancer. Journal of pain and symptom management. 2000;19(6):427-35.
11. Billio A, Morello E, Clarke MJ. WITHDRAWN: Serotonin receptor antagonists for highly emetogenic chemotherapy in adults. The Cochrane database of systematic reviews. 2013(12):CD006272.
12. Vayne-Bossert P, Haywood A, Good P, Khan S, Rickett K, Hardy JR. Corticosteroids for adult patients with advanced cancer who have nausea and vomiting (not related to chemotherapy, radiotherapy, or surgery). The Cochrane database of systematic reviews. 2017;7:CD012002.
13. Hardy JR, O’Shea A, White C, Gilshenan K, Welch L, Douglas C. The efficacy of haloperidol in the management of nausea and vomiting in patients with cancer. Journal of pain and symptom management. 2010;40(1):111-6.
14. Tuca A, Guell E, Martinez-Losada E, Codorniu N. Malignant bowel obstruction in advanced cancer patients: epidemiology, management, and factors influencing spontaneous resolution. Cancer Manag Res. 2012;4:159-69.
15. Romeo M, de Los LGM, Cuadra Urteaga JL, Vila L, Ahlal S, Indacochea A, et al. Outcome prognostic factors in inoperable malignant bowel obstruction. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2016;24(11):4577-86.
16. Walsh D, Davis M, Ripamonti C, Bruera E, Davies A, Molassiotis A. 2016 Updated MASCC/ESMO consensus recommendations: Management of nausea and vomiting in advanced cancer. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2017;25(1):333-40.
17. Radbruch L, Strasser F, Elsner F, Goncalves JF, Loge J, Kaasa S, et al. Fatigue in palliative care patients — an EAPC approach. Palliative medicine. 2008;22(1):13-32.
18. Cramp F, Byron-Daniel J. Exercise for the management of cancer-related fatigue in adults. The Cochrane database of systematic reviews. 2012;11:CD006145.
19. Laviano A, Meguid MM, Rossi-Fanelli F. Cancer anorexia: clinical implications, pathogenesis, and therapeutic strategies. The lancet oncology. 2003;4(11):686-94.
20. Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology. 2013;18(4):616-29.
21. Tuca A, Jimenez-Fonseca P, Gascon P. Clinical evaluation and optimal management of cancer cachexia. Critical reviews in oncology/hematology. 2013;88(3):625-36.
22. Hosie A, Davidson PM, Agar M, Sanderson CR, Phillips J. Delirium prevalence, incidence, and implications for screening in specialist palliative care inpatient settings: a systematic review. Palliative medicine. 2013;27(6):486-98.
23. Agar MR, Lawlor PG, Quinn S, Draper B, Caplan GA, Rowett D, et al. Efficacy of Oral Risperidone, Haloperidol, or Placebo for Symptoms of Delirium Among Patients in Palliative Care: A Randomized Clinical Trial. JAMA internal medicine. 2017;177(1):34-42.
24. Campbell ML, Yarandi HN. Death rattle is not associated with patient respiratory distress: is pharmacologic treatment indicated? Journal of palliative medicine. 2013;16(10):1255-9.
25. Lokker ME, van Zuylen L, van der Rijt CC, van der Heide A. Prevalence, impact, and treatment of death rattle: a systematic review. Journal of pain and symptom management. 2014;47(1):105-22.
la gazette médicale
- Vol. 9
- Ausgabe 3
- Juni 2020