- Behandlung der chronischen myeloischen Leukämie
Bis zur Jahrtausendwende war die chronische myeloische Leukämie (CML) eine meist letal verlaufende Krankheit mit einer mittleren Überlebenszeit von etwa 7 Jahren. Durch die Einführung der Tyrosinkinase-Hemmer (TKI) steht heute eine orale Therapie zur Verfügung, welche für die Mehrzahl der Betroffenen eine normale Lebenserwartung ermöglicht. Bei einem Teil der Patienten kann die Therapie nach einigen Jahren sogar abgesetzt werden, ohne dass es zu einem Rezidiv kommt. Für einen guten Behandlungserfolg sind insbesondere ein gutes Monitoring des molekularen Ansprechens und Kenntnisse über das Nebenwirkungs-Profil der verschiedenen TKIs erforderlich.
Die CML war die erste Krankheit, bei der ein erworbener chromosomaler Defekt als Treiber für eine maligne transformierte Hämatopoiese entdeckt wurde. Durch eine Translokation zwischen den Chromosomen 22 und 9 entsteht das nach dem Ort seiner Entdeckung benannte Philadelphia-Chromosom. Daraus resultiert das pathologische Fusionsgen BCR-ABL, welches für ein Protein codiert, das die hämatopoietischen Zellen in eine ungebremste Teilungsaktivität bringt. Diese Erkenntnisse führten zur Entwicklung eines Medikamentes, welches direkt die Expression des BCR-ABL Gens inhibiert. Der Tyrosinkinase-Inhibitor Imatinib (Glivec®) wurde im Jahr 2000 verfügbar und revolutionierte die Behandlung der CML. So zeigten die Verlaufskontrollen nicht nur ein kontinuierliches Verschwinden des Philadelphia-Chromosoms, sondern auch des viel präziser messbaren BCR-ABL Gens, es kam zu molekularen Remissionen. Zudem war der orale TKI wesentlich besser verträglich als die zuvor verabreichten Interferon-Behandlungen. In der IRIS-Studie mit 553 Patienten auf dem Imatinib-Arm waren nach 10 Jahren 84% am Leben, lediglich 9% waren an den Folgen der CML verstorben.
In der Zwischenzeit sind nebst Imatinib drei weitere TKIs für die Erstlinientherapie zugelassen. Diese haben eine etwas stärkere Wirkung und führen schneller zu einer guten molekularen Remission. Alle TKIs unterscheiden sich aber wesentlich in ihrer Toxizität. Deshalb empfehlen alle aktuellen Guidelines, den TKI der Erstlinientherapie aufgrund der Komorbidität und auch des CML-Risiko-Scores auszuwählen.
Therapieindikation
Im Gegensatz zur chronischen lymphatischen Leukämie ist bei der CML immer die Indikation für eine Therapie gegeben, also auch bei fehlenden Allgemeinsymptomen, normaler Milzgrösse oder nur geringfügigen Blutbildveränderungen. Das Aufschieben der Therapie könnte einen Übergang in eine akzelerierte Phase oder Blastenkrise begünstigen und damit die Prognose deutlich verschlechtern.
Therapiewahl
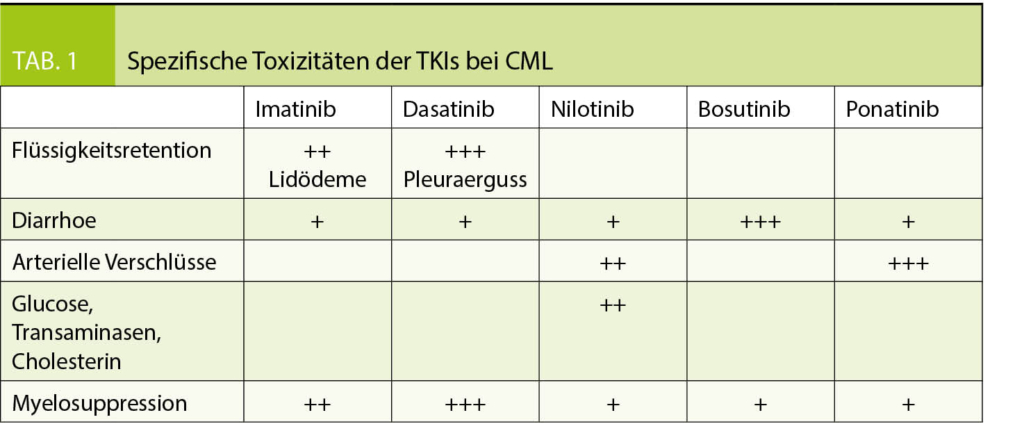
In den meisten Fällen liegt bei Diagnose eine chronische Phase der CML vor. Dafür sind vier TKIs zugelassen. Die robustesten Daten zur Langzeit-Toxizität gibt es für Imatinib, weshalb die meisten Experten zumindest bei niedrigem CML-Risiko-Score die Therapie damit beginnen. Der CML Risiko-Score basiert auf dem Patientenalter, der Milzgrösse unter dem Rippenbogen sowie der Blasten- und Thrombozytenzahl im Blut. Unter https://www.leukemia-net.org/content/leukemias/cml/elts_score/index_eng.html findet sich ein online-calculator für den aktuell gebräuchlichen ELTS-Risiko-Score. Liegt eine CML mit hohem Risiko-Score vor, wird aufgrund der schnelleren und stärkeren Wirkung ein TKI der 2. Generation, also Dasatinib (Sprycel®), Nilotinib (Tasigna®) oder Bosutinib (Bosulif®) bevorzugt. Bei der Medikamentenwahl ist aber stets die Komorbidität des Patienten zu berücksichtigen. So sind aufgrund der spezifischen Toxizität gewisse TKIs bei gewissen Patienten kontraindiziert (Tab. 1).
Im Verlauf der CML können sich molekulare Mutationen einstellen. Dadurch verändert sich die sterische Konfiguration der BCR-ABL-Tasche, in der die TKIs angreifen. Dies kann die Wirkung beeinträchtigen oder verunmöglichen. Bisher sind über 200 Mutationen beschrieben worden. Bei der Mutation T315I ist ausschliesslich der TKI Ponatinib (Iclusig®) wirksam. Eine Mutationsanalyse soll vor allem bei Nicht-Erreichen der therapeutischen Meilensteine und bei verloren gegangener Wirkung, sowie bei akzelerierter Phase oder Blastenkrise bereits initial veranlasst werden.
In der Zeit vor den TKIs war die CML die häufigste Indikation für eine allogene Stammzell-Transplantation. Heute müssen CML-Patienten nur noch selten transplantiert werden, etwa bei Blastenkrise oder akzelerierter Phase, bei ABL1-Mutationen, die mit einer Resistenz auf TKI einhergehen oder bei Intoleranz aller TKIs.
Monitoring
Das molekulare Monitoring ist eine unabdingbare Voraussetzung für eine optimale Therapiesteuerung und Prognose. Die aktuellen Guidelines definieren die therapeutischen Meilensteine, die zu erreichen sind. So muss das BCR-ABL nach 3 Monaten auf 10%, nach 6 Monaten auf 1% und nach 12 Monaten auf 0,1% (= MR3) abfallen. Ist dies nicht der Fall, liegt ein Warnsignal oder ein Therapieversagen vor. Dies impliziert eine erhöhte Wachsamkeit, bzw. eine Mutationsanalyse und einen Therapiewechsel.
Durch Erreichen einer stabilen MR3 ist die Gefahr einer Transformation in eine akzelerierte Phase oder Blastenkrise gebannt. Damit kann man sich aber noch nicht zufrieden geben. Das nächste Ziel ist eine tiefe Remission (MR4, MR4.5 oder MR5), denn nur so kann später ein Absetzen der Therapie in Betracht gezogen werden.
Therapiestopp
Bereits vor 10 Jahren wurden erste Resultate von Patienten publiziert, die den TKI aus eigenem Antrieb abgesetzt hatten. Es zeigte sich, dass etwa die Hälfte der Patienten nicht rezidivierte, sofern sie den TKI über mehrere Jahre eingenommen und eine tiefe molekulare Remission erreicht hatten. Mittlerweile sind Daten solcher Absetzstudien mit weit über 2000 Patienten publiziert und definierte Kriterien zum Therapiestopp haben in den Guidelines Aufnahme gefunden. Bei Einhaltung dieser Kriterien bleiben etwa 50% der Patienten ohne Therapie dauerhaft rezidivfrei.
Als Voraussetzungen für einen Therapiestopp gelten gemäss Oncopedia-Guidelines eine TKI-Einnahme von mindestens 5 Jahren und das Erreichen einer tiefen molekularen Remission (mindestens MR4 = BCR-ABL < 0,01%) während der letzten 2 Jahre.
In der therapiefreien Zeit ist ein engmaschiges molekulares Monitoring im ersten Jahr monatlich, danach alle 2-3 Monate zwingend nötig. Kommt es zu einem molekularen Rezidiv (Verlust einer MR3) muss die TKI-Therapie wieder aufgenommen werden. Allenfalls kann ein späterer Absetzversuch erfolgreich verlaufen.
Eine therapiefreie Remission spart nicht nur erheblich Kosten, sondern vor allem auch Toxizität, die durch eine lebenslange Therapie früher oder später zu erwarten ist. Es sollte deshalb kein CML-Patient lebenslang auf Autopilot unter einer TKI-Therapie stehen.
CML und Kinderwunsch
Angesichts der ausgezeichneten Prognose der CML unter einer TKI-Therapie, kann in der Sprechstunde die Familienplanung zum Thema werden. Neuere Daten zeigen, dass die Zeugung eines Kindes unter einer TKI-Behandlung nicht zu einer erhöhten Missbildungs- oder Abortrate führt, sodass werdende Väter die Therapie beibehalten können. Für Schwangerschaften ist die Datenlage weniger klar. Zwar wurden in neuerer Zeit zahlreiche Kasuistiken über problemlose Schwangerschaften, die unter TKI-Therapie begannen, berichtet. Im Tierversuch erwiesen sich die TKIs jedoch als teratogen, sodass diese vor der Schwangerschaft abgesetzt werden sollten. Da vor einer Schwangerschaft eine stabile tiefe molekulare Remission bestehen sollte, dürfte in den meisten Fällen eine Therapiepause während der Schwangerschaft vertretbar sein. Ist dies nicht der Fall, bietet sich ab dem 2. Trimenon eine Interferon-Behandlung an. Falls dies nicht geht und eine Therapie unabdingbar ist, kann allenfalls ein nicht Placenta-gängiger TKI (Imatinib, Nilotinib) in Betracht gezogen werden.
Copyright bei Aerzteverlag medinfo AG
Benslistrasse 6a
9034 Eggersriet
Urs.Hess1@bluewin.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die TKIs haben die Therapie der CML revolutioniert. CML Patienten in chronischer Phase können mit diesen Medikamenten in den allermeisten Fällen mit einer normalen Lebenserwartung rechnen.
- Die Wahl des TKI für die Erstlinientherapie sollte aufgrund des CML Risiko-Scores und der Komorbidität erfolgen.
- Für den Behandlungserfolg ist es wichtig, dass die molekularen Verlaufskontrollen gemäss Guidelines durchgeführt werden und dass bei Nicht-Erreichen der therapeutischen Meilensteine oder Verlust des Ansprechens eine Mutationsanalyse und eine Therapieanpassung erfolgt.
- Unter der Therapie sollte eine tiefe molekulare Remission (mindestens MR4) angestrebt werden. Bei einer TKI-Einnahme von mindestens 5 Jahren und einer MR4 von mindestens 2 Jahren kann nach Therapiestopp etwa die Hälfte der Patienten rezidivfrei weiterleben.
- Bei jüngeren CML-Patienten mit tiefem molekularem Ansprechen kann eine Familienplanung zum Thema werden.
1. Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer, 2015. 136: E359.
2. Haas, G.P., et al. The worldwide epidemiology of prostate cancer: perspectives from autopsy studies. Can J Urol, 2008. 15: 3866.
3. Han, K.R., et al. Third-generation cryosurgery for primary and recurrent prostate cancer. BJU Int, 2004. 93: 14.
4. Schmid, H.-P., et al. Embolisation der Prostataarterien bei benigner Prostatahyperplasie und beim lokalisierten Prostatakarzinom. Leading Opinions Urol, 2018 8:9.
5. Hamdy, F.C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med, 2016. 375: 1415.
6. Wilt, T.J., et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med, 2017. 377: 132.
7. Bill-Axelson, A., et al. Radical Prostatectomy or Watchful Waiting in Prostate Cancer – 29-Year Follow-up. N Engl J Med, 2018. 379: 2319.
8. Grimm, P., et al. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int, 2012. 109 Suppl 1: 22.
9. Ahmed, H.U., et al. Will focal therapy become a standard of care for men with localized prostate cancer? Nat Clin Pract Oncol, 2007. 4: 632.
10. Crawford, E.D., et al. Targeted focal therapy: a minimally invasive ablation technique for early prostate cancer. Oncology (Williston Park), 2007. 21: 27.
11. Fahmy, W.E., et al. Cryosurgery for prostate cancer. Arch Androl, 2003. 49: 397.
12. Madersbacher, S., et al. High-Energy Shockwaves and Extracorporeal High-Intensity Focused Ultrasound. J Endourol, 2003;17: 667-72
13. Ramsay, C. R., et al. “Ablative Therapy for People with Localised Prostate Cancer: A Systematic Review and Economic Evaluation.” Health Technol Assess, 2015 19: 1.
14. Zhu T.C., et al. Determination of the distribution of light, optical properties, drug concentration, and tissue oxygenation in-vivo in human prostate during motexafin lutetium-mediated photodynamic therapy. J Photochem Photobiol, 2005 79:231
15. Valerio M. et. al. New and Established Technology in Focal Ablation of the Prostate: A Systematic Review. Eur Urol. 2017. 71: 1
16. Mordasini L. et al. Prostatic Artery Embolization in the Treatment of Localized Prostate Cancer: A Bicentric Prospective Proof-of-Concept Study of 12 Patients. J Vasc Interv Rasiolo, 2018 29:589
17. Guenther E et al. Prostate cancer treatment with Irreversible Electroporation (IRE): Safety, efficacy and clinical experience in 471 treatments. PLoS One, 2019 14: e0215093
der informierte @rzt
- Vol. 10
- Ausgabe 6
- Juni 2020