- Urininkontinenz im Alter
Die Inkontinenz der betagten Frau wird aus gynäkologischer Sicht beleuchtet. Wir skizzieren die grundsätzliche Problematik, eine angepasste Abklärung und zeigen Therapieoptionen, deren Gefahren und die Grenzen des Machbaren auf.
Die Gruppe «alte Menschen» ist heterogen. Sie reicht von der aktiven Seniorin bis zu der kaum mobilen Pflegeheimbewohnerin. Die Inkontinenz nimmt mit dem Alter (1) und Gebrechlichkeit zu (2) (Abb. 1).
Die Ursachen sind multifaktoriell. Altersbedingte anatomische Veränderungen, chronische Krankheiten, Polypharmazie, sowie funktionelle und kognitive Einschränkungen spielen eine Rolle. Inkontinenz ist ein geriatrisches Syndrom, das auch ohne Störung im Urogenitaltrakt vorkommen kann (3). Die Inkontinenz ist demnach als Marker für die Gebrechlichkeit zu verstehen und die Inkontinenz ist nicht selten – wie auch eine neurokognitive Störung – Grund für eine Heimeinweisung (4, 5). Neurokognitive Störung und Inkontinenz gehen Hand in Hand (6). In der Urodynamik erkennt man aber lediglich die messbare Detrusor Überaktivität (7), welche dem Krankheitsbild nicht gerecht wird.
Beim alten Menschen bewegen wir uns zwischen therapeutischem Nihilismus und Überbehandlung. Die Therapie verlangt beim alten Menschen eine breitere Sichtweise und den Einbezug von Haus- und Heimarzt, von Pflege und Angehörigen.
Altersbedingte Veränderungen des Urogenitalsystems
Altersbedingte Veränderungen der Blase
Tendenziell sinkt das miktionierte Urinvolumen, der Detrusor wird instabiler, der Resturin nimmt zu, die relative Blasenkapazität wird dabei geringer (8), wobei urodynamische Befunde nur schwach mit der Klinik korrelieren (9). Auch die Kontraktilität der Blase nimmt mit dem Alter ab (10). Die Hypokontraktilität der Blase und der damit zunehmende Restharn kann zur Pollakisurie und Nykturie beitragen (11). Ein instabiler Detrusor in Kombination mit einer reduzierten Kontraktionskraft findet man bei älteren Menschen nicht selten (12). Diese Kombination kann Drang, Stress und obstruktive Symptome hervorrufen und ist eine therapeutische Herausforderung.
Altersbedingte Veränderungen der Urethra
Die Verschlussfunktion der Urethra, gemessen als maximaler urethraler Verschlussdruck, nimmt um 15cm H2O pro Dekade ab (13, 14 ). Die Mucosa wird zunehmend dünner, die Koaptation wird ungenügend, das begünstigt auch die Aszension von Bakterien (15). Diese Ausdünnung der Urethra kann bis ins Trigonum der Blase reichen und über sensible Afferenzen die oben beschriebene Detrusorinstabilität triggern (16). Perucchini konnte zeigen, dass die Menge an quergestreiften Muskelfasern des urethralen Rhabdomyospinkters um 1% pro Lebensjahr abnimmt (17). Die glatte Muskulatur des urethralen Sphinkters (18) ist denselben Veränderungen unterworfen.
Altersbedingte Veränderungen der Vagina
In der Menopause wird die vaginale Mukosa dünn, der pH-Wert steigt, da pathogene Bakterien die östrogenbevorzugenden Laktobazillen ersetzten. Dies kann zu rezidivierenden Harnwegsinfekten führen (19).
Anatomische Veränderungen
Obstruktive Störungen sind bei der Frau selten, sie sind meist bedingt durch einen relevanten Genitaldeszensus mit konsekutivem Quetschhahn oder durch einen Eingriff zur Behandlung der Belastungsinkontinenz.
Nicht gynäkologische Ursachen, die zur Inkontinenz beitragen:
Ein schlecht eingestellter Diabetes führt zur Polyurie, die diabetische Zystopathie und diabetische Polyneuropathie (20) zu Blasenspeicherstörungen.
Muskulo-skelettale Veränderungen können durch Immobilität eine Urge akzentuieren, kann doch die Patientin die Toilette nicht mehr in vernünftiger Zeit erreichen. Schlecht platzierte oder ungünstig gestaltete Toiletten, sowie fehlende Assistenz verschlechtern die Situation. Die Urge ist wiederum Risikofaktor für Stürze und Frakturen (21).
Lungenkrankheiten mit chronischem Husten fördern eine Stress Inkontinenz. Die Herzinsuffizienz und die chronisch venöse Insuffizienz verschlimmern die Nykturie wegen der nächtlichen Rückresorption der Ödeme.
Durch cerebrovaskuläre Insulte entstehen ischämische Bezirke, welche in der neurourologischen Terminologie als suprapontine Läsionen (Läsion oberhalb des pontinen Miktionszentrums) zusammengefasst werden. Diese können die hemmende Funktion miktionsrelevanter kortikaler und subkortikaler Areale auf das pontine Miktionszentrum (Koordinationszentrum) reduzieren. Die Folge davon ist eine neurogene Detrusorüberaktivität. Ein weiteres typisches Beispiel hierfür ist auch die Parkinsonkrankheit. Seltener kommt bei Parkinson Resturin vor, welcher sich durch die Hyopkinesie des quergestreiften Sphinkters der Urethra erklärt. Die L-Dopa Therapie verbessert die Kontinenz häufig nicht (22). Auch Alzheimer und andere Demenzformen verursachen suprapontine Läsionen. Die oben beschriebene, neurologisch verursachte Detrusorüberaktivität zeigt sich ebenfalls, diese kommt zusammen mit den demenzspezifischen Orientierungs- Koordinationsschwierigkeiten.
Betagte, welche an psychischen Krankheiten wie Depressionen leiden, können die Motivation verlieren, kontinent zu bleiben. Handkehrum verschlimmert die Inkontinenz die Depression (23).
Auch die Obstipation ist mit Urininkontinenz assoziiert (24).
Die Abklärung der Inkontinenz der älteren Frau
Eine Inkontinenz ist auch im Alter behandelbar: eine weiterführende Abklärung kann sich lohnen. Man kann festlegen, in wieweit der Inkontinenz eine urogenitale Ursache zugrunde liegt, und es lässt sich in Absprache mit den Betreuungspersonen ein den Lebensumständen der Patientin angepasster Therapievorschlag ausarbeiten.
Am Anfang steht die genaue Anamnese, allenfalls auch durch Drittpersonen. Das Erfassen von Komorbiditäten und der aktuellen Medikation, sowie der sozialen Situation sind zentral.
Mit der sonographischen oder mittels Einmalkatheter durchgeführten Restharnmessung erhält man einen Hinweis auf die Blasenfunktion und kann therapeutische Weichen stellen (25).
Der gynäkologische Status erkennt einen schwerwiegenden Deszensus, welcher zur obstruktiven Miktionsstörung und bei relevanter Resturinbildung zur Überlaufinkontinenz (overflow) führen kann. Eine Stauung der oberen Harnwege ist sehr selten und kann mittels Nierenultraschall ausgeschlossen werden. Ein Augenmerk wird auf die urogenitale Trophik gelegt. Der simple Hustentest mit voller Blase genügt, um die Belastungsinkontinenz klinisch zu erkennen (26, 27).
Obwohl man mit Anamnese, klinischem Untersuch und Ultraschall sehr weit kommt und obwohl die Urodynamik in der Basis-abklärung der Urininkontinenz nicht als Routineuntersuchung empfohlen ist (EAU-Guidelines 2018), ist eine Urodynamik und Zystoskopie auch bei betagten Patientinnen durchführbar und hilft, die Blasenfunktionsstörung genau zu definieren (28). Vor einer invasiven Behandlung ist sie angezeigt. Bei Querschnittläsionen ist die Urodynamik unverzichtbar. Bei der betagten Patientin ist diese allerdings kaum je im Fokus, man sucht die detrusorinhärente Pathologie, Resturinbildung, Verschlussschwäche, die funktionelle Obstruktion.
Die Behandlung der Inkontinenz
Vor einer medikamentösen Therapie sollte man Verhaltenstherapien versuchen. Der Stellenschlüssel einer Institution erlaubt die notwendige Hilfe dafür – wie assistierter Gang zur Toilette – nicht immer (29).
Eine medikamentöse Therapie soll sorgfältig indiziert werden. Für betagte Patientinnen kann sie ungeeignet sein, beispielsweise bei Heimbewohnerinnen, die keine Intention zeigen, auf die Toilette zu gehen oder stark kognitiv und funktionell eingeschränkt sind, und so eine Verbesserung durch die Medikation nicht mehr zu erwarten ist (30).
Medikamentöse Therapie:
Lokales Östrogen soll frühzeitig niedrig dosiert als Basistherapie begonnen werden. Lokale Östrogene sind – anders als die systemisch verabreichten Östrogene – risikolos, verhindern oder behandeln die Atrophie, welche zur Inkontinenz beiträgt und schützen die postmenopausale Frau vor rezidivierenden Harnwegsinfekten (31). Lokal applizierte Östrogene behandeln das genito-urethrale menopausale Syndrom weit effektiver als eine systemische Hormonersatztherapie. In der Schweiz sind nur niedrig- oder ultraniedrig dosierte Präparate zugelassen (32).
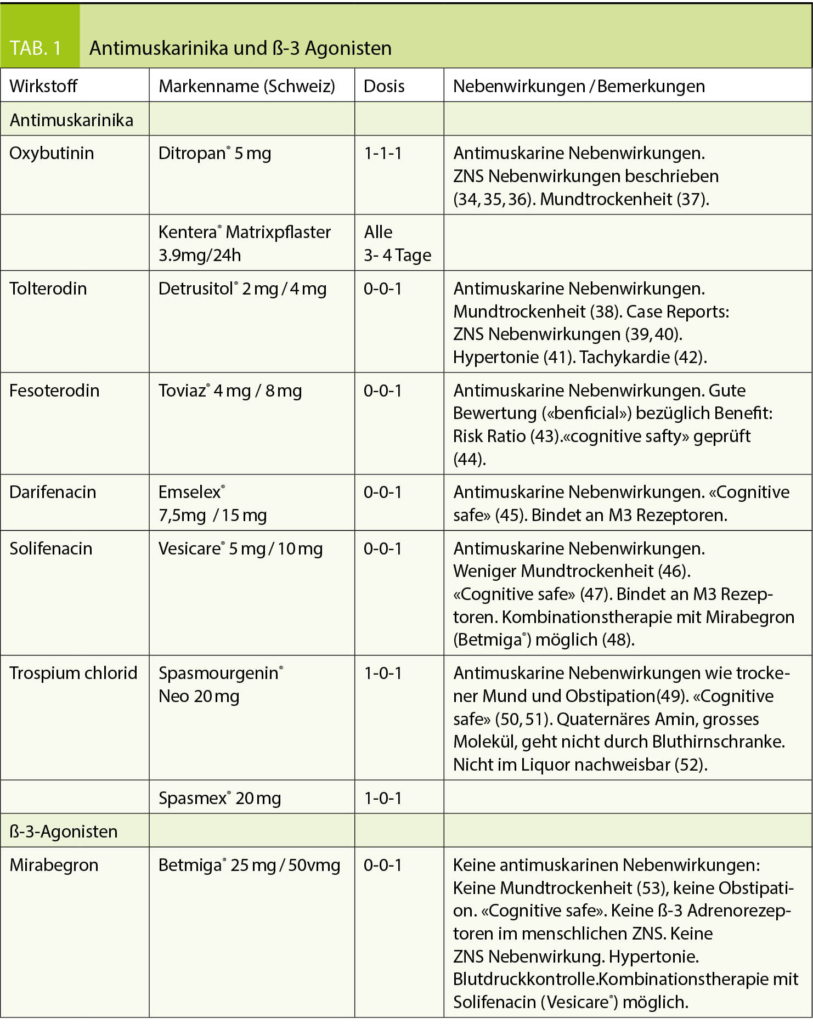
Antimuskarinika hemmen kompetitiv die Muskarinrezeptoren am Detrusor und blockieren den Parasympathikus, welcher die Blasenentleerung verantwortet. Sie haben einen moderaten Effekt (33) und können die Anzahl der Inkontinenzepisoden und die Miktionsfrequenz reduzieren. Antimuskarinika sind in Studien meist mit Hilfe von Miktionstagebüchern gegenüber Placebo oder einem älteren Antimuskarinikum getestet. In der Effektivität unterscheiden sie sich kaum voneinander, hingegen im Nebenwirkungsprofil: Beim älteren Präparat Oxybutynin (Ditropan®, Kentera® Matrixpflaster) sind ZNS Nebenwirkungen beschrieben. Tolterodin (Detrusitol®) und Fesoterodin (Toviaz®) sollen sich verstärkt an der Blase konzentrieren, Fesoterodin wird ein gutes Nutzen-Risiko-Verhältnis attestiert. Solifenacin (Vesicare®) und Darifenacin (Emselex®) sind M3 selektiv und binden hauptsächlich an den Subtyp III der Muscarinrezeptoren und weniger an den Subtyp II, welcher im ZNS vorkommt und gelten bezüglich ZNS Nebenwirkungen als sicher. Das quaternäre Amin Trospium chlorid (Spasmo-Urgenin® Neo, Spasmex®) ist ein grosses Molekül und kann die Bluthirnschranke nicht passieren, also «cognitive safe» (siehe Tabelle).
Der ß-3 Agonist Mirabegron stimuliert die ß-3 Adrenorezeptoren des Detrusors. Diese sympathischen β-3 Rezeptoren am Blasenmuskel vermitteln die Blasenrelaxation und damit die Blasenfüllung. Dieser andere Mechanismus ist eine gute Alternative zu den Antimuskarinika. Der Blutdruck soll kontrolliert werden. Mirabegron (Betmiga®) und Solifenacin (Vesicare®) sind als Kombinationstherapie geprüft (siehe Tabelle).
Bei betagten Patientinnen muss die Pharmakokinetik beachtet werden. Eine Niereninsuffizienz oder eine eingeschränkte Leberfunktion liegen häufig vor: Medikamentöse Therapien soll man darum prinzipiell mit der tiefst möglichen Dosierung beginnen (54). Eine Polypharmazie (>5 Medikamente) ist bei Betagten häufig (55), Interaktionen sind kaum mehr kontrollierbar und einige Medikamente können die Inkontinenz verstärken (56): Medikamente, die das Urinvolumen erhöhen wie Diuretika oder Lithium verschlechtern den Drang und die Nykturie. Sedativa, Hypnotika und Antipsychotika beeinflussen Vigilanz, Schlaf und Mobilität und damit die Kontinenz. Cholinesterasehemmer wie Galantamin (Reminyl®), die bei Alzheimer Demenz eingesetzt werden, können eine Urge Inkontinenz triggern (57, 58). Anticholinerge Präparate können zur Überlaufinkontinenz (overflow) führen.
Die Bereinigung einer langen Medikamentenliste liegt nicht in der Kompetenz der urogynäkologischen Fachperson. Für deren Ergänzung mit Antimuskarinika muss eine gute Indikation vorliegen und die Wirksamkeit der Therapie soll kontrolliert werden.
Medikamentennebenwirkungen
Alzheimerkrankheit und andere Demenzformen sind durch ein cholinerges Defizit im Zentralnervensystem charakterisiert (59). Während beim jungen Menschen anticholinerge Medikamente Mundtrockenheit, Akkommodationsstörungen oder Obstipation hervorrufen, können beim alten Menschen relevantere Nebenwirkungen wie Sedation, Delirium, Halluzinationen und Stürze mit konsekutiven Frakturen auftreten (60). Parkinsonkranke sind speziell sensitiv auf Medikamente mit antimuskarinerger Wirkung (61). Epidemiologische Daten zeigen bei alten Menschen einen positiven Zusammenhang zwischen langfristiger medikamentöser antimuskarinerger Belastung und kognitiver Einschränkung sowie demenzieller Entwicklung (62, 63). Bei vorbestehender Demenz ist der Zusammenhang weniger klar (64, 65).
Neben den bei der überaktiven Blase eingesetzten Antimuskarinika haben auch andere Medikamente anticholinerge Eigenschaften, beispielsweise Biperiden (Akineton®), Butylscopalamin (Buscopan®), Umeclidinium (Incruse Ellipta®) und auch viele Antidepressiva, Neuroleptika und Antihistaminika (66). Die anticholinerge Belastung kumuliert mit jedem zusätzlich eingesetzten Präparat. Bei betagten Patientinnen soll die totale anticholinerge Belastung so gering wie möglich gehalten werden.
Chirurgische Therapie der Inkontinenz
Die Operationsindikation muss mit der Patientin, dem Hausarzt, den betreuenden Personen besprochen werden. Alter und Komorbiditäten führen zu mehr anästhesiologischen und perioperativen Komplikationen. Mit einer längeren Hospitalisation und einem höheren Betreuungsbedarf nach Spitalentlassung ist zu rechnen.
Die Chirurgie bietet auch im Alter die effektivste Behandlung einer Belastungsinkontinenz (67). Für die operative Versorgung einer Belastungsinkontinenz bringen betagte Patientinnen häufig schlechtere Voraussetzungen mit: Sie sind voroperiert, der urethrale Verschlussdruck ist schlecht und die Urethra wenig mobil. Sie haben eine genitale Atrophie und eventuell zusätzlich einen instabilen Detrusor. Versager und Rezidive sind im Alter häufiger (68, 69, 70). Dennoch sind suburethrale Bandeinlagen bestens dokumentierte (71), kurze, minimal invasive Eingriffe, die in Lokalanästhesie und Analgosedation durchgeführt werden können. Die Belastung durch die Operation ist klein. Das gleiche gilt noch mehr für die Injektion von bulking agents in die Urethra.
Die chirurgische Therapie des überaktiven Detrusors wird mittels Applikation von Onabotulinumtoxin A (Botox®) erreicht. Dieses wird zystoskopisch in den Detrusor injiziert und führt zu einer, je nach Dosis partiellen, aber auch reversiblen Denervation der Blase. Der Eingriff ist kurz und kaum belastend und wird in Lokalanästhesie, allenfalls in Kombination mit einer Sedation durchgeführt. Dosis und Intervall müssen individuell titriert werden. Der grosse Vorteil: Die perorale antimuskarinerge Therapie wird durch eine wirksamere (72, 73) lokale Therapie ersetzt. Resturinbildung und kürzere Wirkdauer sind bei älteren Patientinnen häufiger (74).
Hygieneprodukte und Katheter
Für viele betagte Menschen ist eine optimale Versorgung mit Inkontinenzeinlagen für die Lebensqualität essentiell und führt zu physischem, psychischem und sozialem Wohlergehen (75). Auch wenn diese den Beigeschmack eines Forfait hat, ist es doch häufig situationsangepasst und selten unbeliebt.
Selbstkatheterismus ist die Therapie bei atoner Blase mit hohen Restharnmengen (overflow). Bei betagten Menschen wird dies wegen Unbeweglichkeit, Tremor oder Sehschwäche meist zu einer unrealistischen Option. Glücklicherweise darf man bei der denervierten akontraktilen Blase hohe Restharnmengen tolerieren. Es gibt praktisch keine vesikale Druckentwicklung und es kommt deswegen auch kaum zu Reflux und damit auch nicht zu einer Schädigung der oberen Harnwege.
Eine Dauerableitung (Dauerkatheter) ist unbeliebt und sollte auf Grund des erhöhten Infektrisikos (Gefahr z.B. von Sepsis/Delir) nur in ausgewählten Fällen bei funktionell stark eingeschränkten Patientinnen oder bei Kompromittierung der Nierenfunktion im Rahmen der Miktionsstörung erwogen werden.
Copyright bei Aerzteverlag medinfo AG
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
daniel.passweg@triemli.zuerich.ch
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
Die Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Bei der betagten Frau ist die Urininkontinenz multifaktoriell.
- Eine sorgfältige Abklärung lohnt sich, um eine angepasste Therapiestrategie festzulegen.
- Antimuskarinika sind möglich, wichtig dabei ist die anticholinerge Belastung zu beachten. Der ß-3 Agonist Mirabegron ist eine Alternative.
- Chirurgische Inkontinenztherapien sind wenig invasiv und können allenfalls auch im fortgeschrittenen Alter diskutiert werden.
1. B . Baltes, P.B. and J. Smith, New frontiers in the future of aging: from successful aging of the young old to the dilemmas of the fourth age. Gerontology, 2003. 49(2): p. 123-35.
2. Silva, V.A., K.L. Souza, and M.J. D’Elboux, [Urinary incontinence and the criteria of frailness among the elderly outpatients]. Revista da Escola de Enfermagem da U S P, 2011. 45(3): p. 672-8.
3. Inouye, S.K., et al., Geriatric syndromes: clinical, research, and policy implications of a core geriatric concept. J Am Geriatr Soc, 2007. 55(5): p. 780-91.
4. Thom, D.H., M.N. Haan, and S.K. Van Den Eeden, Medically recognized urinary incontinence and risks of hospitalization, nursing home admission and mortality. Age Ageing, 1997. 26(5): p. 367-74.
5. Prince, M., et al., The global prevalence of dementia: a systematic review and metaanalysis. Alzheimer’s & dementia : the journal of the Alzheimer’s Association, 2013. 9(1): p. 63-75 e2.
6. Byles, J., et al., Living with urinary incontinence: a longitudinal study of older women. Age Ageing, 2009. 38(3): p. 333-8; discussion 251.
7. Lee, S.H., et al., Urinary incontinence in patients with Alzheimer’s disease: relationship between symptom status and urodynamic diagnoses. International journal of urology : official journal of the Japanese Urological Association, 2014. 21(7): p. 683-7.
8. Madersbacher, S., et al., The aging lower urinary tract: a comparative urodynamic study of men and women. Urology, 1998. 51(2): p. 206- 12.
9. Resnick, N.M., Elbadawi, A. E., Yalla, S. V., Age and the lower urinary tract: what is normal? . Neurourology and Urodynamics, 1995. 14: p. 1647.
10. Malone-Lee, J., Wahedna, I., Characterisation of detrusor contractile function in relation to oldage. Br J Urol 1993. 72: p. 873-880.
11. Taylor, J.A., 3rd and G.A. Kuchel, Detrusor underactivity: Clinical features and pathogenesis of an underdiagnosed geriatric condition. J Am Geriatr Soc, 2006. 54(12): p. 1920-32.
12. Resnick, N.M. and S.V. Yalla, Detrusor hyperactivity with impaired contractile function. An unrecognized but common cause of incontinence in elderly patients. JAMA, 1987. 257(22): p. 3076-81.
13. Rud, T., Urethral pressure profile in continent women from childhood to old age. Acta obstetricia et gynecologica Scandinavica, 1980. 59(4): p. 331-5.
14. Trowbridge, E.R., et al., Effects of aging on lower urinary tract and pelvic floor function in nulliparous women. Obstetrics and gynecology, 2007. 109(3): p. 715-20.
15. Samsioe, G., et al., Occurrence, nature and treatment of urinary incontinence in a 70-yearold female population. Maturitas, 1985. 7(4): p. 335-42.
16. Kenton, K., et al., Urethral and bladder current perception thresholds: normative data in women. The Journal of urology, 2007. 178(1): p. 189-92; discussion 192.
17. Perucchini, D., et al., Age effects on urethral striated muscle. II. Anatomic location of muscle loss. American journal of obstetrics and gynecology, 2002. 186(3): p. 356-60.
18. Clobes, A., J.O. DeLancey, and D.M. Morgan, Urethral circular smooth muscle in young and old women. Am J Obstet Gynecol, 2008. 198(5): p. 587 e1-5.
19. Juthani-Mehta, M., et al., Diagnostic accuracy of criteria for urinary tract infection in a cohort of nursing home residents. J Am Geriatr Soc, 2007. 55(7): p. 1072-7.
20. Tai, H.C., et al., Metabolic syndrome components worsen lower urinary tract symptoms in women with type 2 diabetes. J Clin Endocrinol Metab, 2010. 95(3): p. 1143-50.
21. Brown, J.S., et al., Urinary incontinence: does it increase risk for falls and fractures? Study of Osteoporotic Fractures Research Group. J Am Geriatr Soc, 2000. 48(7): p. 721-5.
22. Wullner, U., et al., Autonomic dysfunction in 3414 Parkinson’s disease patients enrolled in the German Network on Parkinson’s disease (KNP e V.) the effect of ageing. European Journal of Neurology, 2007. 14(1405-1408).
23. Dugan, E., et al., The association of depressive symptoms and urinary incontinence among older adults. J Am Geriatr Soc, 2000. 48: p. 413-416.
24. Wen-Qing L., et al., Constipation and Risk of Urinary Incontinence in Women: A Meta-Analysis. Int Urogynecol J, 2019. 30(10): p. 1629-1634.
25. Smith, P.P. and G.A. Kuchel, Clinical Meaning of a High Postvoid Residual: When the Value of a Result Is Less and More than One Would Expect. J Am Geriatr Soc, 2015. 63(7): p. 1432-4.
26. Resnick, N.M., et al., Misdiagnosis of urinary incontinence in nursing home women: prevalence and a proposed solution. Neurourol Urodyn, 1996. 15(6): p. 599-613; discussion 613- 8.
27. Diokno, A.C., T.J. Wells, and C.A. Brink, Urinary incontinence in elderly women: urodynamic evaluation. J Am Geriatr Soc, 1987. 35(10): p. 940-6.
28. Resnick, N.M., S.V. Yalla, and E. Laurino, The pathophysiology of urinary incontinence among institutionalized elderly persons. N Engl J Med, 1989. 320(1): p. 1-7.
29. Schnelle, J.F., et al., A standardized quality assessment system to evaluate incontinence care in the nursing home. J Am Geriatr Soc, 2003. 51(12): p. 1754-61.
30. Narayanan, S., et al., Is drug therapy for urinary incontinence used optimally in long-term care facilities? Journal of the American Medical Directors Association, 2007. 8(2): p. 98-104.
31. Raz, R., et al.,A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med, 1993. 329(11): p. 753.
32. Birkhäuser, M., Risiken einer vaginalen Estrogengabe – worum geht es?. info@gynäkologie, 2020. 4(01): p. 15–17.
33. Herbison, P., et al., Effectiveness of Anticholinergic Drugs Compared with Placebo in the Treatment of Overactive Bladder: Systematic Review. BMJ, 2003. 326(7394): p. 841-4.
34. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
35. Donnellan, C.A., et al., Oxybutynin and cognitive dysfunction. BMJ, 1997. 315(7119): p. 1363-4.
36. Wagg, A., et al., Randomised, multicentre, placebo-controlled, double-blind crossover study investigating the effect of solifenacin and oxybutynin in elderly people with mild cognitive impairment: the SENIOR study. European Urology, 2013. 64(1): p. 74-81.
37. Zellner, M., et al., Trospium chloride and oxybutynin hydrochloride in a german study of adults with urinary urge incontinence: results of a 12-week, multicenter, randomized, doubleblind, parallel-group, flexible-dose noninferiority trial. Clinical therapeutics, 2009. 31(11): p. 2519-39.
38. Aziminekoo, E., et al., Oxybutynin and tolterodine in a trial for treatment of overactive bladder in Iranian women. J Family Reprod Health, 2014. 8(2): p. 73-6.
39. Tsao, J.W. and K.M. Heilman, Transient memory impairment and hallucinations associated with tolterodine use. N Engl J Med, 2003. 349(23): p. 2274-5.
40. Edwards, K.R. and J.T. O’Connor, Risk of delirium with concomitant use of tolterodine and acetylcholinesterase inhibitors. J Am Geriatr Soc, 2002. 50(6): p. 1165-6.
41. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
42. Layton, D., G.L. Pearce, and S.A. Shakir, Safety profile of tolterodine as used in general practice in England: results of prescriptionevent monitoring. Drug Saf, 2001. 24(9): p. 703-13.
43. Oelke, M., et al., Appropriateness of oral drugs for long-term treatment of lower urinary tract symptoms in older persons: results of a systematic literature review and international consensus validation process (LUTS-FORTA 2014). Age Ageing, 2015. 44(5): p. 745-55.
44. Kay, G.G., et al., Evaluation of cognitive function in healthy older subjects treated with fesoterodine. Postgraduate medicine, 2012. 124(3): p. 7-15.
45. Kay, G., et al., Differential effects of the antimuscarinic agents darifenacin and oxybutynin ER on memory in older subjects. European Urology, 2006. 50(2): p. 317-26.
46. Herschorn, S., et al., Tolerability of solifenacin and oxybutynin immediate release in older (> 65 years) and younger (</= 65 years) patients with overactive bladder: sub-analysis from a Canadian, randomized, double-blind study. Current medical research and opinion, 2011. 27(2): p. 375-82.
47. Wesnes, K.A., et al., Exploratory pilot study assessing the risk of cognitive impairment or sedation in the elderly following single doses of solifenacin 10 mg. Expert opinion on drug safety, 2009. 8(6): p. 615-26.
48. Yamaguchi, O., et al., Safety and efficacy of mirabegron as ‘add-on’ therapy in patients with overactive bladder treated with solifenacin: a post-marketing, open-label study in Japan (MILAI study). BJU Int, 2015. 116(4): p. 612-22.
49. Sand, P.K., et al., Trospium chloride once-daily extended release is efficacious and tolerated in elderly subjects (aged >/= 75 years) with overactive bladder syndrome. BJU international, 2011. 107(4): p. 612-20.
50. Staskin, D., Kay, G., Tannenbaum,C., Goldman, H.B., Bhashi, K., Ling, J., Oefelein, M.G., Trospium chloride has no effect on memory testing and is assay undetectable in the central nervous system of older patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1294 – 1300.
51. Isik, A.T., et al., Trospium and cognition in patients with late onset Alzheimer disease. J Nutr Health Aging, 2009. 13(8): p. 672-6.
52. Staskin, D., Kay, G., Tannenbaum, C., Goldman, H.B., Bhash,i K., Ling, J., Oefelein, M.G., Trospium chloride is undetectable in older human central nervous system. Journal of the American Geriatrics Society, 2010. 58(8): p. 1618 – 1619.
53. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
54. Rochon, P.A., et al., Age- and gender-related use of low-dose drug therapy: the need to manufacture low-dose therapy and evaluate the minimum effective dose. J Am Geriatr Soc, 1999. 47(8): p. 954-9.
55. Qato, D.M., et al., Changes in Prescription and Over-the-Counter Medication and Dietary Supplement Use Among Older Adults in the United States, 2005 vs 2011. JAMA Intern Med, 2016. 176(4): p. 473-82.
56. Kashyap, M., M. Tu le, and C. Tannenbaum, Prevalence of commonly prescribed medications potentially contributing to urinary symptoms in a cohort of older patients seeking care for incontinence. BMC Geriatr, 2013. 13: p. 57.
57. Hashimoto, M., et al., Urinary incontinence: an unrecognised adverse effect with donepezil. Lancet, 2000. 356(9229): p. 568.
58. Starr, J.M., Cholinesterase inhibitor treatment and urinary incontinence in Alzheimer’s disease. J Am Geriatr Soc, 2007. 55(5): p. 800-1.
59. Terry, A.V., Jr. and J.J. Buccafusco, The cholinergic hypothesis of age and Alzheimer’s disease-related cognitive deficits: recent challenges and their implications for novel drug development. The Journal of pharmacology and experimental therapeutics, 2003. 306(3): p. 821-7.
60. Feinberg, M., The problems of anticholinergic adverse effects in older patients. Drugs Aging, 1993. 3(4): p. 335-48.
61. Wagg, A., C. Verdejo, and U. Molander, Review of cognitive impairment with antimuscarinic agents in elderly patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1279-86.
62. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
63. Fox, C., et al., Effect of medications with anticholinergic properties on cognitive function, delirium, physical function and mortality: a systematic review. Age Ageing, 2014. 43(5): p. 604-15.
64. Fox, C., et al., The impact of anticholinergic burden in Alzheimer’s dementia-the LASERAD study. Age and Ageing, 2011. 40(6): p. 730- 5.
65. Jewart, R.D., et al., Cognitive, behavioral, and physiological changes in Alzheimer disease patients as a function of incontinence medications. Am J Geriatr Psychiatry, 2005. 13(4): p. 324-8.
66. Marti, N., Nebenwirkungen aktuell. pharma-kritik, 2019. 41(4): p. 13 – 16.
67. Malek, J.M., et al., The effect of age on stress and urgency urinary incontinence outcomes in women undergoing primary midurethral sling. Int Urogynecol J, 2015. 26(6): p. 831-5.
68. Tennstedt, S., Design of the Stress Incontinence Surgical Treatment Efficacy Trial (SISTEr). Urology, 2005. 66(6): p. 1213-7.
69. Hellberg, D., et al., The very obese woman and the very old woman: tension-free vaginal tape for the treatment of stress urinary incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2007. 18(4): p. 423-9.
70. Kim, J., et al., Worse long-term surgical outcomes in elderly patients undergoing SPARC retropubic midurethral sling placement. BJU international, 2011. 108(5): p. 708-12.
71. Nilsson, C.G., et al., Long-term Results of the Tension-Free Vaginal Tape (TVT) Procedure for Surgical Treatment of Female Stress Urinary Incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2001. 12 Suppl 2: p. 5-8.
72. Everaert K, Sriram R, A. Kohan A, et al. The efficacy and safety of onabotulinumtoxinA and solifenacin compared to placebo in solifenacin-naïve patients with idiopathic overactive bladder: Results from a multicentre, randomised, double-blind, phase 3b trial. European Urology Supplements, Volume 15, Issue 3, March 2016, Pages e877, e877
73. Visco AG, Brubaker L, Richter HE, et al.; Pelvic Floor Disorders Network. Anticholinergic versus botulinum toxin A comparison trial for the treatment of bothersome urge urinary incontinence: ABC trial. Contemp Clin Trials. 2012 Jan;33(1):184- 96.
74. Liao, C.H. and H.C. Kuo, Increased risk of large post-void residual urine and decreaswed longterm success rate after intravesical onabotulinumtoxinA injection for refractory idiopathic detrusor overactivity. The Journal of urology, 2013. 189(5): p. 1804-10.
75. Getliffe, K., et al., Absorbent products for incontinence: ‘treatment effects’ and impact on quality of life. J Clin Nurs, 2007. 16(10): p. 1936-45.
der informierte @rzt
- Vol. 10
- Ausgabe 7
- Juli 2020