- Tukysa (Tucatinib)

Wirkmechanismus
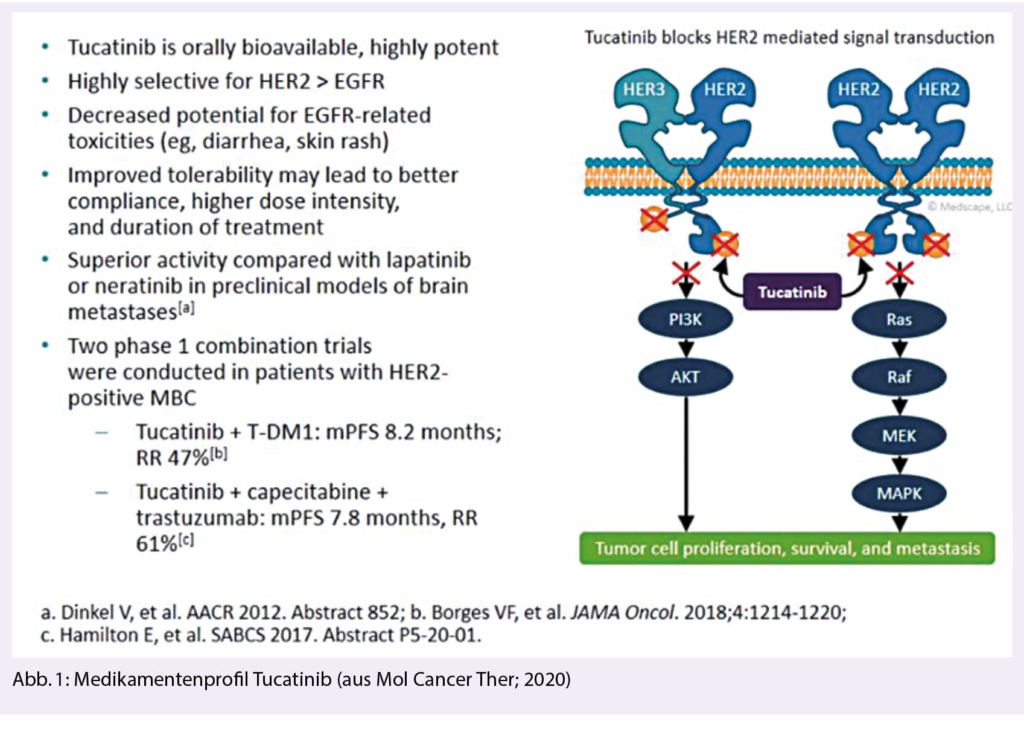
Tucatinib ist ein oraler hochselektiver HER2-Tyrosinkinase-Inhibitor TKI. Durch die hochselektive Bindung an ErbB2 (=HER2) wird dessen Phosphorylierung unterbunden. Durch diese Verhinderung der Signalaktivierung des HER2-Proteins wird die Proliferation maligner HER2+ Zellen gestoppt und die Zellen gehen in Apoptose und sterben ab (Abb. 1).
Klinische Wirksamkeit
Als Zulassungsstudie wurde die doppelblinde, placebo-kontrollierte, 2:1 randomisierte Phase 2-Studie HER2CLIMB (NCT02614794) eingereicht. Tucatinib oder Placebo wurden als Kombination mit Trastuzumab und Capecitabine eingesetzt.
Von total 612 eingeschlossenen Patientinnen mit HER2+ lokal fortgeschrittenem oder metastasiertem Brustkrebs nach Vorbehandlung (Herceptin, Perjeta und/oder TDM1), 410 im Verumarm und 202 im Kontrolarm) wurden alle 291 Patientinnen mit Hirnmetastasen (46% der eingeschlossenen Patientinnen) als geplante explorative Subgruppenanalyse ausgewertet. Davon waren 48% im Tucatinibarm und 46% im Kontrollarm mit Placebo. Die mediane Dauer von der Diagnose bis zum Auftreten von Hirnmetastasen betrug 15.8 Monate (1.1 – 169.2 Monate) und 14.5 Monate (0.5 -99.3 Monate) im Kontrollarm.
Bei 47,3% der Patienten sprachen die Hirnmetastasen auf Tucatinib an, komplett (5,5%) oder partiell (41,8%) an. Im Placeboarm der Studie gab es nur bei 20% der Patienten ein partielles Ansprechen. Die Dauer des Ansprechens betrug mit Tucatinib 6,8 Monate, mit Placebo 3 Monate. Bei 30 Patienten (21 im Tucatinib- und 9 im Placeboarm) wurde bei einem ZNS Progress eine Lokaltherapie durchgeführt und danach die Studienmedikation wieder aufgenommen. Das Risiko einer erneuten Progression mit Tucatinib war deutlich geringer als in der Placebogruppe (HR 0,33; 95% KI 0,11–1,02; p = 0,02). Im Median vergingen vom ersten bis zum erneuten Progress mit Tucatinib 7,6 Monate und mit Placebo 3,1 Monate.
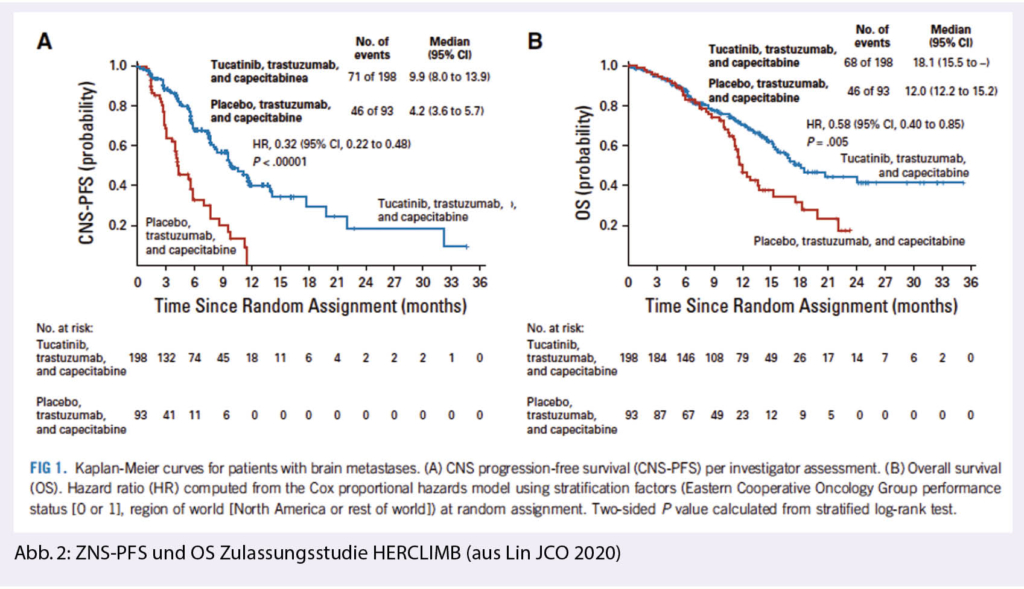
In der Tucatinib-Gruppe war somit das Risiko einer ZNS-Progression gegenüber Placebo um 68% verringert (HR 0,32; 95% KI 0,22–0,48; p < 0,00001). 40,2% der Patienten dieser Gruppe waren nach einem Jahr weiterhin ohne ZNS-Progression, in der Kontrollgruppe keine Patientin. Das mediane ZNS-PFS lag mit Tucatinib bei 9,9 Monaten, mit Placebo bei 4,2 Monaten (Abb. 2: Lin, JCO 2020).
Die Analyse aller eingeschlossenen Patietinnen (N 612) ergab eine mediane PFS mit Tucatinib von 7.8 Monaten (95% confidence interval [CI] 7.5, 9.6) verglichen zu 5.6 Monaten (95% CI 4.2, 7.1) für Patientinnen im Placeboarm (hazard ratio [HR] 0.54; 95% CI 0.42, 0.71; p < 0.00001). Auch das mediane Gesamtüberleben (OS) für alle eingeschlossenen Patientinnen war in der Tucatinib-Gruppe signifikant verlängert mit 20,7 Monaten (11,6 Monate in der Kontrollgruppe), die Ein-Jahres-OS-Rate betrug 71,7% (Placebo: 41,1%; HR 0,49; 95% KI 0,30–0,80). Bei Patienten mit stabilen Hirnmetastasen bei Studienbeginn gab es dagegen keinen signifikanten Unterschied im OS.
Tucatinib hat somit das Potential als neuer Standard beim vorbehandelten metastasierten HER2 + Mammakarzinom in Kombination mit Trastuzumab und Capecitabin für Patientinnen insbesondere mit Hirnmetastasen.
Sicherheit und Nebenwirkungen
Die Kombinationstherapie mit Tucatinib oder Placebo zeigte vor allem folgende Nebenwirkungen:
- Übelkeit, Erbrechen, verminderter Appetit, Durchfall, Stomatitis, Abdominalschmerzen
- Palmar-plantare Erythrodysästhesie
- Müdigkeit
- Lebertoxizität
- Kopfschmerzen
- Anämie
- Exantheme
Insgesamt traten durch die Zugabe von Tucatinib signifikant vermehrt Diarrhoe, Nausea, Erbrechen sowie Hand-Fuss-Syndrom auf. Es gab aber keine zusätzlichen SAE’s (serious adverse events) oder Fatalitäten. Die Sicherheit bei Nieren- oder Leber-Funktionseinschränkungen ist noch nicht geklärt. Letztere muss unbedingt weiter untersucht werden, da die Lebertoxizität offenbar ein Klasseneffekt von Tucatinib ist.
Kommentar:
Auch wenn Tucatinib in Kombination mit Trastuzumab und Capecitabine nach HER2 basierter Vorbehandlung zugelassen ist, ist der klinische Hautpvorteil klar bei Patientinnen zu erwarten, welche zum Zeitpunkt der Behandlung aktive Hirnmetastasen aufweisen. Auch ist festzuhalten, dass nach erneuter ZNS Progression die Wiederaufnahme mit Tucatinib die Prognose weiter verbessert. Hier handelt es sich dann nur noch um kleine Fallzahlen, die zwingend nach einer Bestätigung durch weitere Studien rufen. Es sei daran erinnert, dass wir hier eine zwar grosse randomisierte, verblindete und placebokontrollierte Phase 2-Studie als Grundlage haben, aber wir erwarten, dass diese Daten durch weitere Studien bald bestätigt werden. Es ist uns aber auch klar, dass es sich bei Rezidiven mit Hirnmetastasen bei HER2 positiven Frauen mit Brustkrebs um eine klassische «Unmet Medical Need» Situation handelt und ein solcher Fortschritt klar klinisch bedeutsam ist. In dieser Studie waren Patientinnen mit leptomenigealem Befall ausgeschlossen und es wird noch separat zu untersuchen sein, ob auch diese Patientinnen profitieren können. Eine Studie, welche untersucht, ob Tucatinib nicht bereits früher erfolgreich eingesetzt werden kann, ist unterwegs (HER2CLIMB-02) wo Zweitlinien T-DM1 mit und ohne Tucatinib randomisert wird. Auch hier wurden und werden Frauen mit Hirnmetastasen eingeschlossen.
Schliesslich ist bemerkenswert und höchst erfreulich, dass hier erstmals überhaupt das neue internationale «Project Orbis» angewendet wurde, wo die FDA unter ihrem «Real-Time Oncology Review (RTOR) pilot program» zusammen mit der Swissmedic, den Zulassungsbehörden von Kanada, Australien und Singapur gemeinsam und zeitgleich das gesamte Zulassungsdossier bearbeitet und damit effizienter, schneller und auch mit mehr konsolidierter internationaler Expertise grundsätzlich neue Medikamente beurteilen kann: https://www.swissmedic.ch/swissmedic/de/home/news/mitteilungen/fda-projekt-orbis.html. Es ist zu hoffen, dass sich dieses internationale Programm bewähren wird. Auch haben die Firmen damit klar weniger Aufwendungen und in diesen Ländern einen rascheren Marktzugang. Für wichtige Innovationen ist dies selbstredend auch zum Wohl unserer Patienten.
Copyright bei Aerzteverlag medinfo AG
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
1. Murthy RK, Loi S, Okines A et al. (2020): Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. New England Journal of Medicine, DOI: 10.1056/NEJMoa1914609.
2. Lin NU, Borges V, Anders C et al. (2020) Intracranial Efficacy and Survival With Tucatinib Plus Trastuzumab and Capecitabine for Previously Treated HER2-Positive Breast Cancer With Brain Metastases in the HER2CLIMB Trial. Journal of Clinical Oncology, DOI: 10.1200/JCO.20.00775.
info@onco-suisse
- Vol. 10
- Ausgabe 4
- August 2020