- Efficacy-Effectiveness Gap
Wenn Onkologen* Patienten über eine Therapie informieren, so werden sie zumeist die Evidenz (Datenlage) von klinischen Studien heranziehen und hierauf basierend einen Eindruck zum Verhältnis von Nutzen und Risiken (insbesondere unerwünschte Wirkungen) vermitteln. Da im Alltag behandelte Patienten im Durchschnitt häufig älter und gebrechlicher sind als Studienpatienten und oft eine geringere Leistungsfähigkeit (Performance Status) und mehr Komorbiditäten aufweisen (1), stellt sich die Frage nach der Übertragbarkeit von Studienergebnissen auf den klinischen Alltag.
Lorsque les oncologues* informent les patients sur une thérapie, ils utilisent généralement les preuves (données) issues d’ études cliniques et, sur cette base, donnent une impression de la relation entre les avantages et les risques (en particulier les effets indésirables). Étant donné que les patients traités dans la vie quotidienne sont en moyenne souvent plus âgés et plus fragiles que les patients de l’ étude et qu’ ils présentent souvent un statut de performance inférieur et plus de comorbidités (1), la question de la transférabilité des résultats de l’ étude à la vie clinique quotidienne se pose.
Die in Studien ermittelte Wirkung einer Behandlung (Medikament oder Intervention) wird als Efficacy bezeichnet. Dies im Gegensatz zur Effectiveness, welche die Wirkung im Alltag, d.h. unter real world Umständen bezeichnet. Nachfolgend werden Beispiele und Implikation für den efficacy-effectiveness gap (EEG) dargestellt und diskutiert.
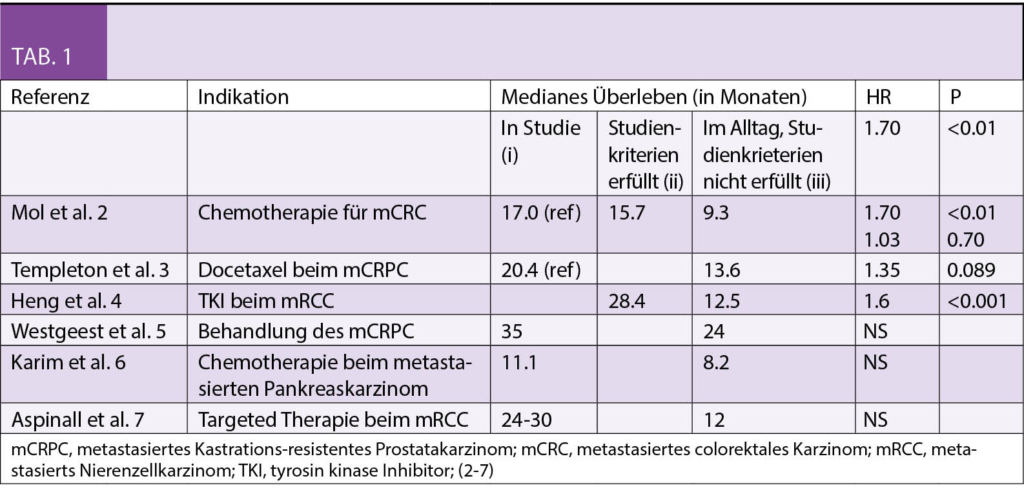
In der Tabelle 1 werden Beispiele für die unterschiedliche Prognose (Gesamtüberleben) von Patienten aufgeführt, welche (i) für eine bestimmte Indikation in einer Studie behandelt wurden, (ii) welche die Ein-/Ausschlusskriterien der entsprechenden Studie erfüllt haben, aber im Alltag behandelt wurden und (iii) für Patienten, welche im Alltag behandelt wurden und die Ein-/Ausschlusskriterien nicht erfüllten (2-7).
Auch ist davon auszugehen, dass im Alltag mehr Toxizitäten zu erwarten sind wie in klinischen Studien berichtet: so lag z.B. die Rate an febrilen Neutropenien durch Zytostatika in Observationsstudien um 74 % höher im Vergleich zu randomisierten Studien mit derselben Therapie (8).
Ein EEG kann nicht nur im Bereich der Onkologie beobachtet werden: Im Rahmen der randomisierten TIMI 9 Studie (9), welche bei Patienten mit akutem Myokardinfarkt (STEMI) den Einsatz von Hirudin mit Heparin verglich, wurden in einem parallelen Register Patienten mit Herzinfarkt nachverfolgt, welche nicht in die Studie eingeschlossen werden konnten: Diese waren tendenziell älter, häufiger Frauen oder hatten bereits früher einen akuten Myokardinfarkt gehabt oder nahmen weniger oft Aspirin ein. Patienten, welche die Studienkriterien erfüllten, aber ausserhalb der Studie behandelt wurden, wiesen eine deutliche höhere (in hospital) Mortalität auf (8%) wie Studienpatienten (5%). Noch höher war die Mortalität bei Patienten, die nicht für die Studie geeignet waren, jedoch behandelt wurden (13%) und bei Patienten, die nicht für die Studie geeignet waren und nicht behandelt wurden (24%).
Wie lassen sich die Unterschiede erklären? Der Hauptgrund für ein EEG liegt in der Selektion von Studienpatienten. Die Einschlusskriterien für randomisierte kontrollierte Studien (RCT) setzen zumeist einen guten Performance Status, nahezu normale Organfunktionen und wenig Komorbiditäten voraus. Nur ein Teil der Patienten in der täglichen Praxis erfüllt diese Einschlusskriterien. Ältere Patienten und solche mit Komorbiditäten und/oder eingeschränktem Performance Status oder gebrechliche Patienten sind in RCT untervertreten. Aus diesem Grund wurden bereits vor Jahren weniger restriktive Selektionskriterien für klinische Studien gefordert (10). Eine Analyse von 86 onkologischen Studien, die zwischen 1987 und 2012 publiziert wurden, hat jedoch ergeben, dass über die Zeit tendenziell mehr Patienten auf Grund von Komorbiditäten und herabgesetzten Altersgrenzen von einer Studienteilnahme ausgeschlossen wurden (11).
Ein Vorteil enger Ein- und Ausschlusskriterien ist gewiss, dass in einer homogenen Population eher ein Wirksamkeitsnachweis für ein neues Medikament möglich ist. Um zu untersuchen, ob eine Intervention dann auch in der täglichen klinischen Praxis ein vergleichbares Risiko/Nutzen-Verhältnis aufweist, sind pragmatische randomisierte «Real-World» Studien hilfreich. Die Studienteilnehmer solcher Studien sollten ein ähnliches Profil aufweisen wie die Patienten in der täglichen Praxis und die Studien sollten auch im Alltagssetting durchgeführt werden. Bespiele für erfolgreiche pragmatische randomisierte Studien mit sehr einfachen Einschlusskriterien (z.B. «wenn der Patient fit genug ist für die Therapie, kann er eingeschlossen und randomisiert werden») gibt es aus dem Vereinigten Königreich: In der ICON1 Studie konnten praktisch alle Frauen mit Ovarial-Karzinom eingeschlossen werden, bei denen «Ungewissheit zum Nutzen einer postoperativen Chemotherapie» bestand. Die Studie zeigte einen absoluten Overall Survival Benefit von 8 % nach 8 Jahren durch die postoperative Chemotherapie (12). Ein anderes Beispiel ist die internationale randomisierte ATLAS-Studie, die untersucht hat, ob bei frühem Brustkrebs eine verlängerte adjuvante Tamoxifen-Gabe von 10 Jahren im Vergleich zu 5 Jahren einen Benefit bringt. Eingeschlossen werden konnten im Grund alle Frauen, bei denen nach 5 Jahren adjuvanter Therapie mit Tamoxifen klinisch kein Rezidiv vorlag und sowohl Patientin und behandelnder Arzt unsicher waren, ob Tamoxifen gestoppt oder für ein paar weitere Jahre fortgeführt werden sollte. Das Studienprotokoll sah explizit keine absoluten Ausschlusskriterien (wie geplante oder bestehend Schwangerschaft, Retinopathie, endometriale Hyperplasie) vor, sondern überliess den Prüfärzten die Risiko-Nutzen-Abwägung für eine verlängerte Therapie mit Tamoxifen. Mit verlängerter Tamoxifen-Einnahme zeigte sich eine Reduktion des Rezidivrisikos von 25.1 auf 21.4 % sowie der Brustkrebs-spezifischen Mortalität von 15.0 auf 12.2 % (13).
Auch wenn randomisierte, kontrollierte Studien den Goldstandard für den Wirkungsnachweis einer neuen Therapie darstellen, können Populations-basierte Beobachtungsstudien helfen, die effictiveness einer Intervention zu untersuchen oder das Vorhandensein eines EEG abzuschätzen. Ein Beispiel hierfür ist eine Studie basierend auf dem Ontario Cancer Registry (Kanada) und Spitalakten von allen Patienten (N=2944) mit muskel-invasivem Urothelkarzinom der Harnblase, die zwischen 1994 bis 2008 eine Zystektomie mit oder ohne adjuvante oder neoadjuvante Chemotherapie erhielten (14). Die 5 Jahres Krebs-spezifischen Überlebensraten und die Gesamt-Überlebensraten (Overall Survival) lagen bei 33% bzw. 29%. Diese Ergebnisse sind deutlich schlechter als die Werte von 63% bzw. 56% von Patienten nach einer Zystektomie aus einer Metaanalyse von klinischen Studien und Single Institution Serien (15). Diese Unterschiede deuten auf einen substantiellen EEG hin. Im Gegensatz dazu hatten die 20% der Patienten aus der oben genannten Serie, die zusätzlich zur Zystektomie eine prä- oder postoperative Chemotherapie erhielten, einen vergleichbaren Gesamt-Überlebens-Benefit. Die Hazard Ratio für Tod (nach Adjustierung für Krankheitscharakteristika oder mit Propensity Scores) betrug ca. 0.7 (14). Dieses Resultat ist vergleichbar mit den Resultaten von randomisierten Studien, was auf einen nur minimalen EEG für diejenigen Patienten hindeutet, die als fit genug eingeschätzt wurden, um eine prä- oder postoperative Chemotherapie zu erhalten.
Zusammenfassend lässt sich sagen, dass ein substantieller EEG für viele Therapien in der täglichen Praxis existiert. Dies bedeutet, dass der Umfang des Nutzens einer Therapie vermutlich kleiner, und das Ausmass der Toxizität grösser ist, als in den Zulassungsstudien berichtet. Oftmals ist die tatsächliche Effektivität einer neuen Krebstherapie nicht bekannt. Dies entweder wegen Fehlens geeigneter Postmarketing Studien oder wegen deren Anfälligkeit für methodische Bias. Die Schlussfolgerungen über den wahren Nutzen der Therapie bleiben dann limitiert. Dieses Problem sollte anerkannt werden, und es sollte in jede Besprechung mit dem Patienten über die Vorzüge einer vorgeschlagenen Therapie einbezogen werden. Dies könnte für den Arzt und/oder den Patienten den Ausschlag für oder gegen eine Therapieeinleitung geben. Die Zulassungsbehörden und Kostenträger könnten Erstzulassungen überdenken, wenn nachträgliche Daten aus der täglichen Routine Praxis verfügbar werden. Die Weiterentwicklung medizinischer Evidenz muss auch nach dem Erscheinen der Zulassungsstudien anhalten. Erkenntnisse, die aus randomisierten Studien gewonnen wurden, sollten ergänzt werden durch Beobachtungs-Studien, welche Daten für die Allgemeinbevölkerung sammeln. Dies würde zum Verständnis beitragen, wie die Einführung/Umsetzung von neuen Therapien in der realen Welt zu verbesserten Ergebnissen für den Patienten führen kann – oder auch nicht.
Tumorzentrum St. Claraspital
4016 Basel
Thomas.Schmid@claraspital.ch
Medizinische Onkologie, St. Claraspital, Basel, Schweiz;
St. Clara Forschung, Basel, Schweiz;
Medizinische Fakultät, Universität Basel, Basel, Schweiz
Arnoud.Templeton@claraspital.ch
Die Auoren haben in Zusammenhang mit disem Artikel keine Interessenskonflikte deklariert.
- Efficacy bezeichnet die Wirkung einer Intervention unter Studienbedingungen; effectiveness unter Alltagsbedingungen. Ein Efficacy-Effectiveness Gap (EEG) bezeichnet die Differenz und existiert für viele Therapien in der täglichen Praxis.
- Ein substantieller EEG bedeutet, dass der Nutzen einer Therapie vermutlich kleiner und das Ausmass der Toxizität grösser ist als in den Zulassungsstudien.
- Der Hauptgrund für einen EEG liegt in der Selektion von Studienpatienten.
- Um zu untersuchen, ob eine Therapie auch in der täglichen Praxis ein vergleichbares Nutzen-/Risiko-Verhältnis aufweist, sind pragmatische randomisierte «Real-World» Studien mit einfachen Einschlusskriterien hilfreich.
- Populations-basierte Beobachtungsstudien, welche Daten für die Allgemeinbevölkerung sammeln, können helfen, das Vorhandensein eines EEG abzuschätzen.
Messages à retenir
- L’ efficacité se réfère à l’ effet d’ une intervention dans des conditions d’ étude ; l’ efficacité dans les conditions de la vie quotidienne. Un écart d’ efficacité (EEG) décrit la différence et existe pour de nombreuses thérapies dans la pratique quotidienne.
- Un EEG important signifie que le bénéfice d’ une thérapie est probablement plus faible et la toxicité plus importante que dans les études d’ enregistrement.
- La raison principale d’ un EEG est la sélection des patients de l’ étude.
- Afin de déterminer si une thérapie présente également un rapport bénéfice/risque comparable dans la pratique quotidienne, des études pragmatiques randomisées du «monde réel» avec des critères d’ inclusion simples sont utiles.
- Les études observationnelles basées sur la population, qui collectent des données pour la population générale, peuvent aider à estimer la présence d’ un EEG.
1. Kennedy-Martin T, Curtis S, Faries D, et al: A literature review on the representativeness of randomized controlled trial samples and implications for the external validity of trial results. Trials 16:495, 2015
2. Mol L, KoopmanM, van Gils CW, et al: Comparison of treatment outcome in metastatic colorectal cancer patients included in a clinical trial versus daily practice in the Netherlands. Acta Oncol 52:950-955, 2013
3. Templeton AJ, Vera-Badillo FE, Wang L, et al: Translating clinical trials to clinical practice: Outcomes of men with metastatic castration resistant prostate cancer treated with docetaxel and prednisone in and out of clinical trials. Ann Oncol 24:2972-2977, 2013
4. Heng DY, Choueiri TK, Rini BI, et al: Outcomes of patients with metastatic renal cell carcinoma that do not meet eligibility criteria for clinical trials. Ann Oncol 25:149-154, 2014
5. Westgeest HM, Uyl-de Groot CA, van Moorselaar RJA, et al: Differences in trial and real-world populations in the Dutch castration-resistant prostate cancer registry. Eur Urol Focus 4:694-701, 2018
6. Karim S, Zhang-Salomans J, Biagi JJ, et al: Uptake and effectiveness of FOLFIRINOX for advanced pancreatic cancer: A population-based study. Clin Oncol (R Coll Radiol) 30:e16-e21, 2018
7. Aspinall SL, Zhao X, Geraci MC, et al: Use of targeted therapies for advanced renal cell carcinoma in the Veterans Health Administration. Cancer Med 8: 6651-6661, 2019
8. Truong J, Lee EK, Trudeau ME, et al: Interpreting febrile neutropenia rates from randomized, controlled trials for consideration of primary prophylaxis in the real world: A systematic review and meta-analysis. Ann Oncol 27:608-618, 2016
9. Bahit MC, Cannon CP, Antman EM, et al: Direct comparison of characteristics, treatment, and outcomes of patients enrolled versus patients not enrolled in a clinical trial at centers participating in the TIMI 9 Trial and TIMI 9 Registry. Am Heart J 145:109-117, 2003
10. George SL: Reducing patient eligibility criteria in cancer clinical trials. J Clin Oncol 14:1364-1370, 1996
11. Srikanthan A, Vera-Badillo F, Ethier J, et al: Evolution in the eligibility criteria of randomized controlled trials for systemic cancer therapies. Cancer Treat Rev 43:67-73, 2016
12. Colombo N, Guthrie D, Chiari S, et al: International Collaborative Ovarian Neoplasm trial 1: A randomized trial of adjuvant chemotherapy in women with early-stage ovarian cancer. J Natl Cancer Inst 95:125-132, 2003
13. Davies C, Pan H, Godwin J, et al: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor positive breast cancer: ATLAS, a randomised trial. Lancet 381:805-816, 2013
14. Booth CM, Siemens DR, Li G, et al: Perioperative chemotherapy for muscle-invasive bladder cancer: A population-based outcomes study. Cancer 120:1630-1638, 2014
15. Vashistha V,Wang H,Mazzone A, et al: Radical cystectomy compared to combined modality treatment for muscle-invasive bladder cancer: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys 97:1002-1020, 2017
info@onco-suisse
- Vol. 10
- Ausgabe 4
- August 2020