- L’ étude VERTIS-CV
L’ efficacité et la sécurité cardiovasculaires de l’ ertugliflozine (Steglujan®), inhibiteur du SGLT2, disponible en association fixe avec la sitagliptine, inhibiteur de la DPP4, ont été examinées dans l’ étude VERTIS-CV (eValuation of ERTugliflozine effIcacy and Safety CardioVascular outcomes) chez des patients atteints de diabète sucré de type 2 (DT2) et de maladies cardiovasculaires athérosclérotiques. L’ ertugliflozine n’ a que partiellement répondu aux attentes de cette grande étude : Son innocuité cardiovasculaire a certes pu être prouvée. Toutefois, l’ objectif consistant à démontrer également une réduction des événements cardiovasculaires a été manqué, à l’ exception d’ une réduction du risque d’ insuffisance cardiaque.
Conception de l’ étude
L’ étude prospective, multicentrique, randomisée et contrôlée par placebo et basée sur les résultats cliniques, a recruté 8238 patients âgés de 40 ans ou plus, atteints de DT2 depuis plus de 13 ans ainsi que d’ une maladie cardiovasculaire athérosclérotique stable confirmée. Les participants étaient majoritairement mâles, obèses, blancs par rapport à d’ autres études de résultats. Le taux d’ HbA1c était modérément élevé (valeur d’ HbA1c de 7,0 à 10,5 %, à une moyenne de 8,2° %). La population atteinte d’ insuffisance cardiaque, représentant 23,7 %, était deux fois plus importante que dans d’ autres études.
Les patients ont reçu de l’ ertugliflozine 5 mg/jour, de l’ ertugliflozine 15 mg/jour ou un placebo en plus de leur traitement standard précédent pendant une période allant jusqu’ à 6,1 ans.
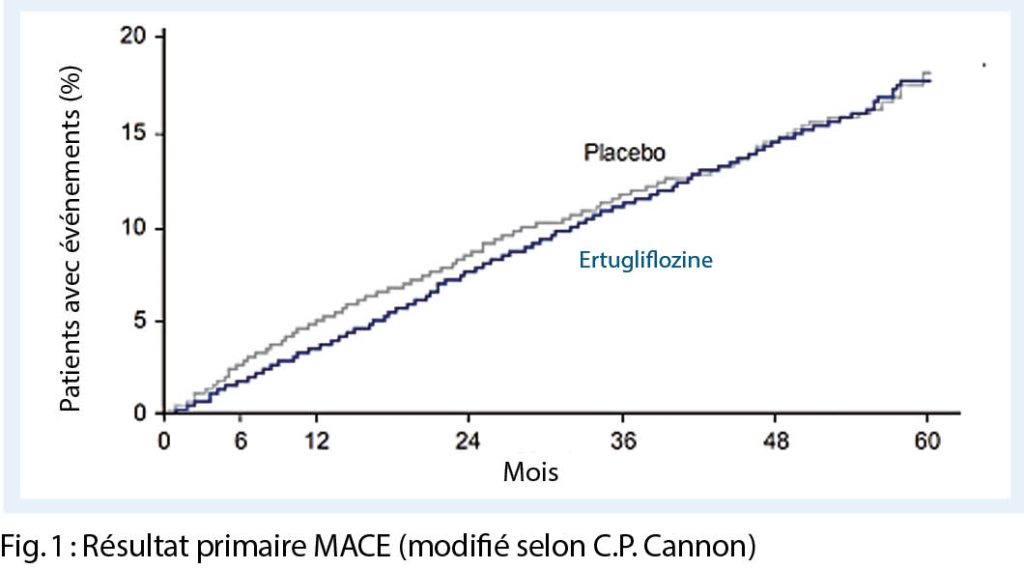
Le principal critère d’ évaluation (non-infériorité) était le résultat combiné de MACE (décès coronarien, infarctus du myocarde non mortel et accident vasculaire cérébral non mortel).
Les paramètres secondaires (supériorité) étaient le résultat combiné du décès cardiovasculaire/insuffisance cardiaque, du décès cardiovasculaire et du composite rénal (décès rénal, dialyse/transplantation et doublement de la créatinine sérique).
Les autres critères d’ évaluation prédéfinis étaient les composantes individuelles de MACE, la combinaison de MACE-plus (MACE plus hospitalisation pour angine instable), l’ infarctus du myocarde mortel ou non, l’ accident vasculaire cérébral mortel ou non, l’ insuffisance cardiaque et la mortalité toute cause confondue.
Résultats
Le critère d’ évaluation principal (non-infériorité) a été atteint, c’ est-à-dire que le médicament est sûr en ce qui concerne les événements cardiovasculaires. Le résultat principal était de 11,9 % dans le groupe ertugliflozine contre 11,9 % dans le groupe placebo, le HR était de 0,97 (IC 95% 0,85-1,11) ; p < 0,001 pour non-infériorité (fig. 1).
Le HR pour les décès cardiovasculaires était de 1,8 % vs 1,9 % (p = 0,39), pour les infarctus du myocarde de 1,7 % vs 1,6 % (p = 0,66) et pour les accidents vasculaires cérébraux de 0,8 % vs 0,8 % (p = 0,99). Le résultat rénal combiné (décès rénal, dialyse/transplantation, doublement de la créatinine sérique) était de 3,2 % vs 3,9 % (p = 0,08), le doublement de la créatinine sérique était de 3,1 % vs 3,8 %.
Il y avait une différence non significative entre les deux doses d’ ertugliflozine de 5 mg et 15 mg, y compris des différences non significatives dans les résultats de sécurité.
Les détails publiés lors du congrès virtuel de l’ ADA montrent qu’ en atteignant la supériorité, il n’ a pas été possible de réduire les décès cardiovasculaires par rapport au placebo ; ainsi le HR pour le composite de la mort cardiovasculaire et de l’ insuffisance cardiaque était de 0,88 (IC 95,8 %, 0,75-1,03 ; p = 0,11 pour la supériorité). Le HR pour les seuls événements cardiovasculaires était de 0,92 (IC 95,8 %, 0,77-1,11).
L’ insuffisance cardiaque était un critère d’ évaluation prédéfini, mais pas un critère d’ évaluation secondaire clé. Le HR pour l’ insuffisance cardiaque était de 0,70 (IC 95 %, 0,54-0,90).
Le HR pour le résultat rénal combiné (composite de la mort rénale, de la dialyse/transplantation ou du doublement de la créatinine sérique) était de 0,81 (IC 95%, 0,63-1,04), indiquant une tendance positive mais manquant la supériorité.
Sécurité
Les événements indésirables ont été similaires dans le groupe de l’ertugliflozine à 5 mg ainsi que dans le groupe des 15 mg et dans le groupe placebo. Les effets indésirables sélectionnés étaient les infections urinaires (12,2 dans le groupe 5 mg, 12,0 dans le groupe 15 mg vs 10,2 dans le groupe placebo, les infections mycosiques génitales (hommes) ont été enregistrées dans 4,4 % et 5,1 % vs 1,2 %, les infections mycosiques génitales (femmes) 6,0 % et 7,8 % vs 2,4 %, respectivement). Les hypoglycémies symptomatiques étaient moins fréquentes dans les groupes de traitement que dans le groupe placebo (28,0 % et 26,5 % vs 28,8 %). Une acidocétose diabétique a été observée dans 0,3% et 0,4% vs 0,1%, des amputations ont été nécessaires dans 2,0% et 2,1% vs 1,6%.
Conclusion
- l Les résultats de cette étude suggèrent que l’ ertugliflozine n’ est pas inférieure au placebo pour réduire les événements CV chez les patients atteints de DT2 et de maladie CV établie.
- l L’ ertugliflozine réduit le risque d’ insuffisance cardiaque.
- l Un effet positif sur la fonction rénale a été observé comme tendance.
- l L’ ertugliflozine a été jugée sûre et n’ a pas montré de signaux de sécurité liés aux amputations.
Source : «Results of the eValuation of ERTugliflozin EffIcacy and Safety CardioVascular outcomes Trial (VERTIS-CV)», présentés par Christopher P. Cannon, Boston, le 16 juin 2020 lors du congrès virtuel de l’ American Diabetes Association (ADA).
riesen@medinfo-verlag.ch