- Kolorektale Lebermetastasen (Teil 2)
Weltweit und in der Schweiz ist das kolorektale Karzinom die dritthäufigste Krebserkrankung. Jährlich erkranken alleine in der Schweiz ca. 4300 Menschen am kolorektalen Karzinom (1). Zum Zeitpunkt der Diagnose zeigen 15-25% der Patienten eine Metastasierung in der Leber (synchrone Metastasen). Bei weiteren 15-30% der Patienten treten Lebermetastasen im späteren Erkrankungsverlauf auf (metachrone Metastasen)(2-4). Die Leber ist dabei der häufigste Manifestationsort kolorektaler Metastasierung. Gründe hierfür sind neben der anatomisch bedingten portalvenösen Drainage des Darmes in die Leber auch ein metastasierungsfreudiges Mikromilieu (5). Und obschon zwei Drittel der Patienten mit hepatisch metastasiertem kolorektalem Karzinom auch eine extrahepatische Ausbreitung zeigen, so sind regionale Behandlungsansätze in der Leber in Kombination mit einer systemischen Therapie mittlerweile Standard geworden und gerechtfertigt, da sie signifikante Überlebensvorteile bis hin zur Heilung zeigen (6). In einem ersten Teil des Artikels wurden in der August-Ausgabe von «der informierte arzt» Abklärungswege und Möglichkeiten der chirurgischen Standardbehandlung aufgezeigt, in diesem aktuellen 2. Teil werden ergänzende chirurgische Möglichkeiten und aktuelle systemische Therapien vorgestellt werden.
Die Resektion kolorektaler Metastasen ist nach wie vor der «Goldstandard» der Behandlung kolorektaler Lebermetastasen. In den letzten zwei Jahrzehnten haben sich verschiedene lokale ablative Verfahren entwickelt, welche als Ergänzung zur Resektion bzw. als zusätzliche Behandlungsoption bei inoperablen Patienten mit kolorektalen Lebermetastasen eingesetzt werden können und sich meist an Behandlungsrichtlinien der Patienten mit Hepatozellulärem Karzinom orientieren: die Radiofrequenzablation (RFA) und die Mikrowellenablation. Ein Vergleich im Sinne eines RCT von ablativen mit chirurgischen Verfahren liegt aktuell nicht vor und mit Spannung werden Ergebnisse laufender Studien erwartet (NCT03088150, NCT02886104).
Sollte man Lebermetastasen offen oder minimal-invasiv operieren?
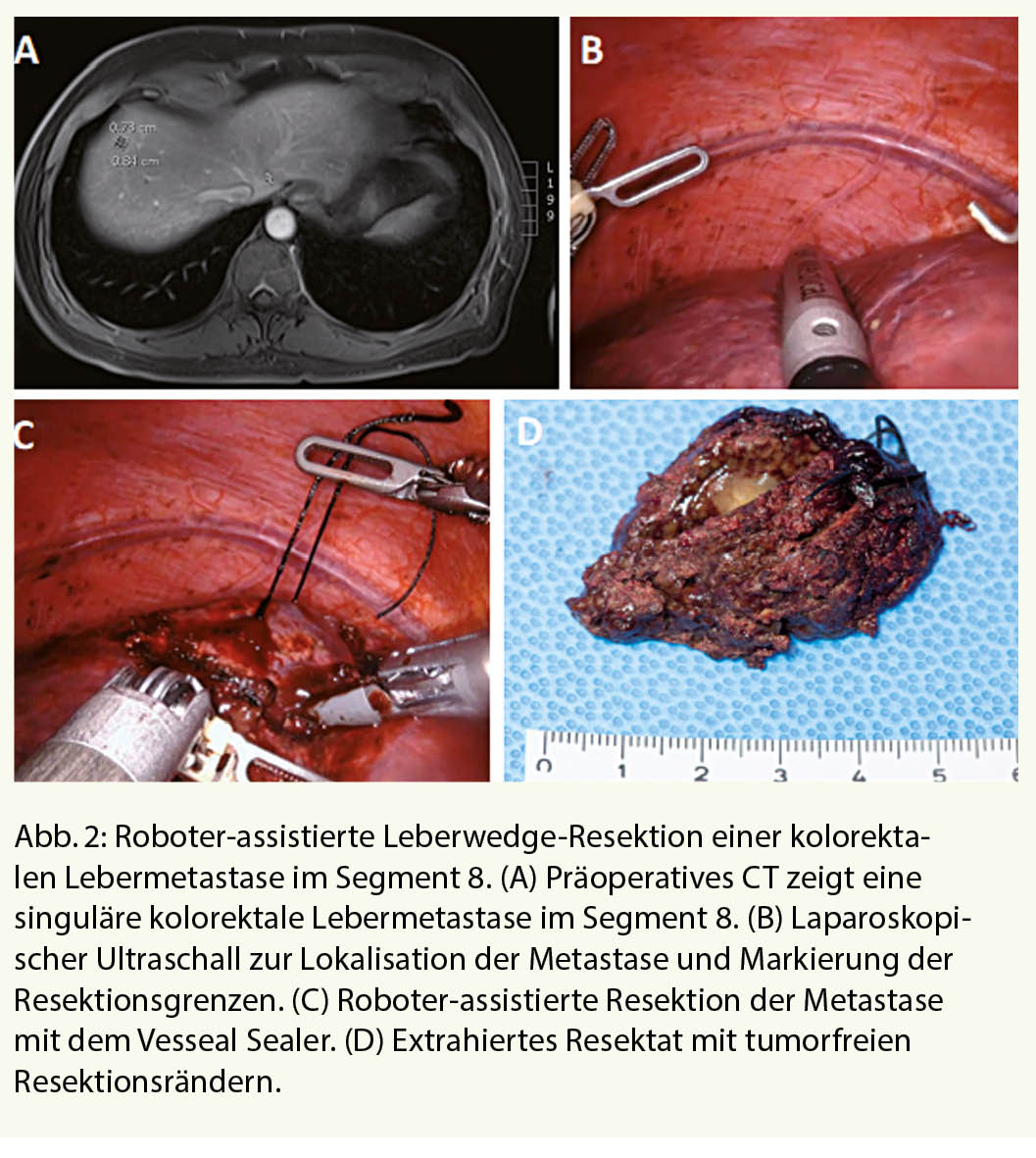
Die minimal-invasive Resektion von kolorektalen Metastasen gewinnt zunehmend an Akzeptanz und Bedeutung. Eine erste randomisierte Studie (OSLO-COMET-Studie) zeigte, dass die laparoskopische Leberresektion bei kolorektalen Metastasen im Vergleich zur offenen Operation mit weniger postoperativen Komplikationen bei gleicher Rate tumorfreier Resektatränder assoziiert ist (32). In unserem Zentrum favorisieren wir derzeit die roboterassistierte Leberresektion, insbesondere wenn die Metastasen in den posterioren (Segmente 6 und 7) oder kranial anterioren (Segment 8) Lebersegmenten lokalisiert sind. Die roboter-unterstützte Technologie bietet bei der Operation mehr Freiheitsgrade in der Bewegung der Instrumente sowie eine bessere Sicht und Steuerungspräzison (33). Auch für die roboter-unterstütze Leberresektion gilt das oberste Ziel der R0-Resektion und die Sicherheit des Patienten (Abb. 2).
Ist eine Lebertransplantation eine Option bei nicht-resektablen Lebermetastasen?
Obwohl mit der Entwicklung neuer zielgerichteter Chemotherapien und neuer Operationsverfahren vielen Patienten mit ausgedehnten Lebermetastasen heute effektiv geholfen werden kann, gibt es Patienten bei welchen ein isolierter und ausgedehnter Leberbefall nicht resektabel ist. Sollte die hepatische Erkrankung durch Chemotherapie gut kontrolliert werden, kann die Möglichkeit einer Lebertransplantation bei selektionierten Patienten evaluiert werden (7, 34).
Wichtige Selektionskriterien bei isoliertem Leberbefall für eine
Lebertransplantation sind:
1. Resektion des Primärtumors sollte mindestens 1-2 Jahre zurückliegen
2. Tumormarker CEA <80 µg/l
3. Tumor mit BRAF Wildtyp
4. Stabile hepatische Erkrankung über einen Zeitraum von 6-12 Monaten
Muss eine Chemotherapie vor oder nach der Leberchirurgie erfolgen?
Eine perioperative systemische Chemotherapie dient der systemischen Krankheitskontrolle, ermöglicht Tumorreduktion vor geplanter Chirurgie und zielt auf Eliminierung mikroskopischer Resterkrankung innerhalb und ausserhalb der Leber ab.
Wie und in welchem Umfang systemische Chemotherapie in die kurative intendierte Behandlung kolorektaler Lebermetastasen integriert wird, hängt von der klinischen Befundkonstellation ab. Grundsätzlich werden zwei Szenarien unterschieden: (1) perioperative oder adjuvante Therapie bei technisch resektablen Lebermetastasen und (2) Vorbehandlung technisch nicht resektabler Lebermetastasen mit dem Ziel der Konversion zur Resektabilität.
Die Indikationsstellung für eine chemotherapeutische Vorbehandlung (neoadjuvante Therapie) technisch resektabler Lebermetastasen wird weiterhin kontrovers beurteilt (35, 36). Die aktuelle S3-Leitlinie empfiehlt bei primär resektabler Erkrankung bei Vorliegen prognostisch günstiger Kriterien die primäre Resektion ohne chemotherapeutische Vorbehandlung (37). Auch aktuelle ESMO-Leitlinien unterscheiden unterschiedliche prognostische Gruppen und empfehlen die primäre Resektion nur bei onkologisch exzellenter Prognose (38). Die Prognose wird anhand klinischer Kriterien beurteilt. Indikatoren ungünstiger Prognose sind das synchrone Auftreten von Lebermetastasen, das Vorliegen von >4 Läsionen, sehr grosse Metastasen (>5cm), ein krankheitsfreies Intervall <12 Monate bei metachroner Metastasierung, der zusätzliche Nachweis extrahepatischer Tumormanifestationen sowie wiederholte Resektionen bei hepatischem Metastasenrezidiv sowie ein stark erhöhtes CEA (39-41). Zur besseren Standardisierung der Beurteilung wurden zahlreiche Risiko- und Prognosescores entwickelt, u.a. der Fong Score (42) (43).
Der gegenwärtige Therapiestandard für die perioperative Therapie resektabler kolorektaler Lebermetastasen beruht auf den Ergebnissen der EPOC-Studie, in der 6 Monate perioperative Chemotherapie mit 5-FU und Oxaliplatin (FOLFOX) das progressionsfreie Überleben, jedoch nicht das Gesamtüberleben der Patienten verbessert haben. Mehrere Metaanalysen kommen zu einem ähnlichen Ergebnis: Perioperative Chemotherapie resektabler kolorektaler Lebermetatastasen verbessert das Progressions-freie Überleben, jedoch nicht das Gesamtüberleben der Betroffenen (14, 15).
Für die Hinzunahme von Antikörpern gibt es in der perioperativen Therapie resektabler Metastasen keine Begründung. Die Hinzunahme von Cetuximab zu 5-FU/Oxaplatin führte in der New EPOC Studie zu einem negativen Ergebnis (44), für Anti-VEGF-Agenzien fehlen Daten.
Sehr wichtig ist, dass die genannten Studien eine prognostisch sehr günstige Patientengruppe analysiert hatten und die gegenwärtige klinische Realität unzureichend abbilden. Auch sind in der Praxis viele Patienten bereits mit 5-FU/Oxaliplatin vorbehandelt.
Wir propagieren daher eine Individualisierung und Personalisierung des Vorgehens bei der perioperativen Chemotherapie für kolorektale Lebermetastasen. Ferner wird die konsequente Weiterentwicklung kombiniert klinisch-biologischer Stratifizierung und die Integration molekularen Monitorings die perioperative Therapie der Zukunft prägen.
Ist eine personalisierte Konversions-Chemotherapie für primär nicht-resektable kolorektale Lebermetastasen neuer Standard?
Bereits ältere Fallserien zeigen, dass primär technisch nicht resektable kolorektale Lebermetastasen durch chemotherapeutische Vorbehandlung in einen sekundär resektablen Zustand überführt werden können (45). Durch die moderne intensivierte und personalisierte Systemtherapie gelingt dies bei immer mehr Patienten, manchmal selbst bei initial ausgedehnter hepatischer Metastasierung. Hauptziel der Konversionstherapie ist Tumorreduktion, man spricht daher häufig von «maximal remissionsinduzierender Therapie». Gleichzeitig gilt es aus Sicht des Onkologen jedoch auch, in einer bestenfalls potenziell kurablen Situation die Systemtherapie patientengerecht und leitlinienkonform einzuleiten, die dann im Falle nicht erreichter sekundärer Resektabilität im Sinne eines Continuum-of-Care Konzeptes nahtlos weitergeführt werden kann. Neuere Daten belegen, dass eine Intensivierung der Erstlinienbehandlung, z.B. durch Verwendung des FOLFOXIRI-Regimes den Patienten prognostisch eher zu nützen scheint (46). Belastet werden die Betroffenen jedoch mit insgesamt höherer Toxizität, die es im Einzelfall gegen kurative Restchance abzuwägen gilt. Der Grenzbereich zwischen technisch Möglichem und onkologisch Sinnhaften muss dabei stets für den Einzelfall neu ausgelotet werden, dies trifft insbesondere für Patienten mit extrahepatischer Metastasierung und ungünstigen prognostischen Kriterien zu (BRAF-Mutation, rechtsseitiger Primärtumor, hohe Tumormarker u.a.).
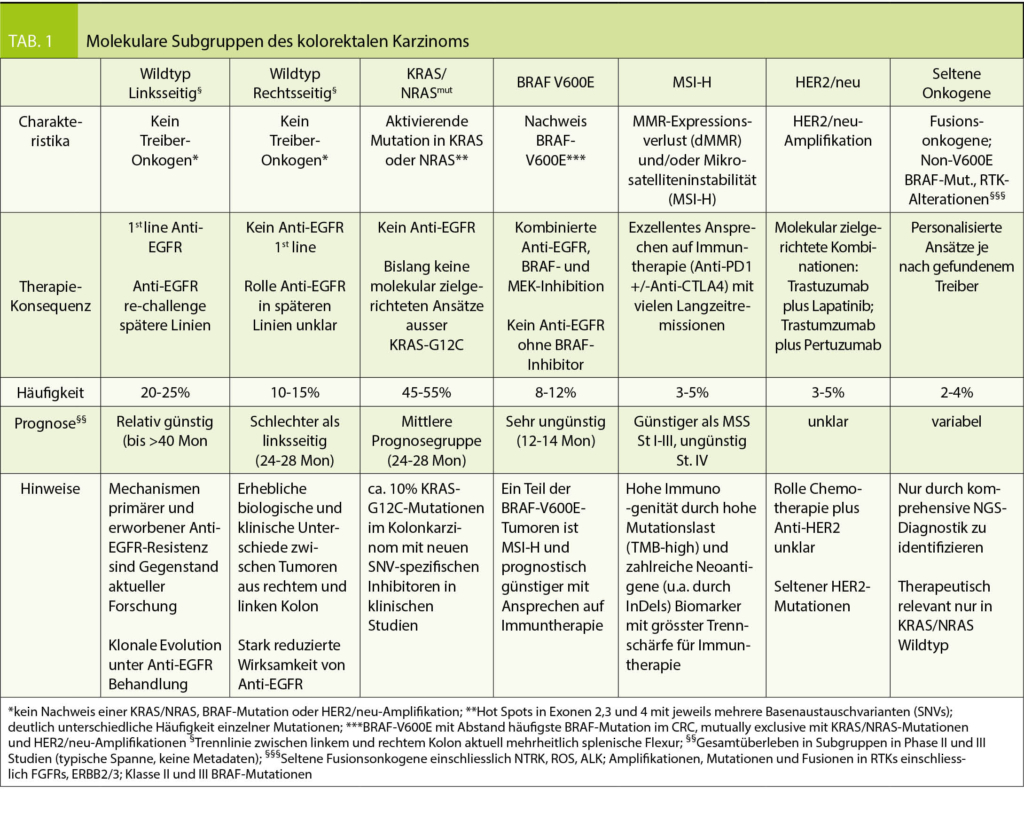
Der Konversionstherapie wird anhand molekularer und biologischer Tumorcharakteristika individuell analog zu den Standards für die palliative Chemotherapie gewählt (Tabelle 1). Die höchsten Ansprechraten erreichen Chemotherapie-Tripletten (FOLFOXIRI-basiert) (47 – 49). Ferner erhöht die Hinzunahme eines Anti-EGFR-Antikörpers zu Doublette (FOLFOX, FOLFIRI) und Triplette (50, 51). Anti-EGFR Therapie kann nur bei linksseitigen Primarien und Fehlen einer Resistenzmutation erfolgen (obligate KRAS, NRAS, BRAF und HER2/neu Testung). Eine typische Wahl für die Konversionstherapie wäre FOLFOXIRI+/-Bevacizumab für KRAS- und BRAF-mutierte Tumore aller Primärlagen und für Wildtyp-Tumoren des rechtsseitigen Kolons und FOLFOX oder FOLFIRI in Kombination mit Anti-EGFR für linksseitige Wildtyp Tumoren. FOLFOXIRI+Anti-EGFR erreichte in einer Phase II-Studie die bislang höchsten dokumentierten Ansprechraten in dieser Subgruppe (48) bei allerdings erheblicher Toxizität des Regimes.
Die optimale Behandlungsdauer der Konversionstherapie ist unklar, maximale radiologische Tumorschrumpfung wurde in Studien nach 12-16 Wochen Chemotherapie erreicht (52). Insgesamt werden typischerweise insgesamt 6 Monate Chemotherapie verabreicht, häufig 3 Monate vor und 3 Monate nach Leberresektion.
Die systemische Behandlung des Kolonkarzinoms unterliegt einem raschen Wandel. Molekulare Subtypisierung basierend auf Treibermutationen, Immunphänotypen, und Genexpressions-basierte Untergruppe (Consensus Molecular Subgroups, CMS) erlangen zunehmende Bedeutung (53), neue Biomarker wie das Mikrobiom werden intensiv erforscht. Eingang in die Routine haben neben der bereits diskutierten Primärtumorlokalisation (54) und Treibermutationen die Testung der Mismatch Repair Gene bzw. Bestimmung des Mikrosatellitenstatus und die routinemässige Testung des BRAF-Mutationsstatus bei KRAS/NRAS Wildtyp Tumoren. Mikrosatelliten-instabile Tumore zeigen exquisites Ansprechen auf Immuncheckpoint-Inhibitoren und sollten nach Meinung der Autoren wenn möglich primär immuntherapiert werden (55) (56). Für die prognostisch extrem ungünstige Gruppe BRAF-V600 mutierter mikrosatelliten-stabiler Tumore befinden sich molekulare Kombinationstherapien in fortgeschrittener klinischer Entwicklung bis hin zu rekrutierenden Erstlinienstudien (BRAF-V600 Inhibition in Kombination mit Anti-EGFR und MEK-Inhibition) (57, 58).
Nachsorge nach Operation oder Chemotherapie: Wie geht es weiter?
Unsere Tumornachsorge richtet sich in erster Linie nach den etablierten Guidelines der Nachsorge des kolorektalen Karzinoms (59, 60). Eine erste Bildgebung mittels CT erfolgt nach Abschluss der adjuvanten Chemotherapie. Im ersten Jahr nach erfolgreicher R0-Resektion führen wir vierteljährlich eine Schichtbildgebung (CT oder MRI) durch und bestimmen den Tumormarker CEA im Serum. Eine zusätzliche CT Untersuchung zum Ausschluss von Lungenmetastasen wird alle 6 Monate bei uns durchgeführt. Im zweiten und dritten Jahr erfolgt, sofern kein Rezidiv vorliegt, die Bildgebung halbjährlich, anschliessend jährlich. Der Grund der intensivierten Nachsorge während der ersten 2 Jahre nach Leberesektion ist, dass das Rezidivrisiko innerhalb dieses Zeitraumes am höchsten ist.
In welche Strukturen ist die Behandlung kolorektaler Lebermetastasen am UniversitätsSpital Zürich eingebunden?
Die Behandlung kolorektaler Lebermetastasen am UniversitätsSpital Zürich erfolgt immer durch einen interdisziplinären Ansatz mit Involvierung der hepatobiliären und kolorektalen Chirurgie, der medizinischen Onkologie, der Strahlentherapie, der Pathologie sowie der diagnostischen und interventionellen Radiologie. Die Leberoperationen für kolorektale Lebermetastasen gehören zur Hoch-spezialisierten Medizin in der Schweiz. Alle Patienten in unserem Zentrum werden am wöchentlichen auf Leber- und Pankreastumore spezialisierten Tumorboard prä- als auch posttherapeutisch besprochen, um den individuellen Behandlungsplan festzulegen. Zudem ist die Behandlung aller Patienten in die Zentrumsstrukturen des Schweizer Zentrums für Leber-, Bauchspeicheldrüsen- und Gallengangserkrankungen (Swiss HPB Center Zurich) sowie des Lebertumorzentrums des Comprehensive Cancer Center Zürich eingebettet. Unser Zentrum ist in der Schweiz das einzige zertifizierte Leberkrebszentrum. Unsere Patienten profitieren von den neusten Innovationen, welche wir am UniversitätsSpital Zürich anbieten können. Darüber hinaus haben unsere Patienten die Möglichkeit an wissenschaftlichen Studien teilzunehmen, welche am UniversitätsSpital durchgeführt werden.
PD Dr. med. Christian E. Oberkofler 1,2,6
Dr. med. Ralph Fritsch 3,6,7
Prof. Dr. med. Thomas Pfammatter 4,6
Dr. med. Helena I. Garcia Schüler 5,7
PD Dr. med. Michelle de Oliveira 1,2
Prof. Dr. med. Philipp Dutkowski 1,2
Prof. Dr. med. Matthias Turina 2,7
Prof. Dr. med. Pierre-Alain Clavien 1,2,6
Prof. Dr. med. Henrik Petrowsky 1,2,6
1 Swiss Hepato-Pancreato-Biliary Center,
2 Klinik für Viszeral und Transplantationschirurgie,
3 Klinik für Medizinische Onkologie und Hämatologie,
4 Institut für Interventionelle Radiologie,
5 Klinik für Radio-Onkologie,
6 Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
7 Colorectal Cancer Center, Comprehensive Cancer Center Zürich
UniversitätsSpital Zürich, Rämistrasse 100, 8091 Zürich
henrik.petrowsky@usz.ch
Schlüsselwörter:
Kolorektale Tumore, Kolorektale Lebermetastasen, Multimodale Therapie, Hepatic Arterial Infusion, Lebertransplantation
Copyright bei Aerzteverlag medinfo AG
Swiss Hepato-Pancreato-Biliary Center
Klinik für Viszeral und Transplantationschirurgie
Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
Klinik für Medizinische Onkologie und Hämatologie
Universität und Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Swiss Hepato-Pancreato-Biliary (HPB) Center
Klinik für Viszeral- und Transplantationschirurgie
Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
Rämistrasse 100
8091 Zürich
henrik.petrowsky@usz.ch
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Durch multimodale Therapien lassen sich auch bei einer primär nicht resektablen Lebermetastasierung onkologische Komplettremissionen erreichen.
- Voraussetzungen für einen derartigen Therapieerfolg sind eine adäquate Patientenselektion, die Individualisierung der systemischen Therapie sowie eine optimale Abstimmung der Therapiesequenz. In der Praxis ist eine frühzeitige Beurteilung durch ein leberchirurgisch erfahrenes Zentrum von zentraler Bedeutung.
- Eine immer grössere Rolle nimmt auch die molekulare Diagnostik der Tumore ein, welche therapierelevante Aufschlüsse über die individuelle Tumorbiologie liefert und zusätzliche systemische Immuntherapien ermöglicht.
1. Krebsliga, Krebs in der Schweiz: wichtige Kennzahlen. 2018.
2. Vera, R., et al., Multidisciplinary management of liver metastases in patients with colorectal cancer: a consensus of SEOM, AEC, SEOR, SERVEI, and SEMNIM. Clin Transl Oncol, 2020. 22(5): p. 647-662.
3. Manfredi, S., et al., Epidemiology and management of liver metastases from colorectal cancer. Ann Surg, 2006. 244(2): p. 254-9.
4. Hackl, C., et al., Treatment of colorectal liver metastases in Germany: a ten-year population-based analysis of 5772 cases of primary colorectal adenocarcinoma. BMC Cancer, 2014. 14: p. 810.
5. Riihimaki, M., et al., Patterns of metastasis in colon and rectal cancer. Sci Rep, 2016. 6: p. 29765.
6. Chow, F.C. and K.S. Chok, Colorectal liver metastases: An update on multidisciplinary approach. World J Hepatol, 2019. 11(2): p. 150-172.
7. Petrowsky, H., et al., Modern therapeutic approaches for treatment of malignant liver tumours. Nature Reviews Gastroenterology & Hepatology, 2020 (in press).
8. Rajakannu, M., et al., Is Cure Possible After Sequential Resection of Hepatic and Pulmonary Metastases From Colorectal Cancer? Clin Colorectal Cancer, 2018. 17(1): p. 41-49.
9. Ubink, I., et al., Surgical and Oncologic Outcomes After Major Liver Surgery and Extended Hemihepatectomy for Colorectal Liver Metastases. Clin Colorectal Cancer, 2016. 15(4): p. e193-e198.
10. Pulitano, C., et al., What defines ‘cure’ after liver resection for colorectal metastases? Results after 10 years of follow-up. HPB (Oxford), 2010. 12(4): p. 244-9.
11. Creasy, J.M., et al., Actual 10-year survival after hepatic resection of colorectal liver metastases: what factors preclude cure? Surgery, 2018. 163(6): p. 1238-1244.
12. Leoni, S., et al., Contrast-enhanced ultrasound in liver cancer. Hepat Oncol, 2015. 2(1): p. 51-62.
13. Niekel, M.C., S. Bipat, and J. Stoker, Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology, 2010. 257(3): p. 674-84.
14. Floriani, I., et al., Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis. J Magn Reson Imaging, 2010. 31(1): p. 19-31.
15. Lincke, T. and C.J. Zech, Liver metastases: Detection and staging. Eur J Radiol, 2017. 97: p. 76-82.
16. Lake, E.S., et al., The influence of FDG PET-CT on the detection of extrahepatic disease in patients being considered for resection of colorectal liver metastasis. Ann R Coll Surg Engl, 2014. 96(3): p. 211-5.
17. Agrawal, A. and V. Rangarajan, Appropriateness criteria of FDG PET/CT in oncology. Indian J Radiol Imaging, 2015. 25(2): p. 88-101.
18. Lee, J.H. and S.W. Lee, The Roles of Carcinoembryonic Antigen in Liver Metastasis and Therapeutic Approaches. Gastroenterol Res Pract, 2017. 2017: p. 7521987.
19. Van Cutsem, E., et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol, 2016. 27(8): p. 1386-422.
20. Benoist, S. and B. Nordlinger, The role of preoperative chemotherapy in patients with resectable colorectal liver metastases. Ann Surg Oncol, 2009. 16(9): p. 2385-90.
21. Adam, R., et al., Tumor progression while on chemotherapy: a contraindication to liver resection for multiple colorectal metastases? Ann Surg, 2004. 240(6): p. 1052-61; discussion 1061-4.
22. Karagkounis, G., et al., Incidence and prognostic impact of KRAS and BRAF mutation in patients undergoing liver surgery for colorectal metastases. Cancer, 2013. 119(23): p. 4137-44.
23. Richman, S.D., et al., Intra-tumoral heterogeneity of KRAS and BRAF mutation status in patients with advanced colorectal cancer (aCRC) and cost-effectiveness of multiple sample testing. Anal Cell Pathol (Amst), 2011. 34(1-2): p. 61-6.
24. Tosi, F., et al., Effect of KRAS and BRAF Mutations on Survival of Metastatic Colorectal Cancer After Liver Resection: A Systematic Review and Meta-Analysis. Clin Colorectal Cancer, 2017. 16(3): p. e153-e163.
25. Kow, A.W.C., Hepatic metastasis from colorectal cancer. J Gastrointest Oncol, 2019. 10(6): p. 1274-1298.
26. Mattar, R.E., et al., Preoperative selection of patients with colorectal cancer liver metastasis for hepatic resection. World J Gastroenterol, 2016. 22(2): p. 567-81.
27. Linecker, M., et al., Dealing with insufficient liver remnant: Associating liver partition and portal vein ligation for staged hepatectomy. J Surg Oncol, 2019. 119(5): p. 604-612.
28. Gallinger, S., et al., Liver resection for colorectal cancer metastases. Curr Oncol, 2013. 20(3): p. e255-65.
29. Petrowsky, H., et al., Second liver resections are safe and effective treatment for recurrent hepatic metastases from colorectal cancer: a bi-institutional analysis. Ann Surg, 2002. 235(6): p. 863-71.
30. Clavien, P.A., et al., Strategies for safer liver surgery and partial liver transplantation. N Engl J Med, 2007. 356(15): p. 1545-59.
31. Schnitzbauer, A.A., et al., Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg, 2012. 255(3): p. 405-14.
32. Chan, A.K.C., et al., The OSLO-COMET Randomized Controlled Trial of Laparoscopic Versus Open Resection for Colorectal Liver Metastases. Ann Surg, 2018. 268(6): p. e69.
33. Fruscione, M., et al., Robotic-assisted versus laparoscopic major liver resection: analysis of outcomes from a single center. HPB (Oxford), 2019. 21(7): p. 906-911.
34. Hagness, M., et al., Liver transplantation for nonresectable liver metastases from colorectal cancer. Ann Surg, 2013. 257(5): p. 800-6.
35. Heinrich, S. and H. Lang, Neoadjuvante Chemotherapie oder primäre Chirurgie bei kolorektalen Lebermetastasen. Der Chirurg, 2014. 85(1): p. 17-23.
36. Lordick, F., et al., Neoadjuvante Chemotherapie oder primäre Chirurgie bei kolorektalen Lebermetastasen. Der Chirurg, 2014. 85(1): p. 11-16.
37. Schmiegel, W., et al., S3-Leitlinie – Kolorektales Karzinom. Z Gastroenterol, 2017. 55(12): p. 1344-1498.
38. Tejpar, S., et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Annals of Oncology, 2016. 27(8): p. 1386-1422.
39. Tsai, M.S., et al., Clinicopathological features and prognosis in resectable synchronous and metachronous colorectal liver metastasis. Ann Surg Oncol, 2007. 14(2): p. 786-94.
40. Adam, R., et al., Managing synchronous liver metastases from colorectal cancer: A multidisciplinary international consensus. Cancer Treatment Reviews, 2015. 41(9): p. 729-741.
41. de Jong, M.C., et al., Repeat curative intent liver surgery is safe and effective for recurrent colorectal liver metastasis: results from an international multi-institutional analysis. J Gastrointest Surg, 2009. 13(12): p. 2141-51.
42. Fong, Y., et al., Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg, 1999. 230(3): p. 309-18; discussion 318-21.
43. Adam, R., et al., The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. Oncologist, 2012. 17(10): p. 1225-39.
44. Primrose, J., et al., Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol, 2014. 15(6): p. 601-11.
45. Adam, R., Chemotherapy and surgery: new perspectives on the treatment of unresectable liver metastases. Ann Oncol, 2003. 14 Suppl 2: p. ii13-6.
46. Cremolini, C., et al., FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol, 2015. 16(13): p. 1306-15.
47. Gruenberger, T., et al., Bevacizumab plus mFOLFOX-6 or FOLFOXIRI in patients with initially unresectable liver metastases from colorectal cancer: the OLIVIA multinational randomised phase II trial. Ann Oncol, 2015. 26(4): p. 702-8.
48. Geissler, M., et al., mFOLFOXIRI + panitumumab versus FOLFOXIRI as first-line treatment in patients with RAS wild- type metastatic colorectal cancer m(CRC): A randomized phase II VOLFI trial of the AIO (AIO- KRK0109). Journal of Clinical Oncology, 2018. 36(15_suppl): p. 3509-3509.
49. Cremolini, C., et al., Activity and Safety of Cetuximab Plus Modified FOLFOXIRI Followed by Maintenance With Cetuximab or Bevacizumab for RAS and BRAF Wild-type Metastatic Colorectal Cancer: A Randomized Phase 2 Clinical TrialCetuximab Plus Modified FOLFOXIRI for RAS and BRAF Wild-type Metastatic Colorectal CancerCetuximab Plus Modified FOLFOXIRI for RAS and BRAF Wild-type Metastatic Colorectal Cancer. JAMA Oncology, 2018. 4(4): p. 529-536.
50. Folprecht, G., et al., Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol, 2010. 11(1): p. 38-47.
51. Ye, L.C., et al., Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol, 2013. 31(16): p. 1931-8.
52. Heinemann, V., et al., Early tumour shrinkage (ETS) and depth of response (DpR) in the treatment of patients with metastatic colorectal cancer (mCRC). European Journal of Cancer, 2015. 51(14): p. 1927-1936.
53. Dienstmann, R., R. Salazar, and J. Tabernero, Molecular Subtypes and the Evolution of Treatment Decisions in Metastatic Colorectal Cancer. American Society of Clinical Oncology Educational Book, 2018(38): p. 231-238.
54. Arnold, D., et al., Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol, 2017. 28(8): p. 1713-1729.
55. Le, D., et al., O-021Safety and antitumor activity of pembrolizumab in patients with advanced microsatellite instability–high (MSI-H) colorectal cancer: KEYNOTE-164. Annals of Oncology, 2018. 29(suppl_5).
56. Lenz, H.-J.J., et al., LBA18_PRDurable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). Annals of Oncology, 2018. 29(suppl_8).
57. Kopetz, S., et al., Updated results of the BEACON CRC safety lead-in: Encorafenib (ENCO) + binimetinib (BINI) + cetuximab (CETUX) for BRAFV600E-mutant metastatic colorectal cancer (mCRC). Journal of Clinical Oncology, 2019. 37(4_suppl): p. 688-688.
58. Corcoran, R.B., et al., Combined BRAF, EGFR, and MEK Inhibition in Patients with BRAFV600E-Mutant Colorectal Cancer. Cancer Discovery, 2018: p. CD-17-1226.
59. AWMF, S3 Leitlienie Kolorektales Karzinom. 2019.
60. Liu, S.L. and W.Y. Cheung, Role of surveillance imaging and endoscopy in colorectal cancer follow-up: Quality over quantity? World J Gastroenterol, 2019. 25(1): p. 59-68.
der informierte @rzt
- Vol. 10
- Ausgabe 9
- September 2020