- Foramen ovale apertum
Das Foramen ovale apertum (PFO) ist eine anatomische Kommunikation zwischen dem linken Vorhof und rechten Vorhof bei fehlendem Verschluss der Fossa ovalis nach der Geburt. Dem PFO kommt per se keine pathologische Bedeutung zu. Die Verbindung zwischen den beiden Vorhöfen ergibt aber die Möglichkeit eines Übertritts von thrombotischem Material oder anderen Substanzen vom venösen in den arteriellen Kreislauf. Die paradoxe Embolie von Thrombusmaterial spielt eine Rolle in der Pathophysiologie des kryptogenen Schlaganfalls. Der perkutane PFO-Verschluss in Ergänzung zur medikamentösen Therapie ist eine ausgezeichnete Option, um weitere Schlaganfälle zu verhindern. Dieser Artikel beschreibt die Pathophysiologie der paradoxen Embolie, die Abklärungen, die nötig sind, um das PFO als Ursache zu identifizieren, und die Technik des PFO-Verschlusses, sowie die Langzeitbehandlung bei kryptogenem Schlaganfall und PFO.
Le foramen ovale apertum (PFO) est une communication entre l’auricule gauche et l’auricum droit en l’absence de fermeture de la fosse ovale après la naissance. Le PFO n’a pas de signification pathologique en soi. Mais le lien entre les deux auricules offre la possibilité d’une fuite thrombotique ou d’autres substances de la veine à la circulation artérielle. L’embolie paradoxale de matériau du thrombus joue un rôle dans la physiopathologie des accidents vasculaires cérébraux cryptogéniques. L’occlusion percutanée du PFO en outre de la thérapie médicamenteuse est une option excellente pour prévenir d’autres accidents vasculaires cérébraux. Cet article décrit la pathophysiologie de l’embolie paradoxale, les clarifications nécessaires pour identifier le PFO comme la cause, et la technique de fermeture du PFO, et le traitement à long terme des accidents vasculaires cryptogéniques et le PFO.
Paradoxe Embolie durch das Foramen ovale apertum als Ursache des kryptogenen Schlaganfalls
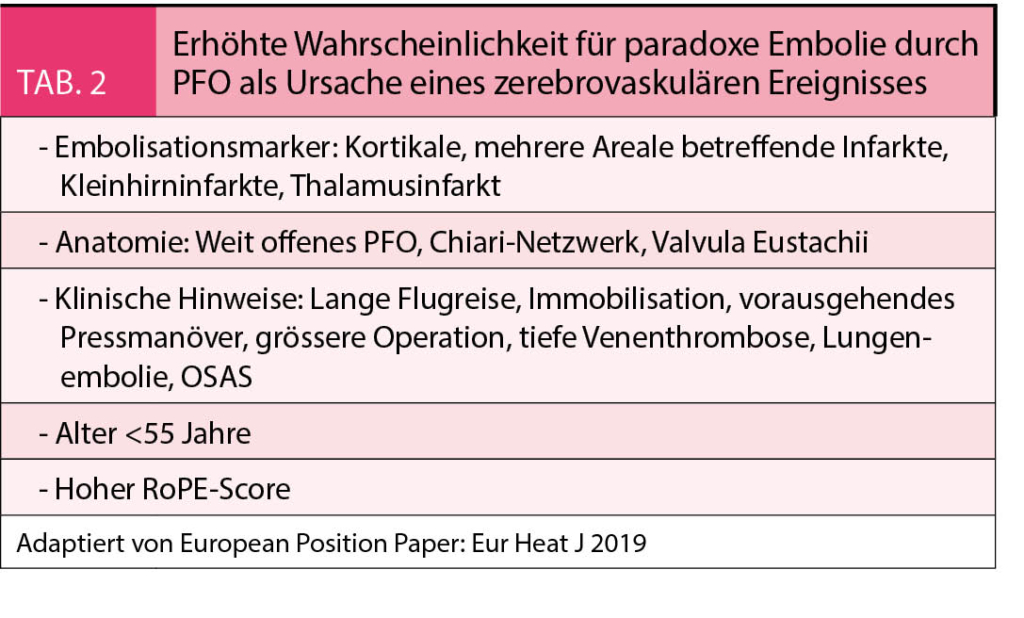
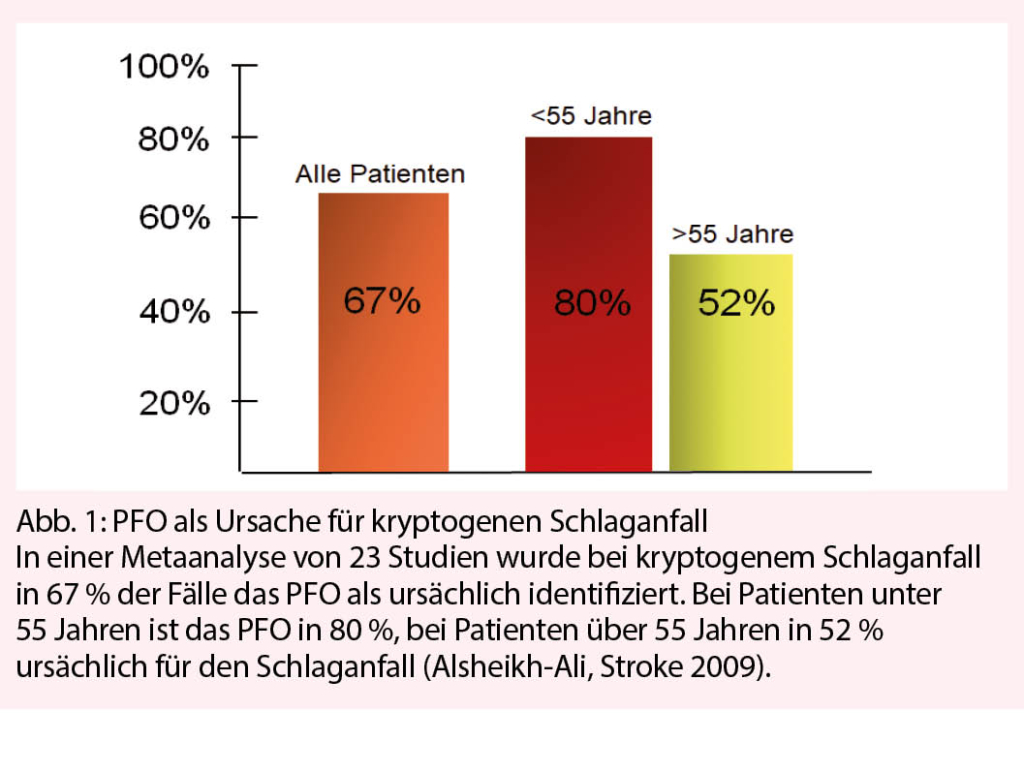
Ein PFO findet sich bei etwa 25 % der Bevölkerung. Obwohl bereits vor 150 Jahren das gleichzeitige Vorkommen von Lungenembolien und peripheren Embolien bei Patienten mit weit offenem PFO beschrieben wurde, wurde erst 1988 die erhöhte Prävalenz eines PFO bei jungen Patienten mit kryptogenem Schlaganfall aufgezeigt (1). Durch das PFO können neben thrombotischem Material auch Gase, entsättigtes Blut oder vasoaktive Substanzen vom venösen in den arteriellen Kreislauf gelangen und zu den entsprechenden Krankheitsbildern führen (Tab. 1). Klinisch am bedeutungsvollsten ist allerdings die paradoxe Embolie als Ursache des kryptogenen Schlaganfalls. Nach einem kryptogenen Schlaganfall gilt es, das PFO zu suchen und nachher zwischen einem inzidentellen PFO und einem ursächlichen PFO zu unterscheiden. In einer Metaanalyse von 23 Studien wurde gezeigt, dass ca. ein Drittel der PFOs inzidentell sind und 67 % ursächlich (Abb. 1) (2). Je jünger der Patient ist, umso wahrscheinlicher ist das PFO und eine dadurch mögliche paradoxe Embolie ursächlich für den kryptogenen Schlaganfall. Bei unter 55-jährigen Patienten ist nach kryptogenem Schlaganfall und Vorliegen eines PFOs dasselbe in 80 % ursächlich für den Schlaganfall. Wird bei einem Patienten mit kryptogenem Schlaganfall ein PFO gefunden, kann die Wahrscheinlichkeit, dass das PFO ursächlich ist, nicht nur aufgrund des Alters, sondern auch aufgrund des Embolisationsmusters im Hirn, der Anatomie des PFOs und aufgrund klinischer Hinweise abgeschätzt werden (Tab. 2). Gleichzeitig bestehende venöse Thrombosen oder Lungenembolien sprechen für eine paradoxe Embolie durch das PFO. Da eine paradoxe Embolie, d. h. ein Rechts-Links-Shunt, durch eine Druckerhöhung im rechten Vorhof begünstigt wird, wird das Auftreten eines Schlaganfalls nach einem Pressmanöver, wie z.B. nach dem morgendlichen Toilettengang, beim Trompete oder anderen Blasinstrument spielen, beim Aufheben schwerer Last etc., die Wahrscheinlichkeit eines ursächlichen PFOs erhöhen. Die Wahrscheinlichkeit, dass der kryptogene Schlaganfall dem PFO geschuldet ist, wird häufig auch anhand des RoPE-Scores abgeschätzt. Der RoPE-Score verwendet das Alter des Patienten, die kardiovaskulären Risikofaktoren und das Embolisationsmuster im Hirn sowie vorausgegangene Schlaganfälle, um die Wahrscheinlichkeit vorauszusagen (3). Obwohl der RoPE-Score häufig verwendet wird, ist er schlecht validiert und für sich alleine als Entscheidungsgrundlage nicht geeignet (4).
Abklärungen bei Verdacht auf kryptogenen Schlaganfall
Die Ursache für einen ischämischen zerebrovaskulären Insult ist in 25% eine Arteriosklerose der hirnzuführenden Arterien, in 25 % eine Erkrankung der kleinen Hirnarterien, in 20 % eine Embolie aus dem Herzen und in 5 % andere Ursachen, wie eine Dissektion der Hirnarterien oder eine Arteriitis (5). In 25 % findet sich keine Ursache und man spricht von einem kryptogenen Schlaganfall. Bei nichtlakunären Schlaganfällen ohne erkennbare Ursache, aber mit Hinweisen auf ein embolisches Geschehen, wie z. B. dem Vorliegen eines PFOs, spontanem Echokontrast im linken Vorhofohr, Non-Compaction des linken Ventrikels etc., spricht man auch von einem Embolic Stroke of Unknown Source (ESUS) (5). Die Diagnose eines kryptogenen Schlaganfalls kann daher nur gestellt werden, wenn andere Ursachen ausgeschlossen sind. Dafür sind mehrere Untersuchungen nötig (Tab. 3). Im Vordergrund steht dabei die Bildgebung des Hirns und der hirnzuführenden Arterien mittels CT oder MRI und Duplexsonographie. Bei jungen Patienten ohne Arteriosklerose ist eine Dissektion der Karotis oder der Vertebralis unbedingt auszuschliessen.
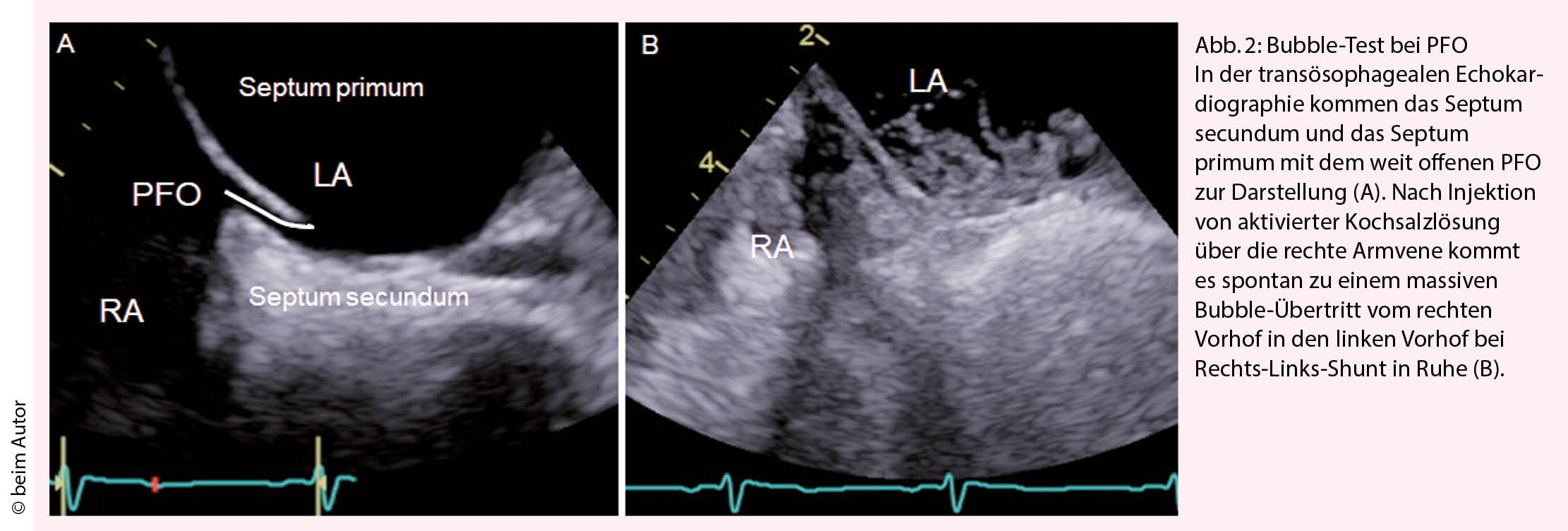
Das Elektrokardiogramm oder ein Langzeit-EKG von 24 bis 72 Stunden, ev. auch eine Langzeitaufzeichnung, sind nötig, um ein Vorhofflimmern auszuschliessen. Die Wahrscheinlichkeit, dass ein okkultes Vorhofflimmern vorliegt, ist altersabhängig. Bei jungen Patienten mit normaler Herzfunktion ist das Vorhofflimmern eine Rarität. Bei Patienten über 60 Jahren oder bei vergrösserten Vorhöfen wird die Wahrscheinlichkeit, dass ein Vorhofflimmern vorliegt, höher und die entsprechende Suche nach Vorhofflimmern wichtiger. Die transthorakale Echokardiographie dient zum Ausschluss einer kardio-embolischen Quelle. Liegt keine Pathologie am Myokard oder den Klappen vor oder besteht der Verdacht auf eine paradoxe Embolie durch das PFO wird eine transoesophageale Echokardiografie (TEE) angeschlossen. Meist wird bereits bei der transthorakalen Echokardiografie, sicher aber bei der TEE ein Bubble-Test durchgeführt (Abb. 2) um festzustellen, ob ein Rechts-Links-Shunt in Ruhe vorliegt oder mittels eines Valsalva Manövers provoziert werden kann. Die TEE ermöglicht zum einen den Ort des Rechts-Links-Shunts zu eruieren, zum anderen Shuntvitien wie ein Vorhofseptumdefekt, falsch mündende Lungenvenen oder eine pulmonale A-V Malformation auszuschliessen. Mittels TEE wird die Morphologie und Anatomie des PFO und des Vorhofs visualisiert, was wichtig ist für einen eventuellen PFO Verschluss. Die Evaluation der Grösse des PFOs in der TEE ist jedoch problematisch, da das Septum primum deckelförmig mehr oder weniger aufgeht und der Bubble-Übertritt damit von der Qualität des Valsalva-Manövers abhängt (Abb. 2). In der TEE kommt in der 2-D Darstellung die schlitzförmige Öffnung des PFO meist als kleine Lücke von 1-4 mm zur Darstellung. In Wirklichkeit variiert die anatomische Grösse des PFO von 4 bis 16 mm, im Mittel beträgt sie 8 ± 3 mm (6, 7).
Keine routinemässige Thrombophilieabklärung
Verschiedene Richtlinien empfehlen bei kryptogenem Schlaganfall und offenem PFO die routinemässige Thrombophilieabklärung (8). Evidenz für diese Empfehlung gibt es nicht. Die angeborenen Thrombophilien d.h. Prothrombin-Mutation, Protein-C, Protein-S, Antithrombin-III sind alle nicht und die Faktor-V-Leiden-Mutation ebenfalls nicht oder höchstens schwach mit einem Schlaganfall bei PFO assoziiert (9, 10). Die erworbene Thrombophilie also das Antiphospholipid-Antikörper-Syndrom kann in seltenen Fällen verbunden sein mit ischämischen Schlaganfällen bei jüngeren Patienten. Die Diagnose ergibt sich aus klinischen Kriterien und stark erhöhten Antikörper über mehrere Monate. Einmalig und nur leicht erhöhte Antikörper sind ungenügend für die Diagnosestellung (9) und rechtfertigen nicht eine orale Antikoagulation. Von einer routinemässigen Thrombophilieabklärung bei einem Patienten mit kryptogenem Schlaganfall ohne weitere klinische Hinweise auf eine Hyperkoagulabilität wird deshalb abgeraten (4, 9, 10). Eine routinemässige Thrombophilieabklärung verbietet sich auch wegen der daraus entstehenden Kosten. Zudem besteht die Gefahr, dass der Patient unnötigerweise oral antikoaguliert wird (10).
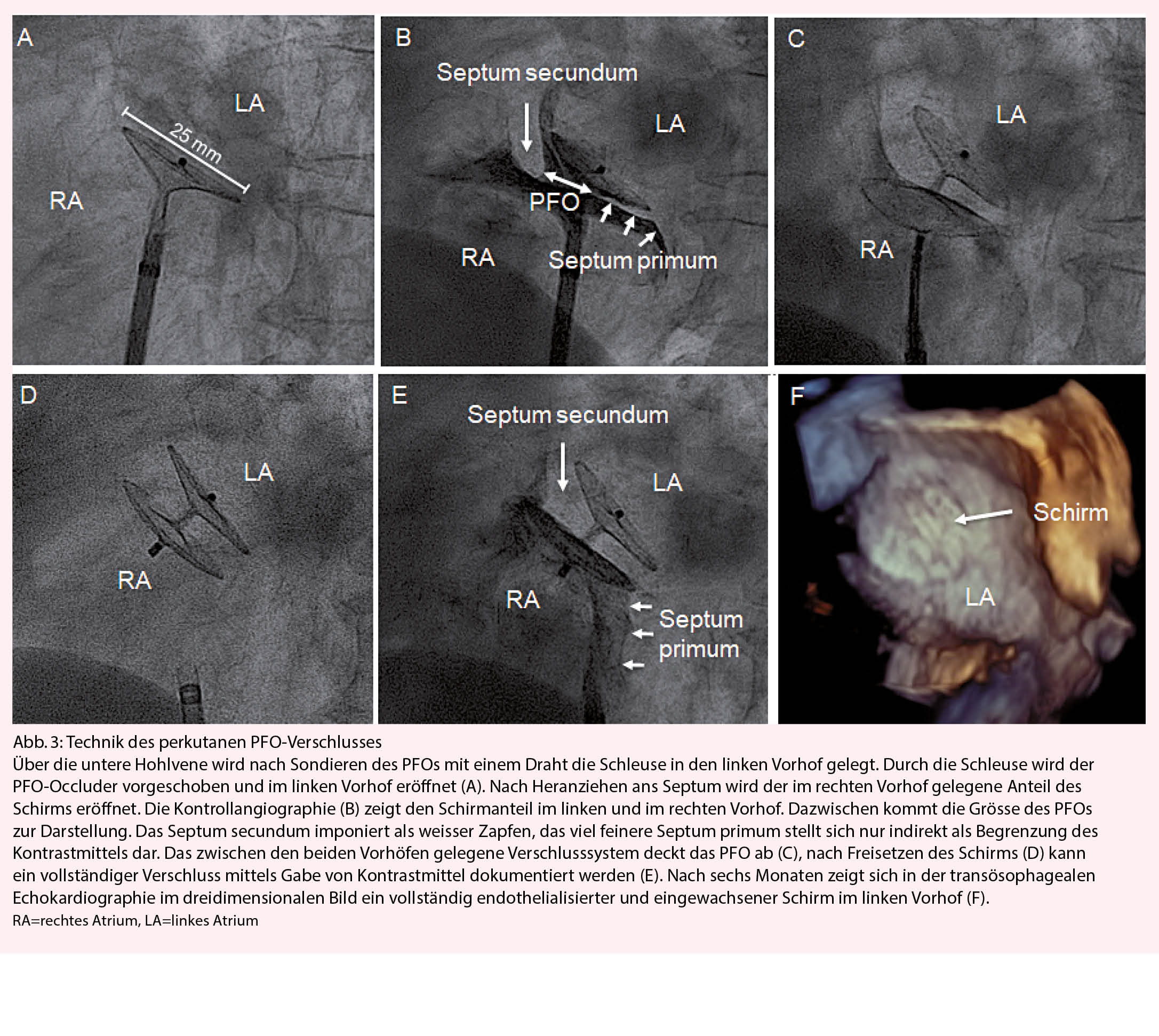
Technik des perkutanen PFO-Verschlusses
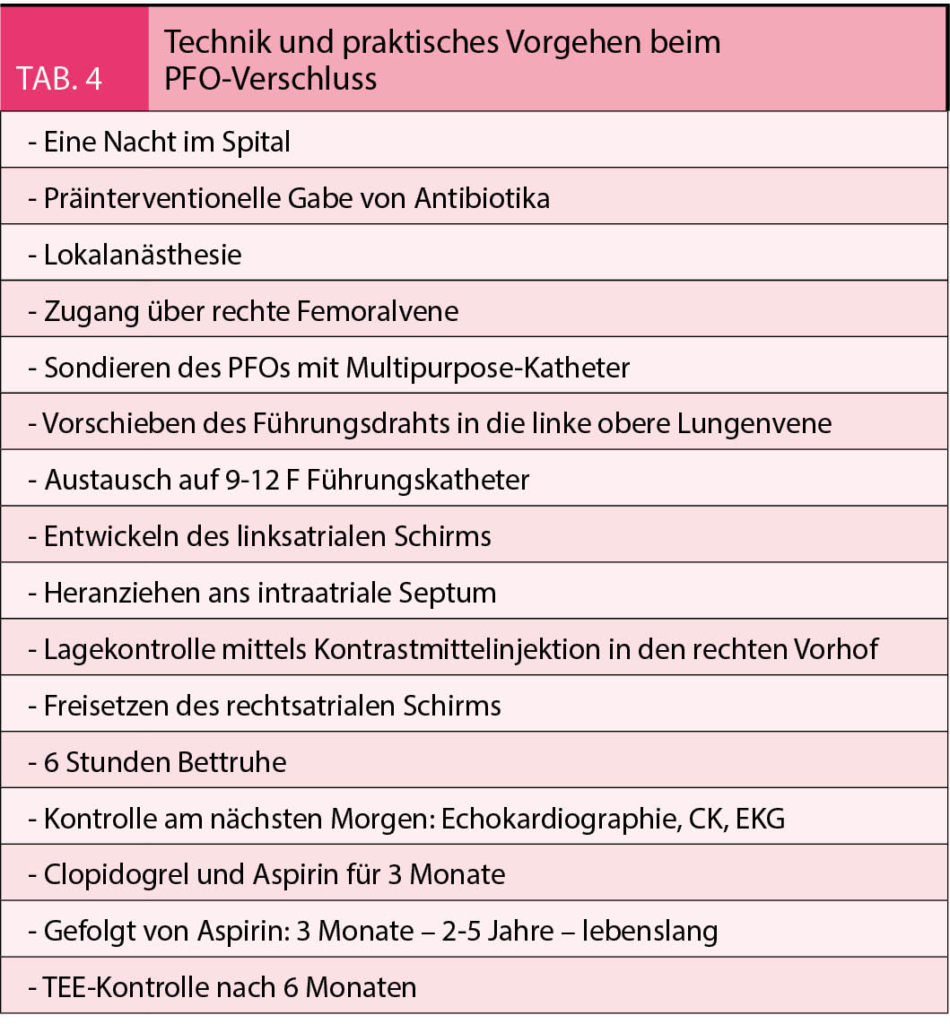
Der perkutane PFO-Verschluss wird in vielen Zentren unter Überwachung mittels Angiografie und TEE durchgeführt, was meist eine Vollnarkose nötig macht. Der PFO Verschluss ist auch mittels angiografischer Überwachung allein und bei Bedarf dem Einsatz einer intrakardialen Echokardiografiesonde, möglich. Allerdings ist eine vorgängige, qualitativ genügende TEE nötig, um den Eingriff zu planen. In der Tabelle 4 sind die Technik und das praktische Vorgehen wie es am Stadtspital Triemli praktiziert wird aufgeführt. Das Verschlusssystem wird über den Führungskatheter, welcher nach dem Sondieren des PFOs in der linken oberen Lungenvene oder im linken Vorhof liegt, eingeführt. Der linksatriale Anteil des Verschlusssystems wird im linken Vorhof eröffnet (Abb. 3A). Er entfaltet sich wie ein Schirm. Daher der Name Schirmverschluss. Der «Schirm» wird nun gegen das interatriale Septum gezogen und fasst das Septum primum und Septum secundum (Abb. 3B). Mittels Kontrastinjektion in den rechten Vorhof über den Führungskatheter wird die Position überprüft. Dann wird der rechtsatriale «Schirm» entfaltet und eine erneute Kontrolle der Position des PFO-Occluders durchgeführt (Abb. 3C). Bei guter Position wird der Occluder freigesetzt (Abb. 3D). Die Kontrolle am nächsten Tag umfasst eine transthorakale Echokardiographie zur Überprüfung der Lage des Occluders, eine Laborkontrolle zur Sicherstellung, dass keine kardiale Schädigung aufgetreten ist (CK, Troponin) und das Aufzeichnen eines EKGs zum Dokumentieren, dass der Patient nicht im Vorhofflimmern ist. Nach sechs Monaten wird eine Kontrollechokardiographie durchgeführt zur Überprüfung des vollständigen Einwachsens des Occluders (Abb. 3F). Die häufigste Komplikation bei der Implantation ist das Auftreten eines Hämatoms an der Einstichstelle. Selten kommt es zu anderen unerwünschten Komplikationen, wie z.B. eine Kontrastmittelallergie, vago-vasale Reaktion, oder kleinen Luftembolien. Noch seltener kommt es zu vaskulären Komplikationen an der Einstichstelle, einer Embolisation des Verschlusssystems oder einem Perikarderguss.
Wirksamkeit und Sicherheit des perkutanen PFO Verschlusses
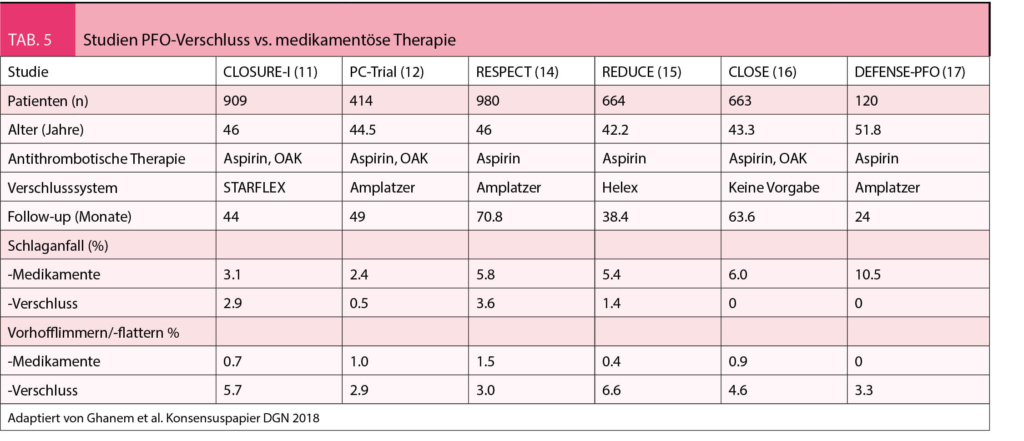
Aufgrund der Pathophysiologie der paradoxen Embolie bietet sich der Verschluss des PFOs für eine optimale Sekundärprävention an. Leider haben die ersten randomisierten Studien (CLOSURE I (11), PC-Trial (12), RESPECT (13), welche eine medikamentöse Therapie (Aspirin oder OAK) gegen den perkutanen PFO-Verschluss verglichen haben, keinen signifikanten Vorteil für den PFO-Verschluss gebracht. Die Ursachen für dieses neutrale Ergebnis waren neben einer suboptimalen Patientenselektion, eine niedrigere als erwartete Ereignisrate, eine zu kurze Nachbeobachtungszeit, viele «Crossovers» (12, 13) und Komplikationen durch ein schlechtes Verschlusssystem (11). Eine Verlängerung der Nachbeobachtungszeit hat denn auch im RESPECT-Trial den Vorteil des PFO-Verschlusses gegenüber der medikamentösen Therapie gezeigt (14). In der Folge wurden von Neurologen Studien durchgeführt, nämlich die REDUCE-Studien (15) und die CLOSE-Studie (16) und von Kardiologen die DEFENSE-PFO-Studie (17), welche den Vorteil des PFO-Verschlusses zur Verhinderung eines erneuten Schlaganfalls eindeutig belegten (Tab. 5).
Bezüglich Sicherheit sind neben den oben angeführten periprozeduralen Ereignissen vor allem das Auftreten eines Vorhofflimmerns zu erwähnen. Im Mittel kam es in 4.2% der Patienten zu einem Vorhofflimmern. Bei den Disc-Occludern (Amplatzer, Figulla) war die Rate tiefer. Das Vorhofflimmern trat periprozedural auf, war meist selbstlimitierend und 30 Tage nach der Implantation eine Seltenheit. Die Wertigkeit dieser kurzdauernden Vorhofllimmerepisoden ist nicht klar. Sie haben in den sechs Studien im Langzeitverlauf nicht zu Schlaganfällen geführt (18). Aufgrund des Abwägens von Nutzen und Risiko in den vorliegenden Studien empfiehlt deshalb die Deutsche Gesellschaft für Neurologie (Tab. 5), dass bei Patienten zwischen 16 und 60 Jahren (nach neurologischer und kardiologischer Abklärung) mit einem kryptogenen Schlaganfall und offenem Foramen ovale mit moderatem oder ausgeprägtem Rechts-Links-Shunt ein interventioneller PFO-Verschluss durchgeführt werden soll (19). Die Amerikanische Akademie für Neurologie hat die Evidenz der sechs Studien ebenfalls sorgfältig reevaluiert und kommt zum gleichen Schluss (18).
Medikamentöse Therapie bei kryptogenem Schlaganfall und PFO
Die Richtlinien empfehlen bei Patienten mit kryptogenem Schlaganfall eine lebenslange anti-thrombotische Therapie (20). Wenn beim kryptogenen Schlaganfall bei PFO eine paradoxe Embolie als Ursache angenommen wird, müsste konsequenterweise eine orale Antikoagulation empfohlen werden. Es gibt aber bis jetzt keine genügend grossen randomisierten Studien, welche den Vorteil einer OAK gegenüber der Plättchenhemmung belegt hätten. Die Meta-analysen waren abhängig von den berücksichtigten Studien leider auch uneinheitlich. Dementsprechend sind die Empfehlungen uneinheitlich. Die deutsche Gesellschaft für Neurologie empfiehlt bei allen Patienten die anti-thrombotische Therapie (19), die europäischen und die amerikanischen Richtlinien empfehlen je nach embolischem und/oder Blutungsrisiko die anti-thrombotische Therapie oder die Antikoagulation einzusetzen (4, 18). Nach einem PFO Verschluss macht eine Antikoagulation keinen Sinn mehr. Zur Nachbehandlung braucht es eine anti-thrombotische Therapie. In den ersten Studien wurde die anti-thrombotische Therapie meist nach sechs Monaten gestoppt. In den neueren Studien wurde sie für zwei Jahre oder die Dauer der Studie beibehalten – mit entsprechend besseren Resultaten (Tab. 5). Es gilt daher der Konsensus, dass die anti-thrombotische Therapie je nach Schlaganfallgefährdung als Ergänzung zum PFO Verschluss individuell angepasst weiter gegeben werden soll (4). Bei jungen Patienten kann sie nach sechs Monaten gestoppt werden, bei älteren Patienten soll sie 2-5 Jahre weitergeführt werden. Bei Vorliegen von kardiovaskulären Risikofaktoren oder einer Arteriosklerose soll sie lebenslang gegeben werden.
PFO Verschluss bei Patienten >60 Jahre und bei Patienten mit kardiovaskulären Risikofaktoren
Auch bei Patienten über 60 Jahren ist das PFO assoziiert mit kryptogenen Schlaganfällen (21). 61 % der kryptogenen Schlaganfälle treten bei über 60-jährigen Patienten auf. Da höheres Alter verbunden ist mit mehr Risikofaktoren für eine venöse Thrombose, ist auch in dieser Altersgruppe die paradoxe Embolie eine wichtige Ursache des kryptogenen Schlaganfalls. Die Rezidivrate des kryptogenen Schlaganfalls bei älteren Patienten ist zudem höher als bei jüngeren Patienten. Leider ist die Studienlage noch nicht klar, ob auch bei diesen Patienten ein PFO-Verschluss sinnvoll ist (21, 22). In den bestehenden Studien fand sich kein Gradient bezüglich Nutzen des PFO Verschlusses zwischen Patienten <45 Jahren und >45-60 Jahren (18). Vorausgesetzt es erfolgte vorgängig eine sorgfältige Abklärung, spricht die Evidenz für den Nutzen des PFO-Verschluss auch bei Patienten über 60 Jahren (18, 21, 22). Ebenfalls ungeklärt ist die Frage, ob Patienten mit Arteriosklerose vom PFO Verschluss profitieren. Auch nach sorgfältiger neurologischer und kardiologischer Evaluation haben aus eigener Erfahrung etwa 10% der Patienten über 40 Jahre und der Patientinnen über 50 Jahre klinisch nicht manifeste arteriosklerotische Veränderungen. Der PFO Verschluss wird weitere paradoxe Embolien verhindern. Zur Verhinderung von arteriosklerotisch bedingten ischämischen Schlaganfällen muss aber eine lebenslange anti-thrombotische Therapie und strikte Kontrolle der kardiovaskulären Risikofaktoren zusätzlich eingesetzt werden.
Copyright bei Aerzteverlag medinfo AG
Stadtspital Zürich Triemli
Klinik für Kardiologie
Birmensdorferstrasse 497
8063 Zürich
franz.eberli@triemli.zuerich.ch
Der Autor war Teil des Clinical Event Committee’s der PC Studie. Er nimmt gegenwärtig an der TREVISIO Studie und der CATALYST Studie der Firma ABBOTT (Hersteller der Amplatzer Verschlussysteme) teil. Die Institution des Autors erhält Forschungsgelder von folgenden Firmen: ABBOTT, Astra Zeneca, Biotronik, Biosensors, Boston Scientific, Cardinal, Fumedica, Medtronic, Terumo.
◆ Bei Patienten mit kryptogenem Schlaganfall soll nach sorgfältiger neurologischer und kardiologischer Abklärung zum Ausschluss von anderen Ursachen ein Foramen ovale apertum gesucht werden.
◆ Bei Vorliegen eines PFO ist es in einem hohen Prozentsatz ursächlich für den Schlaganfall.
◆ Der perkutane PFO Verschluss ist der alleinigen medikamentösen Therapie als Sekundärprävention beim kryptogenen Schlaganfall und PFO überlegen.
◆ Die Kombination PFO Verschluss und längerdauernde anti-thrombotische Therapie verhindert erneute Schlaganfälle am sichersten.
Messages à retenir
◆Chez les patients victimes d’un accident vasculaire cérébral cryptogènique, après une une clarification cardiologique, il faut chercher un foramen ovale apertum pour en exclure d’autres causes.
◆ En présence d’un PFO, il est causal à un pourcentage élevé pour l’accident vasculaire cérébrale.
◆ La fermeture percutanée du PFO est supérieure à la seule thérapie médicamenteuse en tant que prévention secondaire de l’ accident cérébrovasculaire cryptogénique.
◆ La combinaison de la fermeture du PFO et de la thérapie antithrombotique de longue durée est le moyen le plus sûr de prévenir de nouveaux accidents vasculaires cérébraux.
1. Lechat P, Mas JL, Lascault G et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988;318:1148-52.
2. Alsheikh-Ali AA, Thaler DE, Kent DM. Patent foramen ovale in cryptogenic stroke: incidental or pathogenic? Stroke 2009;40:2349-55.
3. Kent DM, Ruthazer R, Weimar C et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology 2013;81:619-25.
4. Pristipino C, Sievert H, D’Ascenzo F et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. Eur Heart J 2019;40:3182-3195.
5. Hart RG, Diener HC, Coutts SB et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol 2014;13:429-38.
6. Alibegovic J, Bonvini R, Sigwart U, Dorsaz P, Camenzind E, Verin V. The role of the sizing balloon in selection of the patent foramen ovale closure device size. Exp Clin Cardiol 2008;13:42-6.
7. Schuchlenz HW, Weihs W, Horner S, Quehenberger F. The association between the diameter of a patent foramen ovale and the risk of embolic cerebrovascular events. Am J Med 2000;109:456-62.
8. Colucci G, Tsakiris DA. Thrombophilie. Swiss Med Forum 2020;20:73-78.
9. Kalaria C, Kittner S. The therapeutic value of laboratory testing for hypercoagulable states in secondary stroke prevention. Neurol Clin 2015;33:501-13.
10. Morris JG, Singh S, Fisher M. Testing for inherited thrombophilias in arterial stroke: can it cause more harm than good? Stroke 2010;41:2985-90.
11. Furlan AJ, Reisman M, Massaro J et al. Closure or medical therapy for cryptogenic stroke with patent foramen ovale. N Engl J Med 2012;366:991-9.
12. Meier B, Kalesan B, Mattle HP et al. Percutaneous closure of patent foramen ovale in cryptogenic embolism. N Engl J Med 2013;368:1083-91.
13. Carroll JD, Saver JL, Thaler DE et al. Closure of patent foramen ovale versus medical therapy after cryptogenic stroke. N Engl J Med 2013;368:1092-100.
14. Saver JL, Carroll JD, Thaler DE et al. Long-Term Outcomes of Patent Foramen Ovale Closure or Medical Therapy after Stroke. N Engl J Med 2017;377:1022-1032.
15. Sondergaard L, Kasner SE, Rhodes JF et al. Patent Foramen Ovale Closure or Antiplatelet Therapy for Cryptogenic Stroke. N Engl J Med 2017;377:1033-1042.
16. Mas JL, Derumeaux G, Guillon B et al. Patent Foramen Ovale Closure or Anticoagulation vs. Antiplatelets after Stroke. N Engl J Med 2017;377:1011-1021.
17. Lee PH, Song JK, Kim JS et al. Cryptogenic Stroke and High-Risk Patent Foramen Ovale: The DEFENSE-PFO Trial. J Am Coll Cardiol 2018;71:2335-2342.
18. Messe SR, Gronseth GS, Kent DM et al. Practice advisory update summary: Patent foramen ovale and secondary stroke prevention: Report of the Guideline Subcommittee of the American Academy of Neurology. Neurology 2020;94:876-885.
19. Diener HC, Grau A, Baldus S. Kryptogener Schlaganfall und offenes Foramen ovale, S2e Leitlinie. In: Leitlinien für Diagnostik und Therapie in der Neurologie 2018. Herausgegeben von der Kommission Leitlinien der Deutschen Gesellschaft für Neurologie. Gemeinsame Empfehlungen der DGN, der DSG und der DGK, 2018.
20. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014;45:2160-236.
21. Mazzucco S, Li L, Binney L, Rothwell PM, Oxford Vascular Study Phenotyped C. Prevalence of patent foramen ovale in cryptogenic transient ischaemic attack and non-disabling stroke at older ages: a population-based study, systematic review, and meta-analysis. Lancet Neurol 2018;17:609-617.
22. Gaspardone A, Sgueglia GA. Cryptogenic stroke over 60 years of age: should patent foramen ovale be closed? Eur Heart J Suppl 2020;22:E82-E86.
info@herz+gefäss
- Vol. 10
- Ausgabe 5
- Oktober 2020