- Herz und Schlafstörungen
Wenn das Hirn schläft, schläft auch das Herz. Deshalb beeinträchtigen Schlafstörungen nicht nur den Wachzustand des Hirns, sondern können auch dem Herz-Kreislaufsystem schaden. Hier gebe ich Einblick in die neuronale Kommunikation zwischen Hirn und Herz während des Schlafs. Untersuchungen an der schlafenden Maus weisen auf eine neue Form dieser Kommunikation hin, die die Aufweckbarkeit im knappen Minutentakt reguliert. Diese könnte für die Aufklärung weitverbreiteter Schlafstörungen beim Menschen von Bedeutung sein.
Quand le cerveau dort, le cœur dort aussi. C’ est pourquoi les troubles de sommeil affligent non seulement l’état d’éveil du cerveau, mais aussi le fonctionnement du système cardiovasculaire. Je résume ici l’ état des connaissances sur la communication neuronale entre le cerveau et le cœur pendant le sommeil. De récentes études expérimentales chez la souris endormie ont mis en évidence que cette communication est en rapport avec la propensité à s’éveiller sur une échelle de temps d’environ 1 minute. Celle-ci pourrait s’ avérer importante pour comprendre des troubles de sommeil répandues chez l’ humain.
Beim Gedanken an eine unruhige Nacht denkt man zunächst an die Müdigkeit des darauffolgenden Tages, das generelle Unwohlsein, die fehlende Unternehmungslust. Schlechter Schlaf verursacht tagsüber mangelndes Konzentrationsvermögen, Gedächtnislücken und emotionale Unausgeglichenheit. Langfristig gilt Schlafmangel als Risikofaktor für weitverbreitete Krankheiten wie Alzheimer, Depressionen, Übergewicht und Diabetes. Entsprechend interessiert sich die Grundlagenforschung heute in erster Linie für die durch Schlafmangel hervorgerufenen Auswirkungen auf die wichtigen neuronalen Kontaktstellen zwischen Nervenzellen im Gehirn, die Synapsen. Sie frägt insbesondere nach deren Rolle in der Verfestigung von Gedächtnisinhalten, der emotionalen Steuerung und der Regulation des Appetits.
Gestörter Schlaf belastet aber auch das Herz-Kreislaufsystem (1). Epidemiologische Studien zeigen ein klar erhöhtes Risiko für kardiovaskuläre Krankheiten und Sterblichkeit bei verschiedenen Schlafstörungen (2-5). Andererseits führen kardiovaskuläre Erkrankungen wie Bluthochdruck zu Schlafstörungen, so dass sich ein regelrechter Teufelskreis einstellen kann. Es gibt also einen wechselseitigen Dialog zwischen Hirn und Herz, der durch schlechten Schlaf aus dem Gleichgewicht gebracht wird. Trotz seiner klinischen Bedeutung verstehen wir die physiologischen Grundlagen dieses Dialogs noch ungenügend. In diesem Artikel zeige ich auf, wie Studien an der Maus hier weiterhelfen können. Sie bieten zudem neue Ansätze, die auch auf den Menschen übertragbar sind.
Vom Hirn zum Herz
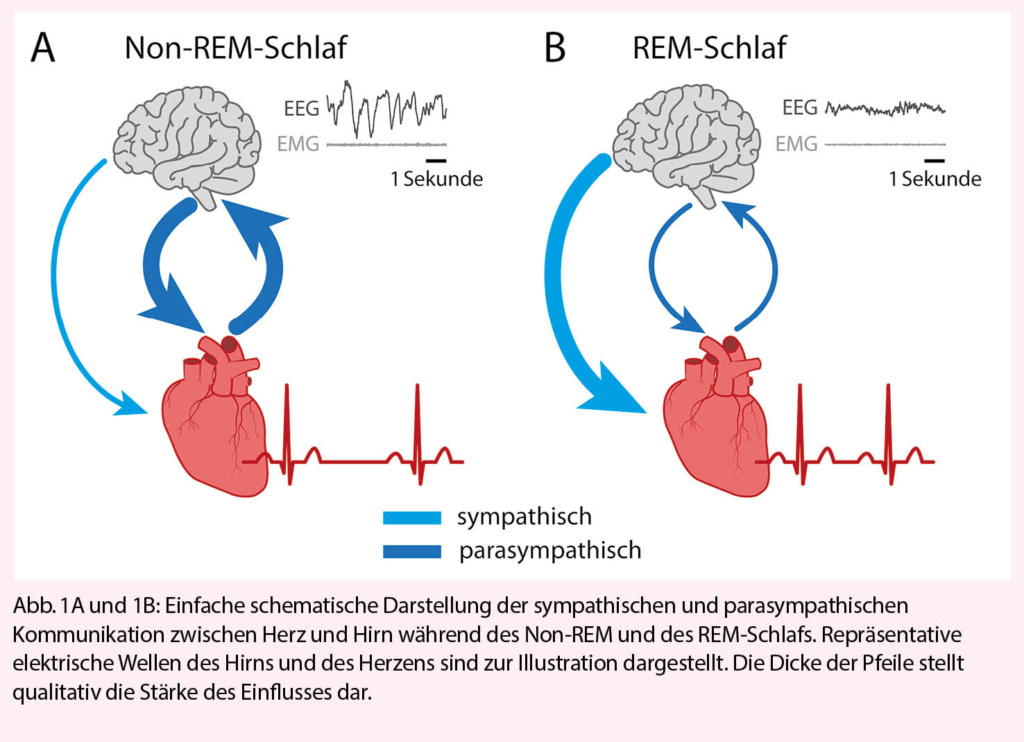
Wenn das Hirn einschläft, «schläft» auch das Herz. Zwar schlägt es weiter, aber die verschiedenen Schlafstadien sind eng an ganz bestimmte Veränderungen der kardiovaskulären Aktivität, wie auch der Funktion anderer Organe, gekoppelt (6). Der Schlaf beginnt mit dem Eintritt in den sogenannten Non-Rapid-Eye-Movement (Non-REM-Schlaf), der etwa 80% der Schlafzeit einnimmt (Abb. 1A). Dabei generiert das Hirn zunehmend langsamere elektrische Wellen, die dafür sorgen, dass wir das Bewusstsein verlieren und uns von den sensorischen Reizen der Umwelt entkoppeln, um uns zu erholen und Gedächtnisinhalte zu konsolidieren. Nun senkt sich die Herzfrequenz um bis zu 10 Schläge pro Minute unter den Ruhepuls, die Gefässe erweitern sich, der arterielle Blutdruck erniedrigt sich um mindestens 10-15% gegenüber dem Wachzustand. Für diese Veränderungen massgeblich ist eine Verringerung der sympathischen Aktivität des autonomen Nervensystems (7), so dass der Einfluss des parasympathischen Nervensystems überhandnimmt. Beim Menschen lässt sich dies sehr schön an der veränderten Variabilität der Herzfrequenz erkennen, da die verschiedenen Frequenzkomponenten das Gleichgewicht zwischen der parasympathischen und sympathischen Aktivität widerspiegeln (8). In der tiefsten sogenannten N3-Phase des Non-REM Schlafes befindet sich das Herz fast ausschliesslich unter parasympathischer Kontrolle. Aus Tierversuchen zeigt sich, dass schlafregulatorische Zentren im Hypothalamus die autonome Kontrolle des Herzens direkt modifizieren, zum Beispiel indem sie hemmende Synapsen an prämotorischen sympatho-exzitatorischen Zellen des Hypothalamus und des Hirnstamms aktivieren (9). Durch synaptische modulatorische Mechanismen könnte sich auch die Empfindlichkeit der autonomen Reflexbögen, wie beispielsweise diejenige des Barorezeptor-Reflexes und der Kopplung von Atmung an Herzrate, zumindest zu Beginn der Nacht erhöhen (8, 9).
Beim Eintritt vom Non-REM- in den REM-Schlaf, auch paradoxaler Schlaf genannt, erhöhen sich dagegen Herzfrequenz und Blutdruck wieder, die sympathische Aktivität steigt an (7) (Abb. 1B). Die Situation erinnert auf den ersten Blick an diejenige des Wachzustandes, der Organismus schläft jedoch weiter (8). Der REM-Schlaf ist bekanntlich traumreich und für die Verarbeitung emotionaler Erlebnisse zuständig. Bildgebende Verfahren zeigen eine gesteigerte Aktivität von Hirnarealen wie der Amygdala und des Frontalkortex während des REM-Schlafs, die an der Entstehung von Furcht und Emotionen beteiligt sind und die sympathische Aktivität steigern (10).
Insgesamt ist die autonome Kontrolle des Herzens im Non-REM-Schlaf gezeichnet durch eine verstärkte Verschaltung an den autonomen Reflexbögen, wohingegen im REM-Schlaf subkortikale und kortikale Hirnareale modifizierend eingreifen (10).
Die Bedeutung des Schlafes für die Gesundheit des kardiovaskulären Systems kann nicht hoch genug eingestuft werden. Das sogenannte «Dipping» (das Abtauchen) der Herzrate und des Blutdrucks während des Non-REM-Schlafs gilt als Bewährungstest für eine gesunde autonome Herzkontrolle. Geschwächtes Dipping wird mit fortschreitendem Alter, Bluthochdruck, Stress und Depression verbunden und gilt, im Falle von Bluthochdruck, als ernstzunehmendes Risiko für Herzerkrankungen, Atherosklerose und erhöhte Sterblichkeit (11). Der Schlaf selber fördert auch die kardiovaskuläre Gesundheit. Häufiges Aufwachen während der Nacht sollte nicht nur als zwar quälend aber im Grunde harmlos abgetan werden. Auch wenn unter Umständen die Schlafdauer kaum verkürzt ist, kann häufiges Aufwachen vorübergehend Blutdruck und Herzrate erhöhen, und die wiederholte Aktivierung des Sympathikus unterbricht die wichtigen Phasen des Dipping. Besonders ausgeprägt sind diese Zusammenhänge bei der obstruktiven Schlaf-Apnoe, bei der die Atmung während des Schlafes unterbrochen wird (12). Dadurch erniedrigt sich der Sauerstoffgehalt des Blutes, was der Körper durch erhöhten Blutdruck und Herzrate zu kompensieren versucht. Dies fördert das Aufwachen und die Ausschüttung von Stresshormonen, was langfristig zu Bluthochdruck führen kann. Etwa 50% aller Patienten mit obstruktiver Schlaf-Apnoe haben Bluthochdruck und sind damit gefährdet, mögliche Folgeerkrankungen wie Herzinfarkt oder Schlaganfall zu erleiden. Schlafapnoe gehört heute zu den etablierten unabhängigen Risikofaktoren für kardiovaskuläre Erkrankungen.
Vom Herz zum Hirn
Schlafstörungen können nicht nur ursächlich zu Folgeerkrankungen des Herzens führen, sondern umgekehrt auch aus Herzerkrankungen hervorgehen. Sie entstehen zum Beispiel aufgrund Sauerstoffmangel und erhöhter Kohlendioxidwerte, die bei Herzschwäche entstehen können, und die über mehrere, peripher und zentral liegende, chemosensorische Signalwege zu einer Aktivierung von Kernen des Hirnstamms wie dem parabrachialen und dem darin liegenden Kölliker-Fuse-Nukleus führen (13). Diese rufen über ihre Projektionen zu Wachzentren des Hirns eine Weckreaktion hervor, um die Leistung des Herzens zu erhöhen und die Atemmuskulatur anzuregen. Die Wahrnehmung der eigenen Herzrate scheint bei Insomniepatienten erhöht (14) und korreliert mit dem Auftreten von Alpträumen im REM-Schlaf (15). Dies illustriert, wie stark die kardiovaskuläre Aktivität das Schlafverhalten beeinflusst. Noch ist aber wenig über viele der dazugehörigen neuronalen Wege bekannt. Anatomische Studien zeigen, dass die Eingangsstelle für vagale sensorische Afferenzen, der Nucleus tractus solitarius, breitgefächerte Projektionen in wichtige Wach-Kontrollzentren des Hirnstamms schickt (16). Erstaunlicherweise zeichnet es sich auch ab, dass die im Schlaf empfangenen autonomen Signale nicht nur für die Schlafstabilität sondern auch für Schlaffunktionen mitbestimmend sind. Es gibt zum Beispiel eine zeitliche Kopplung des Herzschlags an die für gesunden Schlaf wichtigen langsamen elektrischen Wellen (17). Die Behandlung von Schlafapnoe mit der «Continuous-positive-airway-pressure»-Methode verbessert diese Kopplung (18). Es gibt sogar Zusammenhänge zwischen der Dominanz der parasympathischen Aktivität auf das Herz während des Schlafes und der Fähigkeit, Gedächtnisinhalte am Morgen abzurufen (19).
Der ultralangsame, 50-Sekunden-Dialog zwischen Herz und Hirn
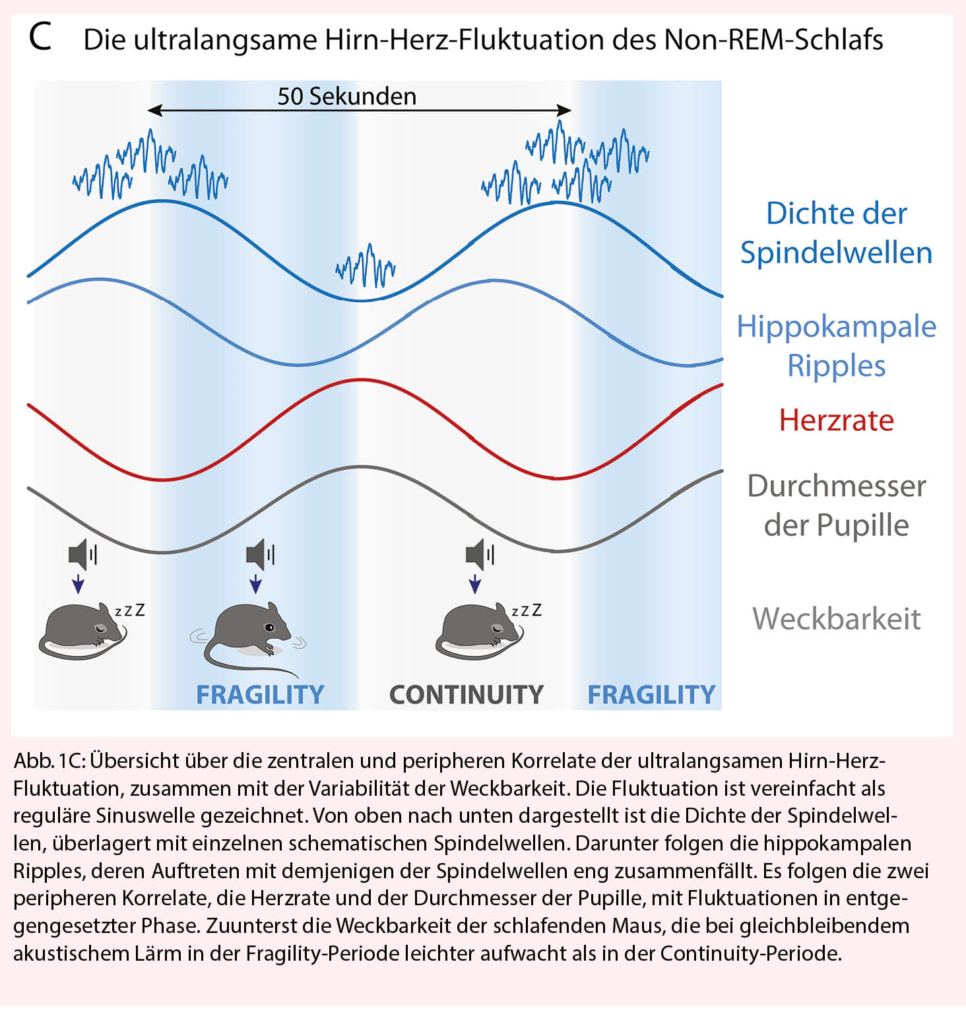
Der Dialog zwischen Hirn und Herz ist zwar je nach Schlafzustand strikt geregelt, er ist jedoch nicht statisch. Wir beobachteten, dass Mäuse auch im konsolidierten (über die Zeit stabilen) Non-REM-Schlaf mal leichter und mal weniger leicht aufwachten, wenn sie kurzem Lärm ausgesetzt wurden (20). Bei genauerer Analyse zeigte es sich, dass diese variable Weckbarkeit sich auf einer periodischen Zeitskala von einer knappen Minute (ca. 50 Sekunden) wiederholte (Abb. 1C). Auf der gleichen Zeitskala veränderte sich im Schlaf-Elektroenzephalogramm das Auftreten wichtiger Hirnwellen, wie der Schlafspindeln und der hippokampalen Ripple-Events. Erstere sind für ihre Rolle in der Abkopplung des schlafenden Hirns von sensorischen Reizen aus der Umgebung bekannt, und gemeinsam mit letzteren sind sie für die Verarbeitung von Gedächtnisspuren wichtig. Beide Wellen zeigten sich vermehrt während der vor Lärm geschützten «Continuity»-phase, und sie waren in der durch erhöhte Aufwachtendenz charakterisierten «Fragility»-Phase verringert. Auf der gleichen 50-Sekunden-Zeitskala veränderte sich auch die Herzrate – sie war erhöht während der Fragility-Phase. Eine andere Studie fand, dass sich der Durchmesser der Pupillen auf derselben Zeitskale veränderte (21). Insgesamt ergibt sich damit das Bild einer Koordination von Hirn- und Herzaktivität im Minutentakt, die mit der geordneten Abwicklung eines wichtigen Verhaltensmerkmals des Schlafs koordiniert ist – der Weckbarkeit. Die Herzrate erhöht sich in jeder Fragility-Periode leicht und nimmt so ein mögliches Aufwachereignis vorweg. In Zusammenarbeit mit Professor Jan Born von der Universität Tübingen haben wir analoge Schwankungen beim Schlaf des Menschen nachweisen können und gefunden, dass diese während der leichten N2-Schlafphase besonders ausgeprägt sind. Unsere neusten Resultate weisen darauf hin, dass diese Schwankungen zentral gesteuert und über parasympathische Mechanismen geregelt werden. Dies würde darauf hinweisen, dass zentrale Mechanismen, die die Weckbarkeit regulieren, auch in die parasympathische Kontrolle des Herzens eingreifen. Als Favorit bietet sich hier der noradrenerge Hirnstammkern des Locus Coeruleus an. Der Locus Coeruleus ist hochaktiv während des Wachzustandes und vermittelt Phasen angespannter Aufmerksamkeit, Stress und Panik im Hirn, wobei er zugleich über das autonome Nervensystem Herzschlag und Blutdruck hochtreibt und die Pupillen erweitert. Interessanterweise bleiben zumindest einige Zellgruppen während des Non-REM-Schlafes phasisch aktiv und regulieren über Synapsen ins Vorderhirn die Aktivität von Spindelwellen (22, 23). Der Locus Coeruleus ist also als Verbindungsglied zwischen kortikalen Schlafrhythmen und der Herzaktivität während des Schlafes prädestiniert. Mit den heutigen genetischen und optogenetischen Methoden in der Maus lassen sich diese, wie auch andere Hypothesen zu den neuronalen Mechanismen, jetzt direkt testen. Langfristig werden solche Studien Fragen, wie individuelle und altersabhängige Eigenschaften des Locus Coeruleus die Herzratenvariabilität und die Schlafqualität beim Menschen beeinflussen, anregen.
Klinische Bedeutung des ultralangsamen Dialogs zwischen Herz und Hirn
Phänomenologische Beobachtungen im halben bis knappen Minutentakt beim menschlichen Schlaf sind nicht neu. Das Cyclic Alternating-Pattern (CAP), auch als «unstabiler» Schlaf bekannt, tritt mit einer 20-40 Sekunden-Rhythmik bevorzugt an Übergangsphasen zwischen Non-REM und REM-Schlaf auf und zeigt spektrale Charakteristika eines Aufwachens im EEG, erhöhte Herzrate und Blutdruck, wie auch erhöhte Weckbarkeit (8, 24). Die CAPs zeigen sich gehäuft in Patienten mit schlafbezogenen Atmungs- oder Bewegungsstörungen. Eindrücklich periodisch finden sich Beinbewegungen alle 20-40 Sekunden bei Restless-Leg-Syndrome-Patienten, aber auch bei vielen Normalschläfern (25, 26). Die Cheyne-Stokes-Atmung, die sich bei Herzschwächepatienten einstellen kann, spielt sich ebenfalls auf solchen Zeitskalen ab (27, 28). Dass ultralangsame Zeitintervalle im Schlaf mehr ins Schweinwerferlicht der Forschung geraten, hängt viel mit dem technischen Fortschritt zusammen. Sie werden in konventionellen EEG-Messungen wegen Hochpassfiltern nicht erfasst, sondern benötigen die technisch schwierigere direct-current-coupled-EEG-Methode (29). Da lässt sich eine ultralangsame Periodik erkennen, die als übergeordnetes Signal das Auftreten mehrerer Schlafwellen wie der Delta-Wellen im gesunden Probanden steuert. Auch das Auftreten von interiktalen epileptiformen Ereignissen im schlafenden Epilepsie-Patienten kann über solche Zeitspannen moduliert werden. Funktionelle Magnetresonanzmessungen weisen auf ultralangsame Fluktuationen in der koordinierten hämodynamischen Aktivierung von subkortikalen und kortikalen Hirnstrukturen, den sogenannten Resting-State-Networks, hin (30). Noch besteht aber Unklarheit darüber, inwiefern diese die Aufweckbarkeit beeinflussen.
Wie und ob die 50-Sekunden-Fluktuation in der Maus und im Menschen mit CAPs und hämodynamischen Aktivitäten im Schlaf zusammenhängen, ist gegenwärtig Gegenstand mehrerer Forschungsgruppen im In- und Ausland. Die Studien an der Maus, bei der wir erstmals variables Aufwachverhalten als natürlichen Teil des Non-REM-Schlafs dokumentiert und mit zentralen und peripheren Parametern quantifiziert haben, hat diesen Fragestellungen neuen Auftrieb gegeben. Die Ursachen und Mechanismen für schlafbezogene Atmungs- und Bewegungsstörungen werden jetzt im Zusammenhang mit einer neuen Dynamik des Non-REM-Schlafs gesehen. Interesse besteht an der erweiterten Rolle von wachaktiven Hirnstrukturen wie dem Locus Coeruleus für den Schlaf. Einblick in ihre elektrische Aktivität und synaptischen Projektionen eröffnen Perspektiven, die Rolle von Stress und Emotionen während des Tages auf Schlafstörungen neu zu gewichten und neue verhaltenstherapeutische und pharmakologische Ansätze für die Kontrolle des Dialogs zwischen Hirn und Herz im Schlaf anzudenken.
Danksagungen: Ich danke Frau Dr. Laura M.J. Fernandez, Senior Scientist in meiner Arbeitsgruppe an der Universität Lausanne, für die gestalterische Mitarbeit an der Abbildung 1. Für Anregungen und wertvolle Literaturhinweise danke ich Frau Dr. Stephany Fulda, Sleep & Epilepsy Center, Neurocenter of Southern Switzerland, Civic Hospital (EOC), Lugano, Schweiz. Frau cand. med. Selina Steiger, Universität Zürich danke ich herzlich für das Korrekturlesen.
Copyright bei Aerzteverlag medinfo AG
Associate Professor
Department für Fundamentale Neurowissenschaften (DNF)
Universität Lausanne
Rue du Bugnon 9
1005 Lausanne
anita.luthi@unil.ch
Die Autorin hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert. Danksagungen:
- Der Schlaf steuert die autonome Kontrolle des Herzens. Die parasympathische Kontrolle dominiert die Phases des Non-REM-Schlafs,
daraus resultiert ein «Dipping» von Herzrate und Blutdruck, welche ein Mass für die kardiovaskuläre Gesundheit darstellt. - Der Dialog zwischen Hirn und Herz ist wechselseitig – nicht nur greift das Hirn in die autonome Kontrolle des Herzens ein, sondern das Herz sendet Rückmeldungen über vagale Afferenzen, die die Aktivität von Wach-Kontrollzentren des Hirnstamms mitregulieren.
- Dieser wechselseitige Dialog steht vielseitigen Ursachen von Schlafstörungen zugrunde, von denen einige verheerende Auswirkungen auf die kardiovaskuläre Gesundheit haben können.
- Tierversuche weisen auf ein dynamisches Wechselspiel zwischen Hirn und Herz im knappen Minutentakt hin, welches die Weckbarkeit steuert und in Verbindung mit weitverbreiteten Schlafstörungen wie der Schlaf-Apnoe oder dem Restless-Leg-Syndrom gebracht werden kann.
Messages à retenir
- Le sommeil modifie le contrôle autonome du cœur. La voie parasympathique domine les phases du sommeil non-REM. Il en résulte un «Dipping» de la fréquence cardiaque et de la pression sanguine qui est une mesure pour la santé cardiovasculaire.
- Le dialogue entre cerveau et cœur est réciproque – le cerveau interfère dans le contrôle autonome du cœur, et le cœur envoie des messages à travers des afférences vagales qui régulent l’activité des centres d’éveil dans le tronc cérébral.
- Ce dialogue réciproque peut être à l’origine de troubles du sommeil dont certains ont des effets délétères sur la santé cardiovasculaire.
- Des expérimentations animales ont révélé l’existence d’un dialogue sur un intervalle d’un peu moins d’une minute. Celui-ci est mis en relation avec des troubles de sommeil répandus tels que les apnées du sommeil ou le syndrome des jambes sans repos.
1. Tobaldini, E., et al., Short sleep duration and cardiometabolic risk: from pathophysiology to clinical evidence. Nat Rev Cardiol, 2019; 16:213-24.
2. Sofi, F., et al., Insomnia and risk of cardiovascular disease: a meta-analysis. Eur J Prev Cardiol, 2014; 21:57-64.
3. Yin, J., et al., Relationship of Sleep Duration With All-Cause Mortality and Cardiovascular Events: A Systematic Review and Dose-Response Meta-Analysis of Prospective Cohort Studies. J Am Heart Assoc, 2017; 6:e005947
4. Hsu, C.Y., et al., The Association Between Insomnia and Increased Future Cardiovascular Events: A Nationwide Population-Based Study. Psychosom Med, 2015; 77:743-51.
5. Fan, M., et al., Sleep patterns, genetic susceptibility, and incident cardiovascular disease: a prospective study of 385 292 UK biobank participants. Eur Heart J, 2020; 41:1182-89.
6. Trinder, J., et al., Sleep and cardiovascular regulation. Pflügers Arch, 2012; 463:161-8.
7. Somers, V.K., et al., Sympathetic-nerve activity during sleep in normal subjects. N Engl J Med, 1993; 328:303-7.
8. Tobaldini, E., et al., Heart rate variability in normal and pathological sleep. Front Physiol, 2013; 4:294.
9. Silvani, A. and R.A. Dampney, Central control of cardiovascular function during sleep. Am J Physiol Heart Circ Physiol, 2013; 305:H1683-92.
10. Chouchou, L. and M. Desseilles, Heart rate variability: a tool to explore the sleeping brain? Front Neurosci, 2014; 8:402.
11. Silvani, A., Sleep disorders, nocturnal blood pressure, and cardiovascular risk: A translational perspective. Auton Neurosci, 2019; 218:31-42.
12. Venkataraman, S., et al., Sleep Apnea, Hypertension and the Sympathetic Nervous System in the Adult Population. J Clin Med, 2020; 9:591
13. Saper, C.B. and S. Kaur, Brain Circuitry for Arousal from Apnea. Cold Spring Harb Symp Quant Biol, 2018; 83:63-9.
14. Wei, Y., et al., I Keep a Close Watch on This Heart of Mine: Increased Interoception in Insomnia. Sleep, 2016; 39:2113-24.
15. Perogamvros, L., et al., Increased heartbeat-evoked potential during REM sleep in nightmare disorder. Neuroimage Clin, 2019; 22:101701.
16. Han, W., et al., A Neural Circuit for Gut-Induced Reward. Cell, 2018; 175:887-8.
17. Naji, M., et al., Timing between Cortical Slow Oscillations and Heart Rate Bursts during Sleep Predicts Temporal Processing Speed, but Not Offline Consolidation. J Cogn Neurosci, 2019; 31:1484-90.
18. Jurysta, F., et al., Long-term CPAP treatment partially improves the link between cardiac vagal influence and delta sleep. BMC Pulm Med, 2013; 13:29.
19. Whitehurst, L.N., et al., New directions in sleep and memory research: the role of autonomic activity. Curr Opin Behav Sci, 2020; 33:17-24.
20. Lecci, S., et al., Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci. Adv., 2017; 3:e1602026.
21. Yüzgeç, O., et al., Pupil size coupling to cortical states protects the stability of deep sleep via parasympathetic modulation. Curr Biol, 2018; 28:392-400.e3.
22. Aston-Jones, G. and F.E. Bloom, Activity of norepinephrine-containing locus coeruleus neurons in behaving rats anticipates fluctuations in the sleep-waking cycle. J Neurosci, 1981; 1:876-86.
23. Swift, K.M., et al., Abnormal Locus Coeruleus Sleep Activity Alters Sleep Signatures of Memory Consolidation and Impairs Place Cell Stability and Spatial Memory. Curr Biol, 2018; 28:3599-609.e4.
24. Parrino, L., et al., CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev, 2006; 10:267-85.
25. Ferri, R., et al., Periodic leg movements during sleep: phenotype, neurophysiology, and clinical significance. Sleep Med, 2017; 31:29-38.
26. Haba-Rubio, J., et al., Prevalence and determinants of periodic limb movements in the general population. Ann Neurol, 2016; 79:464-74.
27. Flinta, I. and P. Ponikowski, Relationship between central sleep apnea and Cheyne-Stokes Respiration. Int J Cardiol, 2016; 206 Suppl:S8-12.
28. Manconi, M., et al., Periodic leg movements in Cheyne-Stokes respiration. Eur Respir J, 2008; 32:1656-62.
29. Vanhatalo, S., et al., Infraslow oscillations modulate excitability and interictal epileptic activity in the human cortex during sleep. Proc Natl Acad Sci U S A, 2004; 101:5053-7.
30. Fox, M.D. and M.E. Raichle, Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging. Nat Rev Neurosci, 2007; 8:700-11.
info@herz+gefäss
- Vol. 10
- Ausgabe 5
- Oktober 2020