- Kardiale Folgen der akuten Lungenembolie
Die akute Lungenembolie gehört zu den häufigsten kardiovaskulären Erkrankungen. Je nach Ausprägung und Ausmass der embolisierten Partikel ist vor allem die frühe klinische Phase von einer akuten Rechtsherzbelastung dominiert, welche bis zum Rechtsherzversagen und kardiogenem Schock führen kann. Aktuelle Behandlungsstrategien umfassen daher neben medikamentösen Ansätzen auch interventionelle oder operative Massnahmen, um vor allem die Nachlasterhöhung für den rechten Ventrikel zu minimieren.
L’ embolie pulmonaire aiguë est l’ une des maladies cardiovasculaires les plus courantes. En fonction de la gravité et de l’ étendue des particules embolisées, la phase clinique précoce en particulier est dominée par un stress aigu du cœur droit, qui peut entraîner une insuffisance cardiaque droite et un choc cardiogénique. Par conséquent, les stratégies de traitement actuelles comprennent non seulement des approches médicamenteuses mais aussi des mesures interventionnelles ou chirurgicales, notamment pour minimiser l’ augmentation de la post-charge ventriculaire droite.
Die akute Lungenembolie (LE) gehört mit einer jährlichen Inzidenz von 39-115/100 000 Personen und einer Sterblichkeit von bis zu 30% zu den relevantesten Notfällen in der kardiovaskulären Medizin (1, 2). Die hohe Mortalität ist dabei vor allem auf eine akute Belastung des rechten Ventrikels (RV) und einer damit verbundenen Verminderung der RV Funktion zurückzuführen (3). Das umfangreiche Verständnis der Pathophysiologie der akuten Lungenembolie und der sekundären rechtsventrikulären Herzinsuffizienz ist daher unumgänglich, um ein rasches und zielgerichtetes Patientenmanagement gewährleisten zu können.
Akute kardiale Folgen der Lungenembolie
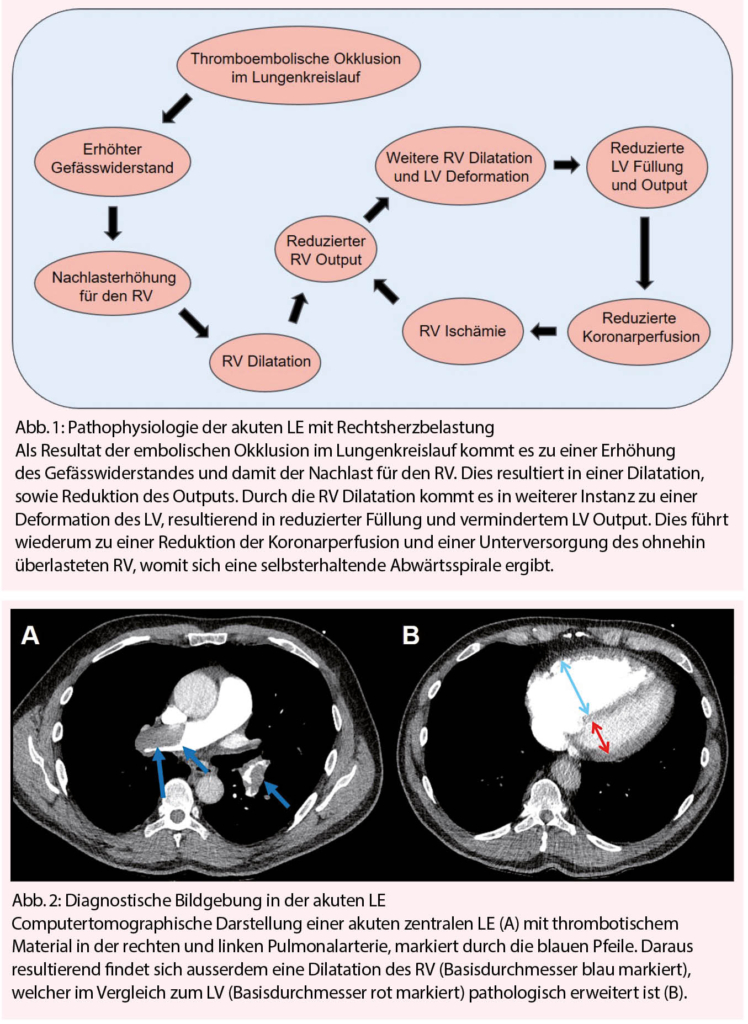
Der Lungenkreislauf ist im Gegensatz zum systemischen Kreislauf ein Niederdrucksystem welcher auch auf grosse Veränderungen des Herzminutenvolumens mit nur minimalen Druckveränderungen reagiert. Der gravierende Unterschied zwischen den beiden Kreisläufen wird vor allem unter körperlicher Belastung deutlich – während der linke Ventrikel auf starke körperliche Belastungen mit einem Anstieg des systemischen Blutdrucks reagiert, kompensiert der rechte Ventrikel den Anstieg des Herzminutenvolumens durch ein Rekrutieren der unterfüllten Mikrozirkulation der Lunge und der alveolären Kapillaren. Anders als im systemischen Kreislauf jedoch ist in der pulmonalen Zirkulation der vaskuläre Widerstand gering und benötigt somit keinen relevanten kompensatorischen Anstieg des Blutdrucks. Entsprechend den daraus resultierenden Anforderungen ist es nicht verwunderlich, dass relevante anatomische Unterschiede zwischen RV und LV bestehen. Der RV ist dünnwandig (enddiastolisch 3-5 mm), muskelschwach und als Halbmondsichel an den muskelstarken (enddiastolisch 6-10mm), als Hohlorgan konstruierten LV aufgelagert (4). Durch die Konfiguration des RV ist die Funktion von der Vorlast und einer entsprechenden Dehnbarkeit des Myokards abhängig. Es können so zwar grosse Blutvolumina verarbeitet werden, das Schlagvolumen gegen einen erhöhten Widerstand ist jedoch stark eingeschränkt. In der Akutphase einer Lungenembolie resultiert die embolische Verlegung der Lungenstrombahn in einem abrupten Anstieg des pulmonalen Widerstandes. Durch diese plötzliche Erhöhung der Nachlast kommt es zu einer Dilatation des RV und einer Abnahme der Kontraktilität. Der dilatierte RV führt durch eine Druckverschiebung des interventrikulären Septums zu einer verminderten Füllung des LV («D-Shape» des LV Cavums). Zudem kommt es zu einer Erweiterung des Trikuspidalklappen-Annulus mit einer daraus resultierenden Trikuspidalklappeninsuffizienz, welche den Vorwärtsfluss zusätzlich negativ beeinflusst und das Herzminutenvolumens weiter reduziert (4). Durch die vermehrte Wandspannung des dilatierten RV und die Reduktion des Herzminutenvolumens resultiert eine verminderte Koronarperfusion und kardiale Ischämie (5), die diese Abwärtsspirale weitergehend unterhält (Abb. 1). Die durch die Embolie ausgelöste Hypoxie im Lungengewebe führt durch die Freisetzung von Serotonin und Thromboxan A2 zu einer Vasokonstriktion der Kapazitätsgefässe der Lunge mit einer weiteren Erhöhung des Gefässwiderstandes (6). Eine Okklusion von 25-30% des pulmonalen Gefässbettes resultiert bereits in einer Erhöhung des pulmonal-arteriellen Druckes (7). Ungefähr die Hälfte aller LE Patienten haben Zeichen einer Rechtsherzbelastung, die man meist bei einer Gefässobstruktion von 50-70% vorfindet (8). Eine beginnende Rechtsherzinsuffizienz stellt einen entscheidenden Faktor in der Risikostratifizierung, Therapiestrategie und Prognose der akuten LE dar (9).
Diagnostik und Risikostratifizierung
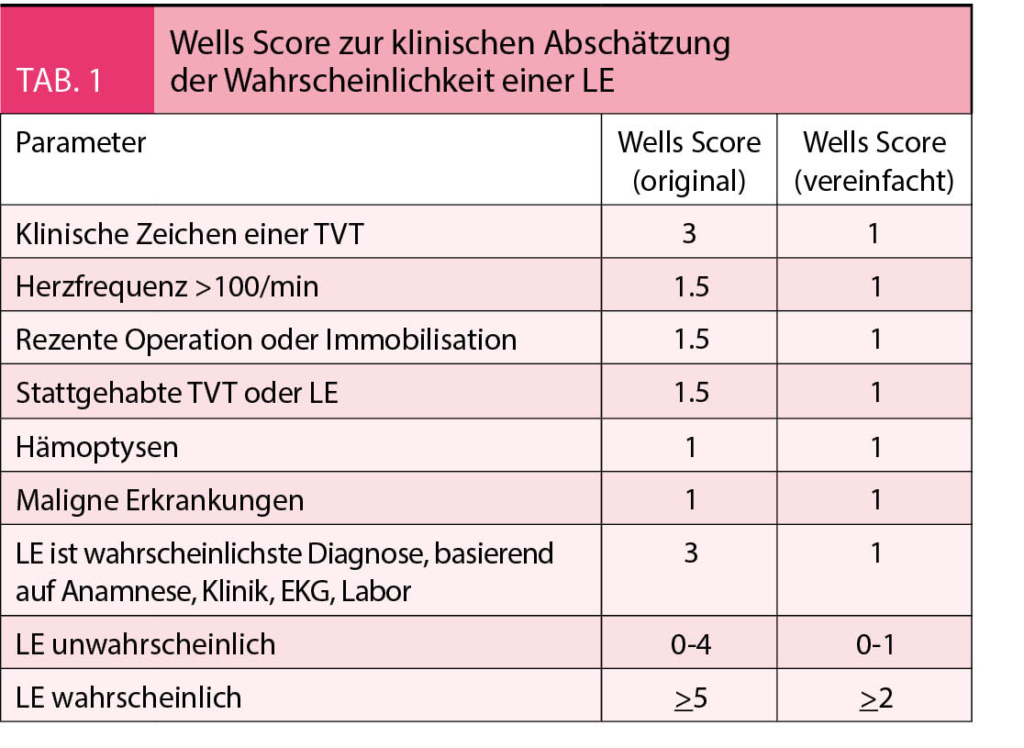
Das klinische Erscheinungsbild einer LE ist sehr variabel und betroffene Patienten werden mit unterschiedlicher Ausprägung von Dyspnoe, Thoraxschmerzen, synkopalen Zuständen, Husten oder Hämoptysen im Notfallzentrum vorstellig. Aufgrund der Vielfalt der Symptome eignet sich zur klinischen Abschätzung der Wahrscheinlichkeit einer Lungenembolie der Wells-Score (9) (Tab. 1), welcher in Verbindung mit einer D-Dimer Bestimmung im Blut eine hohe Vortestwahrscheinlichkeit für die LE ermöglicht. Weitere klinische Hinweise ergeben sich oft aus bestehender Hypoxie, Hypokapnie, abnormem Thoraxröntgen, sowie typischen EKG-Veränderungen mit Zeichen der Rechtsherzbelastung (inkompletter oder kompletter Rechtsschenkelblock, SI-QIII Typ, T-Negativierung über den Brustwandableitungen) (9).
Der Goldstandard zur Diagnosesicherung einer LE ist die CT-Pulmonalisangiographie, welche neben der Diagnosesicherung auch noch eine Risikostratifizierung durch indirekte Zeichen der Rechtsherzbelastung (RV Dilatation mit einer RV/LV ratio > 0.9) zulässt (10). (Abb. 2) Die transthorakale Echokardiographie (TTE) hat ihren Stellenwert vor allem bei hämodynamisch instabilen Patienten, und ermöglicht neben einem raschen Ausschluss der wichtigsten kardialen Differentialdiagnosen, wie LV Dysfunktion, relevanten Klappenvitien, einem Perikarderguss auch die Beurteilung einer möglichen RV-Druckbelastung, RV Dilatation oder Dysfunktion als Folge der LE (11).
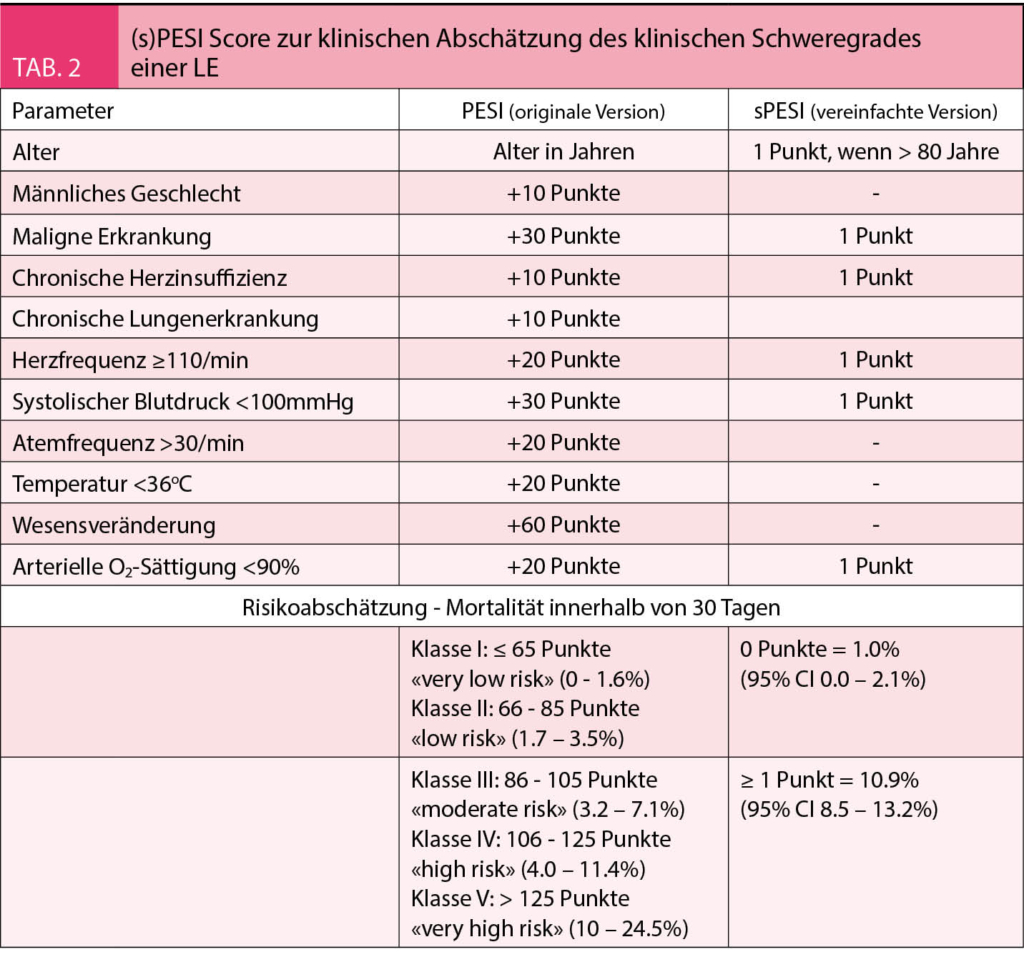
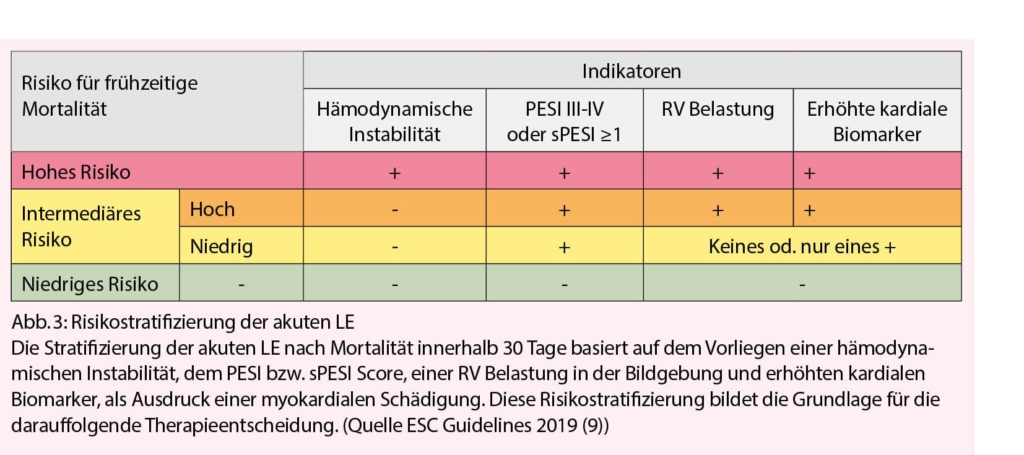
Die Europäische Gesellschaft für Kardiologie (ESC) hat erst im letzten Jahr die Richtlinien zur Diagnostik und Therapie der akuten Lungenembolie revidiert (9). Unverändert zur Vorversion wird auch im 2019 Update die akute LE entsprechend dem prognostizierten frühen Mortalitätsrisiko anhand eines Ampelsystems stratifiziert. Je nach hämodynamischer Relevanz, klinischem Schweregrad, bildgebendem Befund einer Rechtsherzbelastung oder kardialer Ischämie wird die klinische Akutsituation der LE in ein niederes, intermediäres oder hohes Risiko unterteilt. Der klinische Schweregrad wird dabei anhand eines validierten Risiko-Scores («Pulmonary Embolism Severity Score» (PESI), bzw. dessen vereinfachte Version (sPESI)) klassifiziert (12, 13) (Tab. 2). Die schematische Darstellung der ESC Empfehlung für die Stratifizierung von LE Patienten nach ihrem Risiko ist in Abb. 3 dargestellt.
Therapie der akuten Lungenembolie
Das Akutmanagement der Lungenembolie beinhaltet neben unterstützenden Massnahmen wie Sauerstoffgabe, milder Volumengabe und Flüssigkeitsmanagement, dem Einsatz von kreislaufunterstützenden Medikamenten und vereinzelt Bronchodilatatoren oder Antibiotika, auch therapeutische Schritte zur Reperfusion der Lungenstrombahn. Die supportive Gabe von O2 bei einer peripheren O2-Sättigung <90% verringert bereits früh eine durch Hypoxie verursachte pulmonale Vasokonstriktion und somit eine weitere Nachlasterhöhung. Eine assistierte oder mechanische Beatmung sollte so lange wie möglich hinausgezögert und nur bei respiratorischer Erschöpfung des Patienten in Erwägung gezogen werden (14, 15). In der Tat kann die Verringerung der Vorlast während der medikamentösen Narkoseeinleitung (16), oder die Erhöhung der Nachlast durch hypoxische Phasen während der orotrachealen Intubation oder durch hohe Tidalvolumina und positivem end-exspiratorischen Druck während der maschinellen Ventilation zu einer Verschlechterung der Hämodynamik führen.
Ein hämodynamischer Einbruch bei akuter LE ist zumeist durch eine abrupte Rechtsherzbelastung mit RV Dilatation und -insuffizienz bedingt. In dieser Situation kann ein langsames Anheben der Vorlast durch vorsichtige Volumen-Bolusgaben zu einer stimulierenden Dehnung des RV führen mit kompensatorischem Anstieg der Kontraktilität und des Herzminutenvolumens. Grosse und rasche Infusionsmengen jedoch können zu einer weiteren Dekompensation des RV in das klinische Bild des manifesten kardiogenen Schocks führen. In dieser Situation ist die kontinuierliche Infusion vasoaktiver Substanzen (Dobutamin, Noradrenalin) notwendig, um einen entsprechenden Kreislauf und Perfusion aufrecht zu erhalten.
Das Ausmass der Akuttherapie der LE richtet sich nach dem Schweregrad und der klinischen Präsentation der Patienten und ist bereits während der diagnostischen Phase indiziert. Eine Antikoagulation wird dabei bereits bei klinischem Verdacht auf eine LE und nach sorgfältiger Berücksichtigung des individuellen Blutungsrisikos initiiert bis weitere Testresultate zur Verfügung stehen. Unfraktioniertes oder niedermolekulares Heparin in gewichtsadaptierter Dosierung wird speziell dann eingesetzt, wenn aufgrund der klinischen Risikokonstellation eine Reperfusionstherapie noch nicht ausgeschlossen ist. Bei LE Patienten mit niedrigem Risiko kann direkt mit einer oralen Therapie begonnen werden. In dieser Situation, wie auch in der weiterführenden Antikoagulation nach stattgehabter LE sind die neuen oder direkten oralen Antikoagulantien (NOAKs) (Apixaban, Rivaroxaban, Dabigatran und Edoxaban) die Therapie der Wahl (9).
Bei Patienten mit massiver bzw. fulminanter Lungenembolie und hämodynamischer Instabilität oder therapierefraktärem kardiogenen Schock sollte eine systemische thrombolytische Therapie, zur raschen Auflösung des embolischen Materials und zügiger Entlastung des RV, in Betracht gezogen werden. Obwohl die Thrombolyse in dieser gut selektionierten Patientenpopulation mit einem Überlebensvorteil verbunden ist, werden hohe Raten an schweren Blutungskomplikationen und auch ein fehlendes Therapieansprechen mit dieser Therapie in Verbindung gebracht. Zudem ist die Langzeit-Überlegenheit der systemischen Thrombolyse im Hinblick auf funktionales Outcome und Entwicklung einer CTEPH aktuell nicht gesichert. Alternative Methoden der LE Behandlung umfassen minimal-invasive, katheter-gestützte Lyse- oder Embolusextraktionstherapien wie auch die chirurgische Embolektomie (9), welche lediglich in erfahrenen Lungenemboliezentren durchgeführt werden.
Chronische kardiale Folgen − Chronisch Thrombo-Embolische Pulmonale Hypertonie (CTEPH)
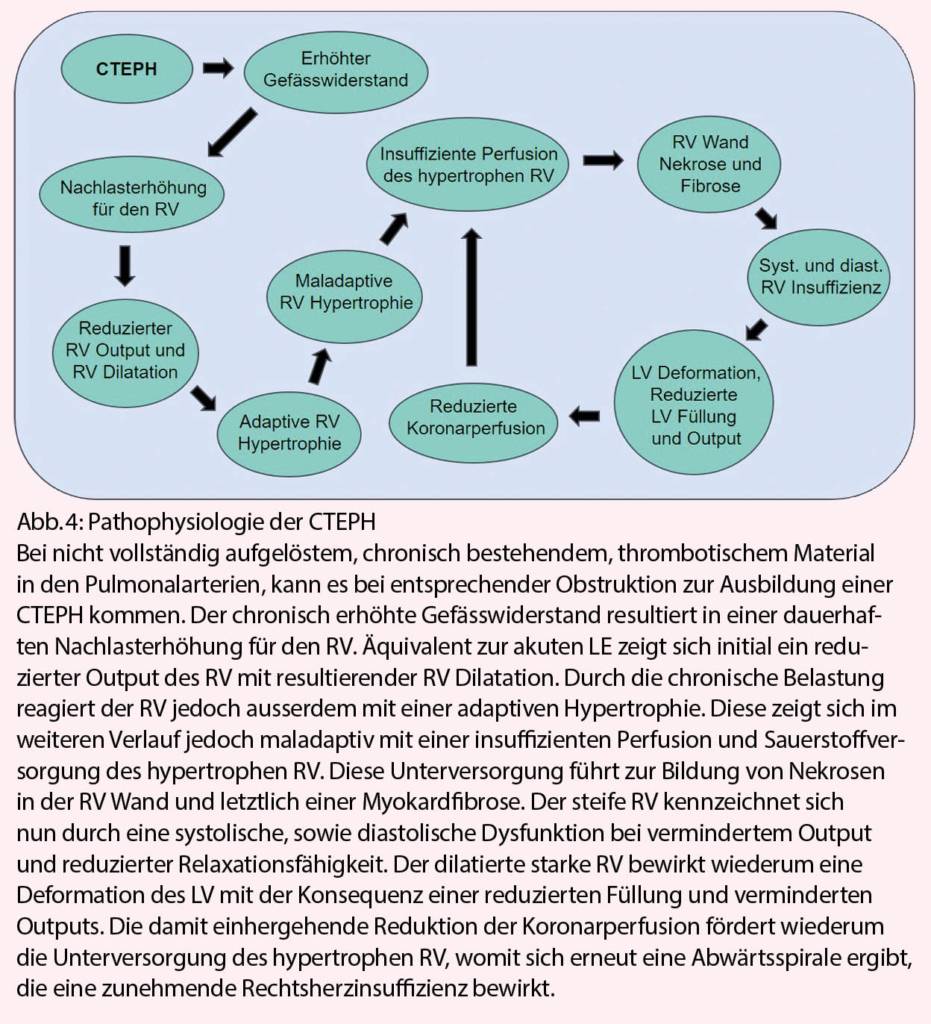
In 3-4% aller LE Patienten führen unzureichend aufgelöste und verbleibende Lungenembolien zu einer chronischen Belastung des RV (17). Durch entzündliche Prozesse vernarben die verbleibenden Emboliepartikel und verursachen durch den obstruktiven Charakter eine dauerhafte RV-Nachlasterhöhung (18). Daneben kommt es durch die chronische Drucksteigerung im Lungenkreislauf zu mikrovaskulären Läsionen und einem Gefässremodelling in den verbleibenden nicht-okkludierten Anteilen der Lunge mit einem weiteren Anstieg des pulmonal-vaskulären Widerstands. Der RV reagiert auf die chronisch erhöhte Nachlast mit einer adaptiven Hypertrophie, um den erhöhten Widerstand durch eine verbesserte Pumpleistung und einen erhöhten Blutdruck kompensieren zu können. Die Zunahme der RV Muskeldicke führt dabei zu einem erhöhten Sauerstoffbedarf, der jedoch nur unzureichend gedeckt werden kann – eine chronische Ischämie, zunehmende Fibrosierung und Nekrose des RV Myokards sind die Folge (19, 20). Der RV verliert damit seine Elastizität und Relaxationsfähigkeit (21), und es entwickelt sich im späteren Krankheitsverlauf eine klinisch relevante Rechtsherzinsuffizienz, die unbehandelt mit einer erhöhten Sterblichkeit verbunden ist. (Abb. 4)
Als Kardinalsymptome der CTEPH wird von betroffenen Patienten eine progrediente Belastungsdyspnoe beschrieben, welche zudem von anhaltender Abgeschlagenheit, Müdigkeit oder auch von Synkopen begleitet werden kann. Bereits frühzeitig und vor Absetzen der oralen Antikoagulation sollte bei verbleibend symptomatischen Patienten die Verdachtsdiagnose einer CTEPH ausgeschlossen werden. Eine transthorakale Echokardiographie und eine Ventilations-/ Perfusions-Szintigraphie liefern die dafür benötigte Information (3). Bei echokardiographischen Zeichen einer RV-Hypertrophie, Trikuspidalinsuffizienz mit hohen Flussgeschwindigkeiten (>3.8 m/s) bzw. hohem systolischen Gradienten (>60mmHg), sollte eine Rechtsherzkatheteruntersuchung mit Pulmonalisangiographie durchgeführt werden. [9] Nach Bestätigung einer CTEPH ist neben einer dauerhaften oralen Antikoagulation auch eine gezielte medikamentöse Behandlung einzuleiten. Riociguat, als Stimulator der löslichen Guanylatcyclase, ist in dieser Situation das Mittel der Wahl. Riociguat wirkt über eine gezielte Stimulation der glatten Muskelzellen der Pulmonalarterien, und führt über eine Ausschüttung von zyklischem Guanosinmonophosphat (cGMP) zu einer pulmonal-vasodilatorischen Wirkung und einer Entlastung des RV. Die operative pulmonale Endarterektomie ist die einzig potentiell kurative Therapie der CTEPH. Dabei wird in einer aufwändigen Operation unter Einsatz der Herz-Lungenmaschine das Narbengewebe innerhalb der Pulmonalarterien manuell herausgeschält. Aufgrund der Komplexität dieser Operationstechnik wird diese nur in sehr selektionierten und erfahrenen Zentren angeboten, kann jedoch dann mit niedrigem Operationsrisiko durchgeführt werden. Patienten mit zentralen Gefässokklusionen und langstreckigen Verschlüssen sollten zur operativen Sanierung vorgestellt werden; periphere Läsionen jedoch sind dieser Operationstechnik nicht zugängig. In dieser Situation und vor allem bei Patienten mit segmentaler und subsegmentaler Pathologie hat sich in den letzten Jahren eine perkutane Behandlungsoption durchgesetzt. Mittels Kathetereingriff werden dabei intraluminale fibrotische Strikturen mittels Ballon aufgedehnt und die Lungensegmente somit der Perfusion wieder freigegeben. Auch für diese Behandlungsoption ist eine langjährige Erfahrung und Spezialisierung notwendig, ist dann jedoch mit reproduzierbar guten Ergebnissen und einer niedrigen Komplikationsrate verbunden (3).
Abkürzungen: CTEPH Chronisch thromboembolische pulmonale Hypertonie, LE Lungenembolie, LV Linker Ventrikel, NOAKs Neue, direkte orale Antikoagulantien, RV Rechter Ventrikel (s)PESI (simplified) Pulmonary Embolism Severity Score, TAPSE tricuspid annular plane systolic excursion
Copyright bei Aerzteverlag medinfo AG
Zentrum für Lungenembolien
Klinik und Poliklinik für Kardiologie
Universitätsspital, Inselspital Bern
Freiburgstrasse 20
3010 Bern
stefan.stortecky@insel.ch
Zentrum für Lungenembolie
Klinik und Poliklinik für Kardiologie
Universitätsspital, Inselspital Bern
Freiburgstrasse 20
3010 Bern
Dr. Stortecky ist der Empfänger von Forschungsgrants an die Institution von Edwards Lifesciences, Medtronic, Abbott Vascular und Boston Scientific; er ist ein Berater für BTG und Teleflex und hat Honorare für Vorträge von BTG und Boston Scientific erhalten. Dr. Draxler berichtet über keine Interessenskonflikte.
◆ Akute kardiale Folgen der Lungenembolie mit RV Belastung und schwerer Rechtsherzinsuffizienz sind ursächlich für klinisch kritische Situationen und die erhöhte Mortalität der akuten LE.
◆ Eine RV Belastung unterschiedlichen Ausmasses wird bei annähernd jedem zweiten Patienten mit einer LE diagnostiziert.
◆ RV Dilatation und -dysfunktion sind wichtige Faktoren bei der Risikostratifizierung und der Therapieentscheidung bei Patienten mit akuter LE.
◆ Nur 3-4% aller Patienten mit akuter LE entwickeln das klinische Bild einer CTEPH im weiteren klinischen Verlauf.
◆ Eine CTEPH ist assoziiert mit einer initial adaptiven, jedoch später maladaptiven RV Hypertrophie, welche aufgrund einer Minderperfusion zur Bildung von Myokardfibrose und -nekrose führt, mit dem Resultat einer systolischen und diastolischen RV Insuffizienz.
Messages à retenir
◆ Les conséquences cardiaques aiguës de l’ embolie pulmonaire avec charge du ventricule droit et l’ insuffisance cardiaque droite sévère sont la cause de situations cliniquement critiques et de la mortalité accrue de l’ embolie pulmonaire aiguë.
◆ Le stress lié à une charge du ventricule droit est diagnostiqué à des degrés divers chez environ un patient sur deux atteint d’ une embolie pulmonaire.
◆ La dilatation et le dysfonctionnement du ventricule droit sont des facteurs importants dans la stratification du risque et les décisions de traitement chez les patients atteints d’ une embolie pulmonaire aiguë.
◆Seuls 3 à 4 % des patients atteints d’ une embolie pulmonaire aiguë développent le tableau clinique de l’ hypertension pulmonaire thromboembolique chronique au cours de l’ évolution clinique ultérieure.
◆L’ hypertension pulmonaire thromboembolique chronique est associée
à une hypertrophie du ventricule droit d’ abord adaptative, mais ensuite maladaptive, qui entraîne une fibrose et une nécrose du myocarde dues à une mauvaise perfusion, entraînant une insuffisance systolique et diastolique du ventricule droit.
am Online-Beitrag unter: www.medinfo-verlag.ch
info@herz+gefäss
- Vol. 10
- Ausgabe 6
- Dezember 2020