- La sarcoïdose – une maladie multi- systémique avec des aspects divers
La plupart des patients atteints de sarcoïdose sont initialement asymptomatiques. Lorsque les symptômes apparaissent, les patients signalent principalement un essoufflement, une toux ou des douleurs thoraciques non spécifiques. Les rémissions spontanées sont courantes, mais dans environ 25 % des cas, on observe une augmentation de la maladie pulmonaire qui, dans 10 % des cas, peut entraîner un sérieux dysfonctionnement pulmonaire. Cet article présente les actuelles options de traitement.
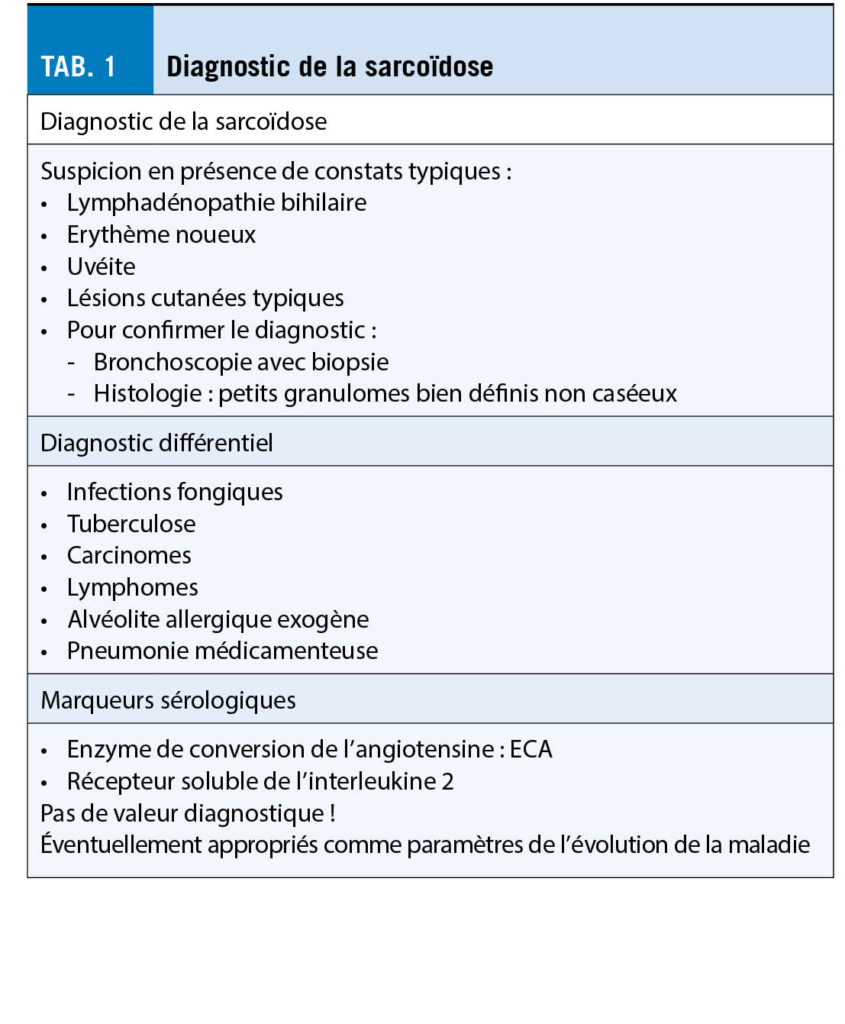
La sarcoïdose est une affection multisystémique caractérisée par des granulomes non caséeux. Ils peuvent se produire dans tous les organes, mais le plus souvent et le plus fréquemment, les poumons, les ganglions lymphatiques, la peau, les yeux et le foie sont touchés. La cause est inconnue, bien que l’ inhalation de substances nocives soit suspectée dans les cas de prédisposition génétique. La prévalence en Suisse est de 44/100 000, la prévalence des sarcoïdoses hospitalisées de 16/100 000. L’ incidence annuelle moyenne est de 7/100 000. Les informations sur le diagnostic, le diagnostic différentiel et les marqueurs sérologiques sont résumées dans le tableau 1.
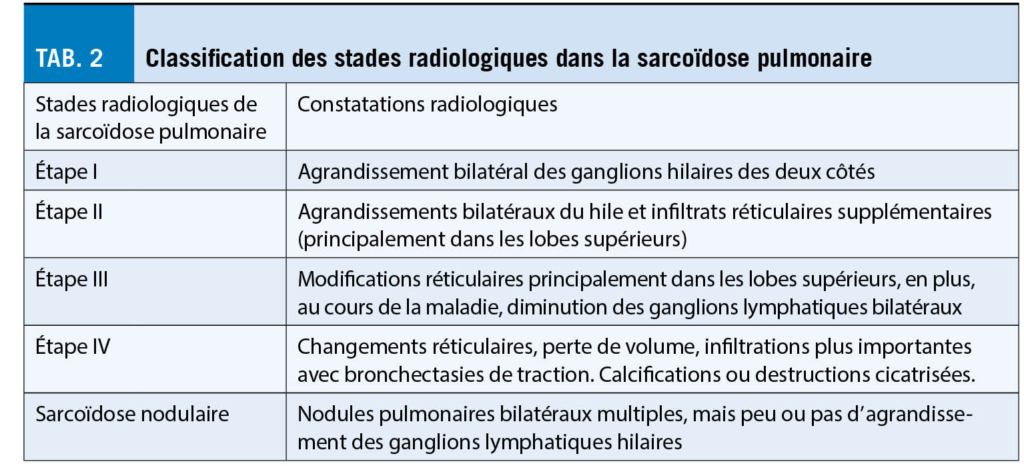
La plupart des patients atteints de sarcoïdose pulmonaire n’ ont pas besoin de traitement, car un grand nombre d’ entre eux restent asymptomatiques, ne progressent pas ou même guérissent spontanément. Toutefois, pour les patients présentant une atteinte fonctionnelle importante des poumons, il faut discuter d’ un traitement afin d’ éviter des lésions irréversibles des organes pulmonaires telles que la fibrose pulmonaire ou ce qu’ on appelle le Honeycombing (pour la classification des stades radiologiques, voir le tableau 2).
Les stéroïdes systémiques sont toujours les médicaments les plus utilisés pour le traitement de la sarcoïdose pulmonaire, car ils peuvent généralement réduire le processus inflammatoire granulomateux. Cependant, en raison des effets secondaires connus, leur utilisation et l’ évolution spontanée de la sarcoïdose doivent toujours faire l’ objet d’ un examen critique.
Indication pour une thérapie
Afin de décider si une thérapie glucocorticoïde doit être utilisée, il faut tenir compte du fait que certains patients présentent généralement une évolution bénigne, comme le stade I et l’ absence de symptômes, ce qui n’ est pas une indication de thérapie ! Donc attitude attentiste mais surveillance.
En cas de symptômes, notamment de dyspnée et d’ atteinte de plus de trois organes ou d’ augmentation des infiltrats pulmonaires, un traitement doit être appliqué.
Sarcoïdose pulmonaire
L’ indication actuelle du traitement de la sarcoïdose pulmonaire par glucocorticoïdes est la détérioration de la fonction pulmonaire dans un intervalle de 3 à 6 mois, lorsque la capacité pulmonaire totale (CPT) baisse de 10 % ou plus, lorsque la capacité de diffusion (DLCO/VA) baisse de 20 % ou plus, ou lorsque l’ analyse des gaz du sang artériel se détériore. En outre, des changements radiographiques progressifs avec augmentation des infiltrats interstitiels, le développement de cavités ou des signes de développement d’ une fibrose avec Honeycombing, ou bien des signes d’ hypertension pulmonaire.
Sarcoïdose extrapulmonaire
Parfois, une manifestation extrapulmonaire de sarcoïdose est à l’ origine d’ une thérapie glucocorticoïde, bien que les modifications pulmonaires soient stables. Cela inclut les manifestations de sarcoïdose des yeux, du système nerveux, du cœur, des reins ou une hypercalcémie persistante. D’ autres indications potentielles pour la thérapie sont la détérioration de l’ état général, les arthralgies ou les affections cutanées dérangeantes. En outre, maladie des sinus paranasaux ou du foie.
Quand peut-on se passer de thérapie ?
La thérapie glucocorticoïde n’ est pas indiquée chez les patients suivants :
- Patients asymptomatiques au stade radiologique I : 60 à 80 % de ces patients ont une rémission spontanée.
- Patients asymptomatiques en phase II : Modifications radiologiques et fonction pulmonaire normale et seulement légèrement restreinte (légèrement restrictive ou obstructive avec un échange gazeux normal). Ces patients sont examinés tous les 3 à 6 mois afin d’ exclure toute progression. Chez ces patients, il est important de surveiller la détérioration progressive au moyen d’ un grand test de la fonction pulmonaire ou de superviser l’ échange gazeux avant de commencer le traitement. 50% des patients non traités en phase II restent stables
- Patients asymptomatiques au stade III et fonction pulmonaire normale ou légèrement limitée : Ces patients doivent également être contrôlés tous les 3 à 6 mois. Dans ce groupe, 33% des patients non traités présentent une disparition des infiltrats dans les 5 ans, mais la plupart des patients ont besoin d’ une thérapie.
Thérapie initiale
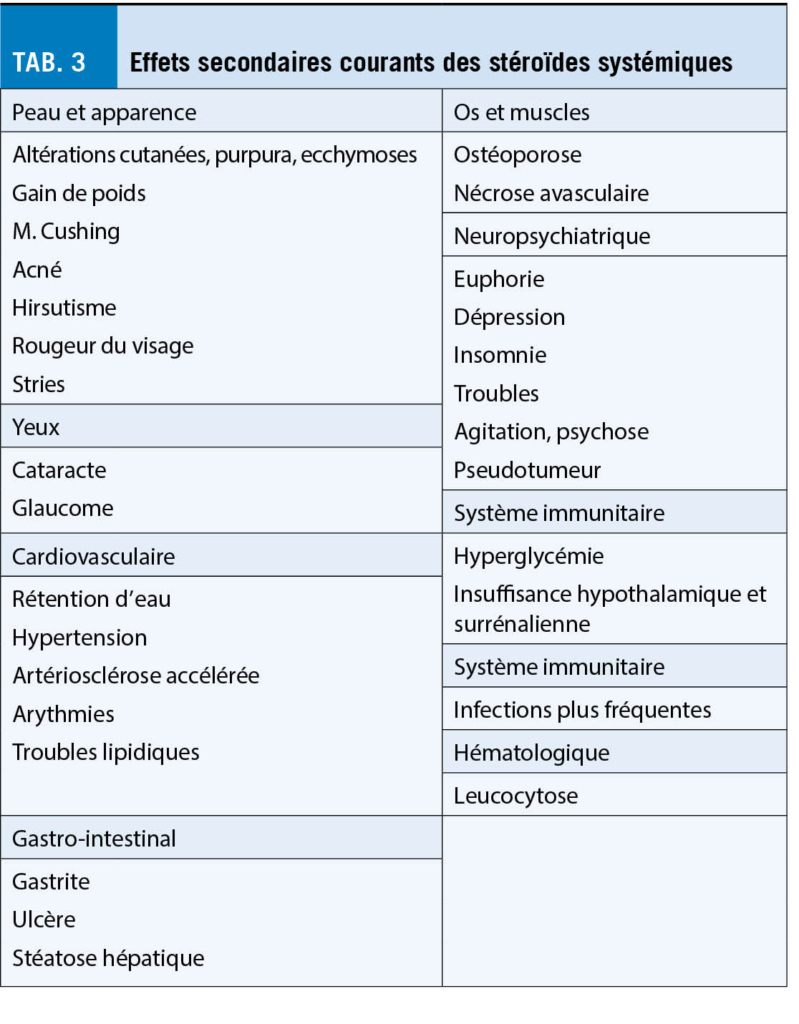
Les glucocorticoïdes oraux sont les plus couramment utilisés dans le monde pour réduire les symptômes de la sarcoïdose et de la maladie pulmonaire progressive, bien que les stéroïdes ne guérissent généralement pas complètement la maladie. Ils améliorent généralement les symptômes tels que la toux chronique ou l’ essoufflement. De plus, les changements radiologiques s’ améliorent au cours de la maladie, surtout au début. Néanmoins, l’ inconvénient est l’ apparition d’ effets secondaires (tab. 3) et le bénéfice incertain de la thérapie dans le cadre d’ un traitement à long terme. Avant de commencer une thérapie, les patients doivent être examinés en détail, en particulier les organes affectés doivent être identifiés et les comorbidités telles que l’ insuffisance cardiaque, la thromboembolie, l’ hypertension pulmonaire, le diabète sucré ou la tuberculose, qui peuvent initialement se dérouler de manière similaire, doivent être exclues par un diagnostic différentiel. La clarification porte sur la fonction pulmonaire pléthysmographique, l’ HRCT des poumons, l’ exclusion de la tuberculose par des méthodes bactériologiques et des tests interféron-gamma, et, en cas de suspicion, l’ échocardiographie pour exclure l’ hypertension pulmonaire.
Le traitement commence généralement par une dose de 0,3 à 0,6 mg de prednisone orale par kg de poids corporel (ce qui signifie normalement 20 à 40 mg par jour, selon la gravité de la maladie). Pour les patients souffrant de détresse respiratoire à l’ effort avec des infiltrats radiographiques n’ augmentant que lentement, la dose la plus faible suffit en général. Pour les patients présentant une progression rapide de la maladie, par ex. ayant besoin d’ oxygène, il convient de choisir en priorité des doses plus élevées. La dose initiale est indiquée pendant 4 à 6 semaines, après le patient est à nouveau évalué. Si, au cours de la maladie, les symptômes et les changements radiologiques, y compris les tests fonctionnels des poumons, restent stables ou s’ améliorent, la dose peut être réduite lentement (5 à 10 mg toutes les 4 à 12 semaines pour atteindre une dose minimale de 0,2 à 0,4 mg par kilo, soit environ 10 à 15 mg par jour). Si dans un délai de 6 semaines les paramètres restent inchangés, la dose sera prolongée de 6 semaines supplémentaires. La thérapie glucocorticoïde à haute dose (80-100 mg par jour) est rarement utilisée, le plus souvent en cas d’ insuffisance respiratoire aiguë ou de manifestation cardiaque, neurologique, ophtalmologique dans les voies respiratoires supérieures.
Réponse clinique
Les patients qui répondent à la thérapie glucocorticoïde systémique doivent l’ éliminer lentement sur une période maximale de 12 mois si les symptômes et les résultats radiographiques s’ améliorent.
Absence d’ amélioration ou intolérance aux glucocorticoïdes
Bien que la majorité des patients répondent aux glucocorticoïdes, il y a aussi ceux qui n’ y répondent pas ou qui développent des effets secondaires graves. Ces patients sont candidats à une thérapie immunosuppressive telle que le méthotrexate, l’ azathioprine, le léflunomide ou les inhibiteurs du TNF-alpha.
Thérapie d’ entretien
Il n’ y a pas de recommandation bien fondée sur des preuves. L’ expérience montre que des doses de 10 à 15 mg par jour sont généralement suffisantes pour prévenir toute détérioration supplémentaire. Pendant la thérapie d’ entretien, le patient est examiné toutes les 4 à 12 semaines pour détecter les effets secondaires. Dans la plupart des cas, les patients peuvent réduire progressivement et arrêter les stéroïdes dans un délai d’ un an. Un tiers des patients doivent à nouveau augmenter la dose et seule une petite partie des patients ont besoin d’ une thérapie sur plusieurs années.
Cas résistants
Chez les patients qui développent des effets secondaires pertinents de la thérapie glucocorticoïde ou qui souffrent de diabète sucré, d’ ostéoporose ou d’ autres maladies compliquées, on essaie une autre forme de thérapie immunosuppressive légère.
Les médicaments ayant l’ effet et le bénéfice attendus les plus importants dans la sarcoïdose pulmonaire progressive avec des effets secondaires le plus souvent légers sont le méthotrexate, l’ azathioprine, le léflunomide ou les mycophénolates. En outre, les antagonistes du TNF-alpha présentent de bons effets. Cependant, il n’ existe pas de bonnes études randomisées sur ces médicaments immunosuppresseurs. Tous présentent un risque de toxicité, en particulier de myélosuppression, d’ hépatotoxicité ou d’ apparition d’ infections opportunistes. Le méthotrexate est le médicament le plus couramment utilisé à la place des stéroïdes, mais son utilisation n’ est pas possible en cas de maladie du foie. Les patients qui ne peuvent pas tolérer le méthotrexate sont généralement traités avec l’ une des autres thérapies immunosuppressives mentionnées ci-dessus. Si aucune des thérapies mentionnées ci-dessus n’ est possible, on passe aux antagonistes du TNF-alpha, en particulier l’ infliximab ou l’ adalimumab. La combinaison d’ un inhibiteur du TNF-alpha avec le méthotrexate est utilisée avec succès dans la polyarthrite rhumatoïde, elle est effective et réduit le risque de développer des anticorps inhibiteurs du TNF-alpha. Pourtant, cette thérapie n’ a jamais été correctement étudiée dans le cas de la sarcoïdose et peut être associée à un risque accru d’ infection ou de développement tumoral.
Suivi de la thérapie
De la même manière que pour la thérapie glucocorticoïde, l’ effet est régulièrement évalué au moyen de tests de la fonction pulmonaire, d’ analyses des gaz du sang et en observant les changements radiologiques.
Thérapie glucocorticoïde par inhalation
L’ utilisation de glucocorticoïdes inhalés pour le traitement de la sarcoïdose pulmonaire donne des résultats contradictoires. Les glucocorticoïdes inhalés semblent améliorer l’ alvéolite et peuvent être bénéfiques chez certains patients. Le budésonide a été le mieux étudié à une dose de 800-1600 µg deux fois par jour et s’ est révélé avoir un bon effet sur la toux chronique dans la sarcoïdose.
Article traduit de «der informierte arzt» 11_2020
Copyright Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
L’ auteur a déclaré n’ avoir aucun conflit d’ intérêts en relation avec cet article.
- La plupart des patients atteints de sarcoïdose pulmonaire n’ ont pas besoin de traitement, car beaucoup restent asymptomatiques et la maladie ne progresse pas, mais peut même présenter une rémission spontanée.
- Pour les patients asymptomatiques atteints de sarcoïdose pulmonaire et ne présentant pas d’ atteinte extrapulmonaire significative, il suffit de suivre de près les patients sur le plan fonctionnel et radiologique sans thérapie glucocorticoïde.
- Les cas avec progression ou les rares cas initialement graves constituent des indications pour le traitement de la sarcoïdose pulmonaire.
- Les patients atteints de sarcoïdose pulmonaire présentant des symptômes et des signes d’ aggravation radiologique ou de détérioration de la fonction pulmonaire sont initialement traités avec des glucocorticoïdes oraux.
- Les patients présentant des symptômes prononcés et des changements radiologiques marqués, ainsi que les patients souffrant de dysfonctionnement pulmonaire modéré à grave, doivent également être traités par une thérapie glucocorticoïde orale.
- La dose de la thérapie glucocorticoïde initiale est généralement de 0,3-0,6 mg par kg (généralement 20-40 mg par jour). Cette dose doit être maintenue pendant 4 à 6 semaines. Soit que les symptômes persistent ou les changements radiologiques s’ aggravent, soit que la fonction pulmonaire diminue en dessous de cette dose, le traitement est prolongé de 4 à 6 semaines. Si, par contre, les symptômes restent stables ou s’ améliorent, la dose peut être progressivement réduite.
- La surveillance doit être basée sur les symptômes, l’ examen clinique, le suivi radiographique et, surtout, des tests réguliers de la fonction pulmonaire par un pneumologue (la spirométrie seule n’ est pas suffisante).
- Les patients présentant une toux chronique, des signes d’ hyperréactivité bronchique, qui n’ont pas déjà besoin de stéroïdes systémiques, peuvent être traités de manière probatoire avec des glucocorticoïdes inhalés, par exemple du budésonide 800-1600 µg deux fois par jour.
- La thérapie systémique chronique aux glucocorticoïdes a de nombreux effets secondaires.
1. Epidemiology of sarcoidosis, Ungprasert P, Carmona EM, Utz JP et al Mayo Clin Proc. 2016 Feb;91(2):183-8. Epub 2015 Dec 22.
2. Outcome of the treatment for sarcoidosis, Hunninhake GW, Gilbert S, Pueringer R et al Am J Respir Crit Care Med. 1994; 149(4 Pt 1):893
3. New treatment strategies for pulmonary sarcoidosis: antimetabolits, biological drugs, and other treatment approaches, Lancet Respir Med. 2015 Oct;3(10):813-22. Epub 2015 Jul 20.
4. Sarcoidosis, Iannuzzi MC, Rybicki BA, Teirstein AS. N Engl J Med. 2007; 357(21):2153
5. Corticosteroid treatment in pulmonary sarcoidosis, Turner-Warwick M, Mc Allister W, Lawrence R et al, Thorax.1986:41(12):903
6. Pharmacotherapy for pulmonary sarcoidosis: a Delphi consensus study. Schutt AC, Bullington WM, Judson MA, Respir Med 2010;104(5):717. Epub 2010 Jan 20
7. Inhaled corticosteroids can modulate the immunpathogenesis of pulmonary sarcoidosis, Spiteri MA, Newman SP, Clarke SW, Poulter LW, Eur Respir J 1989; 2(3):218
la gazette médicale
- Vol. 9
- Ausgabe 7
- Dezember 2020