- Apport de la neuro-imagerie dans le diagnostic des troubles cognitifs
Les troubles cognitifs représentent une condition prévalente et invalidante avec un impact majeur sur la santé publique. Dans la démarche diagnostique, les techniques d’ imagerie radiologique et de médicine nucléaire peuvent souvent déterminer l’ étiologie du déclin cognitif et ainsi permettre une prise en charge individualisée et adaptée. Dans cet article nous allons résumer les indications et l’ apport des différentes techniques d’ imagerie utilisées en pratique clinique.
Face au vieillissement de la population, les troubles cognitifs sont devenus un enjeu de santé publique prioritaire, avec une prévalence en Suisse en 2019 de 154 700 personnes et près de 29 500 nouveaux cas par année (source OFSP). L’ impact économique est très important avec près de 11.8 milliards de francs dépensés en 2017 selon une étude réalisée en 2019 sur mandat de l’ Association Alzheimer, sans compter les pertes en lien avec des retraits précoces de population active. Face à cela, il apparaît important de mettre en œuvre des stratégies d’ investigation permettant d’ établir un diagnostic précoce et correct, permettant de mettre en place une prise en charge médicale et sociale adaptée à ces patients. Ceci peut comprendre un accompagnement personnalisé, mais aussi l’ institution de traitements pour freiner la progression du déclin et pour diminuer ses symptômes. Le tableau clinique seul, sans examen d’ imagerie associée, ne permet pas en effet de différencier avec une précision satisfaisante un déclin cognitif dû, par exemple, à une dépression, d’ un processus neurodégénératif.
Parmi les principales causes de démence on trouve notamment: la maladie neurodégénérative d’ Alzheimer (MA) – qui représente à elle seule deux tiers des cas – la démence d’ origine vasculaire, la maladie à corps de Lewy, et la démence fronto-temporale.
Le diagnostic initial d’ un trouble cognitif repose sur la clinique et le bilan neuropsychologique, à la suite desquels il sera possible d’ établir des hypothèses étiologiques, qui seront ensuite confirmées ou infirmées grâce à l’ imagerie. En effet, grâce aux progrès technologiques récents et à la complémentarité de la neuro-imagerie anatomique et moléculaire, il est dorénavant possible d’ établir dans la majorité des cas un diagnostic étiologique précis (1).
Imagerie anatomique par IRM
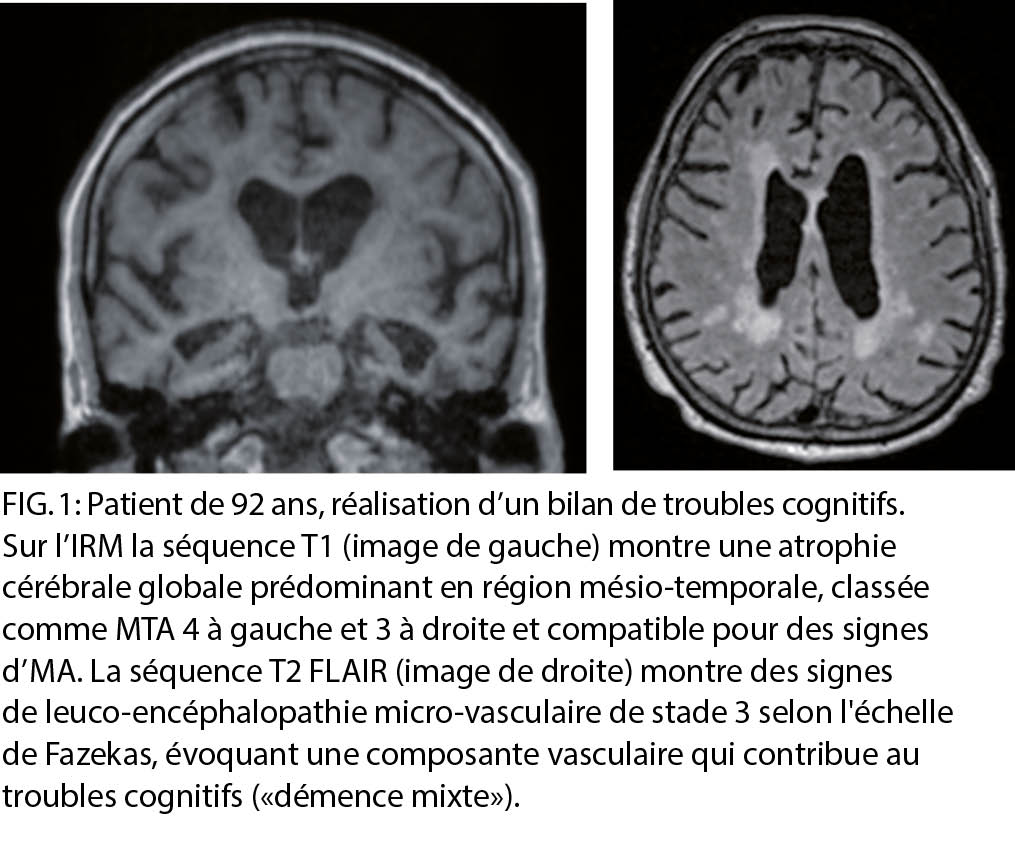
L’ imagerie anatomique a pour but initial d’ exclure une cause traitable, chirurgicale ou non, expliquant les troubles cognitifs (p.ex.: hématome extra-/sous-dural, hydrocéphalie, tumeur, encéphalite). Elle permet ensuite d’ orienter le diagnostic notamment par la recherche d’ une atrophie cérébrale générale ou focalisée sur une région du cerveau, compatible avec une démence dégénérative primaire, ainsi que la recherche de lésions vasculaires, telles que les séquelles d’ infarctus ou d’ anomalies de signal de la substance blanche. La modalité d’ imagerie recommandée en première intention est l’ IRM, plus sensible que le scanner, avec un protocole comprenant les séquences résumées dans le tableau 1 (2) (fig. 1).
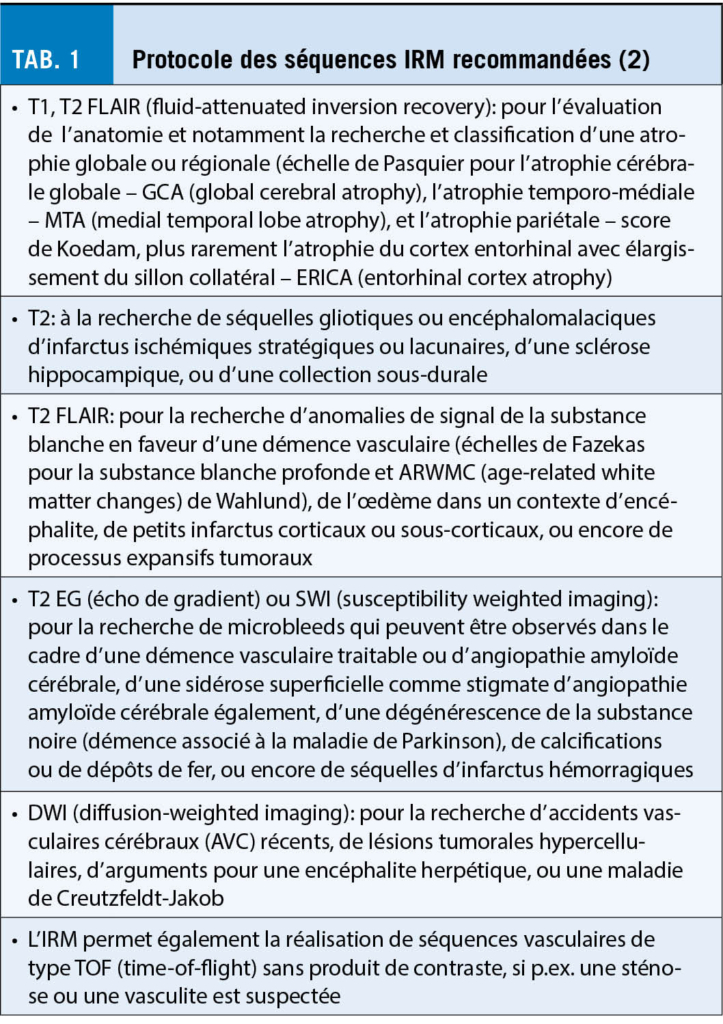
Des techniques d’ IRM avancées qui ne sont pas utilisées en routine clinique mais qui peuvent contribuer au diagnostic d’ une démence comprennent le DTI (diffusion tensor imaging), la perfusion ASL (arterial spin labeling) et la resting state fMRI (IRM fonctionnelle). Les examens IRM peuvent facilement être répétés pour surveiller la vitesse de progression d’ un atteinte neurodégénérative ou vasculaire, pour juger de l’ effet d’ un traitement débuté. Des examens IRM répétées sont également utiles pour exclure des effets secondaires de traitements anti-amyloïdes tels que l’ ARIA (amyloid-related imaging abnormalities). Quand l’ IRM n’ est pas disponible ou contre-indiquée, ou chez les patient claustrophobiques ou ne supportant pas un examen d’ une certaine durée, un scanner sans injection de produit de contraste peut être proposé. Il permettra notamment d’ apprécier la trophicité cérébrale et la présence de séquelles vasculaires, même si son contraste est moindre.
Imagerie moléculaire par TEP et TEMP
Devant une forme cliniquement atypique ou une évolution rapide de troubles cognitifs, chez les patients jeunes (<65 ans), ou dans tous les cas dans lesquels l’ évaluation clinique, neuropsychologique et d’ imagerie morphologique ne permettent pas au médecin d’ arriver à un diagnostic avec un niveau de confiance adéquat, des examens d’ imagerie moléculaire peuvent s’ avérer un outil complémentaire précieux (3). Plusieurs modalités d’ imagerie utilisant différents radiotraceurs sont utilisées à l’ heure actuelle pour ces bilans parmi lesquels on trouve la tomographie par émission de positrons (TEP) avec de la 18F-fluorodésoxyglucose (18F-FDG), la TEP amyloïde et la TEMP (tomographie par émission mono-photonique) au 123I-ioflupane (DaT scan).
La TEP cérébrale avec 18F-FDG permet de réaliser une imagerie du métabolisme cérébral, en utilisant un radiotraceur constitué d’ une molécule de glucose sur laquelle un groupe hydroxyle est remplacé par du 18-fluor. Le radiotraceur est transporté dans les cellules par des transporteurs de glucose, puis phosphorylé, restant ainsi piégé dans les cellules et permettant d’ étudier le métabolisme cellulaire régional. L’ examen est réalisé avec des appareils hybrides qui associent l’ acquisition TEP avec une imagerie de tomodensitométrie (TEP-TDM).
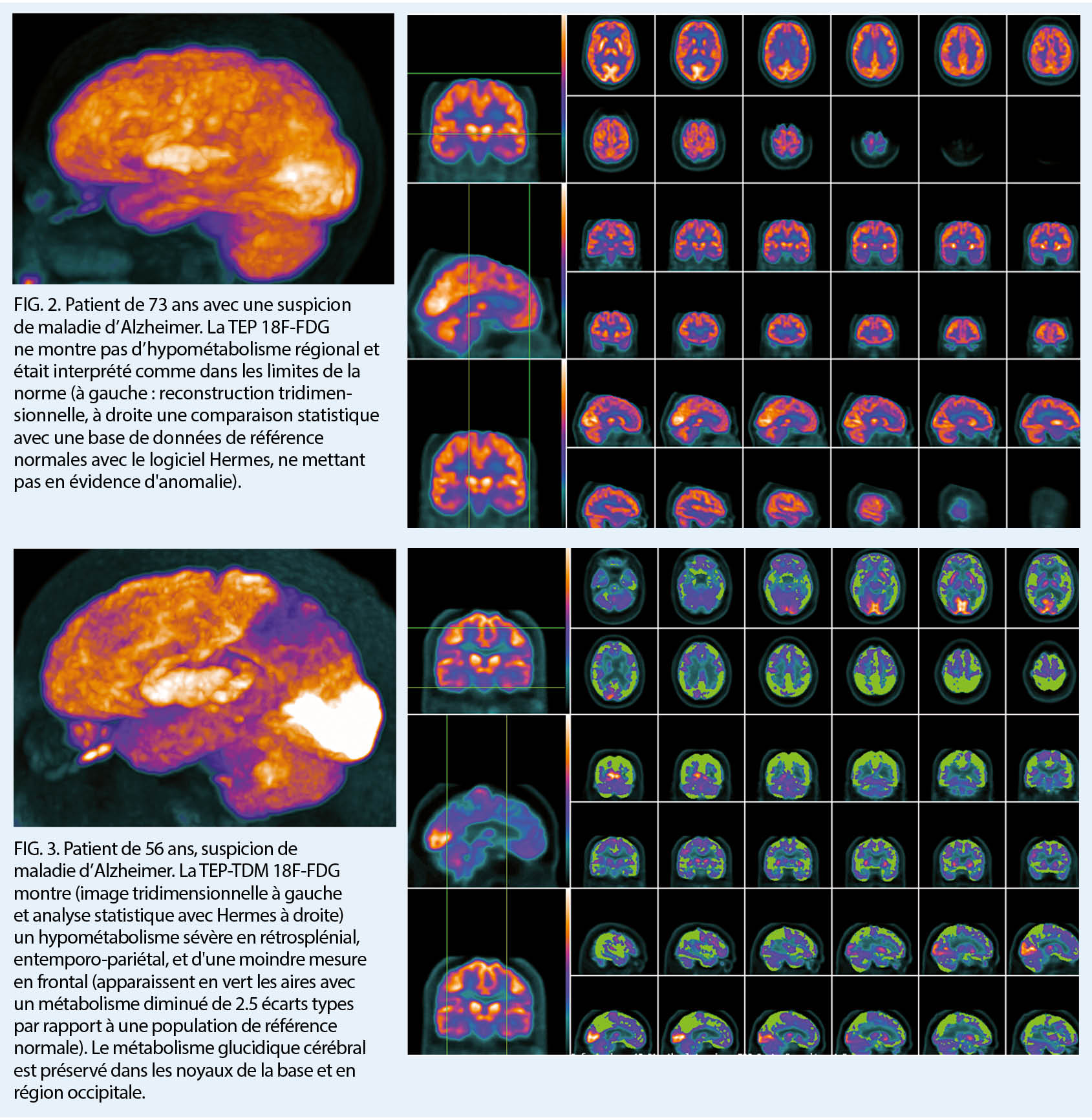
Le cerveau étant glucose-dépendant et métaboliquement actif, la cartographie du métabolisme glucidique cérébral constitue le reflet de l’ activité neuronale et permet ainsi une détection topographique des zones hypo- ou hyperfonctionnelles, correspondant à une perte ou un dysfonctionnement synaptique à ces niveaux. L’ hypométabolisme ayant une topographie régionale différente selon les différentes atteintes neurodégénératives, la TEP F18-FDG est utile pour les différencier (4) (fig. 2, 3)
A titre d’ exemple, le pattern topographique métabolique visualisé pour la MA montre un hypométabolisme plutôt postérieur, au niveau du néocortex temporo-pariétal, et au niveau du cortex cingulaire postérieur, en préservant les aires primaires, le cervelet et les noyaux gris centraux, avec une sensibilité de 80% et une spécificité de 90% pour la MA au stade de démence. Cet examen est à l’ heure actuelle pris en charge selon l’ Ordonnance sur les prestations de l’ assurance des soins (OPAS) dans les cadre suivant: «Comme examen complémentaire dans des cas peu clairs, après un examen non conclusif du liquide céphalo-rachidien ou lorsqu’ une ponction lombaire est impossible ou contre-indiquée après un examen préalable interdisciplinaire et sur prescription de spécialistes en médecine interne générale avec formation approfondie en gériatrie, en psychiatrie et psychothérapie ou en neurologie; jusqu’ à l’ âge de 80 ans révolus, avec un test de Folstein (Mini-Mental-Status-Test) d’ au moins 10 points et une démence durant depuis 5 ans au maximum; pas d’ examen préalable par TEP ou TEMP (Single Photon Emission Computed Tomography).»
Les radiotraceurs amyloïdes ont révolutionné l’ étude de la MA
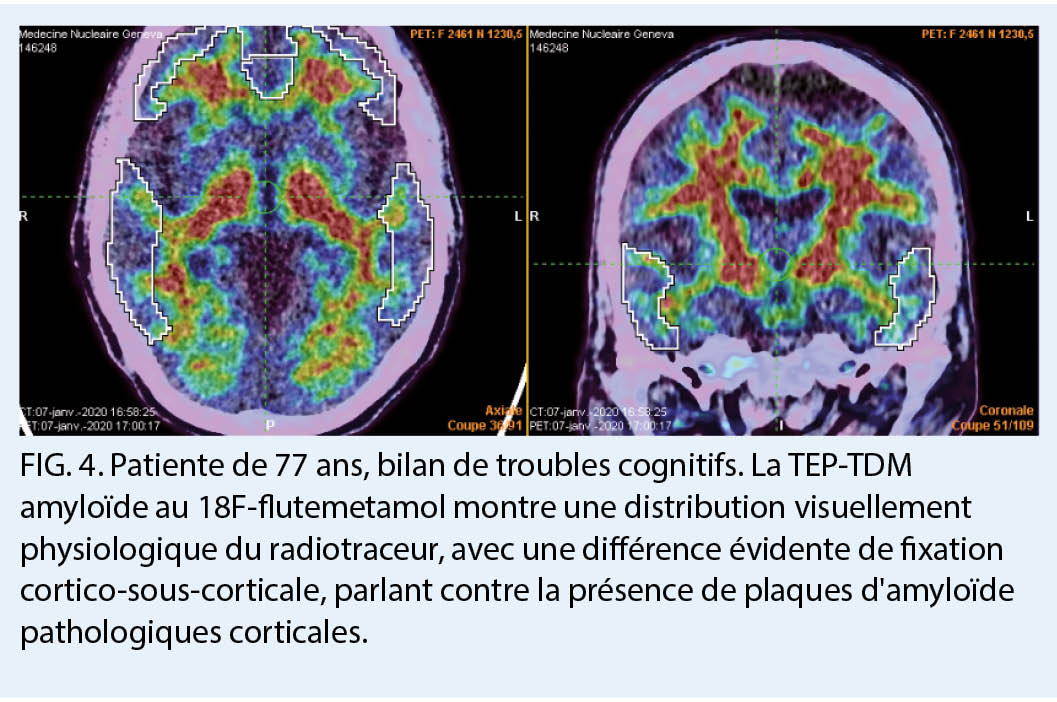
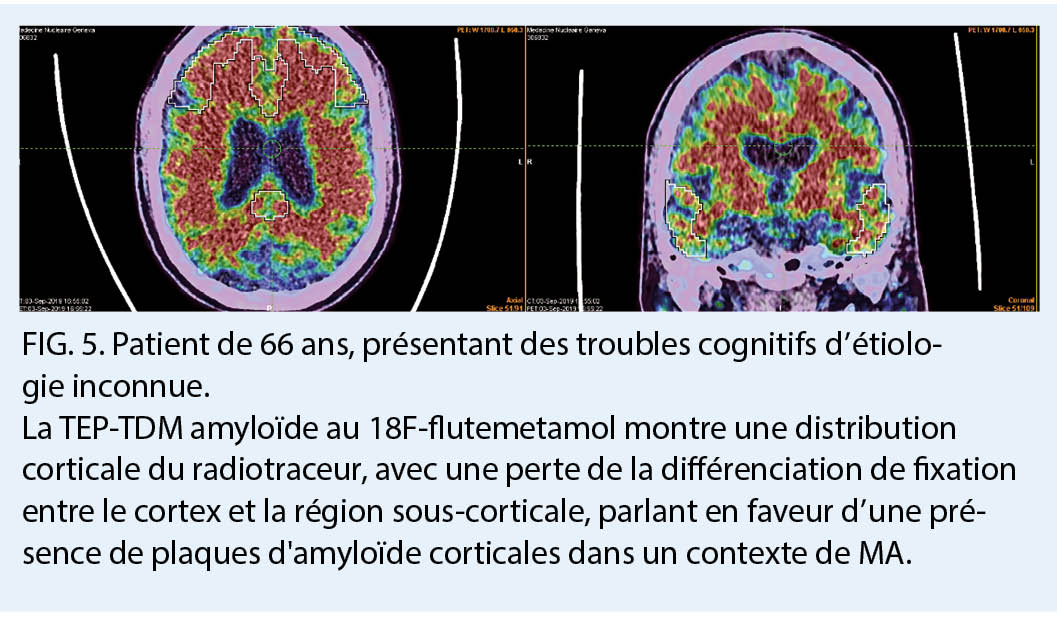
Un groupe plus récent de radiotraceurs a révolutionné l’ étude de la MA en permettant de mesurer avec une sensibilité et spécificité élevée la présence au niveau cortical de plaques de bêta-amyloïde extracellulaires, l’ un des deux marqueurs moléculaires requis pour le diagnostic neuropathologique de la maladie d’ Alzheimer. Le 18F-flutemetamol, le 18F-florbetaben, et le 18F-florbetapir ont été approuvés pour cette indication par Swissmedic. Le mécanisme de ces traceurs étant de se lier aux plaques amyloïdes, ils constituent ainsi un traceur physiopathologique. Ainsi, l’ analyse des images montrera une fixation physiologique de la substance blanche dans un cas négatif, et a contrario, une augmentation de la fixation dans les zones corticales sera considérée comme positive pour une déposition corticale de plaques amyloïdes. Une imagerie négative permet d’ exclure le diagnostic de MA (haute spécificité), alors qu’ une imagerie positive, surtout en association avec un marqueur de neurodégénérescence tel qu’ une atrophie temporo-mésiale ou un hypométabolisme postérieur, permet d’ identifier parmi les sujets avec un déficit cognitif léger (mild cognitive impairment, MCI) ceux qui sont susceptibles d’ évoluer vers un stade démentiel de la MA (5) (fig. 4, 5). Des acquisitions en phase précoce immédiatement après injection du radiotraceur permettent d’ estimer la perfusion cérébrale régionale et donnent des informations similaires à celles données par la TEP 18F-FDG, permettant ainsi de combiner les deux informations sur un même examen grâce à une acquisition multiphasique.
La TEP avec traceurs amyloïdes est prise en charge selon l’ OPAS avec les mêmes indications et restrictions appliqués pour la TEP 18F-FDG. Vu que l’ examen n’ est pas admissible après un examen préalable par TEP 18F-FDG, une seule TEP remboursée, à FDG ou amyloïde, peut à l’ heure actuelle être proposée au patient dans le cadre de l’ OPAS. Pourtant, les deux examens donnent des informations complémentaires et les arbres décisionnels proposés par différentes sociétés savantes proposent la réalisation des deux examens pour obtenir un diagnostic concluant selon le tableau clinique et le résultat du test (6).
DaT-scan
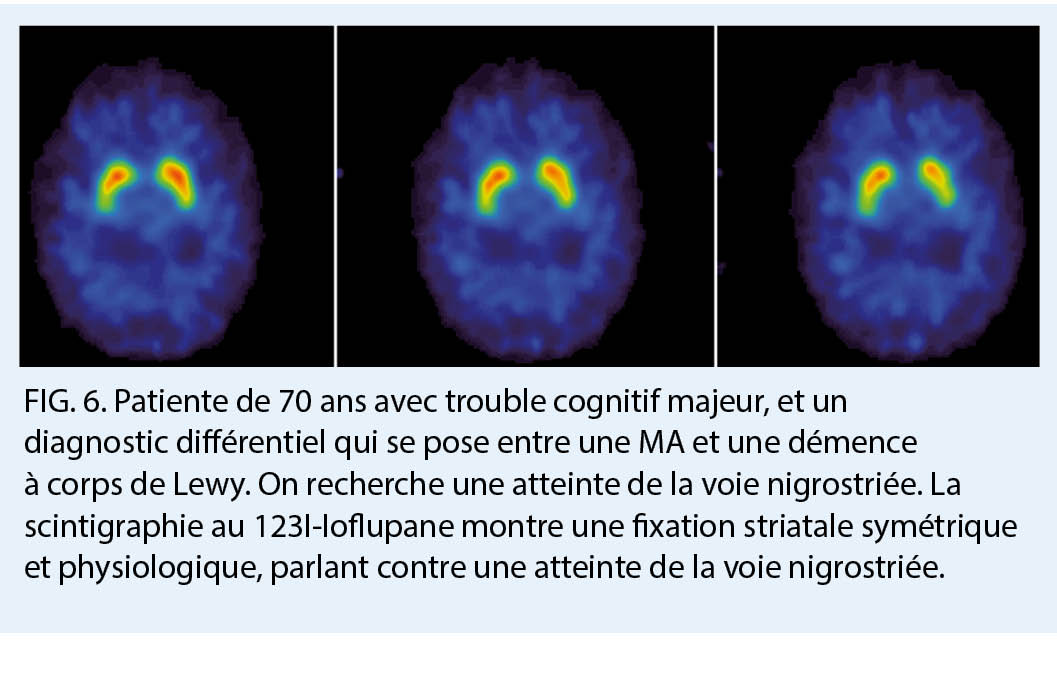
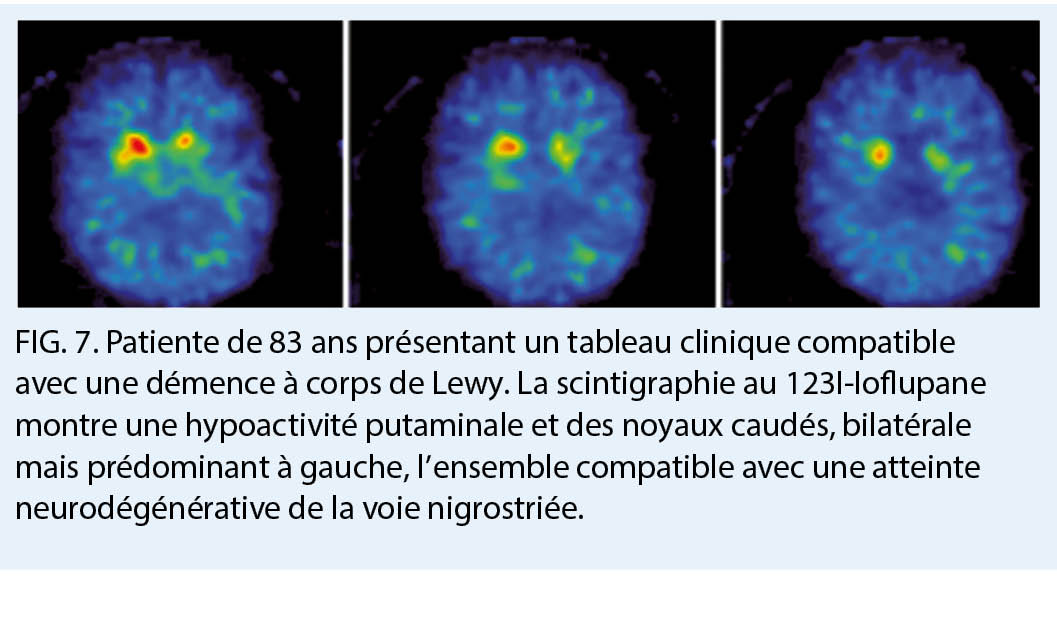
La TEMP 123I ioflupane (DaT-scan) permet pour sa part une analyse des terminaisons synaptiques des neurones dopaminergiques, qui sont spécifiquement atteints dans la démence à corps de Lewy, la démence de la maladie de Parkinson, et dans d’ autres syndromes parkinsoniens pouvant être associés à une démence telles que la paralysie supra-nucléaire progressive, l’ atrophie multi-systématisée, et la dégénérescence cortico-basale. Ces neurones, principalement retrouvés dans la substance noire, ont des axones s’ étendant dans le striatum, et dont le fonctionnement repose sur le largage de dopamine. Le radiotraceur lui va cibler le transporteur dopaminergique présynaptique (dopamine transporter, DaT). Dans les atteintes de la voie nigrostriée, il existe ainsi une disparition des neurones dopaminergiques résultant en une diminution voir une absence d’ accumulation du radiotraceur. Le DaT-scan permettra d’ aider au diagnostic différentiel notamment entre une démence à corps de Lewy et une MA (7). Cette indication n’ est pas prise en charge par l’ assurance obligatoire de soins à l’ heure actuelle.
Radiotraceurs tau
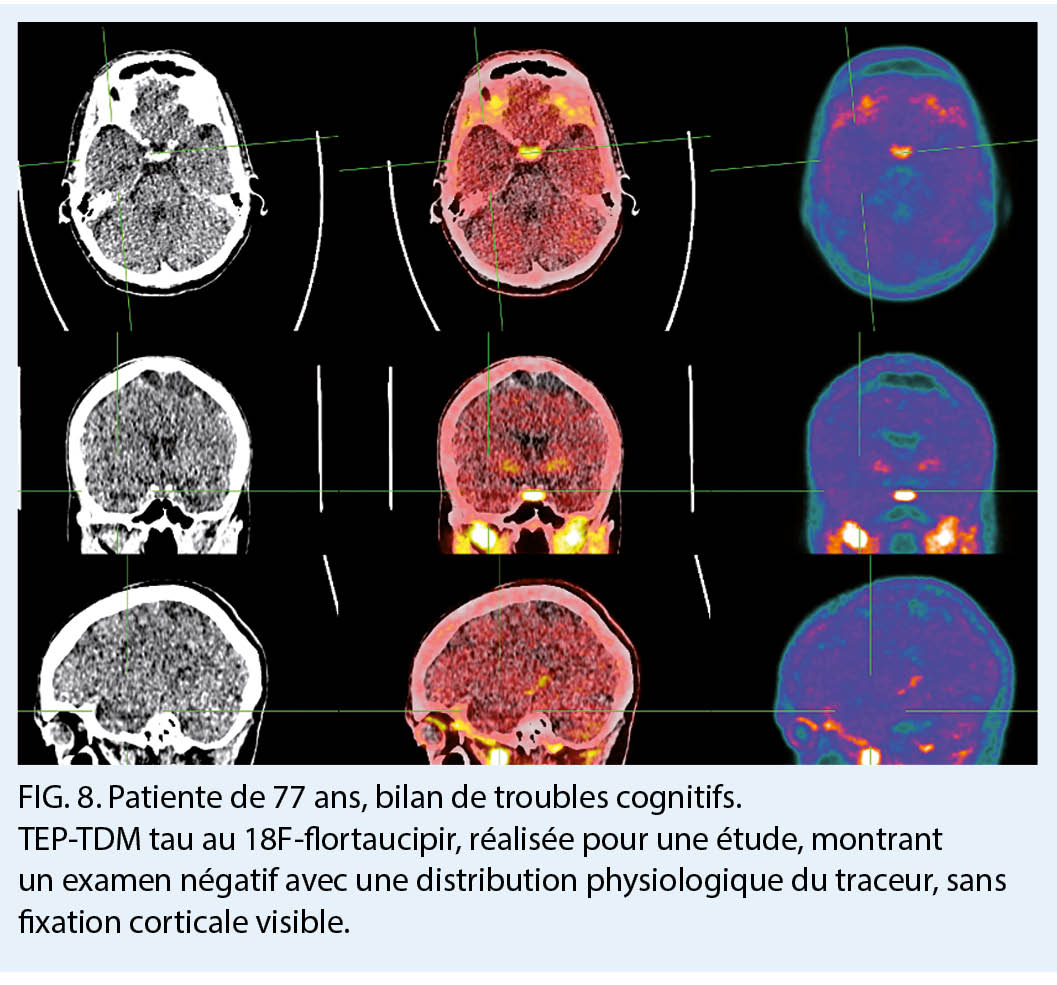
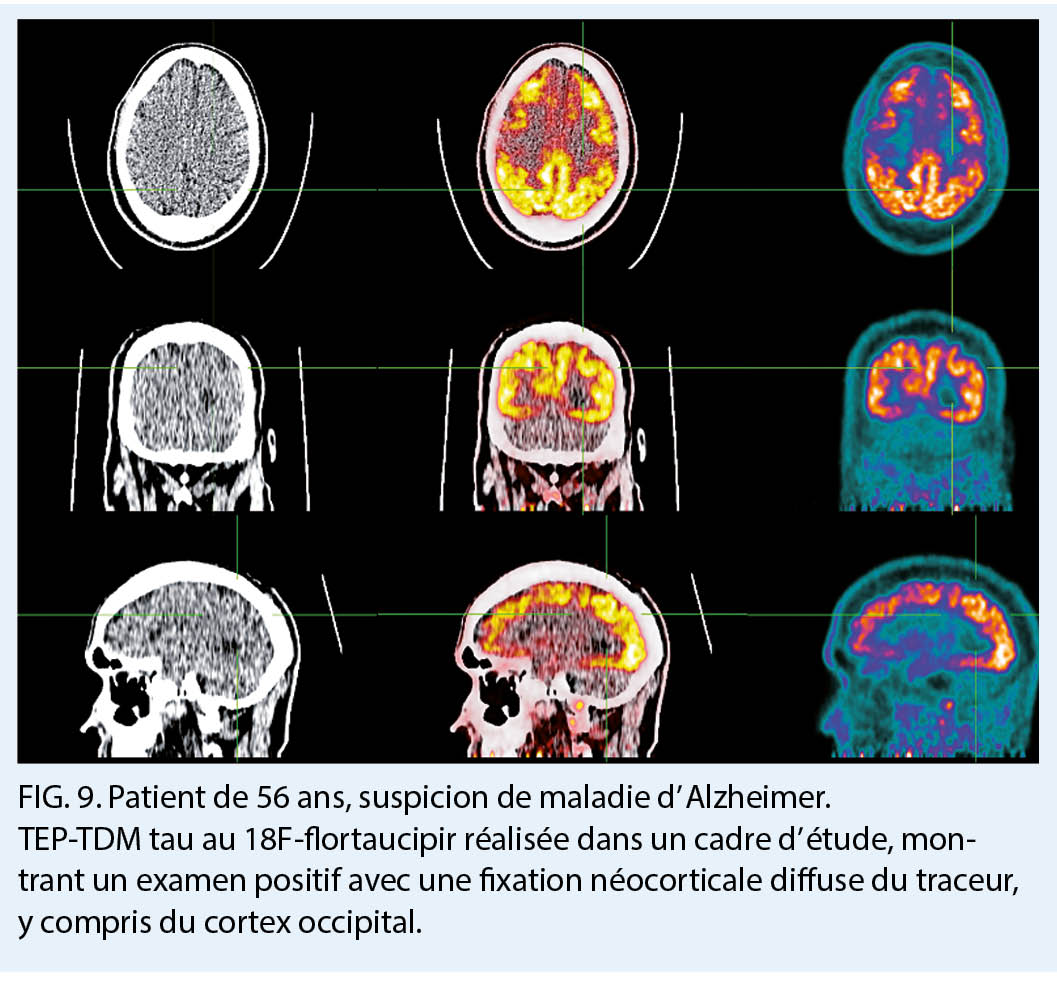
Enfin, parmi les derniers radiotraceurs physiopathologiques développés pour le diagnostic d’ une MA se trouvent les radiotraceurs tau, dont le plus répandu est le 18F-flortaucipir (8). L’ hyperphosporylation et l’ agrégation intracellulaire anormale des protéines tau constituent le deuxième marqueur moléculaire de la MA, en association avec les plaques extracellulaires d’ amyloïde. Les traceurs se fixent ainsi sélectivement sur les amas neurofibrillaires et permettent de visualiser l’ accumulation progressive du radiotraceur au niveau de différentes régions cérébrales selon les patterns topographiques des stades de Braak telles qu’ elles sont retrouvées lors d’ études neuropathologiques. Ces traceurs présentent un grand potentiel pour le staging et le suivi de la MA, mais également pour distinguer les pathologies MA versus non MA, puisqu’ ils permettent de mesurer avec une bonne précision les stades neuropathologiques avancés de la MA qui s’ associent quasi invariablement à la présence de plaques amyloïdes (fig. 8, 9). L’ imagerie TEP tau a récemment (mai 2020) franchi une étape importante pour son utilisation dans la pratique clinique en obtenant une approbation par la Food and Drug Administration (FDA) aux Etats-Unis pour cette indication. En Suisse, cette modalité d’ imagerie est utilisée dans le cadre d’ études de recherche mais n’ est pas encore approuvée pour son utilisation clinique.
Pour conclure, le diagnostic des troubles cognitifs constitue un enjeu important dans la médecine actuelle, aussi bien pour l’ adaptation de la prise en charge de ces patients que pour la mise en place et le développement de nouveaux traitements. Pour ce faire, le bilan minimal comprendra une évaluation neuropsychologique mais également une imagerie cérébrale dont l’ IRM est l’ examen de première intention. La neuro-imagerie moléculaire peut constituer un outil diagnostic précieux puisqu’ elle permet, de par l’ utilisation de radiotraceurs topographiques tel que la 18F-FDG et physiopathologiques tels que les traceurs dopaminergiques, amyloïde et tau, de s’ approcher du diagnostic «anatomo-pathologique» in vivo.
Copyright Aerzteverlag medinfo AG
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
elsa.hervier@hcuge.ch
Service de Radiologie, Département Diagnostique, Hôpitaux Universitaires de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
Les auteurs déclarent n’ avoir aucun lien d’ intérêt en relation avec le contenu de cet article. VG a reçu des financements pour la recherche du Fonds National Suisse de la recherche scientifique (projets IZSEZ0_188355, 320030_169876 et 320030_185028) et de la Fondation Velux (projet 1123), ainsi que des financements pour la recherche et pour des présentations scientifiques à travers son institution, de la part de Siemens Healthineers, GE Healthcare, Life Molecular Imaging, Cerveau Technologies, Roche, Merck.
- Chez les patients présentant des troubles cognitifs, le tableau clinique ne permet pas à lui seul de différencier avec une précision satisfaisante l’ étiologie du déclin cognitif
- à l’ heure actuelle le bilan minimal chez ces patients comprend ainsi une évaluation neuropsychologique et un examen d’ imagerie cérébrale dont l’ IRM, en général sans injection de produit de contraste, est l’ examen de première intention
- la neuro-imagerie moléculaire constitue quant à elle un outil diagnostic complémentaire et très utile chez les patients dont le diagnostic reste incertain à l’ issu du premier bilan car elle permet de poser un diagnostic «anatomo-pathologique» in vivo
1. Scheltens, P., Blennow, K., Breteler, M.M., de Strooper, B., Frisoni, G.B., Salloway, S., Van der Flier, W.M., 2016. Alzheimer’s disease. Lancet. 388, 505-17.
2. Park, M., Moon, W.J., 2016. Structural MR Imaging in the Diagnosis of Alzheimer’s Disease and Other Neurodegenerative Dementia: Current Imaging Approach and Future Perspectives. Korean J Radiol. 17, 827-845.
3. Frisoni, G.B., Boccardi, M., Barkhof, F., Blennow, K., Cappa, S., Chiotis, K., Demonet, J.F., Garibotto, V., Giannakopoulos, P., Gietl, A., Hansson, O., Herholz, K., Jack, C.R., Jr., Nobili, F., Nordberg, A., Snyder, H.M., Ten Kate, M., Varrone, A., Albanese, E., Becker, S., Bossuyt, P., Carrillo, M.C., Cerami, C., Dubois, B., Gallo, V., Giacobini, E., Gold, G., Hurst, S., Lonneborg, A., Lovblad, K.O., Mattsson, N., Molinuevo, J.L., Monsch, A.U., Mosimann, U., Padovani, A., Picco, A., Porteri, C., Ratib, O., Saint-Aubert, L., Scerri, C., Scheltens, P., Schott, J.M., Sonni, I., Teipel, S., Vineis, P., Visser, P.J., Yasui, Y., Winblad, B., 2017. Strategic roadmap for an early diagnosis of Alzheimer’s disease based on biomarkers. Lancet Neurol. 16, 661-676.
4. Nobili, F., Arbizu, J., Bouwman, F., Drzezga, A., Agosta, F., Nestor, P., Walker, Z., Boccardi, M., 2018. European Association of Nuclear Medicine and European Academy of Neurology recommendations for the use of brain (18) F-fluorodeoxyglucose positron emission tomography in neurodegenerative cognitive impairment and dementia: Delphi consensus. Eur J Neurol. 25, 1201-1217.
5. Chiotis, K., Saint-Aubert, L., Boccardi, M., Gietl, A., Picco, A., Varrone, A., Garibotto, V., Herholz, K., Nobili, F., Nordberg, A., 2017. Clinical validity of increased cortical uptake of amyloid ligands on PET as a biomarker for Alzheimer’s disease in the context of a structured 5-phase development framework. Neurobiol Aging. 52, 214-227.
6. Boccardi, M., Nicolosi, V., Festari, C., Bianchetti, A., Cappa, S., Chiasserini, D., Falini, A., Guerra, U.P., Nobili, F., Padovani, A., Sancesario, G., Morbelli, S., Parnetti, L., Tiraboschi, P., Muscio, C., Perani, D., Pizzini, F.B., Beltramello, A., Salvini Porro, G., Ciaccio, M., Schillaci, O., Trabucchi, M., Tagliavini, F., Frisoni, G.B., 2020. Italian consensus recommendations for a biomarker-based aetiological diagnosis in mild cognitive impairment patients. Eur J Neurol. 27, 475-483.
7. Vaamonde-Gamo, J., Flores-Barragan, J.M., Ibanez, R., Gudin, M., Hernandez, A., 2005. [DaT-SCAN SPECT in the differential diagnosis of dementia with Lewy bodies and Alzheimer’s disease]. Rev Neurol. 41, 276-9.
8. Dodich, A., Mendes, A., Assal, F., Chicherio, C., Rakotomiaramanana, B., Andryszak, P., Festari, C., Ribaldi, F., Scheffler, M., Schibli, R., Schwarz, A.J., Zekry, D., Lovblad, K.O., Boccardi, M., Unschuld, P.G., Gold, G., Frisoni, G.B., Garibotto, V., 2020. The A/T/N model applied through imaging biomarkers in a memory clinic. Eur J Nucl Med Mol Imaging. 47, 247-255.
la gazette médicale
- Vol. 9
- Ausgabe 7
- Dezember 2020