- Biomarqueurs des démences dans le plasma et le liquide céphalo-rachidien
La recherche de nouveaux traitements qui ciblent la période asymptomatique avant l’ apparition des troubles cognitifs et de la démence en association aux études des biomarqueurs diagnostiques et pronostiques représentent une piste prometteuse pour l’ avenir. Nous allons revoir les biomarqueurs des démences validés pour l’ utilisation clinique actuelle, ainsi que présenter dans quelles directions la recherche pourra orienter la pratique dans ce domaine.
Les avancées scientifiques conduisent à une démarche diagnostique « clinico-biologique » des démences en utilisant des biomarqueurs permettant de rendre les diagnostics plus précis et précoces, avant l’ apparition des troubles cognitifs (1). L’ intérêt d’ un diagnostic précoce est de pouvoir mettre en place un traitement pharmacologique et un soutien approprié pour le patient et son entourage (2). Pour cette raison, le développement de nouveaux traitements qui ciblent la période asymptomatique, mais biologiquement active de la maladie, est suivi des études des biomarqueurs diagnostiques et pronostiques.
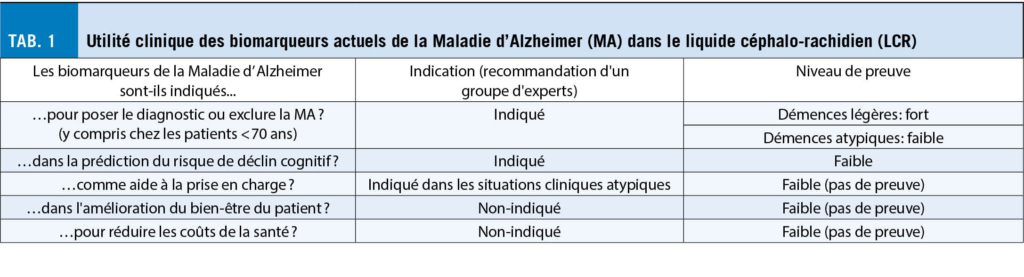
Le développement des biomarqueurs des démences a nettement évolué depuis le milieu des années 2000, principalement par l’ identification et la validation des biomarqueurs du liquide céphalo-rachidien (LCR) pour la maladie d’ Alzheimer (MA)(3). L’ objectif de cet article est de vous présenter un résumé de leur utilisation clinique actuelle, ainsi que quelques pistes prometteuses pour l’ avenir (tab. 1).
Maladie d’ Alzheimer et LCR
La MA est la maladie neurodégénérative la plus fréquente, comptant pour 60 % de toutes les démences (1). La neuropathologie comprend la formation d’ agrégats extracellulaires du peptide β-amyloïde42 (Aβ42) appelés plaques amyloïdes et la dégénérescence neurofibrillaire constituée d’ amas intraneuronaux de filaments de protéines tau hyperphosphorylées. On note une corrélation entre l’ étendue de la dégénérescence neurofibrillaire et la gravité des troubles cognitifs, contrairement aux dépôts de plaques amyloïdes, qui sont souvent diffus au moment du début des symptômes (1).
Trois principaux biomarqueurs du LCR sont reconnus dans la MA et ont été évalués dans de nombreuses études. Il s’ agit de l’ Aβ42, de concentration diminuée en raison de son accumulation dans les plaques corticales, de la protéine tau totale (Tau) et de la tau phosphorylée (p-Tau) ; les concentrations élevées de ces 2 derniers marqueurs corrèlent, respectivement, avec la perte neuronale et la dégénérescence neurofibrillaire. Leur sensibilité et spécificité atteignent 85-90 % (4). De telles concentrations se rencontrent également dans le LCR des patients avec une MA au stade de Déficit Cognitif Léger (DCL), dans lequel les troubles cognitifs ne sont pas associés à un retentissement significatif sur l’ autonomie du patient comme dans la démence. En effet, l’ abaissement de l’ Aβ42 dans le LCR précède d’ au moins 10 ans les troubles cognitifs de la MA (4). Cependant, les plaques amyloïdes sont plus prévalentes avec le vieillissement, rendant ce marqueur moins spécifique à partir de 80 ans.
Les contre-indications aux dosages des biomarqueurs du LCR sont celles relatives à la réalisation de la ponction lombaire, comme l’ hypertension intra-crânienne, les troubles de la crase (y compris les traitements anticoagulants) ou les infections cutanées au site de ponction. Le risque inhérent à l’ arrêt de l’ anticoagulation pour réaliser la ponction lombaire doit toujours être minutieusement considéré. Les données de la littérature divergent concernant la supériorité des biomarqueurs du LCR comparés à d’ autres biomarqueurs basés sur la neuro-imagerie structurelle, fonctionnelle ou amyloïde (IRM, 18F-FDG-TEP ou TEP-Amyloïde). Il n’ y a donc pas de recommandation pour l’ utilisation préférentielle d’ un biomarqueur en particulier. Ce choix dépendra plutôt du coût et de la disponibilité de l’ examen, ainsi que de l’ expertise locale de la clinique mémoire.
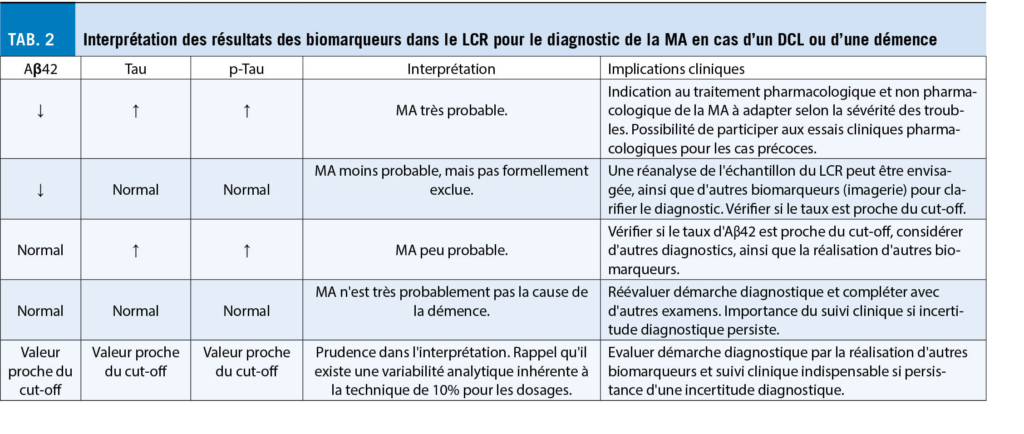
Dans la pratique clinique actuelle, les biomarqueurs de la MA dans le LCR présentent une utilité pour le diagnostic de la MA, notamment au stade léger ainsi que dans le diagnostic différentiel des tableaux cliniques atypiques (âge précoce, atteinte non-mnésique au premier plan, etc.) (tab. 2).
Autres démences et biomarqueurs du LCR
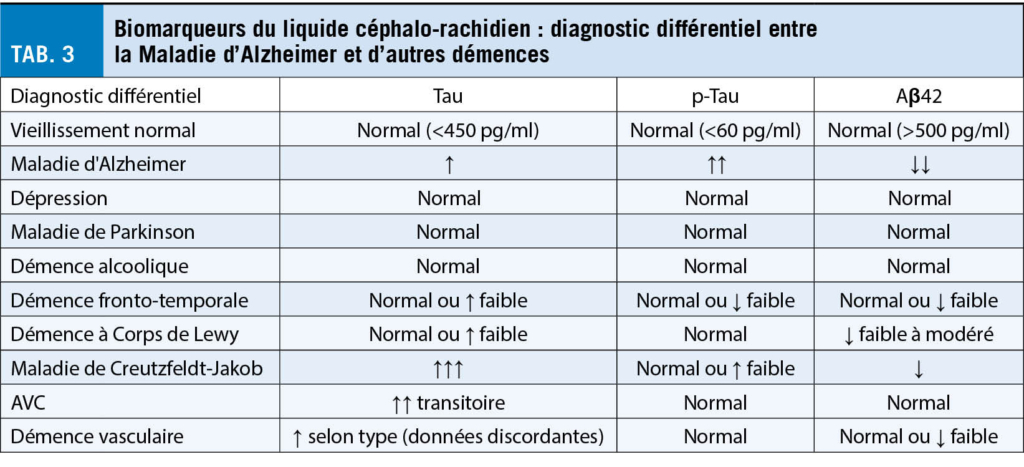
L’ utilisation clinique des marqueurs LCR de la MA dans le diagnostic différentiel des démences est résumée dans le tableau 3.
Finalement, rappelons ici les maladies plus rares comme le Creutzfeldt-Jakob, pour laquelle la présence de la protéine 14-3-3 dans le LCR est une grande aide au diagnostic, ainsi que les encéphalites auto-immunes, para-néoplasiques et infectieuses où des anticorps spécifiques peuvent être retrouvés dans le LCR. Bien que disponibles dans la pratique, ces analyses ne font pas l’ objet d’ une pratique routinière, mais complètent la démarche lors d’ un tableau clinique évocateur.
D’ autres biomarqueurs sont élevés dans certaines pathologies cognitives tels que le neurofilament de chaîne légère (Nf-L) qui reflète une destruction axonale ou encore les marqueurs d’ inflammation tels que la métalloprotéase matricielle 9 (5, 6).
La maladie de Parkinson et la démence à Corps de Lewy résultent de l’ accumulation d’ alpha-synucléine (α-syn) au niveau cérébral dans des inclusions appelées « corps de Lewy » observées chez des patients souffrant de ces deux maladies apparentées (7). Des plaques amyloïdes et une dégénérescence neurofibrillaire sont aussi souvent présentes (jusqu’ à 40 % des cas). Le dosage dans le LCR des concentrations de α-syn ne permet pas de faire le diagnostic différentiel entre les synucléinopathies. On remarque toutefois des concentrations diminuées d’ α-syn totale et augmentées d’ α-syn oligomérique et phosphorylée chez le malade de Parkinson comparé aux contrôles, représentant des possibles marqueurs dans la pratique clinique d’ avenir.
Ces formes mixtes avec la MA diffèrent dans le pronostic ; les concentrations basses d’ Aβ42 dans le LCR sont associées au développement de l’ atteinte cognitive chez les patients avec une Maladie de Parkinson. Pour la démence à Corps de Lewy, les concentrations de Tau sont plus élevées que dans la maladie de Parkinson, mais plus basses que dans la MA, avec une association entre la concentration retrouvée et la sévérité de la démence. Pour l’ instant l’ utilisation de ces marqueurs n’ est pas validée cliniquement en dehors du diagnostic de MA.
Biomarqueurs des démences dans le plasma
Ils présentent des avantages en comparaison aux marqueurs du LCR tels que la facilité de réalisation d’ un bilan sanguin dans différents contextes (cabinet, hôpital, domicile), la praticité d’ ajouter le dosage à d’ autres marqueurs faisant déjà partie du contrôle de santé habituel, avec une procédure moins invasive et potentiellement moins coûteuse que les biomarqueurs par tomographie par émission de positons (TEP-Amyloïde, TEP-Tau).
Jusqu’ à présent, ils ne font l’ objet que de protocoles de recherche, et aucun des marqueurs mentionnés ci-dessous ne présente une précision, une standardisation et une reproductibilité suffisantes pour être mis en œuvre en pratique clinique. En plus, les biomarqueurs reflétant l’ activité du système nerveux central ont une très faible concentration dans le sang périphérique et ils peuvent être le produit d’ une activité non cérébrale ou fluctuer en fonction d’ une perturbation de leur clairance.
La plupart des études réalisées jusqu’ à présent portent sur les marqueurs classiques de la MA: Aβ, Tau et p-Tau, suivis des marqueurs génétiques et de biomarqueurs basés sur d’ autres mécanismes liés à la démence tels que l’ inflammation, la réponse immunitaire, le stress oxydatif, les lésions de l’ ADN, un dysfonctionnement mitochondrial et des lésions neuronales ou microvasculaires. À l’ heure actuelle, il existe plus de 150 biomarqueurs sanguins, nous résumons ici ceux ayant le plus grand potentiel d’ utilisation clinique :
1. Aβ42, Aβ40 et le ratio Aβ42/Aβ40 : Plusieurs études ont démontré des taux plasmatiques de Aβ42, Aβ40 et Aβ42/Aβ40 progressivement plus faibles chez les personnes avec un déclin cognitif subjectif, un DCL et une démence due à la MA en comparaison aux personnes sans maladie ni plainte cognitive. Néanmoins, il existe une grande variabilité avec une mauvaise concordance entre les différentes techniques proposées. L’ expression périphérique d’ Aβ, notamment celle secondaire à la libération des peptides Aβ par les plaquettes et les cellules endothéliales, principalement dans la version du peptide composé par 40 aminoacides (l’ Aβ40), ainsi que les autres protéines sériques sont des facteurs confondants supplémentaires diminuant l’ utilité de ces dosages (8).
2. Tau et p-Tau : Celui qui présente le plus grand potentiel clinique est le dosage de p-Tau, avec une corrélation mieux établie avec les taux dans le LCR. Deux isoformes présentent les résultats les plus encourageants : p-Tau181 et p-Tau217, la dernière a été démontrée comme supérieure dans une étude récente, qui a démontré que la p-Tau217 présente une sensibilité et spécificité de 91 % dans la différentiation d’ une démence due à la MA en comparaison à d’ autres étiologies neurodégénératives. Il s’ agit du résultat le plus significatif de tous les marqueurs plasmatiques étudiés jusqu’ à présent, mais qui nécessitera une validation au niveau populationnel (9, 10).
3. Nf-L : Il s’ agit d’ une protéine localisée exclusivement dans le cytoplasme neuronal, décrite comme un marqueur sensible mais non spécifique de lésion axonale dans plusieurs maladies neurologiques, dosée dans le LCR et dans le plasma. Des taux sériques élevés ont été retrouvés chez les personnes avec une MA, mais aussi dans les cas des démences vasculaires y compris après un accident vasculaire cérébral, les démences fronto-temporales, les syndromes parkinsoniens atypiques, l’ hydrocéphalie à pression normale et le traumatisme crânien. Concernant la MA, le Nf-L refléterait la perte neuronale liée à l’ amyloïde comme la protéine p-Tau, mais aussi celle liée à d’ autres mécanismes, étant un marqueur global de la sévérité de la perte neuronale (11).
4. Enzyme de clivage 1 de la protéine précurseur amyloïde du site β (BACE1) : Il s’ agit de l’ enzyme responsable du premier clivage à l’ origine des peptides Aβ. L’ activité enzymatique mesurée dans le plasma est progressivement augmentée chez les patients avec un DCL qui ont évolué vers une démence de type Alzheimer lors d’ un suivi de 3 ans (12).
5. Autres : Les micro ARN (ARNmi) sont des petits ARN (18-25 nucléotides) qui régulent l’ expression d’ autres gènes au niveau post-transcriptionnel. Une catégorie d’ ARNmi associée à différents gènes impliqués dans la MA présente une expression sérique diminuée par analyse de RT-PCR et serait donc un potentiel marqueur dans les stades prodromiques (13). La sous-expression d’ autres classes d’ ARNmi a été décrite dans les démences vasculaires et dans la maladie à Corps de Lewy (14).
Plusieurs biomarqueurs inflammatoires ainsi que les molécules impliquées dans la dysfonction endothéliale et la cascade de coagulation font aussi objet d’ études dans les démences vasculaires et la MA (6). De manière similaire que pour le LCR, les dosages plasmatiques de la α-syn totale, phosphorylée et sous la forme d’ agrégats sont étudiés dans la maladie à Corps de Lewy et la maladie de Parkinson (17).
Conclusions
L’ approche clinico-biologique dans le diagnostic des démences, ainsi que les essais thérapeutiques allant vers les phases pré-symptomatiques des maladies ont accéléré la recherche des biomarqueurs plasmatiques et du liquide céphalo-rachidien.
Bien que seuls les biomarqueurs de la Maladie d’ Alzheimer dans le LCR soient utilisés dans la pratique actuelle, la perspective est de développer différents panels de biomarqueurs plasmatiques et du LCR qui puissent à la fois déterminer avec exactitude l’ (es) étiologie(s) de la démence, mais aussi refléter la sévérité de la maladie et par conséquent, être utilisés dans le suivi thérapeutique.
Copyright Aerzteverlag medinfo AG
Service de Gériatrie, Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève
Hôpital des Trois-Chêne
Chemin du Pont-Bochet 3
1226 Thônex.
Service de Gériatrie, Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève
Hôpital des Trois-Chêne
Chemin du Pont-Bochet 3
1226 Thônex.
aline.mendes@hcuge.ch
Les auteurs n’ ont aucun conflit d’ intérêt à déclarer.
- La démarche diagnostique « clinico-biologique » des démences en utilisant des biomarqueurs permet de rendre les diagnostics plus précoces, avant ou au tout début des troubles cognitifs. Cela est parti-
culièrement important pour la recherche de nouveaux traitements pharmacologiques. - Les biomarqueurs du LCR sont altérés de manière précoce dans la Maladie d’ Alzheimer et leur réalisation est actuellement indiquée dans les situations cliniques atypiques et pour confirmer l’ étiologie.
- Les biomarqueurs dans le plasma font objet de plusieurs protocoles de recherche et de résultats récents encourageants pour certains, mais leur utilisation en pratique clinique n’ a pas été validée.
Références :
1. Elahi FM, Miller BL. A clinicopathological approach to the diagnosis of dementia. Nat Rev Neurol. 2017 Aug;13(8):457–76.
2 Simonsen AH, Herukka S-K, Andreasen N, Baldeiras I, Bjerke M, Blennow K, et al. Recommendations for CSF AD biomarkers in the diagnostic evaluation of dementia. Alzheimers Dement J Alzheimers Assoc. 2017 Mar;13(3):274–84.
3 Hampel H, O’Bryant SE, Molinuevo JL, Zetterberg H, Masters CL, Lista S, et al. Blood-based biomarkers for Alzheimer disease: mapping the road to the clinic. Nat Rev Neurol. 2018;14(11):639–52.
4 Olsson B, Lautner R, Andreasson U, Öhrfelt A, Portelius E, Bjerke M, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis. Lancet Neurol. 2016 Jun;15(7):673–84.
5 Llorens F, Schmitz M, Ferrer I, Zerr I. CSF biomarkers in neurodegenerative and vascular dementias. Prog Neurobiol. 2016 May;138–140:36–53.
6 Cipollini V, Troili F, Giubilei F. Emerging Biomarkers in Vascular Cognitive Impairment and Dementia: From Pathophysiological Pathways to Clinical Application. Int J Mol Sci. 2019 Jun;20(11). DOI: 10.3390/ijms20112812
7 Parnetti L, Paciotti S, Farotti L, Bellomo G, Sepe FN, Eusebi P. Parkinson’s and Lewy body dementia CSF biomarkers. Clin Chim Acta Int J Clin Chem. 2019 Aug;495:318–25.
8 Ritchie C, Smailagic N, Noel-Storr AH, Takwoingi Y, Flicker L, Mason SE, et al. Plasma and cerebrospinal fluid amyloid beta for the diagnosis of Alzheimer’s disease dementia and other dementias in people with mild cognitive impairment (MCI). Cochrane Database Syst Rev. 2014 Jun;(6):CD008782.
9 Janelidze S, Mattsson N, Palmqvist S, Smith R, Beach TG, Serrano GE, et al. Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med. 2020;26(3):379–86.
10 Janelidze S, Stomrud E, Smith R, Palmqvist S, Mattsson N, Airey DC, et al. Cerebrospinal fluid p-tau217 performs better than p-tau181 as a biomarker of Alzheimer’s disease. Nat Commun. 2020 03;11(1):1683.
11 Gaetani L, Blennow K, Calabresi P, Filippo MD, Parnetti L, Zetterberg H. Neurofilament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry. 2019 Aug;90(8):870–81.
12 Shen Y, Wang H, Sun Q, Yao H, Keegan AP, Mullan M, et al. Increased Plasma Beta-Secretase 1 May Predict Conversion to Alzheimer’s Disease Dementia in Individuals With Mild Cognitive Impairment. Biol Psychiatry. 2018 01;83(5):447–55.
13 Takousis P, Sadlon A, Schulz J, Wohlers I, Dobricic V, Middleton L, et al. Differential expression of microRNAs in Alzheimer’s disease brain, blood, and cerebrospinal fluid. Alzheimers Dement J Alzheimers Assoc. 2019;15(11):1468–77.
14 Shigemizu D, Akiyama S, Asanomi Y, Boroevich KA, Sharma A, Tsunoda T, et al. A comparison of machine learning classifiers for dementia with Lewy bodies using miRNA expression data. BMC Med Genomics. 2019 30;12(1):150.
15 Engelhart MJ, Geerlings MI, Meijer J, Kiliaan A, Ruitenberg A, van Swieten JC, et al. Inflammatory proteins in plasma and the risk of dementia: the rotterdam study. Arch Neurol. 2004 May;61(5):668–72.
16 Ray S, Britschgi M, Herbert C, Takeda-Uchimura Y, Boxer A, Blennow K, et al. Classification and prediction of clinical Alzheimer’s diagnosis based on plasma signaling proteins. Nat Med. 2007 Nov;13(11):1359–62.
17 Chang C-W, Yang S-Y, Yang C-C, Chang C-W, Wu Y-R. Plasma and Serum Alpha-Synuclein as a Biomarker of Diagnosis in Patients With Parkinson’s Disease. Front Neurol. 2020 Jan;10. DOI: 10.3389/fneur.2019.01388
la gazette médicale
- Vol. 9
- Ausgabe 7
- Dezember 2020