- Neue RET-Inhibitoren für die Behandlung von soliden Tumoren
RET Alterationen erweitern das Spektrum an behandelbaren somatischen und genomischen Tumor-Alterationen wie NTRK-Fusionen, ALK, BRAF, EGFR, MET, ROS1 und Mikrosatelliteninstabilität. Studien mit neuen selektiven RET-Inhibitoren zeigen auf, wie therapeutisch relevant die molekulare Testung des RET-Gens heute ist, und weisen den Weg zu tumor-agnostischen Therapien.
Les altérations RET élargissent le spectre des altérations tumorales somatiques et génomiques traitables telles que les fusions NTRK, ALK, BRAF, EGFR, MET, ROS1 et l’instabilité des microsatellites. Les études sur les nouveaux inhibiteurs sélectifs de RET montrent à quel point les tests moléculaires du gène RET sont aujourd’hui pertinents sur le plan thérapeutique et ouvrent la voie à des thérapies de diagnostic des tumeurs.
RET als Protoonkogen auf Chromosom 10 spielt eine physiologische Rolle in der Embryogenese der Niere und des enterischen Nervensystems. Kloniert wurde das Gen 1985 im Rahmen einer Transfektion von Lymphomzellen und deshalb wurde es mit «rearranged during transfection» (RET) bezeichnet. Kurz darauf folgte die Entdeckung von RET-Fusionen als Treibermutation bei papillären Schilddrüsenkarzinomen (papillary thyroid cancer, PTC).
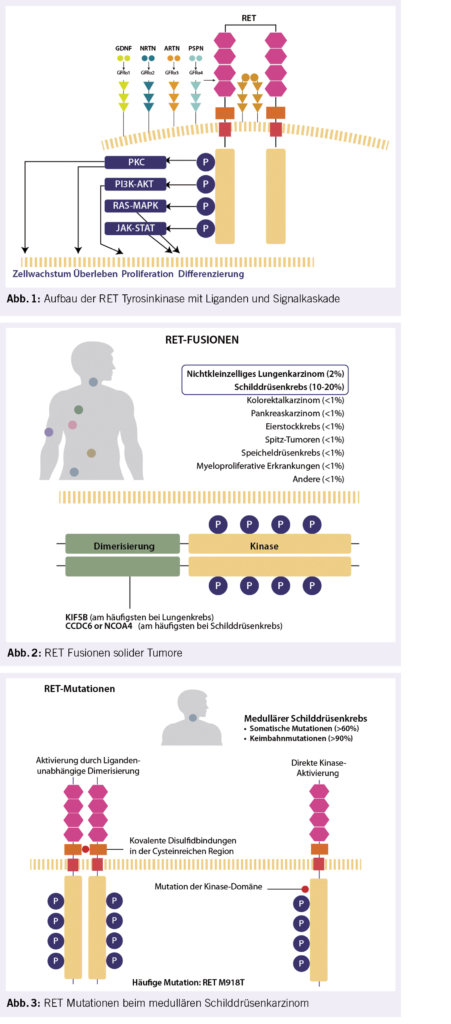
RET kodiert für eine transmembranäre Rezeptortyrosinkinase. Speziell ist, dass RET nicht direkt an seine Liganden, die GDNF (glial cell line-derived neutrotrophic factor) Familie, bindet. Die GDNF Liganden binden zuerst an GFR Alpha-Familie-Rezeptoren (GDNF family receptor) und dies führt zur Homodimerisierung von RET und Autophosphorylierung der intrazellulären Domäne. Über mehrere Signalkaskaden wird die Zellproliferation aktiviert (Abb. 1).
Aktivierende RET-Fusionen (Abb. 2) beinhalten die intakte RET-Kinase Domäne in der 3`-Position, welche eine Fusion mit einem 5`-Partner eingeht. Es sind mehr als 30 verschiedene Fusionspartner bekannt. Die häufigsten Fusionspartner beim Bronchialkarzinom (non-small cell lung cancer, NSCLC) sind KIF5B und beim PTC sind es CCDC6 und NCOA4.
RET-Fusionen finden sich bei 1-2% der NSCLC vom Typ Adenokarzinom (häufig Nichtraucher) und in 5-10% der PTC, wobei eine höhere Frequenz nach Strahlenexposition auftritt. Daneben finden sich RET-Fusionen seltener auch bei anderen soliden Tumoren von Pankreas, Mamma, Ovar und beim kolorektalen Karzinom.
Meist schliessen aktivierende RET-Alterationen andere Treibermutationen aus. RET-Punktmutationen (Abb. 3) können die extrazelluläre Domäne als auch die Kinase-Domäne betreffen. Extrazelluläre Mutationen finden sich oft in der cysteinreichen Region, was zu kovalenten Disulfid-Bindungen und zur ligandunabhängigen Dimerisierung und Signalkaskadenaktivierung führt. Mutationen in der Kinase-Domäne führen zu einer konstitutiven Aktivierung von RET und auch über diesen Weg zur ligandunabhängigen Signalkaskadenaktivierung.
RET-Punktmutationen kommen typischerweise beim medullären Schilddrüsenkarzinom (medullary throid cancer, MTC) vor. Die hereditären multiplen endokrinen Neoplasien (MEN) und das familiäre MTC weisen RET-Keimbahnmutationen auf und machen etwa 25% der medullären Schilddrüsenkarzinome aus. Die restlichen 75% sind sporadische MTC, welche in etwa 60% eine somatische RET-Mutationen aufweisen.
Beim MEN Typ 2A ist am häufigsten die extrazelluläre cysteinreiche Domäne mutiert, beim Typ 2B ist es M918T in der Kinasedomäne und beim familiären MTC ist es V804M. Bei den somatischen Mutationen ist M918T ebenfalls die häufigste Mutation, welche einen aggressiveren Phänotyp bedingt. Mutationen im Codon 804 werden Gatekeeper-Mutationen genannt, da sie zu einer sterischen Hinderung führen, so dass Multikinase-Inhibitoren (MKI) nicht andocken können und eine Resistenz auftritt.
Der Goldstandard für die RET-Testung ist das NGS (next generation sequencing), wobei als Ausgangsmaterial DNA und/oder RNA aus dem Tumor dient. Falls das lokale Labor kein NGS anbietet, kann RET mittels FISH (Fusion) oder PCR (Punktmutation) untersucht und ein positives Resultat extern mit NGS validiert werden. Die Immunhistochemie spielt keine Rolle bei der Diagnostik von klinisch relevanten RET-Alterationen und die «liquid biopsy» ist kein vollwertiger Ersatz für eine Gewebeuntersuchung. Breite NGS-Panels können RET-Punktmutationen anzeigen, die nicht unbedingt prädiktiv sind für ein Ansprechen auf eine zielgerichtete Therapie, vor allem wenn der Tumor viele Mutationen in verschiedenen Genen aufweist und es sich weder um ein Bronchial- noch Schilddrüsenkarzinom handelt. In solchen Fällen ist eine Rücksprache mit Experten ratsam, bevor RET als therapeutisches Ziel erwogen wird.
Bisherige Therapiemöglichkeiten für RET-alterierte Schilddrüsenkarzinome
Patienten mit MTC oder radiojodrefraktärem PTC werden bisher mit Multikinase-Inhibitoren (MKI) behandelt, sofern sie symptomatisch sind oder gemäss RECIST (response evaluation criteria in solid tumors) progredient sind und nicht chirurgisch oder radiotherapeutisch angegangen werden können (ESMO Guidelines).
Für Patienten mit MTC sind bisher Vandetanib (1) (in der Schweiz zugelassen) und Cabozantinib (2) mögliche Optionen. Radiojodrefraktäre PTC werden bisher mit Lenvatinib (3) oder Sorafenib (4) behandelt. Die Ansprechrate (ORR) liegt bei diesen Medikamenten zwischen 12%-65% und das mediane progressionsfreie Überleben (PFS) bei 10-30 Monaten.
Aufgrund dessen, dass es sich bei all diesen Medikamenten jedoch um nicht spezifische RET- Inhibitoren, sondern um MKI mit einer gewissen «off-target activity» handelt, zeigen sich häufig entsprechende Nebenwirkungen wie Hautausschlag, Hypopigmentierungen, Hypertonie und Diarrhoe. Oft sind Dosisreduktionen notwendig, was das therapeutische Potenzial weiter einschränkt.
Bisherige zielgerichtete Therapiemöglich-keiten für RET-positive NSCLC
Prospektive Studien wurden durchgeführt mit Vandetanib, Lenvatinib und Cabozantinib, wobei Letzteres von allen MKI die beste Wirkung zeigte, aber auch die bekannten Nebenwirkungen. GLORY, eine globale «real world»Registerstudie, bei der auch Schweizer Zentren teilnahmen, blieb ebenfalls deutlich unter den Erwartungen, mit einem PFS zwischen 2-3 Monaten und einer ORR von 18%-37% (5). MKI werden heute für die Behandlungen von RET-positiven NSCLC kaum noch verwendet, da jetzt bessere Inhibitoren verfügbar sind.
Neue potente und hochselektive RET-Inhibitoren
Aufgrund der klinisch relevanten Nebenwirkungen und der suboptimalen Pharmakokinetik von MKI, wurden hochselektive Inhibitoren entwickelt. Das Ziel war auch die Hemmung von Tumoren mit der Gatekeeper-Mutation RET-V804, welche mit einer erworbenen Resistenz auf MKI assoziiert ist.
Selpercatinib (LOXO-292) und Pralsetinib (BLU-667) wurden beide parallel entwickelt und haben erste Phase I/II Studien abgeschlossen. Diese beiden Medikamente können die Resistenz gegen die Gatekeeper-Mutation RET-V804 umgehen, da sie nicht wie die bisherigen MKI das Tor zum Andocken passieren müssen. Selpercatinib und Pralsetinib binden in einer neuen Methode an die RET-Kinase, indem sie sich um die Torwand herumwinden und so einen sterischen Zusammenstoss mit RET-V804 vermeiden. Dies zeigt die Bedeutung von Computermodellen bei der Entwicklung von Krebsmedikamenten der neusten Generation.
Klinische Studien mit Selpercatinib und Pralsetinib
Die Zulassungsstudie von Selpercatinib, LIBRETTO-001, ist eine laufende Phase I/II Studie (6, 7), die an 65 Zentren in 12 Ländern durchgeführt wird, darunter auch in der Schweiz (Luzern).
Nebst Patienten mit RET-alterierten Schilddrüsenkarzinomen und RET-fusionspositiven NSCLC (diese Kohorten sind inzwischen für die Rekrutierung geschlossen) können immer noch Patienten mit anderen soliden Tumoren mit aktivierender RET-Alteration eingeschlossen werden. Die Sicherheit, Verträglichkeit und Wirksamkeit wurde inzwischen bei 531 Patienten evaluiert. Knapp die Hälfte (48%) der ausgewerteten Patienten hatte ein Schilddrüsenkarzinom und ebenfalls knapp die Hälfte (48%) ein NSCLC.
Der primäre Endpunkt des Phase I Teils war die Dosisfindung, derjenige des Phase II Teils die Gesamtansprechrate in definierten Kohorten mit NSCLC, respektive MTC/PTC. Sekundäre Endpunkte waren Dauer des Ansprechens (DOR), PFS und Sicherheit.
In der MTC-Kohorte war die ORR 69% bei den mit Cabozantinib oder Vandetanib vortherapierten Patienten und 73% ohne Vorbehandlung.
In der PTC-Kohorte zeigte Selpercatinib eine ORR von 79%.
In der NSCLC-Kohorte betrug die ORR 64% bei den mit Platin vortherapierten Patienten und 85% bei Patienten ohne Vortherapie. Von 10 Patienten mit messbaren Hirnmetastasen bei Einschluss hatten 9 (90%) ein Ansprechen nach RECIST.
Insgesamt wurde Selpercatinib gut toleriert und nur 2% der Patienten mussten die Therapie aufgrund einer Nebenwirkung stoppen. Selpercatinib zeigte hohe Ansprechraten, welche bei den Patienten mit Schilddrüsenkarzinom vergleichbar sind mit den MKI, mit jedoch besserem Sicherheitsprofil. Bei Patienten mit NSCLC ist die Wirkung deutlich höher als mit MKI und vergleichbar mit zielgerichteten Therapien gegen ALK oder ROS1.
Selpercatinib (Retsevmo®) wurde 2020 von der FDA für die Therapie RET-positiver metastasierter MTC, PTC oder NSCLC unabhängig von der Therapielinie zugelassen. Die Zulassung in der Schweiz wird Anfang 2021 erwartet. Im Ausland wird die Wirksamkeit von Selpercatinib im Vergleich zu den jeweiligen Standardtherapien für MTC (LIBRETTO-531) respektive NSCLC (LIBRETTO-431) im Rahmen eines Phase-III-Programms geprüft.
Die Phase I/II ARROW-Studie (8, 9) untersuchte in den gleichen Indikationen die Wirksamkeit von Pralsetinib (BLU-667). Auch hier zeigte sich eine ORR von 60% bei Cabozantinib oder Vandetanib vortherapierten MTC und eine ORR von 74% bei Patienten ohne Vortherapie. Bei NSCLC zeigte sich eine ORR von 65%, mit intrazerebralem Ansprechen bei 56% der auswertbaren Fälle. Pralsetinib (Gavreto®) wurde 2020 von der FDA zugelassen und wird nun in einer Phase III-Studie (AcceleRET lung) bei RET- NSCLC geprüft. Diese Studie soll an zwei Schweizer Zentren aktiviert werden.
Ausblick
Selpercatinib und Pralsetinib gelten heute als die besten RET-Inhibitoren. In der Praxis ist es oftmals so, dass Kliniker diesen TKIs den Vorzug über MKI geben möchten. Resultate aus den Erstlinienstudien sind nicht vor 2022 zu erwarten, weshalb der Einsatz in frühen Linien hier individuell mit Patienten, Versicherungen und Firmen abgeklärt werden muss, sollten sich die Swissmedic Zulassungen wie erwartet auf vorbehandelte Patienten beschränken. Resistenzen auf Selpercatinib und Pralsetinib sind durch ähnliche Mutationen im Codon 810 charakterisiert, sodass ein Wechsel vom einen auf das andere kaum Sinn macht (10). Aktuell arbeiten Firmen an neuen Präparaten, welche auch bei Tumoren mit RET-810 Mutation wirken sollen. Zudem weisen gewisse resistente Tumoren eine MET-Amplifikation auf (11). Ob Studien mit Kombinations-TKI-Therapien bei diesen seltenen Entitäten machbar sind, wird sich zeigen.
Copyright bei Aerzteverlag medinfo AG
FMH Med. Onkologie und Innere Medizin
Ernährungsmedizin DAEM/DGEM
Leitende Ärztin Medizinische Onkologie
Luzerner Kantonsspital, Tumorzentrum, Spitalstrasse, 6000 Luzern 16
daniela.weiler@luks.ch
FMH Med. Onkologie und Innere Medizin
Co-Chefarzt Medizinische Onkologie
Luzerner Kantonsspital, Tumorzentrum, Spitalstrasse, 6000 Luzern 16
oliver.gautschi@luks.ch
DW und OG nahmen als LIBRETTO-Studienärzte an meetings und advisory boards der Herstellerfirma LILLY teil. OG ist zudem Berater für diese Firma, welche jedoch beim Verfassen dieses Artikels nicht beteiligt war.
◆ Behandelbare RET-Treibermutationen spielen bei metastasierten Schilddrüsen- und Bronchialkarzinomen eine wichtige Rolle. RET Fusionen finden sich in 1-2% der NSCLC und in 5-10% der PTC.
◆ 25% der MTC sind hereditär und weisen Keimbahnmutationen auf, die restlichen 75% sind sporadisch mit somatischer RET Mutation in 60%.
◆ Multikinase Inhibitoren haben aufgrund ihrer «off target» Aktivität relevante Nebenwirkungen und eine suboptimale Antitumoraktivität.
◆ Die neuen RET-Inhibitoren Selpercatinib und Pralsetinib sind hochselektiv und potent und zeigen dadurch höhere Ansprechraten bei besserer Verträglichkeit Sicherheitsprofil.
◆ Testung auf behandelbare RET-Alterationen ist heute zumindest bei metastasierten Schilddrüsen- und Bronchialkarzinomen obligat.
Messages à retenir
◆ Les mutations traitables de RET jouent un rôle important dans les
carcinomes métastatiques de la thyroïde et des bronches. Les fusions RET se trouvent dans 1-2% des NSCLC et dans 5-10% des PTC.
◆ 25% des MTC sont héréditaires avec des mutations germinales et les 75% restants sont sporadiques avec une mutation somatique
RET dans 60% des cas.
◆ Les inhibiteurs de multikinase ont des effets secondaires importants et une activité antitumorale sous-optimale en raison de leur activité «hors cible».
◆ Les nouveaux inhibiteurs de RET, le selpercatinib et le pralsetinib, sont très sélectifs et puissants et présentent donc des taux de réponse plus élevés avec une meilleure tolérance Profil de sécurité.
◆ Les tests de détection des altérations de RET traitables sont désormais obligatoires, au moins pour les carcinomes métastatiques de la thyroïde et des bronches.
- Wells SA et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 2012; 30(2): 134–141
- Elisei R et al. Cabozantinib in progressive medullary thyroid cancer. J Clin Oncol 2013; 31(29): 3639–3646
- Schlumberger M et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 2015; 372(7): 621–630
- Brose MS et al. Sorafenib in radioactive iodine refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 2014; 384(9940): 319–328
- Gautschi O et al. Targeting RET in Patients With RET-Rearranged Lung Cancers: Results From the Global, Multicenter RET Registry. J Clin Oncol 2017,35(13): 1403-1410
- Wirth LJ et al. Efficacy of selpercatinib in RET-altered thyroid cancers. N Engl J Med 2020; 383: 825-35
- Drilon A et al. Efficacy of selpercatinib in RET fusion–positive non–small-cell lung cancer. N Engl J Med 2020; 383:813-24
- Hu M et al. Results from the registrational phase I/II ARROW trial of pralsetinib (BLU-667) in patients with advanced RET mutation-positive medullary thyroid cancer. ESMO Virtual Congress 2020. Ann Oncol 2020,31 (suppl): abstr 1913O
- Gainor JF et al. Registrational dataset from the phase I/II ARROW trial of pralsetinib (BLU-667) in patients with advanced RET fusion+ non-small cell lung cancer. ASCO20 Virtual Scientific Program. J Clin Oncol. 2020;38 (suppl):abstr 9515
- Solomon B et al. RET Solvent Front Mutations Mediate Aquired Resistance to Selective RET Inhibition in RET-Driven Malignancies. JTO 2020, 15(4):541-549
- Lin JJ et al. Mechanism of resistance to selective RET kinase inhibitors in RET fusion-positive non-small-cell lung cancer. Ann Oncol 2020, 31(12):1725-32
info@onco-suisse
- Vol. 11
- Ausgabe 2
- April 2021