- Faut-il un dépistage de l’ anévrisme de l’ aorte abdominale ?
L’ anévrisme de l’aorte abdominale (AAA) représente encore un risque important de mortalité pour les hommes de plus de 65 ans, malgré une prévalence en baisse. Jusqu’à présent en Suisse, aucun programme national de dépistage n’a été mis sur pied, bien que les données scientifiques favorisent cette piste. Dans le présent article, j’ aimerais défendre l’idée du dépistage de l’ AAA en Suisse. Je souhaite également vous exposer les différentes lacunes de connaissances et les doutes existants au sujet du dépistage.
Les hommes de plus 65 ans, en particulier les fumeurs et anciens fumeurs, sont les plus touchés par l’ AAA. Le risque de rupture lié dépend fortement du diamètre de l’ anévrisme, qui, normalement, augmente avec l’ âge. Une opération est indiquée en cas de symptômes, d’ accroissement rapide du diamètre (> 1 cm/an) ou à partir d’ un diamètre de 5.5 cm. Dans le cas de petits anévrismes, le risque de rupture est bas et ne justifie donc pas une intervention, raison pour laquelle les contrôles échographiques sont privilégiés (1).
Malheureusement, il faut considérer encore aujourd’ hui le risque de mortalité comme élevé en cas de rupture. Une grande partie des patients meurent encore avant d’ arriver à l’ hôpital, et le taux de mortalité est de plus de 30% dans le cas d’ une opération d’ urgence (2). En Suisse, en 2017, environ 300 personnes ont été hospitalisées après qu’ une rupture d’ AAA ait été diagnostiquée (3). Contrairement à d’ autres pays européens, comme le Danemark ou la Grande Bretagne, nous ne disposons pas d’ un programme national de dépistage (4). Les raisons de cette situation ne sont pour moi pas évidentes, lorsqu’ on pense par exemple au programme de dépistage déjà mis en place dans le domaine de l’ oncologie. Je vous donne ici un aperçu des données probantes penchant en faveur d’ un programme de dépistage. En raison de l’ absence d’ un programme national de dépistage, les médecins de premier recours ont un rôle central dans la détection précoce de l’ AAA.
Un programme de dépistage utile devrait remplir les critères suivants (5) :
- La maladie doit avoir un impact significatif sur la qualité de vie.
- Des possibilités de traitement acceptables doivent exister.
- Existence d’ une période de latence asymptomatique, durant laquelle le diagnostic et le traitement de la maladie entraînent une réduction de la morbidité et de la mortalité.
- Le traitement de la maladie pendant la phase de latence doit amener de meilleurs résultats qu’ une prise en charge après l’ apparition de symptômes.
- La pose du diagnostic doit être bon marché et peu contraignante.
Il s’ avère que le dépistage pour l’ AAA remplit ces critères de manière idéale. Quatre grandes études randomisées ont déjà été consacrées à comprendre si le dépistage pour l’ AAA pouvait réduire la mortalité auprès du groupe cible (les hommes de plus de 65 ans) dans le cas d’ anévrisme (6-9). Deux de ces études ont été menées en Grande Bretagne, une au Danemark et une autre en Australie. Une seule de ces quatre études a été dédiée à la même question concernant les femmes (10). A chaque fois, la méthode de diagnostic utilisée a été l’ échographie, qui permet de poser un diagnostic exact dans 98.5 % des cas (fig. 1) (11).
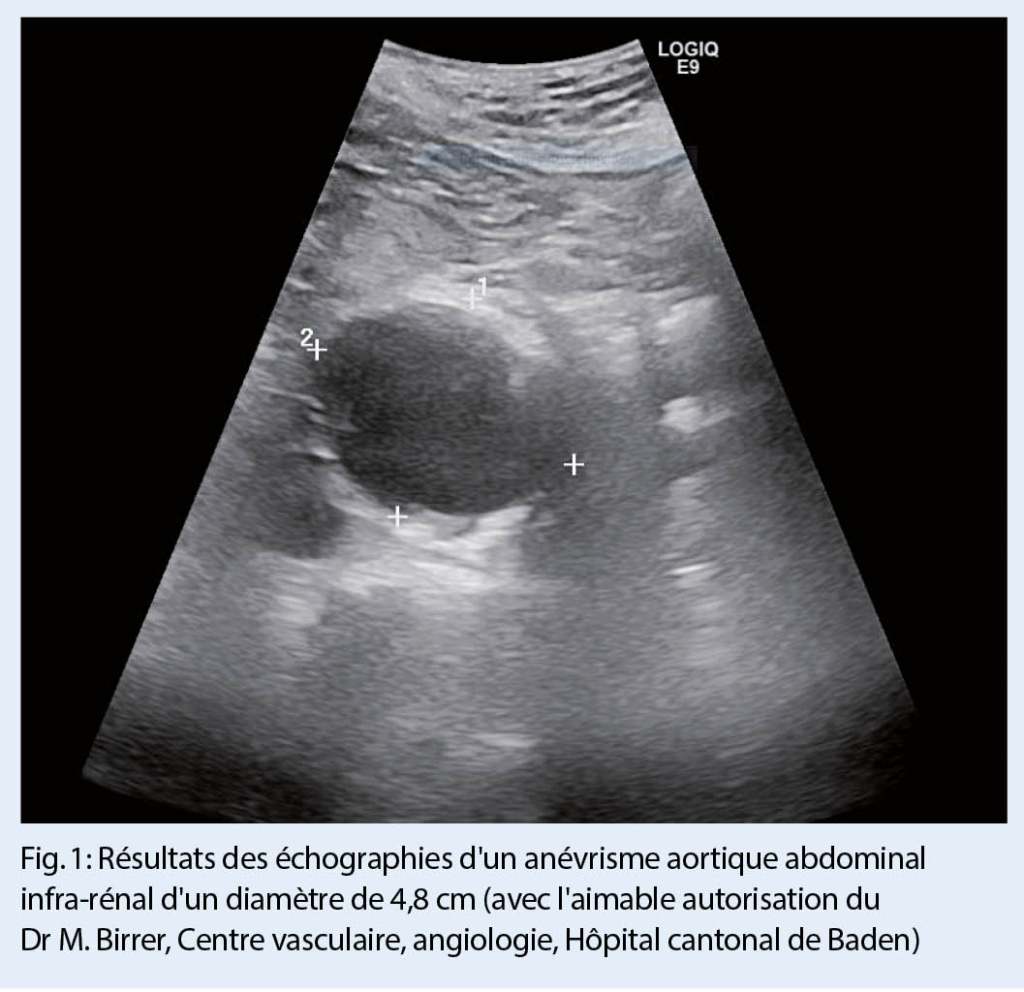
La méta-analyse de la Bibliothèque Cochrane a démontré une réduction significative de la mortalité spécifique à l’ anévrisme d’ environ 40 % chez les hommes des groupes ayant été dépisté, après trois à cinq ans de suivi (Odds Radio 0,95, 95 % CI 0,85-1,07)(12). Cela s’ applique également, bien que dans une faible mesure, à la mortalité totale, qui a été réduite dans les groupes dépistés même après un long suivi (rapport de risque de 0,987, IC à 95 % 0,975-0,99, p = 0,03) (13). Sur la base des données de l’ étude britannique MASS (Multicentre Aneurysm Screening Study), le modèle suivant peut être créé : en supposant que 80 % des patients inscrits viennent au dépistage et que la mortalité postopératoire d’ une chirurgie élective d’ un anévrisme est de 5 %, ce qui est plutôt élevé selon les normes actuelles, 240 hommes doivent être invités pour éviter un décès prématuré de 10 ans lié à un anévrisme (nombre nécessaire pour le dépistage = 240) (14). Plusieurs systèmes de santé nationaux (comme par exemple le Preventive Services Task Force, les lignes directrices du NICE) ont estimé que cette mesure était rentable.
Comme mentionné plus haut, le dépistage chez les femmes n’ a été analysé que dans le cadre de petites études. En raison de la prévalence plus faible de l’ AAA chez les femmes et surtout en raison de leur apparition plus tardive dans la vieillesse, l’ étude de Chichester n’ a pas pu établir de réduction de la mortalité associée à l’ AAA. La fréquence accrue des comorbidités chez les personnes âgées, qui augmentent le risque en cas d’ opération, et le taux de rupture plus élevé dans les groupes de contrôle et de dépistage expliquent ce résultat (10).
Les critiques soulignent des dommages potentiels qui pourraient être provoqués par le dépistage. Ceux-ci sont à chercher, d’ une part, dans la morbidité et la mortalité des interventions électives déclenchées par le dépistage. D’ autre part, certaines études constatent une influence négative du dépistage sur la qualité de vie et demandent, bien que cette influence soit faible, que l’ on dispose de plus de données à ce sujet (15).
Un autre point de discussion est le fait que dans le suivi de l’ étude MASS, une diminution de l’ effet protecteur du dépistage a été observée après environ huit ans. Cela était dû à des ruptures d’ anévrisme chez des patients qui étaient encore considérés comme normaux au moment du dépistage. La moitié de ces patients présentaient déjà une ectasie aortique (diamètre 2-2,9 cm) au moment du dépistage. Afin de compenser cet effet, un contrôle est généralement proposé à ces patients après 5 à 10 ans. Comme il s’ agit d’ un petit nombre de personnes, peu de ressources sont nécessaires (16).
Toutes les études contrôlées et randomisées ont débuté au siècle dernier et nous savons que la prévalence (alors de 4 à 7 %), ainsi que l’ incidence de rupture de l’ AAA, sont plutôt en baisse (17). L’ utilisation plus courante des techniques endovasculaires, qui n’ ont pas été utilisée lors de l’ étude MASS, a entraîné une réduction de la mortalité péri-opératoire. En outre, les examens de tomodensitométrie et d’ IRM dans d’ autres disciplines ont entraîné une augmentation constante du diagnostic précoce opportuniste des AAA. L’ espérance de vie de l’ ensemble de la population a augmenté. Il est donc légitime de se demander si les résultats de ces études sont encore valables aujourd’ hui, pour les raisons susmentionnées.
Cela a pu être démontré de manière impressionnante en Suède. La diminution de la prévalence de l’ AAA à 1,5 % (IC 1,5 %-1,6 %) est pour ainsi dire compensée par une diminution de la mortalité péri-opératoire dans le groupe de dépistage à 0,9 %. Il en résulte un rapport coût-efficacité supplémentaire de 7 770 euros par QUALY (Quality Adjusted Life Year Gain), ce qui est considéré comme efficace pour un programme de dépistage (<25 000 euros) (18). Actuellement, dans l’ étude danoise VIVA, une réduction de la mortalité – toutes causes confondues – pourrait également être démontrée par le dépistage de la population (19). Il existe donc de nombreuses preuves de la pertinence du dépistage de l’ AAA au niveau de la politique de santé pour la population d’ aujourd’ hui. Ces deux études contredisent ainsi l’ opinion commune selon laquelle les AAA seraient de nos jours de toute façon (co-)détectés tôt ou tard lors d’ un autre examen radiologique.
Trois sous-groupes méritent une attention particulière :
- Depuis des années, des schémas familiaux de maladies d’ AAA ont été décrits. Cette observation a été scientifiquement prouvée par Emma Larsson et ses collègues, qui ont constaté un doublement du risque de maladie d’ anévrisme chez les parents au premier degré (20). Il en résulte la recommandation d’ un dépistage de l’ AAA dès l’ âge de 50 ans.
- En raison de l’ association fréquente des AAA avec les anévrismes artériels périphériques, le dépistage est recommandé aux patients atteints d’ anévrismes poplités et périphériques. Ravn et al. ont constaté une coïncidence allant jusqu’ à 40 % des deux maladies dans leur population de patients (21).
- En raison des facteurs de risque communs tels que l’ abus de nicotine, l’ hypertension et l’ hypercholestérolémie, l’ idée de dépister les patients souffrant de sténose carotidienne, de maladie coronarienne ou de maladies artérielles périphériques pour l’ AAA s’ impose. Cependant, il ne fournit pas de données exactes à ce sujet, et il faut supposer que la prévalence accrue de l’ AAA chez ces patients s’ accompagne également d’ une comorbidité accrue et d’ une espérance de vie réduite. Ceci pourrait réduire l’ utilité du dépistage. Il n’ est donc pas clair si le dépistage de ce sous-groupe est particulièrement recommandable du point de vue de l’ économie de la santé (22).
Nous souhaitons cependant souligner ici l’ importance d’ une prophylaxie secondaire optimale au moyen d’ un traitement antiagrégant plaquettaire, de statines et de médicaments contre l’ hypertension artérielle. Cela améliore considérablement le pronostic à long terme chez les patients chez qui un AAA ou une ectasie aortique ont été diagnostiqués (23, 24).
La conclusion est que le dépistage de l’ AAA est nécessaire. Je recommande un seul examen échographique de l’ aorte chez les patients de sexe masculin âgés de plus de 65 ans. Les patients dont l’ aorte présente un diamètre supérieur à 5 cm devraient être directement dirigés vers un chirurgien vasculaire. Il n’ y a pas de recommandation de contrôle dans le cas d’ aortes normales de moins de 2 cm de diamètre. Toutes les autres aortes devraient être contrôlées régulièrement par échographie. Un programme national de dépistage aurait sans aucun doute le potentiel de réduire la mortalité liée aux anévrismes dans notre pays.
Article traduit de « der informierte arzt » 2019;9(12):13-14
Copyright Aerzteverlag medinfo AG
Gefässzentrum
Kantonsspital Baden
Im Ergel 1
5401 Baden
stephan.engelberger@ksb.ch
L’ auteur n’ a déclaré aucun conflit d’ intérêt avec cet article.
◆ L’ AAA est parfaitement adapté au dépistage en raison de la longue période de latence asymptomatique dans la plupart des cas et de la mortalité élevée en cas de rupture.
◆ Les programmes de dépistage peuvent réduire considérablement la mortalité liée aux anévrismes.
◆ Chez les hommes de plus de 65 ans, une seule échographie de l’ aorte abdominale est donc conseillée.
1. Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. Eur J Vasc Endovasc Surg. 2019;57(1):8-93.
2. Investigators IT, Powell JT, Sweeting MJ, Thompson MM, Ashleigh R, Bell R, et al. Endovascular or open repair strategy for ruptured abdominal aortic aneurysm: 30 day outcomes from IMPROVE randomised trial. BMJ. 2014;348:f7661.
3. Bundesamt für Statistik Medizinische Statistik der Krankenhäuser. Online Daten Statistisches Lexikon der Schweiz. 2018.
4. Engelberger S, Rosso R, Sarti M, Del Grande F, Canevascini R, van den Berg JC, et al. Ultrasound screening for abdominal aortic aneurysms. Swiss Med Wkly. 2017;147:w14412.
5. Frame PS, Carlson SJ. A critical review of periodic health screening using specific screening criteria. The Journal of Family Practice 1975;2(1):29-36.
6. Scott RA, Wilson NM, Ashton HA, Kay DN. Influence of screening on the incidence of ruptured abdominal aortic aneurysm: 5-year results of a randomized controlled study. Br J Surg. 1995;82:1066-70.
7. Scott RAP. The Multicentre Aneurysm Screening Study (MASS) into the effect of abdominal aortic aneurysm screening on mortality in men: a randomised controlled trial. The Lancet. 2002;360(9345):1531-9.
8. Lindholt JS, Juul S, Fasting H, Henneberg EW. Screening for abdominal aortic aneurysms: single centre randomised controlled trial. BMJ. 2005;330(7494):750.
9. Norman PE, Jamrozik K, Lawrence-Brown MM, Le MT, Spencer CA, Tuohy RJ, et al. Population based randomised controlled trial on impact of screening on mortality from abdominal aortic aneurysm. BMJ. 2004;329(7477):1259.
10. Scott RA, Bridgewater S. G., Ashton H.A. . Randomized clinical trial of screening for abdominal aortic aneurysm in women. Britisch Journal of Surgery. 2002;89:283-5.
11. Lindholt J. S. VS, Juul S., Henneberg E. W. Fasting H. . The validity of ultrasonographic scanning as screening method for abdominal aortic aneurysm. European Journal of Vascular and Endovascular Surgery. 1999;17:472-5.
12. Cosford PA, Leng GC. Screening for abdominal aortic aneurysm. Cochrane Database Syst Rev. 2007(2):CD002945.
13. Lederle FA. The Last (Randomized) Word on Screening for Abdominal Aortic Aneurysms. JAMA Intern Med. 2016;176(12):1767-8.
14. Thompson SG, Ashton HA, Gao L, Scott RA, Multicentre Aneurysm Screening Study G. Screening men for abdominal aortic aneurysm: 10 year mortality and cost effectiveness results from the randomised Multicentre Aneurysm Screening Study. BMJ. 2009;338:b2307.
15. Cotter AR, Vuong K, Mustelin L, Yang Y, Rakhmankulova M, Barclay CJ, et al. Do psychological harms result from being labelled with an unexpected diagnosis of abdominal aortic aneurysm or prostate cancer through screening? A systematic review. BMJ Open. 2017;7(12):e017565.
16. Thompson SG, Ashton HA, Gao L, Buxton MJ, Scott RA, Multicentre Aneurysm Screening Study G. Final follow-up of the Multicentre Aneurysm Screening Study (MASS) randomized trial of abdominal aortic aneurysm screening. Br J Surg. 2012;99(12):1649-56.
17. Laine MT et al.: A Population-Based Study of Abdominal Aortic Aneurysm Treatment in Finland 2000 to 2014. Circulation. 2017 Oct 31;136:1726-1734
18. Wanhainen A, Hultgren R, Linne A, Holst J, Gottsater A, Langenskiold M, et al. Outcome of the Swedish Nationwide Abdominal Aortic Aneurysm Screening Program. Circulation. 2016;134(16):1141-8.
19. Lindholt JS, Søgaard R. Population screening and intervention for vascular disease in Danish men (VIVA): a randomised controlled trial. The Lancet. 2017;390(10109):2256-65.
20. Larsson E, Granath F, Swedenborg J, Hultgren R. A population-based case-control study of the familial risk of abdominal aortic aneurysm. J Vasc Surg. 2009;49(1):47-50; discussion 1.
21. Ravn H, Wanhainen A, Björk M. Risk of new aneurysms after surgery for popliteal artery aneurysm. Britisch Journal of Surgery. 2008;95:571-5.
22. Wanhainen A, Lundkvist J, Bergqvist D, Bjorck M. Cost-effectiveness of different screening strategies for abdominal aortic aneurysm. J Vasc Surg. 2005;41(5):741-51; discussion 51.
23. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-81.
24. Erbel R, Aboyans V, Boileau C, Bossone E, Bartolomeo RD, Eggebrecht H, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873-926.
la gazette médicale
- Vol. 10
- Ausgabe 4
- Juli 2021








