- Kongressausgabe der info@onkologie
 Hier finden Sie das PDF der Kongresszeitung
Hier finden Sie das PDF der Kongresszeitung
EDITORIAL Best of ASCO 2021
Das zweite virtuelle ASCO Annual Meeting hat an den Börsen weniger Staub aufgewirbelt als auch schon und die überraschenden alltagstauglichen «Breaking News» waren sehr überblickbar. Besonders positiv herausgestochen ist sicherlich der Bereich der urologischen Onkologie, insbesondere für Prostata- und Nierenzellkarzinome.
Dagegen eher blass waren die Neuigkeiten in der gastrointestinalen Onkologie. Beim Mamma- und Lungenkarzinom waren in spezifischen Teilbereichen positive Resultate durchaus vorhanden, wie auch bei vielen weiteren Entitäten.
Das heisst auch, dass an den vielen Fronten wie gehabt in kleineren Schritten gearbeitet wird, neue Targets und Substanzen erprobt, bewährte Therapien optimiert, prädiktive und prognostische Faktoren sowie «companion diagnostics» getestet werden. Da und dort wird über erwartete Langzeit-Daten berichtet und natürlich sind auch erste COVID-19-bezogene Daten bei Krebspatienten bereits greifbar. Nicht überraschend, aber bedrückend sind die vielen Berichte über schlechtere Behandlungsergebnisse bei sozial deprivierten Patientinnen und Patienten – nicht nur, aber vor allem auch wegen massiv zu hohen Kosten sowie fehlender Informationen und fehlender sozialer Unterstützung.

Für unsere LeserInnen mag die Liste der Late Breaking Abstracts (LBA) und die Best-of-Wahl der Kolleginnen und Kollegen von der Veranstaltung der Schweizerischen Arbeitsgemeinschaft für Klinische Krebsforschung (SAKK) «Chicago in the Mountains» ein hilfreiches Instrument sein, um sich schnell einen ersten Überblick zu verschaffen. Diese Nachbearbeitung und Einordnung der wichtigsten Präsentationen des ASCO war wiederum ausgezeichnet gemacht und allen Beteiligten gehört ein grosses Kompliment ausgesprochen. Die Diskussion der GU-Session, z.B. mit Zuschaltung von Tom Powles direkt aus London, war herausragend.
Hier also die LBAs der Plenary Session des ASCO 2021 und die Hitliste des Teams «Chicago in the Mountains», wobei die LBAs auch Teil davon sind.
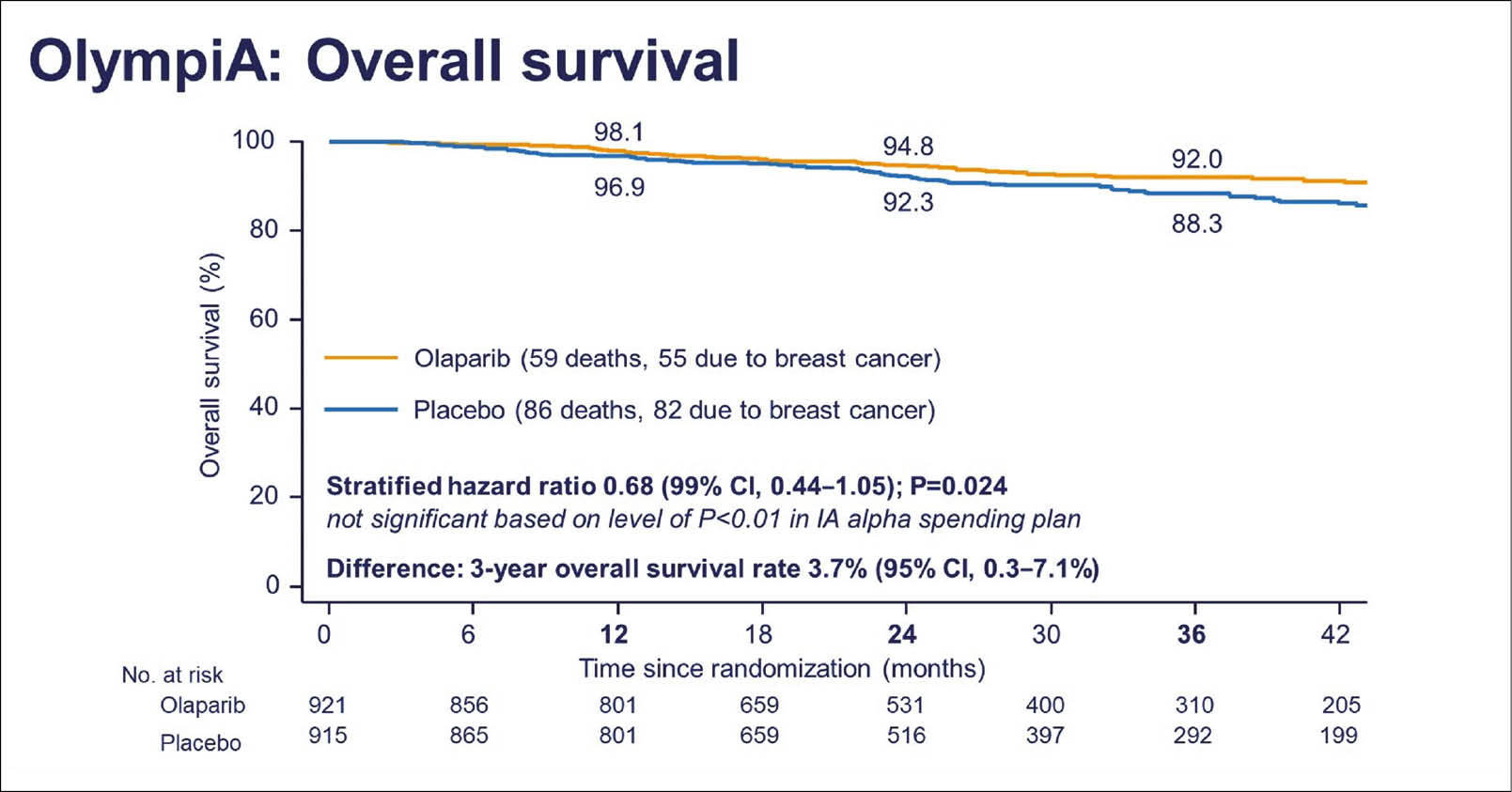
Adjuvanter früher Einsatz von Olaparib bei Patientinnen mit Her2-negativem Brustkrebs mit BRCA-1- oder -2-Mutation.
Die grosse internationale Phase-III-Studie OlympiA ist die erste Studie, die den Einsatz eines PARP-Inhibitors als adjuvante Therapie nach Abschluss einer multimodalen Erstlinien-Standardtherapie untersucht. Es wurden 1836 Patientinnen mit einer BRCA-1- oder BRCA-2-Keimbahnmutation und Brustkrebs mit hohem Risiko und HER2-Negativität eingeschlossen, ebenso wie Patientinnen mit tripel-negativem oder Hormonrezeptor-positivem Mammakarzinom mit einer BRCA-1/2-Keimbahnmutation. Alle Patientinnen hatten zu gleichen Teilen verteilt entweder eine adjuvante oder neoadjuvante Chemotherapie erhalten und waren operiert und gegebenenfalls bestrahlt worden. 1:1 randomisiert erhielten die Patientinnen entweder ein Jahr lang Olaparib (300 mg zweimal täglich) oder Placebo. Der primäre Endpunkt der Studie war das invasive krankheitsfreie Überleben (iDFS), d.h. Überleben ohne invasives Rezidiv, ohne Metastasen und ohne neue sekundäre Malignome. Sekundäre Endpunkte waren das Überleben ohne Fernmetastasen oder neue Malignome (dDFS). Die geplante Interimsanalyse fand nach einer medianen Beobachtungszeit von 2,5 Jahren statt. Unerwünschte Nebenwirkungen (NW) Grad >3 waren im Verum-Arm am häufigsten Anämien (8,7%), Neutropenien (4,8%), Leukopenien (3,0%), Fatigue (1,8%) und Lymphopenien (1,2%) und entsprachen damit dem erwarteten Toxizitätsprofil ohne neue Sicherheitssignale.
Der primäre Endpunkt der Studie wurde bereits zu diesem frühen Zeitpunkt erreicht: im Olaparib-Arm war eine 42%ige Risikoreduktion für das iDFS dokumentiert. Die geschätzte Rate des iDFS nach drei Jahren lag in der Placebogruppe bei 77,1%, in der Olaparib-Gruppe bei 85,9%. Der Unterschied von 8,8% war statistisch signifikant (HR 0,58; 95% KI: 0,41–0,82; p<0,0001). Auch die Raten des auf drei Jahre bezogenen dDFS waren signifikant besser mit 80,4% in der Placebo- und 87,5% in der Olaparib-Gruppe (HR 0,57; 95% KI 0,39–0,83; p<0,0001). In beiden Fällen begannen sich die Überlebenskurven zu separieren. Trotz häufigerer NW war die Lebensqualität der Patientinnen, gemessen mit dem Instrument EORTC QLQ-C30 Global Health, mit Olaparib vergleichbar bezüglich Placebogruppe.
Das Gesamtüberleben (OS) und weitere sekundäre Endpunkte waren zum Zeitpunkt dieser frühen Interimsanalyse noch nicht reif oder signifikant unterschiedlich. Es zeigte sich aber ein Trend zugunsten von Olaparib im OS, und kommende Auswertungen reifer Daten werden hier bald Klarheit schaffen.
ThC
Quelle: LBA1: OlympiA: A phase III, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients with germline BRCA1/2 mutations and high-risk HER2-negative early breast cancer.
Beim Zervixkarzinom ist die adjuvante Carbo/Taxol-Therapie unwirksam
Diese international randomisierte Phase-III-Studie OUTBACK untersuchte bei Patientinnen mit lokal fortgeschrittenem Zervixkarzinom mit FIGO-2008-Stadium IB1 (mit Lymphknotenbefall), IB2, II, IIIB oder IVA, die für eine Standard-Strahlenchemotherapie in kurativer Intention infrage kamen, ob Carbo-Taxol adjuvant nach einer kurativ intendierten Standardtherapie das Gesamtüberleben verbessert. Randomisierte Patientinnen erhielten entweder die Standardtherapie (Kontrollgruppe, n=456) oder zusätzlich adjuvant vier Zyklen Carboplatin/Paclitaxel (ACT: n=463). Primärer Endpunkt der Studie war das Gesamtüberleben OS nach 5 Jahren. Die ACT-Gruppe zeigte zusätzlich die typischen Nebenwirkungen der Chemotherapie: Grad 3-5 Nebenwirkungen über die ersten zwölf Monate nach Randomisierung traten bei 81% und in der Kontrollgruppe bei 62% der Patientinnen auf. Nach einem Jahr litten Patientinnen aus dem ACT-Arm immer noch häufiger an einer Polyneuropathie als Patienten der Standardgruppe (7% vs. 2% sensorische Polyneuropathie Grad 2). Fünf Jahre überlebten in der Standardgruppe 71%, in der ACT-Gruppe 72% der Patientinnen, (HR 0,90; 95% KI: 0,70–117; p=0,8). Auch das PFS zeigte keinen Vorteil für die ACT-Gruppe (HR 0,86; p=0,06). Es fand sich auch kein Unterschied in der Art der Rezidive: vergleichbar viele Patientinnen in beiden Gruppen entwickelten Fernmetastasen. In Subgruppenanalysen fand sich auch bei besonders hohem Rezidivrisiko kein Unterschied.
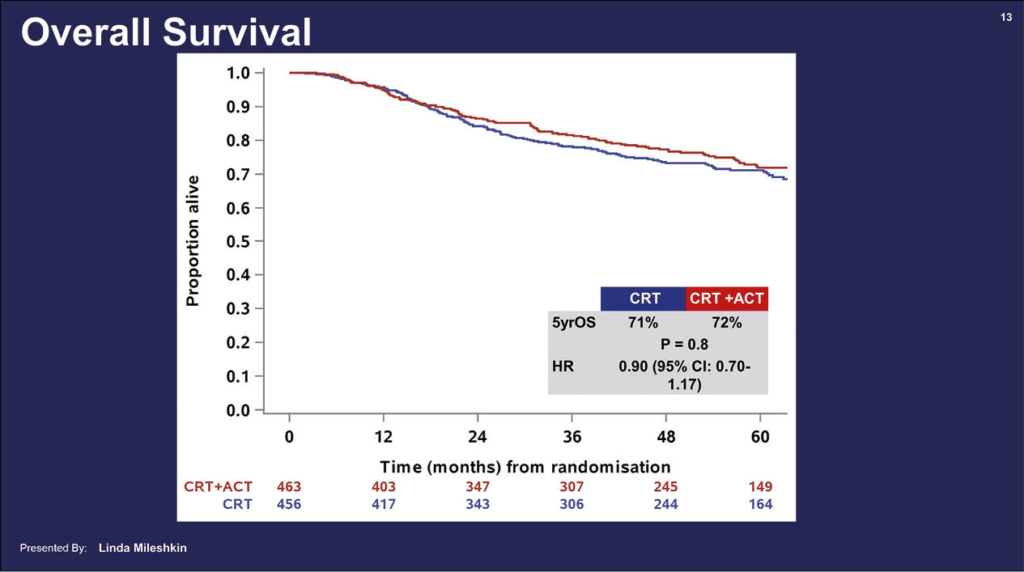
Die Lebensqualität der Patienten in der ACT-Gruppe war nicht nur während der adjuvanten Chemotherapie, sondern auch noch in den 3 bis 6 Monaten danach klar gegenüber der Standardtherapie-Gruppe geringer als in der Kontrollgruppe. Somit ist klar, dass die adjuvante Chemotherapie mit 4 Zyklen Carbo/Taxol bei Patientinnen mit Zervixkarzinom nach initialer Standardbehandlung auch nach 5 Jahren im Gesamtüberleben wirkungslos ist und somit keinen Platz in der Behandlung hat.
ThC
Quelle: LBA3: Adjuvant chemotherapy following chemoradiation as primary treatment for locally advanced cervical cancer compared to chemoradiation alone: The randomized phase III OUTBACK Trial (ANZGOG 0902, RTOG 1174, NRG 0274
CodeBreaK 101-Studie
Sotorasib als Kombinationspartner
Die Mutation des KRAS-G12C ist eine wichtige onkogene Treibermutation. Der spezifische Inhibitor von KRAS-G12C Sotorasib konnte in der CodeBreaK 100-Studie bei Patienten mit einem KRAS-G12C mutierten und intensiv vorbehandelten NSCLC seine Wirksamkeit bei tolerabler Verträglichkeit mit beherrschbarer Toxizität zeigen.
Im Rahmen der offenen Phase-1b-Studie (CodeBreaK 101-Studie) sollen jetzt der Stellenwert und die Sicherheit bzw. Verträglichkeit von Sotorasib allein oder in Kombination mit anderen Substanzen bei Patienten mit fortgeschrittenen oder metastasierten KRAS-G12C mutierten soliden Tumoren bewertet werden. Dazu gehören folgende Tumorentitäten, die mit verschiedenen Kombinationen: behandelt werden:
NSCLC mit Hirnmetasten: Sotorasib-Monotherapie
NSCLC: Sotorasib plus TKI oder Anti-PDL1-Therapie oder Anti-PD1-Therapie oder Chemotherapie
Darmkrebs: Sotorasib plus Anti-VEGF-Therapie plus Chemotherapie
Andere solide Tumoren: Sotorasib plus MEK-Inhibitor + /- EGFR-Inhibitor oder Anti-PD1-Therapie oder SHP2-Inhibitor oder Anti-EGFR-
Therapie + /- Chemotherapie oder CDK-Inhibitor oder mTOR-Inhibitor.
PS
ASCO 2021, #201161
Zelluläre Immuntherapie ist wirksam bei Synovial- und Myxoidem Rundzell-Sarkom
Adaptive zelluläre Immuntherapien mit CAR-T-Zellen sind bei Leukämien und Lymphomen teilweise hochwirksame Therapien mit kurativem Potential. Viele tumorspezifische Antigene sind intrazellulär lokalisiert und sind mit einem CAR-T-Ansatz nicht gezielt angehbar. Dies kann durch die Verwendung von T-Zell-Rezeptoren (TCR) überwunden werden, welche MHC-Peptide erkennen, die von intrazellulären Proteinen abgeleitet sind.
In der Phase-II-Studie SPEARHEAD-1 mit 39 Patienten wurde in einer einarmigen Studie Afamitresgene autoleucel (Afami-cel, früher ADP-A2M4) bei Patienten mit fortgeschrittenem Synovialsarkom und «myxoid/round cell liposarcoma» (MRCLS) geprüft. Afami-cel SPEAR T-Zellen sind gegen MAGE-A4-positive Tumore gerichtet. MAGE-A4 ist stark exprimiert beim Synovialsarkom und MRCLS bei gleichzeitiger Koexpression von HLA-A*02. Eine Phase-I-Studie (CTOS 2020) mit Afami-cel war in dieser Konstellation klar positiv mit klinisch bedeutsamem Ansprechen.
Die 37 Patienten waren zwischen 16-75 Jahre alt, HLA*02-positiv mit MAGE-A4-Expression in ≥ 30% der Tumorzellen, welche ≥ 2+ waren in der Immunohistochemie.
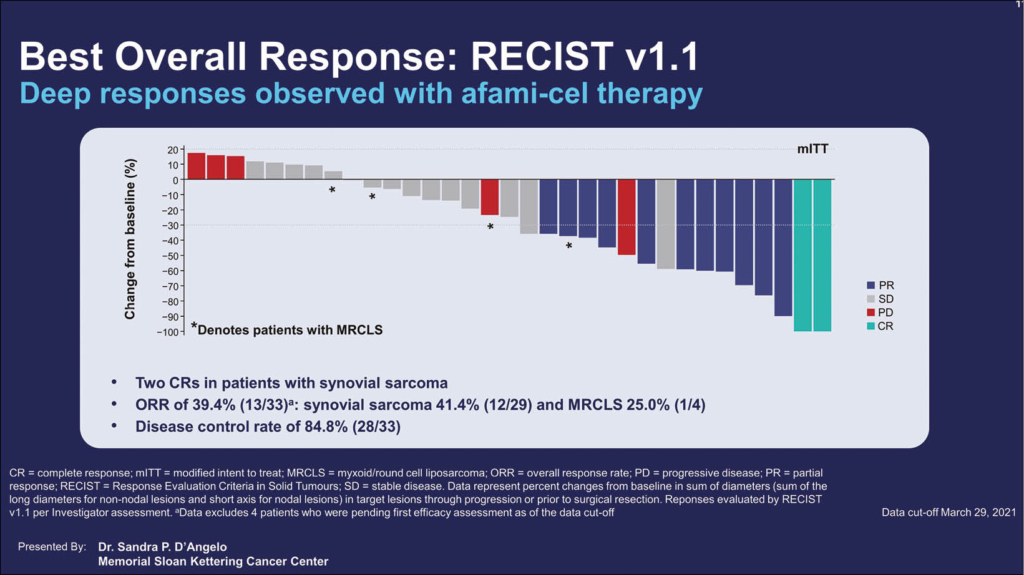
Beim Cut-off 29.3.2021 waren 37 Patienten mit Afami-cel, davon 32 mit Synovialsarkomen, und 5 mit MRCLS behandelt worden. Afami-cel wurden in Dosierungen von 1–10 × 109 transduzierten T-Zellen verabreicht, nach vorangegangener lymphozytenreduzierender Induktion mit Chemotherapie. Der Primäre Endpunkt war OR. 33 Patienten konnten bereits für die OR evaluiert werden, bei 4 Patienten war die Evaluation noch zu früh.
Die OR war 41.4% für Patienten mit Synovialsarkom und 25.0% für MRCLS-Patienten. Eine CR konnte bei 2 Patienten mit Synovialsarkom dokumentiert werden, 10 hatten eine PR und 13 eine stabile Situation SD und 4 einen Tumorprogress PD, d.h. die Krankheitskontrolle war > 80%. Von den 4 Patienten mit MRCLS konnten 1 PR, 2 SD und eine PD dokumentiert werden. Die mediane Dauer des Ansprechens wurde noch nicht erreicht. Als Nebenwirkungen wurden milde Symptome von einem Zytokine-Freisetzungs-Syndrom festgestellt und auch die hämatologischen Nebenwirkungen waren mild und reversibel. Es ist nun eine Fortsetzung der Studie mit total 90 Patienten geplant: 45 in Kohorte (bereits erreicht) 1 und 45 in Kohorte 2. Genetisch modifizierte T-Zell-Rezeptor-gerichtete Therapien sind neben CAR-T-Zellen eine weitere Option der zellulären Immuntherapien und hier darf eine Zulassung dieser innovativen Therapie in naher Zukunft erwartet werden, da es sich um eine «unmet need»-Situation ohne vergleichbare therapeutische Alternativen handelt.
ThC
Quelle: Abstract 11504: SPEARHEAD-1: A phase 2 trial of afamitresgene autoleucel (formerly ADP-A2M4) in patients with advanced synovial sarcoma or myxoid/round cell liposarcoma.
CodeBreaK 100-Studie bei NSCLC
Auch PRO sprechen für Sotorasib
Bei ca. 25 bis 30% aller NSCLC-Patienten findet sich das Onkogen KRASG12C. Sotorasib ist der erste irreversible und selektive KRASG12C-Inhibitor. In der einarmigen Phase-II-Studie (CodeBreaK 100-Studie) erhielten 126 mit 1 bis 3 Therapielinien vorbehandelte Patienten mit einem nicht-leinzelligen Lungenkarzinom (NSCLC), deren Tumor eine KRAS-G12C –Punktmutation auswies, die Substanz in einer Dosierung von 960 mg täglich. Alle Patienten waren vorbehandelt, meist mit einer Platin-basierten Chemotherapie und einem Checkpoint-Inhibitor. Bei einer medianen Dauer von 10,0 Monaten betrug die Ansprechrate (Rückgang der Tumormasse um wenigstens 30%) 37,1% und das PFS lag bei 6.8 Monaten. Bei vier Patienten (3,2%) bildeten sich der Tumor und die Metastasen vollständig zurück. Das Sicherheitsprofil war tolerierbar.
Jetzt wurden Daten über das Patient related Outcome (PRO) berichtet. Analysiert wurden die Gesundheits-bezogene Lebensqualität (QoL), die körperliche Funktionsfähigkeit und die Tumor-Symptome. Es fand sich eine Verbesserung bzw. Aufrechterhaltung der Lebensqualität, der körperlichen Funktionsfähigkeit und der Symptome (Schmerzen, Dyspnoe, Husten, Appetitverlust, Übelkeit, Erbrechen, Schlaflosigkeit, Verstopfung). Diese Daten zusammen mit dem Wirksamkeits- und Sicherheitsprofil stützen die Anwendung von Sotorasib bei dieser Patientenpopulation.
PS
ASCO 2021; #200635
Fortgeschrittenes Magenkarzinom
Chemo plus Nivolumab ist wirksamer als Chemo allein
Im Rahmen einer Phase-3-Studie (CheckMate 649) wurde bei Patienten mit einem fortgeschrittenen Magenkarzinom die Kombination Nivolumab plus Chemotherapie mit der alleinigen Chemotherapie verglichen.
Eingeschlossen in diese Studie wurden 1.581 Patienten mit einem fortgeschrittenen HER2-negativen Karzinom des Magens, der Kardia oder einem Adenokarzinom des Ösophagus. Sie erhielten randomisiert die Kombination Nivo + Chemo (Fluoropyrimidin + Platin-haltige Substanz) oder nur eine Chemotherapie und zwar unabhängig vom PD-L1-Status. Endpunkte waren das OS und das PFS.
Das mediane Gesamtüberleben betrug in der Nivolumab-Gruppe 13,8 Monate im Vergleich zu 11,6 Monate unter der alleinigen Chemotherapie. Bei Patienten mit einem PD-L1-CPS ≥ 5 waren es 14,4 Monate in der Nivolumab-Gruppe vs. 11,6 Monate in der Kontroll-Gruppe. Das mediane PFS lag unter Nivolumab bei 7,7 Monaten im Vergleich zu 6,9 Monate unter der Chemotherapie. Bei der Gesamtüberlebensrate nach 12 Monaten waren es 55% bzw. 48%, bei der PFS-Rate nach 12 Monaten 33% vs. 23%.
Das Sicherheitsprofil war akzeptabel. UEs Grad 3 und 4 traten unter Nivolumab bei 59% auf vs. 44% in der Chemotherapie-Gruppe, wobei die Neutropenie und die Anämie am häufigsten waren. Behandlungsbedingte Schwerwiegende UEs führten bei 22% in der Nivolumab-Gruppe zu einem Behandlungsabbruch gegenüber 24% bei der Chemotherapie.
Fazit: Die Zugabe von Nivolumab zur Chemotherapie führte bei Patienten mit einem Tumor-PD-L1-CPS ≥ 5 zu einem verbesserten Gesamtüberleben und einem verbesserten PFS. Doch alle randomisierten Patienten unabhängig vom PD-L1-Status profitierten bzgl. OS und PFS von Nivolumab.
PS
ASCO 2021
Metastasiertes Hormon-sensitives Prostatakarzinom
Post-hoc-Analyse unterstreicht Ergebnisse der ARCHES-Studie
Im Rahmen der ARCHES-Studie konnte gezeigt werden, dass Enzalutamid plus ADT das radiografische progressionsfreie Überleben bei Männern mit einem metastasierten, aber noch hormonsensitiven Prostatakarzinom signifikant verbessert im Vergleich zur alleinigen ADT. Nach neuen Daten einer Post-hoc-Analyse besteht der Benefit unabhängig davon, wann die Metastasierung nachgewiesen wurde.
Bei der ARCHES-Studie handelt sich um eine randomisierte doppelblinde, placebokontrollierte Phase-III-Studie, welche die Wirksamkeit und Sicherheit von Enzalutamid plus Androgendeprivationstherapie (ADT) bei 1.150 Patienten mit einem metastasierten hormonsensitiven Prostatakarzinom (mHSPC) im Vergleich zur alleinigen ADT untersuchte. Der primäre Endpunkt war das radiografische progressionsfreie Überleben (rPFS). Enzalutamid plus ADT reduzierte das Risiko für rPFS oder Tod um 61% (HR = 0,39; p < 0,0001) im Vergleich mit ADT allein. Die mediane Zeit für ein rPFS-Ereignis war im Verum-Arm noch nicht erreicht und lag im Kontroll-Arm bei 19,4 Monaten.
Signifikante Verbesserungen fanden sich in allen Subgruppen (Erkrankungsmuster zu Studienbeginn, Lokalisation der Metastasen, vorherige Docetaxel-Therapie). So profitierten alle Patienten unabhängig davon, welches Metastasenmuster vorlag: Knochenmetastasen und/oder Weichteilmetastasen und/oder viszerale Metastasen. Bei Patienten ohne viszeraler Metastasierung war der Benefit etwas ausgeprägter Auch das Risiko für einen PSA-Anstieg war ebenso vermindert wie die Notwendigkeit für eine neue antineoplastische Therapie.
Eine Post-hoc-Analyse zeigte jetzt, dass der Benefit unabhängig davon bestand, ob die Metastasierung sich erst nach der Erstdiagnose entwickelt hatte (M0) oder bereits primär bestand (M1). 246 Patienten hatten einen M0-Status, 890 Patienten einen M1-Status. Das rPFS konnte bei M0 unter Enzalutamid + ADT im Vergleich zu ADT um 58% und bei M1 um 62% verbessert werden. Bei der Gesamtgruppe betrug es 61%, also kein Unterschied. Bei der M0-und der M1-Subgruppe mit Enza + ADT war das rPFS noch nicht erreicht, unter ADT allein betrug es in der M0-Gruppe 22,1 Monate, in der M1-Gruppe 16,6 Monate. Auch war der Vorteil der Kombination bzgl. der Zeit bis zum PSA-Anstieg und dem ORR uneingeschränkt in beiden Gruppen nachweisbar und mit dem Gesamtergebnis vergleichbar. Insgesamt zeigt diese Post-hoc-Analyse, dass der Benefit von Enza plus ADT unabhängig davon besteht, wann die Metastasen aufgetreten sind, primär bei Diagnosestellung oder erst im weiteren Verlauf.
PS
ASCO, #5071
ARI bei fortgeschrittenem Prostatakarzinom
Chemotherapie-naive Patienten profitieren stärker von Enzalutamid
Beim fortgeschrittenen Prostatakarzinom sind die Androgenrezeptor-Inhibitoren der zweiten Generation eine sinnvolle und gut wirksame Alternative zur Chemotherapie, vor allem bei älteren Patienten mit Komorbiditäten; denn sie sind deutlich verträglicher. Im Rahmen einer Registerstudie wurden die beiden ARI bei älteren Patienten mit einem medianen Alter von ca. 75 Jahren miteinander verglichen. Ausgewertet wurden die Daten von 5,895 Patienten, von denen initial 43,5% Enzalutamid und 56,5% Abirateron erhielten. 51,6% erhielten nur eines dieser Präparate. Die Patienten in der Enza-Gruppe waren etwas älter und hatten mehr Komorbiditäten. Sie erhielten auch seltener beide Substanzen und auch seltener eine Chemotherapie.
Die Patienten der Enza-Gruppe zeigten ein längeres Überleben, nämlich 24,1 Monate vs. 22,2 Monate unter Abir. Das Sterberisiko war um 13% niedriger. Bei Patienten, die zwei oder mehr Optionen erhielten, fand sich kein Benefit bzgl. OS im Vergleich zu Patienten, die nur mit Enza oder Abir therapiert wurden. Patienten, die Chemotherapie-naiv waren, profitierten im Vergleich mit Abirateron stärker von Enza (medianes OS: 18,9 vs. 13,6 Monate).
PS
ASCO 2021, #5032
Plattenepithel-Oesophaguskarzinom
Neue Erstlinientherapie mit Checkpoint-Inhibitoren?
Diese internationale 3-armige Phase-III-Studie CheckMate 648 untersuchte die Wirksamkeit der Standardchemotherapie 5-Fu + Cisplatin alleine oder in Kombination mit Nivolumab oder der kombinierten Immuntherapie mit Nivolumab und Ipilimumab ohne Chemotherapie bei Patienten mit einem nicht vorbehandelten, nicht operablen, fortgeschrittenen, rezidivierten oder metastasierten Ösophagus-Karzinom. Es ist bereits gezeigt worden, dass Nivolumab als Zweitlinientherapie das Gesamtüberleben von Patienten mit fortgeschrittenem Ösophaguskarzinom, die Chemotherapie refraktär waren oder diese nicht vertragen hatten, verbessert.
Total 970 Patienten wurden rekrutiert und 1:1:1 randomisiert in einen der 3 folgenden Behandlungs-Arme: 1. Nivolumab (240 mg alle zwei Wochen) und Chemotherapie (5-Fluor-ouracil 800 mg/m an den Tagen 1-5 und Cisplatin 80 mg/m an Tag 1 in vierwöchjgen Zyklen). 2. Nivolumab (3 mg/kg alle zwei Wochen) und Ipilimumab (1 mg/kg alle 6 Wochen);
3. nur Chemotherapie (5-Fluorouracil und Cisplatin in gleicher Dosierung wie in Arm 1). In den Immuntherapie-Armen war eine bis zu 24 Monate lange Behandlung erlaubt.
Primäre Endpunkte der Studie waren OS und PFS. Knapp die Hälfte der Patienten wies eine PD-L1-Expression auf. Die minimale Beobachtungszeit dieser Analyse betrug 12,9 Monate ab Randomisierung. Die Toxizität entsprach den erwarteten typischen Nebenwirkungen: im Nivolumab-Chemotherapie-Arm und Chemotherapie-Arm Nausea, Appetitverlust und Stomatitis, im Nivolumab-Ipilimumab-Arm Pruritus, Hautausschläge und Hypothyreoidismus. Neue Sicherheitssignale wurden nicht beobachtet und die Anzahl der behandlungsbedingten Todesfälle war in allen drei Armen ausgeglichen und gering.
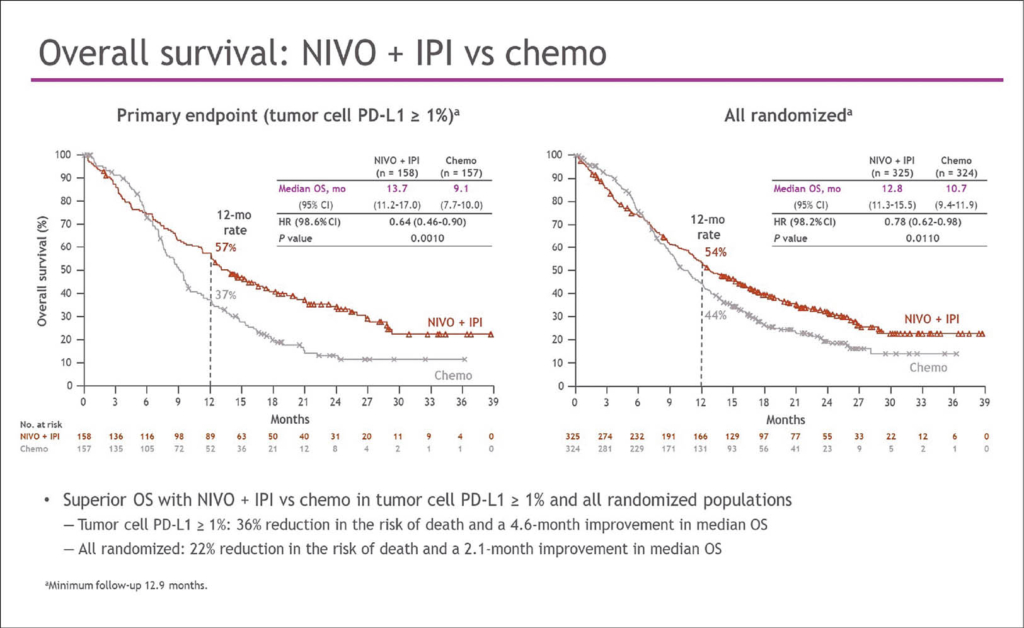
Die objektive Ansprechrate ORR der Patienten mit PD-L1-positiven Tumoren lag mit Nivolumab-Chemotherapie bei 53%, mit der kombinierten Immuntherapie bei 35% und mit Chemotherapie alleine bei 20%. Am meisten profitierten nicht unerwartet Patienten mit PD-L1-Expression: sowohl Nivolumab plus Chemotherapie als auch Nivolumab plus Ipilimumab verbesserten das OS von Patienten mit PD-L1-Expression der Tumorzellen von ≥ 1% signifikant. Das mediane OS lag in der Gruppe mit Nivolumab plus Chemotherapie bei 15,4 Monaten, im Chemotherapiearm bei 9,1 Monaten (HR 0,54; 99,5% KI: 0,37–0,80; p < 0,0001). Die Kaplan-Meier-Kurven gingen früh und anhaltend auseinander. Die 12-Monats-OS-Rate betrug mit der Kombination Nivolumab-Chemotherapie 58%, bei Chemotherapie alleine 37%. Der OS-Vorteil zeigte sich auch in der Gesamtpopulation unabhängig von der PD-L1-Expression mit einem medianen OS mit Nivolumab von 13,2 Monaten gegenüber der Chemotherapie mit 10,7 Monaten (HR 0,74; 99,1% KI 0,58–0,96; p = 0,0021). Für das PFS wurde nur bei Patienten mit einer Tumor-PD-L1-Expression > 1% ein signifikanter Unterschied zugunsten von Nivolumab-Chemotherapie festgestellt, nicht aber bei allen Patienten unabhängig von diesem Biomarker. Auch die chemotherapiefreie Kombination von Nivolumab-Ipilimumab führte zu einer signifikanten Verbesserung des medianen OS gegenüber der Chemotherapie alleine, sowohl bei Patienten mit PD-L1-Tumorexpression von ≥ 1% (13,7 vs. 9,1 Monate, HR 0,64; 98,6% KI 0,46–0,90; p = 0,0010) als auch bei allen Patienten (12,8 vs. 10,7 Monate; HR 0,78; 98,2% KI 0,62–0,98). Auch bei diesem Vergleich war der Unterschied des PFS nicht signifikant. Die Subgruppenanalyse zeigte eine kleine Subgruppe von Frauen die im Chemotherapie-Arm mit einem medianen OS von 14,8 Monaten extrem gut abschnitten. Dadurch war der Unterschied zu den Immuntherapie-Kombinationen nicht mehr gross. Die Immuntherapie-Wirksamkeit war aber bei Frauen nicht schlechter als bei Männern. Hier zeichnen sich also zwei neue Optionen in der Erstlinientherapie dieser Patienten mit sehr bescheidener Prognose ab.
ThC
Quelle: LBA4001: Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): First results of the CheckMate 648 study.
Bessere Prognose mit 177Lu-PSMA-617 für Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom (mCRPC)
177Lu-PSMA-617 bindet mit hoher Affinität an das prostataspezifische Membranantigen (PSMA) und wird durch Endozytose als therapeutisches Isotop in die Tumorzellen aufgenommen. In den Tumor- sowie in den umgebenden Zellen führt 177Lu-PSMA-617 durch DNA-Schäden zum Zelltod. Die Ergebnisse der randomisierten, offenen Phase-III-Studie VISION zeigen, dass 177Lu-PSMA-617 zusätzlich zur Standardtherapie bei Patienten mit metastasiertem kastrationsresistenten Prostatakarzinom (mCRPC) zu einem signifikant besseren Überleben ohne radiographisch dokumentierte Progression in der Bildgebung (radiographic Progression Free Survival, rPFS) führt. Untersucht wurden Männer mit einem PSMA-positiven mCRPC, die zuvor bereits neuere Androgenrezeptor-Inhibitoren und ein bis zwei Taxan-Regimes erhalten hatten. PSMA-positiv waren Tumoren, wenn in 68Ga-PSMA-11-Scans die Werte höher als in der Leber waren. Die Randomisierung erfolgte 2:1 in eine Behandlungsgruppe mit 177Lu-PSMA-617 (7,4 GBq alle 6 Wochen x 6 Zyklen) (n = 551) und eine Gruppe mit Standard Of Care (SOC) alleine (n=280) zusätzlich zur Standardtherapie. Die SOC wurde durch den jeweiligen Untersucher festgelegt, wobei eine zytotoxische Chemotherapie oder eine Radium-223-Behandlung ausgeschlossen waren. Es gab zwei primäre Endpunkte: das rPFS und das OS.
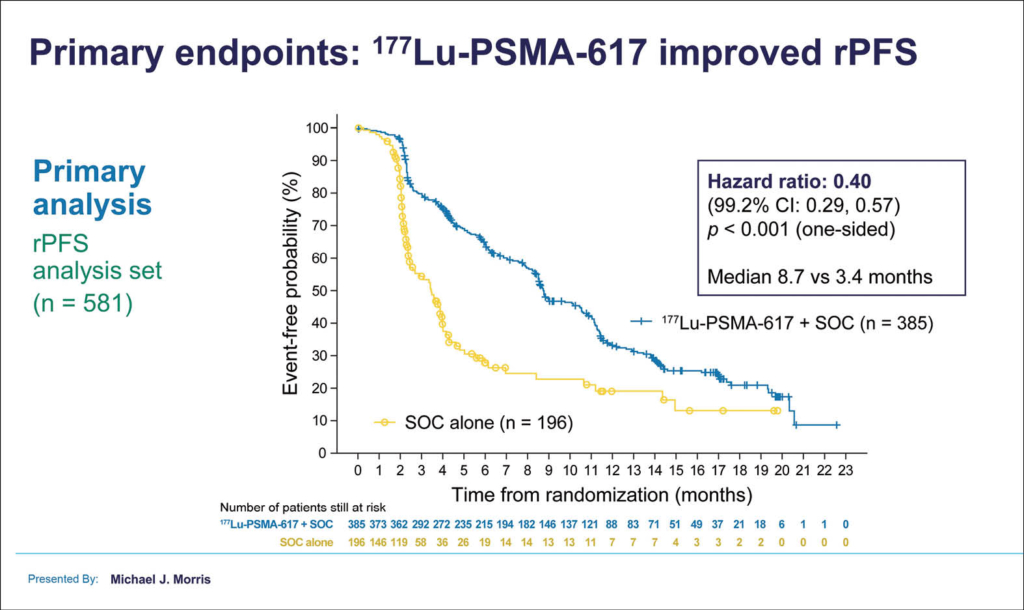
Mit 177Lu-PSMA-617 plus SOC war eine Knochenmarkstoxizität wie erwartet häufiger ≥ Grad 3: 17,6% vs. 6,8% bei SOC alleine. Auch Fatigue und Übelkeit/Erbrechen waren im Verum-Arm gehäuft. Insgesamt wurde bei 28,4% der Patienten der Verum-Gruppe ein unerwünschtes Ereignis des Grades ≥3 dokumentiert, gegenüber 3,9% in der Kontrollgruppe. Beide primären Endpunkte wurden nach einer medianen Beobachtungsdauer von 20,9 Monaten erreicht. Das mediane OS war mit 177Lu-PSMA-617 zusätzlich zur SOC signifikant verbessert: 15,3 vs. 11,3 Monate in der SOC-Gruppe. Das relative Risiko zu versterben war in der Verum-Gruppe um 38% reduziert (HR 0,62: 95% KI 0,52–0,74; p < 0,001). Eine hohe Dropout-Rate in der SOC-Gruppe in den ersten 9 Monaten (56%!) wurde von den Autoren darauf zurückgeführt, dass 177Lu-PSMA-617 in einigen Regionen zu diesem Zeitpunkt auch ausserhalb der Studie verfügbar wurde. Um gleichwohl eine ausreichende Power zu erreichen, wurde deshalb die Zahl der zu rekrutierenden Patienten erhöht. Wurden nun nur die Patienten einbezogen, die nach der Anpassung des Studiendesigns rekrutiert worden waren, ergab sich mit 177Lu-PSMA-617 plus SOC ein medianes rPFS von 8,7 Monaten, mit SOC eines von nur 3,4 Monaten. Somit zeigt sich eine 60%ige Risikoreduktion für Progression oder Tod (HR: 0,40; 99,2% Konfidenzintervall [KI] 0,29–0,57; p < 0,001). Hier bietet sich also nach der noch ausstehenden Zulassung von 177Lu-PSMA-617, die Option einer klinisch relevanten Prognoseverbesserung für stark vorbehandelte Patienten mit mCRPC. Weitere Studien werden zeigen müssen, ob ein früherer Einsatz sinnvoll sein könnte.
ThC
Quelle: LBA4: Phase III study of lutetium-177-PSMA-617 in patients with metastatic castration-resistant prostate cancer (VISION).
Adjuvante Immuntherapie mit Pembrolizumab verbesserte DFS nach Nephrektomie bei Patienten mit Nierenzellkarzinom und hohem Metastasierungsrisiko
In dieser klinischen Situation ist zu erwarten, dass bis zur Hälfte dieser Patienten mit einer Metastasierung rechnen müssen. Die internationale Placebo-kontrollierte Phase-III-Studie KEYNOTE-564 untersuchte bei Patienten mit einem klarzelligen Nierenzellkarzinom und hohem Rezidiv-Risiko nach Nephrektomie eine einjährige adjuvante Immuntherapie mit dem Checkpoint-Inhibitor Pembrolizumab. Die Operation durfte bei Randomisierung nicht länger als 12 Wochen zurückliegen und eine vorangegangene Systemtherapie war nicht erlaubt. Primärer Endpunkt der Studie war das krankheitsfreie Überleben (DFS). Die Ergebnisse einer geplanten Interimsanalyse nach median 24.1 Monaten Beobachtungszeit liegen nun vor. Insgesamt wurden 994 Patienten randomisiert, 496 erhielten die adjuvante Therapie mit Pembrolizumab, 498 Placebo. Die adjuvante Therapie bestand aus 200 mg Pembrolizumab oder Placebo alle drei Wochen und wurde bis zu 17 Zyklen, d.h. einem Jahr gegeben. Behandlungsassoziierte unerwünschte Wirkungen des Grads ≥3 waren mit Pembrolizumab häufiger als mit Placebo (18,9% vs. 1,2%). Am häufigsten traten Fatigue (20,3% vs. 14,3%), Pruritus (18,6% vs. 11,5%), Hypothyreoidismus (17,6% vs. 2,6%), Diarrhoe (15,8% vs. 10,3%) und Hautausschläge (15,0% vs. 7,3%) auf. Zum Abbruch der Therapie führten Nebenwirkungen bei 20,7% der Patienten im Pembrolizumab-Arm und bei 2% der Patienten im Placebo-Arm. Es wurde kein Todesfall im Zusammenhang mit Pembrolizumab-Behandlung festgestellt.
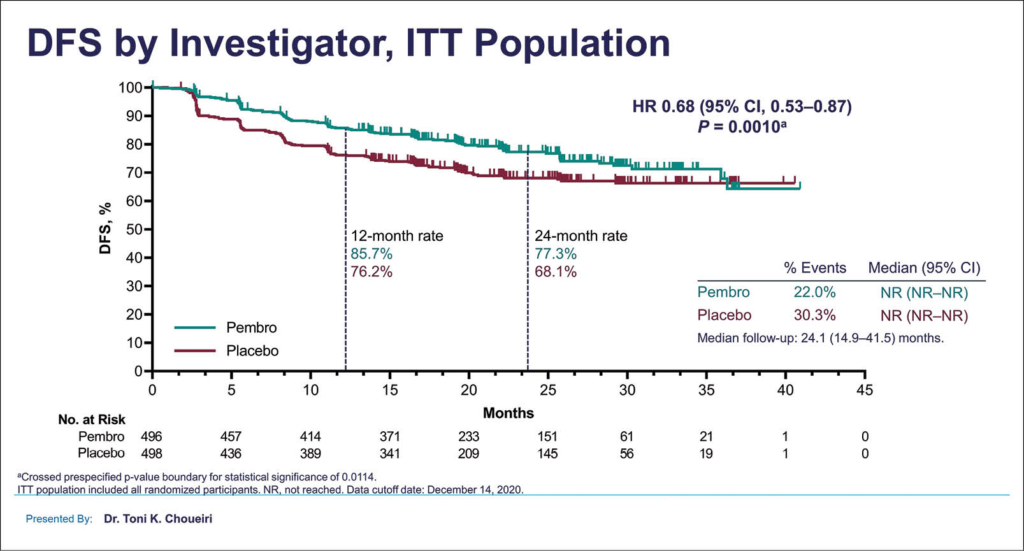
Das mediane DFS, der primäre Studienendpunkt, wurde in beiden Gruppen bisher nicht erreicht, die Hazard Ratio (HR) mit 0,68 (95% CI: 0,53−0,87; p = 0,0010) zeigte aber bereits einen klaren Vorteil zugunsten der adjuvanten Immuntherapie. Die geschätzte DFS-Rate nach 2 Jahren lag mit Pembrolizumab bei 77,3%, mit Placebo bei 68,1% (HR 0,68; p = 0,001), wobei der Vorteil auch in den verschiedenen untersuchten Subgruppen dokumentiert wurde. Bisher verstarben 51 Patienten (18 in der Pembrolizumab-, 33 in der Placebogruppe). Das mediane Gesamtüberleben ist noch länger nicht erreicht mit so wenigen Ereignissen. Die geschätzte Überlebensrate nach 2 Jahren wurde mit 96,6% für die Pembrolizumab- und 93,5% für die Placebo-Gruppe errechnet. Die KEYNOTE-564-Studie ist somit die erste positive Phase-III-Studie mit einem Checkpointinhibitor in der adjuvanten Situation beim RCC. Mit dem früh aufgetretenen signifikanten und klinisch relevanten Vorteil im DFS könnte die adjuvante Immuntherapie mit Pembrolizumab nach Resektion eines operablen RCC mit hohem Risiko zum Therapiestandard werden, sollte die ersehnte OS-Verbesserung klinisch bedeutsam sein.
ThC
Quelle: LBA5: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for patients with renal cell carcinoma: Randomized, double-blind, phase III KEYNOTE-564 study.
Prognoseverbesserung durch Abirateron bei Patienten mit hormonsensitivem de novo metastasierendem Prostatakarzinom (mCSPC): Studie PEACE-1
In der mehrarmigen Phase-III-Studie PEACE-1 wurde mit einen 2×2 factorial design Androgendeprivation (ADT) + / - Docetaxel (Standard of care, SOC) in Kombination mit Abirateron und Strahlentherapie (RXT) bei Patienten mit neu metastasiertem, kastrationssensitivem Prostatakarzinom (mCSPC) geprüft. Die Studie hat zwei koprimäre Studienendpunkte: das radiologische progressionsfreien Überleben (rPFS) sowie das Gesamtüberleben. Von November 2013 bis Dezember 2018 wurden 1173 Patienten, medianes Alter 67 Jahre, eingeschlossen. Davon hatten 57% eine High Volume Disease. Von allen Patienten erhielten als SOC 710 Patienten ADT+Docetaxel und 463 Patienten nur ADT. Der mediane Follow-up war 3.5 Jahre. Erste Ergebnisse bezüglich dieser beiden Arme zeigen nun eine hochsignifikante Verbesserung des rPFS im Studienarm mit Abirateron und bestätigen damit Daten aus den CHAARTED- und LATITUDE-Studien. Der Zusatz von Abirateron zu ADT + Docetaxel verbessert den Krankheitsverlauf (rPFS) der Patienten mit neu diagnostiziertem mCSPC mit einem klinisch relevanten Benefit von 2,5 Jahren (HR: 0.50 (0.40-0.62), p < 0.0001). Der Zusatz von Abiraterone zu ADT alleine sowie Abiraterone und ADT+Docetaxel (Gesamte Population) zeigte ein rPFS von 2.2 versus 4.5 Jahre (HR: 0.54 (0.46-0.64), p < 0.0001). Die Toxizität im Verum-Arm mit zusätzlich Abiraterone war nur geringfügig erhöht.
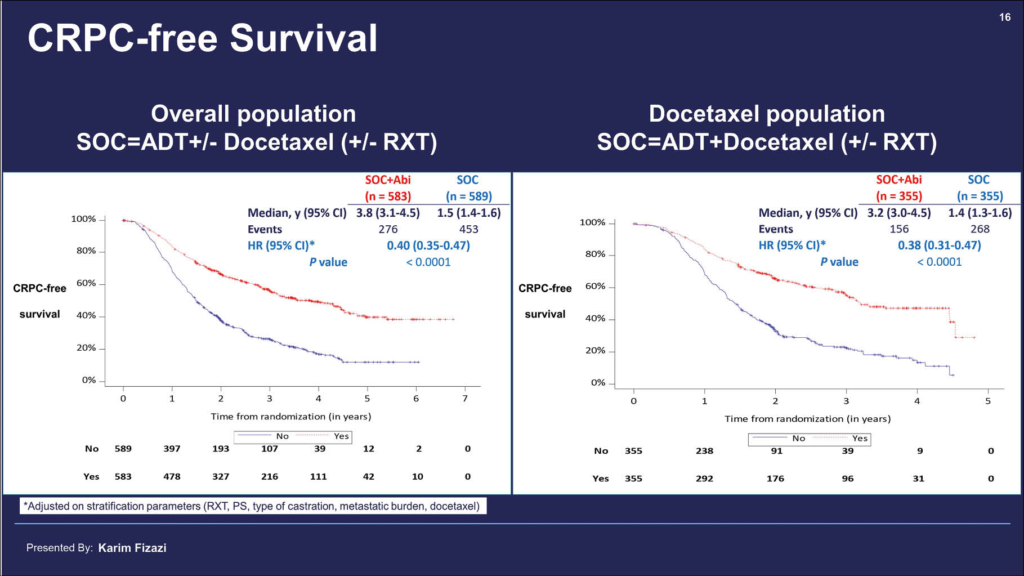
Daten zum 2. Studienendpunkt Gesamtüberleben und zur Lebensqualität liegen zwar noch nicht vor, aber ein solch ausgeprägter und klinisch relevanter rPFS Benefit dürfte sich bald als «practice changing» erweisen.
ThC
Quelle: Abstract 5000: A phase 3 trial with a 2×2 factorial design of abiraterone acetate plus prednisone and/or local radiotherapy in men with de novo metastatic castrationsensitive prostate cancer (mCSPC).
NSCLC: positive Daten zu Amivantamab, Aumolertinib und Patritumab Deruxtecan
Dass neue Medikamente für spezifische Targets bei NSCLC-Patienten für viele bereits bekannte Subgruppen untersucht werden, die auch in refraktären Situationen noch wirksam sind, ist erfreulich. Dies umso mehr, wenn dies gleich mehrfach zutrifft. Gehen wir in aller Kürze dem Alphabet nach: Amivantamab (abstract 9006): Amivantamab, ein EGFR-MET bispezifischer Antikörper, und Lazertinib, ein Tyrosinkinase-Inhibitor der 3. Generation, haben in Kombination sowohl bei therapienaiven als auch bei Osimertinib-rezidivierten Patienten mit EGFR+ NSCLC Wirksamkeit gezeigt. Darüber hinaus wurden sie als mögliche prädiktive Biomarker untersucht.
NSCLC-Patienten mit EGFR-Exon-19-Deletion oder L858R-Mutation, die unter Osimertinib ohne Chemotherapie progredient waren, wurden in die Kombinationskohorte der laufenden CHRYSALIS-Studie (NCT02609776) aufgenommen. Die Patienten erhielten 1050/1400 mg Amivantamab + 240 mg Lazertinib. Osimertinib-Resistenzmutationen oder Amplifikationen in EGFR/MET, die durch Next-Generation-Sequencing (NGS) entweder in der ctDNA oder in der Tumorbiopsie identifiziert wurden – ebenso wie die Immunhistochemie für EGFR- und MET-Expression – wurden als potenzieller Biomarker für das Ansprechen untersucht. Für die 45 Osimertinib-Rezidiv-Patienten war die OR 36% (1 CR, 15PR) und das mediane progressionsfreie Überleben (mPFS) betrug 4,9 Monate. Die genetische Untersuchung identifizierte 17 Biomarker-positive-Patienten, von denen 8 (47%) ansprachen. Von den restlichen 28 Patienten sprachen 8 (29%) an. Von diesen 28 Patienten hatten 18 unbekannte Mechanismen der Osimertinib-Resistenz (8 PR) und bei zehn wurden Nicht-EGFR/MET-Resistenzmechanismen identifiziert (OR 0%). Das mPFS für die Biomarker-positiven und die übrigen Patienten betrug 6,7 Monate.
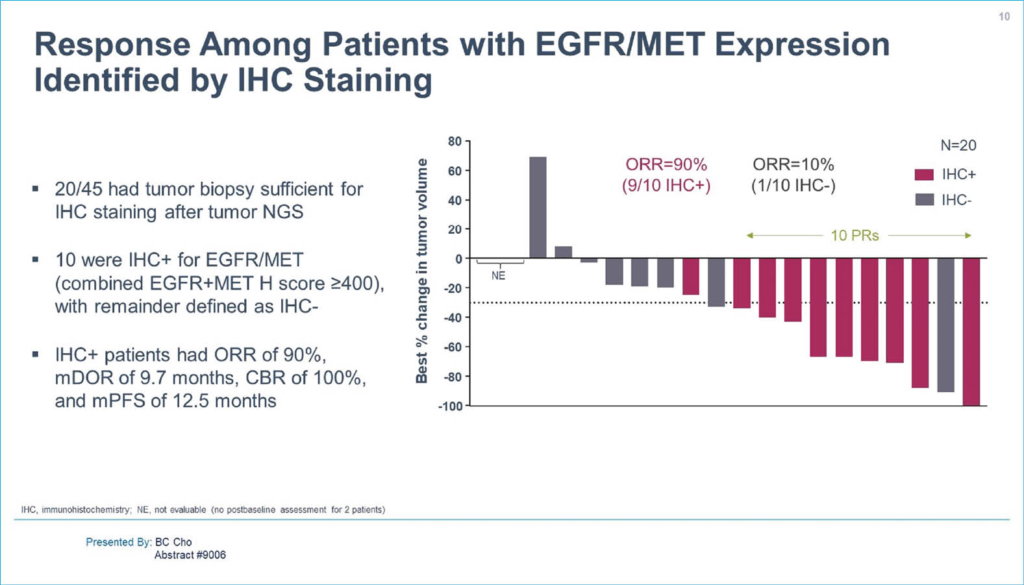
Aulomertinib (abstract 9013)
Aulomertinib ist ein irreversibler EGFR-TK-Inhibitor der 3. Generation, in China entwickelt und zugelassen für Patienten mit EGFR-mutiertem NSCLC mit EGFR T790M, welche progredient sind nach vorangehenden EGFR TKIs. Diese chinesische randomisierte Phase-3-Studie (AENEAS study) verglich Aulomertinib oral 110 mg täglich mit Gefitinib oral 250 mg täglich bei unbehandelten lokal fortgeschrittenen oder metastasierten 429 Patienten mit NSCLC und EGFR Exon-19-Deletion oder L858R in einer 1:1 Randomisation. Der primäre Endpunkt war das PFS, sekundäre Endpunkte waren OR, DoR und OS. Aulomertinib verlängerte das mediane PFS signifikant auf 19.3 vs 9.9 Monate (HR 0.46, p <0.0001). Auch die DoR war entsprechend signifikant verlängert und die OS-Daten waren noch nicht reif. Auch die Verträglichkeit war im Verumarm besser trotz fast doppelt so langer Behandlung (median 463 vs. 254 Tage, SAEs 4.2% vs. 11.2%). Mit dieser mehr als verdoppelten PFS und einem bis anhin günstigen Sicherheitsprofil ist Aulomertinib nun eine attraktive Option für diese Patienten. Die Resultate einer laufenden Phase-3-Studie im Vergleich zu Osimertinib wird zeigen, wo dieser neue EGFR-TKI der 3.Generation seinen Platz finden wird.
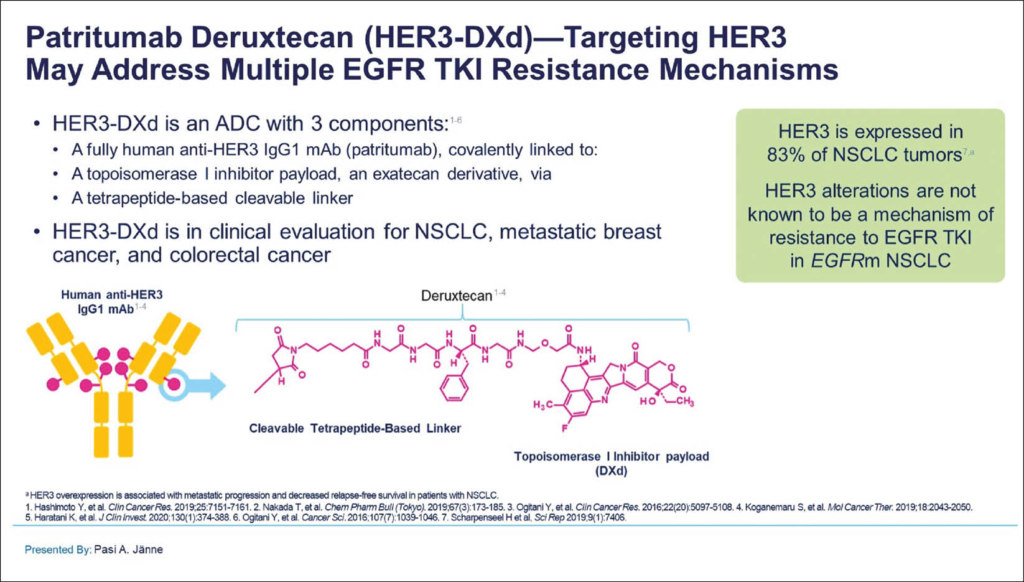
Patritumab Deruxtecan (HER3-DXd) (abstract 9007)
Patritumab Deruxtecan (HER3-DXd) ist ein neues Antikörper-Wirkstoff-Konjugat, bestehend aus einem monoklonalen Antikörper gegen HER3, welcher durch einen spaltbaren Linker auf Tetrapeptid-Basis an einen Topoisomerase-1-Inhibitor gebunden ist. HER3 wird in 83% der NSCLC-Tumoren exprimiert. In dieser noch laufenden Phase-1-Studie (NCT03260491) zu HER3-DXd bei Patienten mit lokal fortgeschrittenem oder metastasiertem EGFR-mutiertem NSCLC, bei denen eine vorherige EGFR-TKI-Therapie versagt hatte, wurden 57 Patienten eingeschlossen, die median 4 Vorbehandlungen hatten. Die mediane Behandlungsdauer betrug 5,5 Monate und 18 Patienten (32%) waren noch immer unter Therapie.
HER3-DXd 5,6 mg/kg IV wurde alle 3 Wochen verabreicht und der mediane Follow-up betrug 10.2 Monate. Die OR betrug 39% (n=22: 1 CR, 21 PR, und 19 SD) und die Krankheitskontrollrate 72%. Die mediane DoR war 6,9 Monate, das mediane PFS 8,2 Monate. Auch Patienten mit anamnestischen Hirnmetastasen und Platin-Vorbehandlung zeigten eine OR von 37%. Die häufigsten AEs Grad ≥3 waren Thrombozytopenie (30%), Neutropenie (19%) und Müdigkeit (14%). Eine interstitielle Lungenerkrankung wurde bei 4 Patienten (7%; 1 Grad ≥3 [2%]) dokumentiert. In 11% wurde Therapie-assoziiert ein Therapieabbruch festgehalten. Nun läuft eine Phase-2-Studie (HERTHENA-Lung01) mit HER3-DXd bei Patienten mit EGFR-mutiertem NSCLC nach Versagen von EGFR-TKI und platinbasierter Chemotherapie.
ThC
Quelle: Abstract 9007: Efficacy and safety of patritumab deruxtecan (HER3-DXd) in EGFR inhibitor-resistant, EGFR-mutated (EGFRm) non-small cell lung cancer (NSCLC).
Synovialsarkom
Zelluläre Immuntherapie ist wirksam bei Synovial- und Myxoidem Rundzell-Sarkom
Adaptive zelluläre Immuntherapien mit CAR-T-Zellen sind bei Leukämien und Lymphomen teilweise hochwirksame Therapien mit kurativem Potential. Viele tumorspezifische Antigene sind intrazellulär lokalisiert und sind mit einem CAR-T-Ansatz nicht gezielt angehbar. Dies kann durch die Verwendung von T-Zell-Rezeptoren (TCR) überwunden werden, welche MHC-Peptide erkennen, die von intrazellulären Proteinen abgeleitet sind.
In der Phase-II-Studie SPEARHEAD-1 mit 39 Patienten wurde in einer einarmigen Studie Afamitresgene autoleucel (Afami-cel, früher ADP-A2M4) bei Patienten mit fortgeschrittenem Synovialsarkom und «myxoid/round cell liposarcoma» (MRCLS) geprüft. Afami-cel SPEAR T-Zellen sind gegen MAGE-A4-positive Tumore gerichtet. MAGE-A4 ist stark exprimiert beim Synovialsarkom und MRCLS bei gleichzeitiger Koexpression von HLA-A*02. Eine Phase-I-Studie (CTOS 2020) mit Afami-cel war in dieser Konstellation klar positiv mit klinisch bedeutsamem Ansprechen.
Die 37 Patienten waren zwischen 16-75 Jahre alt, HLA*02-positiv mit MAGE-A4-Expression in ≥ 30% der Tumorzellen, welche ≥ 2+ waren in der Immunohistochemie.
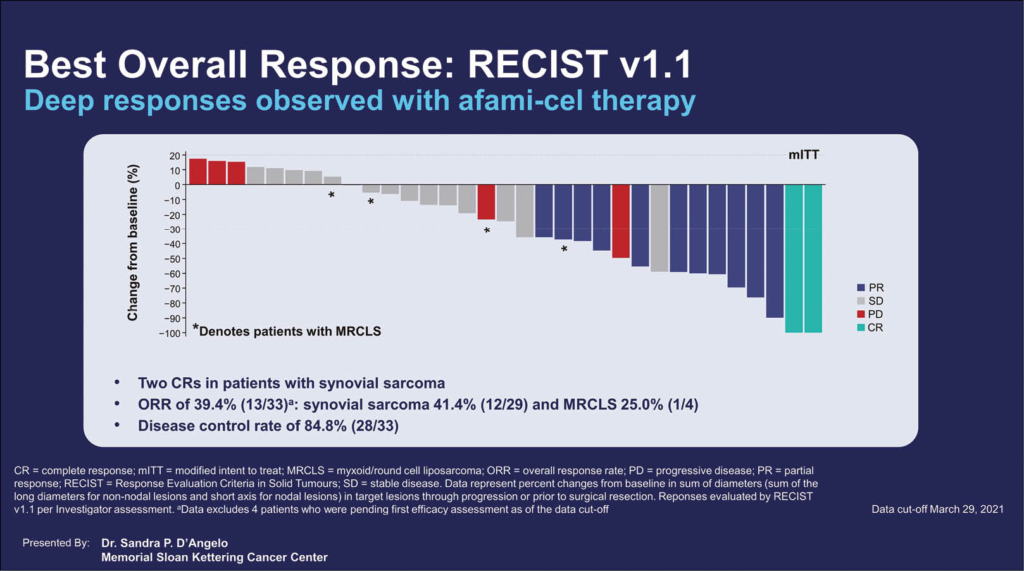
Beim Cut-off 29.3.2021 waren 37 Patienten mit Afami-cel, davon 32 mit Synovialsarkomen, und 5 mit MRCLS behandelt worden. Afami-cel wurden in Dosierungen von 1–10 × 109 transduzierten T-Zellen verabreicht, nach vorangegangener lymphozytenreduzierender Induktion mit Chemotherapie. Der Primäre Endpunkt war die Overall Response Rate (ORR). 33 Patienten konnten bereits für die OR evaluiert werden, bei 4 Patienten war die Evaluation noch zu früh.
Die ORR war 41.4% für Patienten mit Synovialsarkom und 25.0% für MRCLS-Patienten. Eine CR konnte bei 2 Patienten mit Synovialsarkom dokumentiert werden, 10 hatten eine PR und 13 eine stabile Situation SD und 4 einen Tumorprogress PD, d.h. die Krankheitskontrolle war > 80%. Von den 4 Patienten mit MRCLS konnten 1 PR, 2 SD und eine PD dokumentiert werden. Die mediane Dauer des Ansprechens wurde noch nicht erreicht. Als Nebenwirkungen wurden milde Symptome von einem Zytokine-Freisetzungs-Syndrom festgestellt und auch die hämatologischen Nebenwirkungen waren mild und reversibel. Es ist nun eine Fortsetzung der Studie mit total 90 Patienten geplant: 45 in Kohorte (bereits erreicht) 1 und 45 in Kohorte 2. Genetisch modifizierte T-Zell-Rezeptor-gerichtete Therapien sind neben CAR-T-Zellen eine weitere Option der zellulären Immuntherapien und hier darf eine Zulassung dieser innovativen Therapie in naher Zukunft erwartet werden, da es sich um eine «unmet need»-Situation ohne vergleichbare therapeutische Alternativen handelt.
ThC
Quelle: Abstract Nr. 11504: SPEARHEAD-1: A phase 2 trial of afamitresgene autoleucel (formerly ADP-A2M4) in patients with advanced synovial sarcoma or myxoid/round cell liposarcoma
Längeres OS mit Ribociclib bei Patientinnen mit metastasiertem HR+/HER2- Mammakarzinom
In der grossen und bereits im NEJM publizierten positiven Phase-III-Studie MONALEESA-3 wird Ribociclib (Kisqali®), ein zugelassener CDK4/6-Inhibitor, oder Placebo plus Fulvestrant in der Erst- und Zweitlinie bei postmenopausalen Frauen mit fortgeschrittenem HR + /HER2- Mammakarzinom, die nicht für eine kurative Therapie infrage kamen und noch keine Therapie für eine fortgeschrittene Erkrankung (Lokalrezidiv oder Metastasen) erhalten hatten, untersucht. Die Therapie erfolgte 2:1 randomisiert mit Ribociclib (600 mg oral einmal täglich, n = 484) oder Placebo (n=242) an 21 aufeinanderfolgenden Tagen mit 7 Tagen Therapiepause pro 28-tägigem Zyklus. Alle Patientinnen erhielten Fulvestrant in einer Dosis von 500 mg i.m. an Tag 1 jedes Zyklus und im ersten Zyklus auch am Tag 15.
Hier wird nun der Follow-up nach 56,3 Monaten präsentiert: die mediane OS-Rate in der Gesamtpopulation mit Ribociclib betrug 53,7 Monate, in der Placebo-Gruppe 41,5 Monate. Damit war das Mortalitätsrisiko mit Ribociclib um 27,3% verringert (HR 0,726; 95% KI 0,588–0,897. Die 4-Jahresüberlebensrate lag mit Ribociclib bei 53,6%, mit Placebo bei 44,5%. Die 5-Jahresüberlebensraten waren 46,0% in der Verumgruppe und 31,1% in der Placebogruppe.
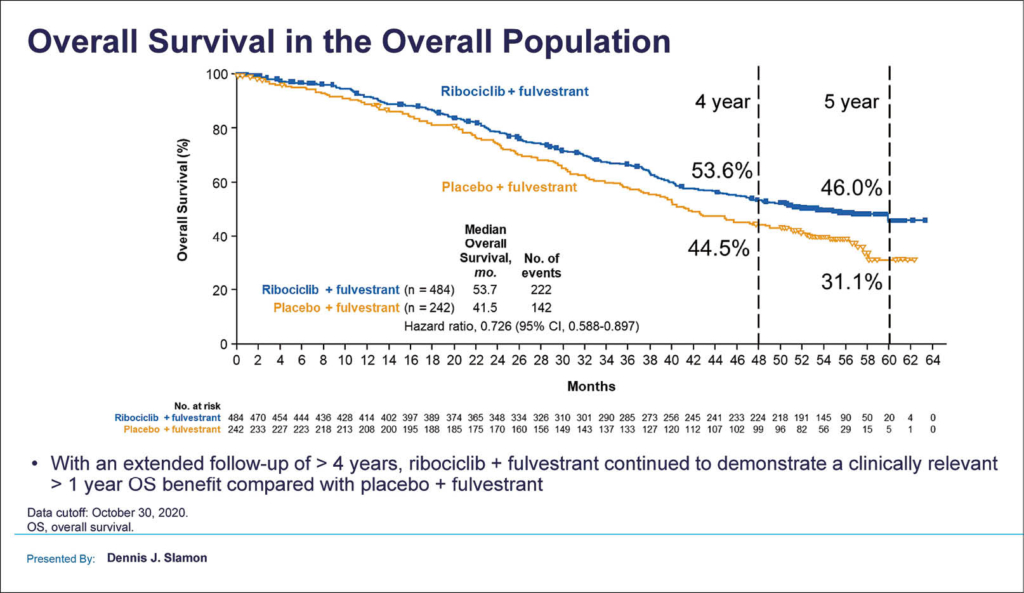
Die OS-Resultate in der ersten Linie, d.h. bei neu aufgetretenem fortgeschrittenem Mammakarzinom oder einem Rezidiv mehr als 12 Monate nach einer neo(adjuvanten) endokrinen Therapie eines frühen Mammakarzinoms, ergaben ebenfalls einen klaren Vorteil für Ribociclib (medianes OS nicht erreicht vs. 51,8 Monate in der Placebo-Gruppe; HR 0,640; 95% KI 0,464–0,883). Ein OS-Vorteil fand sich in vielen Subgruppen, auch bei Patientinnen mit Leber- oder Lungenmetastasen, drei und mehr Metastasenlokalisationen und einer klinischen endokrinen Resistenz. Eine Chemotherapie musste bei Patientinnen im Ribociclib-Arm im Median erst etwa 20 Monate später eingesetzt werden als im Placebo-Arm. Die mediane Zeit bis zur nächsten Chemotherapie lag mit Ribociclib plus Fulvestrant bei 48, mit Placebo plus Fulvestrant bei 28,8 Monate (HR 0,704; 95% KI 0,566–0,876). Das PFS 2 (von der Randomisierung bis zum zweiten Progress) betrug im Median 37,4 Monate, während es im Placebo-Arm bei 28,1 Monaten lag (HR 0,693; 95% KI 0,570–0,844). Bei Patienten mit Erstlinientherapie war dieser Vorteil noch ausgeprägter (HR 0,63; 95% KI 0,47–0,84). Dabei war der Vorteil unabhängig von der Art der Folgetherapie von Ribociclib plus Fulvestrant. Bezüglich Toxizität gab es keine neuen Sicherheitssignale. Somit wird ein klinisch bedeutsamer Überlebensvorteil nach 5 Jahren von einem Jahr auch in der Erstlinientherapie mit Ribociclib nach > 4 Jahren Follow-up bestätigt und scheint sich weiter zu vergrössern.
ThC
Quelle: Abstract 1001: Updated overall survival (OS) results from the phase III MONALEESA-3 trial of postmenopausal patients (pts) with HR+/HER2- advanced breast cancer (ABC) treated with fulvestrant (FUL),
ribociclib (RIB).
Fortgeschrittenes Ösophaguskarzinom
Kombination Nivolumab plus Ipilimumab ist alleiniger Chemotherapie überlegen
Der bisherige Standard in der First line bei Patienten mit einem fortgeschrittenen Ösophaguskarzinom ist die Chemotherapie. Im Rahmen der CheckMate-648-Studie wurde die Kombination Nivolumab + Chemotherapie mit der Kombination Nivolumab + Ipilimumab und der alleinigen Chemotherapie verglichen.
Das Ösophaguskarzinom ist einer der häufigsten zum Tode führenden Tumore. Die 5-Jahresüberlebensrate liegt bei 25%. Eingeschlossen in diese Phase-III-Studie wurden 970 Patienten mit einem nicht-vorbehandelten, nicht resezierbaren, fortgeschrittenen, rezidivierten oder metastasierten Plattenepithelkarzinom des Ösophagus und zwar unabhängig von dem PD-L1-Status. Sie erhielten randomisiert Nivolumab + Fluorouracil + Cisplatin oder Nivolumab + Ipilimumab oder Chemotherapie allein. Als Endpunkte wurden das OS und das PFS festgelegt. Das Mindest-Follow up betrug 13 Monate.
Sowohl die Kombination Nivolumab + Chemotherapie als auch die Kombination Nivolumab + Ipilimumab waren bei Patienten mit einem PD-L1 ≥ 1% der alleinigen Chemotherapie überlegen (OS: 15,4 vs. 13,7 vs. 9,1 Monate). Aber auch bei Auswertung aller Studien-Patienten zeigte sich ein Benefit in den beiden Studienarmen mit Nivolumab (OS: 13,2 vs. 12,8 vs. 10,7 Monate). Die Ergebnisse waren statistisch signifikant. Auch das PFS wurde durch die Gabe von Nivolumab zusätzlich zur Chemotherapie bei Patienten mit PD-L1 ≥ 1% verbessert und zwar um 35%. Dagegen fand sich beim PFS kein signifikanter Unterschied zwischen Nivolumab + Ipilimumab im Vergleich zur alleinigen Chemotherapie. Die ORR betrug 53% bei Nivo + Chemo vs. 35% bei Nivo + Ipi vs. 27% bei Chemo.
Zusammenfassend kann man sagen, dass sowohl die Kombination Nivo + Chemo als auch die Kombination Nivo + Ipi der alleinigen Chemo signifikant überlegen ist. Mit der Kombination Nivo + Ipi steht jetzt erstmals auch eine Chemotherapie-freie Behandlungsoption zur Verfügung.
PS
ASCO 2021, #LBA4001
Sotorasib als erste Therapie bei KRAS-G12C-mutiertem Lungenkarzinom
Mutationen der RAS-Proteinfamilie lassen sich bei gut 30% aller Malignome nachweisen und Inhibitoren dieses Pathways haben somit ein grosses Potential, waren aber bisher immer erfolglos und galten als «undrugable». Am häufigsten betreffen diese Mutationen KRAS, und die Punktmutation KRAS-G12C. Diese ist funktional eine Treibermutation für 10-15 % der nichtkleinzelligen Lungenkarzinome. Mit Sotorasib liegt ein erster spezifischer direkter KRAS- G12C-Inhibitor vor. Dieser wurde untersucht in der Phase-2-Studie CodeBreaK 100 und hat es gleichzeitig zum ASCO 2021 ins NEJM geschafft. Dies lässt die Erwartungen hochschnellen, dass nun KRAS endlich therapeutisch beeinflussbar ist und, neben NSCLC, auch für Kolorektale Malignome und andere Malignome zur Anwendung kommen könnte, wie von der positiven Phase-1-Studie bereits erwartet werden konnte.
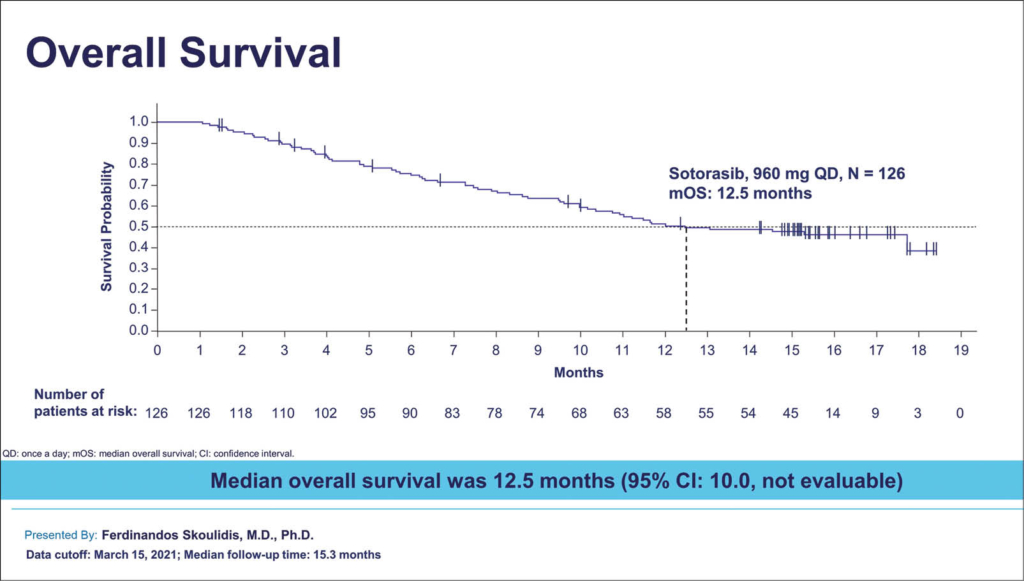
So wurde nun eine unkontrollierte Phase-2-Studie bei 126 Patienten mit KRAS p.G12C-mutiertem fortgeschrittenem NSCLC, welche mit Standard-Therapien vorbehandelt wurden, durchgeführt. Dies mit einer täglichen oralen Dosis von Sotorasib 960 mg. Der primäre Endpunkt war die Overall Ansprechrate (OR). Sekundär wurde die Dauer des Ansprechens (DOR) und der Krankheitskontrolle (DC), das PFS, OS und die Sicherheit evaluiert. Auch wurden «exploratory biomarkers» als mögliche Prädiktoren für das Ansprechen evaluiert. 124 Patienten konnten ausgewertet werden: ein Ansprechen fand sich bei 46/124 Patienten (37.1%; 95% KI, 28.6- 46.2), mit 4 CRs (3.2%) und 42 PRs (33.9%). Die mediane Dauer des Ansprechens betrug 11.1 Monate, Krankheitskontrolle in 100/124 Patienten (80.6%; 95% CI, 72.6-87.2). Das mediane PFS war 6.8 Monate (95% CI, 5.1-8.2), und das mediane OS war 12.5 Monate. Therapie-assoziierte Nebenwirkungen wurden in 88/126 aller Patienten (69.8%), mit Grad 3 bei 25 (19.8%) bez. Grad 4 bei einem Patienten (0.8%) registriert, ohne neue Sicherheitssignale. Als Hauptnebenwirkungen wurden milde, gastrointestinale und lebertoxische Effekte angegeben. Ein Ansprechen fand sich in verschiedenen Subgruppen (PD-L1 Expression, TMB, und begleitenden Mutationen von STK11, KEAP1, oder TP53).
Somit liegt erstmals eine positive Phase 2 mit einem KRAS-Inhibitor in dieser Subpopulation mit KRAS p.G12C-mutiertem fortgeschrittenem und vorbehandeltem NSCLC vor und nun werden weitere Entitäten folgen, allen voran Patienten mit kolorektalem Karzinom.
ThC
Quelle: Abstract 9003: Overall survival and exploratory subgroup analyses from the phase 2 CodeBreaK 100 trial evaluating sotorasib in pretreated KRAS p.G12C mutated non-small cell lung cancer.
Knochenprotektion bei Behandlung von Knochenmetastasen beim Prostatakarzinom zwingend notwendig
In der PEACE-III-Studie (Phase 3 EORTC-1333-GUCG/PEACE-III), vorgestellt von
Prof. Dr. med. Silke Gillessen, Bellinzona wurden Patienten mit knochenmetastasierendem hormonrefraktärem Prostatakarzinom 1:1 randomisiert zu Enzalutamid (160 mg täglich) + Radium-223 (alle 4 Wochen für 6 Zyklen) oder Enzalutamid alleine. Dabei zeigte sich früh, dass sehr viele Knochenfrakturen speziell im Arm mit zusätzlich Radium-223, aber auch im Enzalutamid-alleine-Arm auftraten. Deswegen entschied das Data Monitoring Committee mit einem «Urgent Safety Letter», dass ab sofort bei allen Patienten knochenprotektive Medikamente wie Denosumab oder Bisphosphonate eingesetzt werden müssen.

Die Wirkung dieser Massnahme für die Knochengesundheit nach einem Jahr Behandlung mit Denosumab oder Bisphosphonat war äusserst effektiv: für die Enzalutamid-alleine-Gruppe war die Reduktion der Knochenfrakturen von 15.6% auf 2.7% gesunken, für die Gruppe Enzalutamid + Radium-223 von 37,1% auf 2.7%! Somit ist klar, dass diese einfache Massnahme zum Erhalt der Knochengesundheit hocheffektiv ist und trotz der nicht sehr grossen Fallzahl in dieser Analyse, aber mit eindrücklichem Effekt in der Praxis, zwingend umgesetzt werden muss. Diese Empfehlung wurde bereits in die wichtigsten Guidelines wie NCCN, ESMO und EUA aufgenommen.
ThC
Quelle: Abstract 5002: Phase 3 EORTC-1333-GUCG/PEACE-III trial (NCT02194842): Patients randomized 1:1 to either enzalutamide (160 mg daily plus radium-223 every 4 weeks for 6 cycles) or enzalutamide alone.
Fortgeschrittenes malignes Melanom
Kombination Relatlimab plus Nivo ist Nivo-Monotherapie überlegen
Relatlimab ist ein gegen den Checkpoint LAG-3 gerichteter monoklonaler Antikörper. Im Rahmen der RELATIVITY-047-Studie wurde die Kombination von Relatlimab plus Nivolumab in einer fixen Einzelinfusion gegeben mit einer Nivolumab-Monotherapie bei Patienten mit einem bisher unbehandelten, nicht resezierbaren oder metastasierten fortgeschrittenen malignem Melanom verglichen.
LAG-3 (Lymphozyte activation gen 3) ist ein neuer Angriffspunkt, genauer gesagt Checkpoint, für eine Immuntherapie. Relatlimab ist der erste spezifisch gegen LAG-3 gerichtete monoklonale Antikörper, also ein neuer Checkpoint-Inhibitor. Bei Nivolumab handelt es sich um einen PD-1-Inhibitor. Angesichts der komplementären Wirkmechanismen hofft man, dass die Kombination beider Wirkstoffe wirksamer ist als eine Nivolumab-Monotherapie. Im Rahmen der Phase 2/3 RELATIVITY-047-Studie wurde die Kombination Rela + Nivo mit der Nivo-Monotherapie verglichen und zwar bei Patienten mit einem fortgeschrittenen nicht resezierbaren bzw. metastasierten malignem Melanom.
Mit der Kombination wurde das mediane PFS von 4,63 auf 10,12 Monate verlängert (HR 0,75; p=0,0055). Der Benefit der Kombination zeigte sich schon sehr früh bei der ersten Kontrolle und blieb über die Zeit konstant und zwar bei allen vordefinierten Subgruppen.
Das Sicherheitsprofil der Kombination war akzeptabel und konsistent mit früheren Daten. UEs Grad 3 und 4 traten bei 18,9% unter der Kombination auf und bei 9,7% unter der Monotherapie mit Nivo. 14,6% mussten unter der Kombination die Therapie unterbrechen im Vergleich zu 9,7% in der Nivo-Gruppe.
PS
ASCO 2021, #9503
Fortgeschrittenes malignes Melanom
Auch nach 6,5 Jahren lebt noch jeder zweite Patient unter der Immuntherapie
Im Rahmen der CheckMate-067-Studie wurde bei Patienten mit einem fortgeschrittenen malignen Melanom die Kombination der beiden Checkpoint-Inhibitoren Nivolumab plus Ipilimumab mit der Nivo- und Ipi-Monotherapie verglichen. Dabei erwies sich die Kombination als eindeutig überlegen. Jetzt wurden die Ergebnisse nach einem Follow up von 6,5 Jahren präsentiert.
Das mediane Überleben nach dieser Zeit lag unter der Kombination bei 72,1 Monaten im Vergleich zu 36,9 Monaten unter Nivo und 19,9 Monaten unter Ipi. Das PFS betrug nach dieser langen Zeit bei der Kombination 34%, bei Nivo 29% und bei Ipi bei 7%. Die PFS-Dauer betrug 11,5 Monate bzw. 6,9 Monate bzw. 2,9 Monate. 49% der Patienten lebten nach 6,5 Jahren noch. 77% der Patienten mit der Kombination, 69% mit Nivo und 43% mit Ipi waren Therapie-frei und benötigten keine Folgetherapie.
Der Benefit der Kombination und der Nivo-Monotherapie im Vergleich zu einer Ipi-Monotherapie zeigte sich in allen Subgruppen unabhängig vom BRAF-mut-Status und dem Vorhandensein von Lebermetastasen. Bei Patienten mit einer BRAF-Mutation betrug die OS-Rate 57% unter der Kombination vs. 43% bei Nivo und 25% bei Ipi. Beim BRAF-Wild-Typ waren es 46% vs. 42% vs. 22%. Bei Lebermetastasen waren die OS-Raten 38% vs. 31% vs. 22%. Die Dauer der Therapie ist in der Kombi-Gruppe bzw. Nivo-Gruppe noch nicht erreicht und lag unter Ipi bei 19,2 Monaten. Das Sicherheitsprofil war vergleichbar mit früheren Daten. Fazit der Studie: Auch im Langzeitverlauf ist die Kombination Nivo + Ipi einer Immun-Monotherapie mit Nivo oder Ipi überlegen.
PS
ASCO 2021, #9506
Neue Erstlinientherapie am Horizont für Patienten mit Nasopharynx-Karzinom
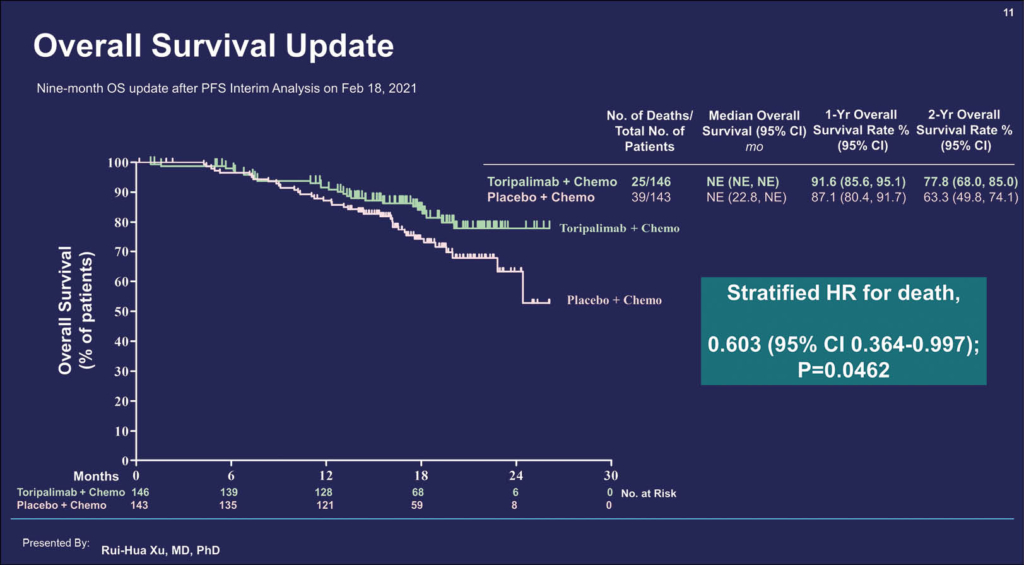
In dieser multizentrischen Placebo-kontrollierten Phase-III-Studie JUPITER-02 wurde die Frage untersucht, ob der anti-PD1-monoklonale Antikörper Toripalimab zur Standard-Chemotherapie mit Cisplatin+Gemzar eine klinisch bedeutsame Wirksamkeit zeigt. Patienten hatten entweder ein bereits metastasiertes Nasopharynxkarzinom oder ein bislang unbehandeltes Rezidiv nach kurativ intendierter Therapie und noch keine Chemotherapie erhalten. 289 Patienten aus China, Taiwan und Singapur wurden in zwei Behandlungsgruppen randomisiert. Alle erhielten Gemcitabin in einer Dosis von 1000 mg an Tag 1 und 8 eines jedes Zyklus und Cisplatin in einer Dosis von 80 mg/m² an Tag 1 eines Zyklus. Die Patienten erhielten entweder zusätzlich Toripalimab in einer Dosis von 240 mg (n = 146) oder im Kontrollarm Placebo (n=143) alle drei Wochen für maximal sechs Zyklen. Primärer Endpunkt der Studie war das PFS nach RECIST-Kriterien. Die Nebenwirkungen (NW) entsprachen dem Muster anderer bekannter PD1-Hemmer: Immunassoziierte unerwünschte Ereignisse traten bei 39,7% der mit Toripalimab behandelten Patienten auf und erreichten bei 7,5% einen Grad ≥ 3.
Insgesamt war die Rate der NW inklusive Grad ≥ 3 in beiden Studienarmen vergleichbar (89,0% versus 89,5% mit Placebo). In der Verum-Gruppe brachen etwas mehr Patienten als in der Placebo-Gruppe die Therapie wegen NW ab (7,5% vs. 4,9%); Todesfälle wegen NW waren in beiden Gruppen selten (2,7% vs. 2,8%). Die Ansprechrate war 77,4% für den Arm Toripalimab + GC und 66,4% für den Kontrollarm (p = 0,0335). Die mediane Ansprechdauer betrug 10,0 versus 5,7 Monate (HR = 0,50; 95% KI 0,33–0,78). Toripalimab+GC zeigte eine Verlängerung des medianen PFS von 11,7 Monaten gegenüber 8,0 Monaten für den Kontrollarm. Das PFS nach einem Jahr betrug 49,4% versus 27,9% im Placebo-Arm der Studie. Die HR lag bei 0,52 (95% KI 0,36–0,74; p = 0,0003). Der Effekt war unabhängig von der PD-L1-Expression. Die Kaplan-Meier-Kurve des OS zeigte bereits einen Vorteil. Das mediane OS ist zwar in beiden Gruppen noch nicht erreicht, die stratifizierte HR liegt aber im Februar 2021 bereits bei 0,603 (95% KI 0,364–0,997; p = 0,0462). Nach 2 Jahren lebten 77,8% der Patienten im Interventions- und 63,3% der Patienten im Standardarm der Studie. Toripalimab ist in China bereits in der 3. Linie zugelassen und die FDA prüft nun ein beschleunigtes Zulassungsverfahren.
ThC
Quelle: LBA2: JUPITER-02: Randomized, double-blind, phase III study of toripalimab or placebo plus gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC).