- CMV-Screening
Kongenitale CMV-Infektionen können zu schweren kindlichen Beeinträchtigungen führen. In den letzten Jahren wurden erhebliche Fortschritte bei der Risikoeinschätzung, der frühzeitigen mütterlichen Diagnostik sowie medikamentöser Behandlungen zur Verhinderung einer transplazentaren fetalen Infektion gemacht. Dadurch erweitert sich das Spektrum der Optionen bei frühzeitig erkannter mütterlicher CMV-Infektion und die Frage, ob ein CMV-Screening sinnvoll ist, muss neu bewertet werden.
Une infection congénitale à CMV peut occasionner de graves lésions chez l’enfant. Dans les dernières années, des progrès considérables ont été réalisés dans l’évaluation du risque, le diagnostic précoce d’une infection maternelle et dans le traitement médicamenteux pour empêcher une infection transplacentaire du fœtus. Ainsi, l’éventail des options en cas d’infection maternelle à CMV reconnue rapidement s’élargit; et la question de savoir si le dépistage du CMV fait sens doit être réévaluée.
Das humane Cytomegalie-Virus (CMV) gehört zur Gruppe der Herpesviren und persistiert nach einer primären Infektion lebenslang als latente Infektion im Körper. Während die Mehrzahl der CMV-Infektionen bei immunkompetenten Menschen asymptomatisch verlaufen und somit nicht klinisch erkennbar sind, kann es seltener zu einem mononukleoseartigen Krankheitsbild mit langwierigem Fieber und Abgeschlagenheit kommen, das im Blutbild mit einer Lymphozytose und dem Nachweis atypischer Lymphozyten einhergeht. Im Gegensatz zur Epstein-Barr-Virus-Infektion dominiert jedoch das Fieber, während die klassischen klinischen Zeichen der Mononukleose, die Lymphadenopathie und Tonsillitis, signifikant seltener vorhanden sind.
Körpersekrete als Infektionsquelle
Die Infektion findet durch Kontakt mit infizierten menschlichen Körpersekreten (Speichel, Urin, Tränenflüssigkeit, Samenflüssigkeit etc.) statt und wird v.a. durch engen körperlichen Kontakt übertragen. Kleinkinder gelten als die wichtigsten Überträger was auch damit zusammenhängt, dass diese eine zeitlich lange Virusausscheidung zeigen. So haben Mütter mit einem krippenbetreuten Kleinkind ein bis zu 10-fach erhöhtes Risiko für eine CMV-Infektion (1). Frauen, die in der ersten Schwangerschaft CMV negativ waren, hatten zum Zeitpunkt der Folgeschwangerschaft eine Serokonversionsrate von 15.8%, bei einem Drittel lag eine frische Infektion perikonzeptionell oder im ersten Trimenon vor (2). Die von der Seroprävalenz abhängige Serokonversionsrate Schwangerer im Allgemeinen wird für die Schweiz im Vergleich dazu auf ca. 0.5-1% geschätzt. Das Risiko für Kleinkindbetreuerinnen ist etwa 4-fach erhöht. Für Medizinalpersonen konnte trotz relevantem Expositionsrisiko in Studien bisher keine signifikante Risikoerhöhung objektiviert werden, was mit einer erhöhten Routine bei den Hygienemassnahmen zusammenhängen könnte.
Die Rate an durchgemachten CMV-Infektionen (Seroprävalenz) von Frauen im gebärfähigen Alter ist unter anderem abhängig vom sozioökonomischen Entwicklungsstand eines Landes. Die Durchseuchung erreicht bis zu 100% in Teilen von Afrika, Asien und Südamerika. In der Schweiz und West-Europa wird die Seroprävalenz auf ca. 50% geschätzt (3). Das bedeutet, dass etwa die Hälfte der Schwangeren das Risiko trägt, sich neu mit dem CMV zu infizieren.
Risiken der CMV-Infektion
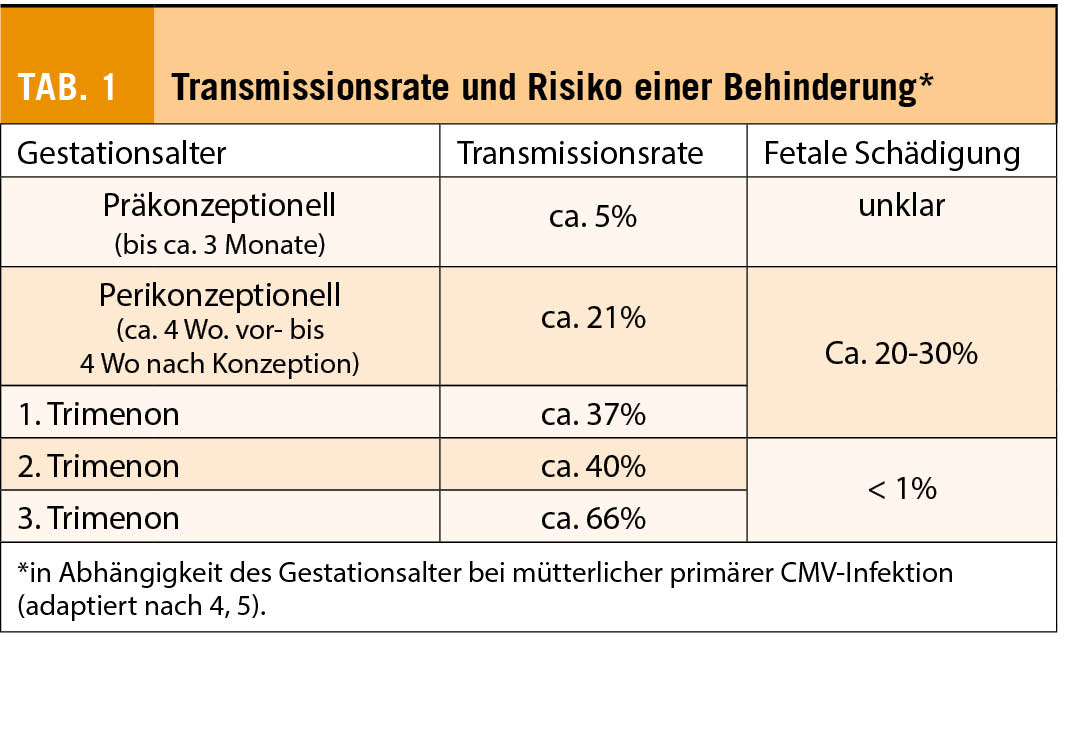
Eine mütterliche CMV-Infektion kurz vor- oder während der Schwangerschaft kann zu erheblicher Schädigung des Feten führen und ist die häufigste infektionsbedingte Ursache für neurokognitive Entwicklungsstörungen und für sensoneuronalen Gehörverlust. Die Wahrscheinlichkeit, dass es bei einer mütterlicher Primärinfektion zu einer transplazentaren Infektion des Feten kommt, steigt mit zunehmendem Gestationsalter an (Tab. 1). Gleichzeitig sinkt das Risiko einer fetalen Schädigung mit fortschreitendem Gestationsalter erheblich. Aktuelle Daten beziffern das Risiko für eine relevante fetale Schädigung auf 20-30%, wenn die mütterlichen Primärinfektion perikonzeptionell- bzw. im ersten Trimenon stattgefunden hat. Hingegen fällt das Risiko auf unter 1%, wenn die Infektion nach dem ersten Trimenon stattgefunden hat (4, 5).
Neben der primären CMV-Infektion können auch Reaktivierungen der latenten Infektion und Re-Infektionen mit einem anderen CMV-Stamm zu fetalen Schädigungen führen. Da die nichtprimäre Infektion diagnostisch schwierig einzuordnen ist, sind exakte Zahlen nicht bekannt, es werden jedoch deutlich geringere Transmissionsraten zwischen 0.2-3.4% geschätzt, wenngleich manche dies für unterschätzt halten (6, 7). Wenn es jedoch zu einer fetalen Infektion kommt, ist das Schädigungspotential dem der Primärinfektion vergleichbar (8).
Erkennung nur über eine serologische Diagnostik
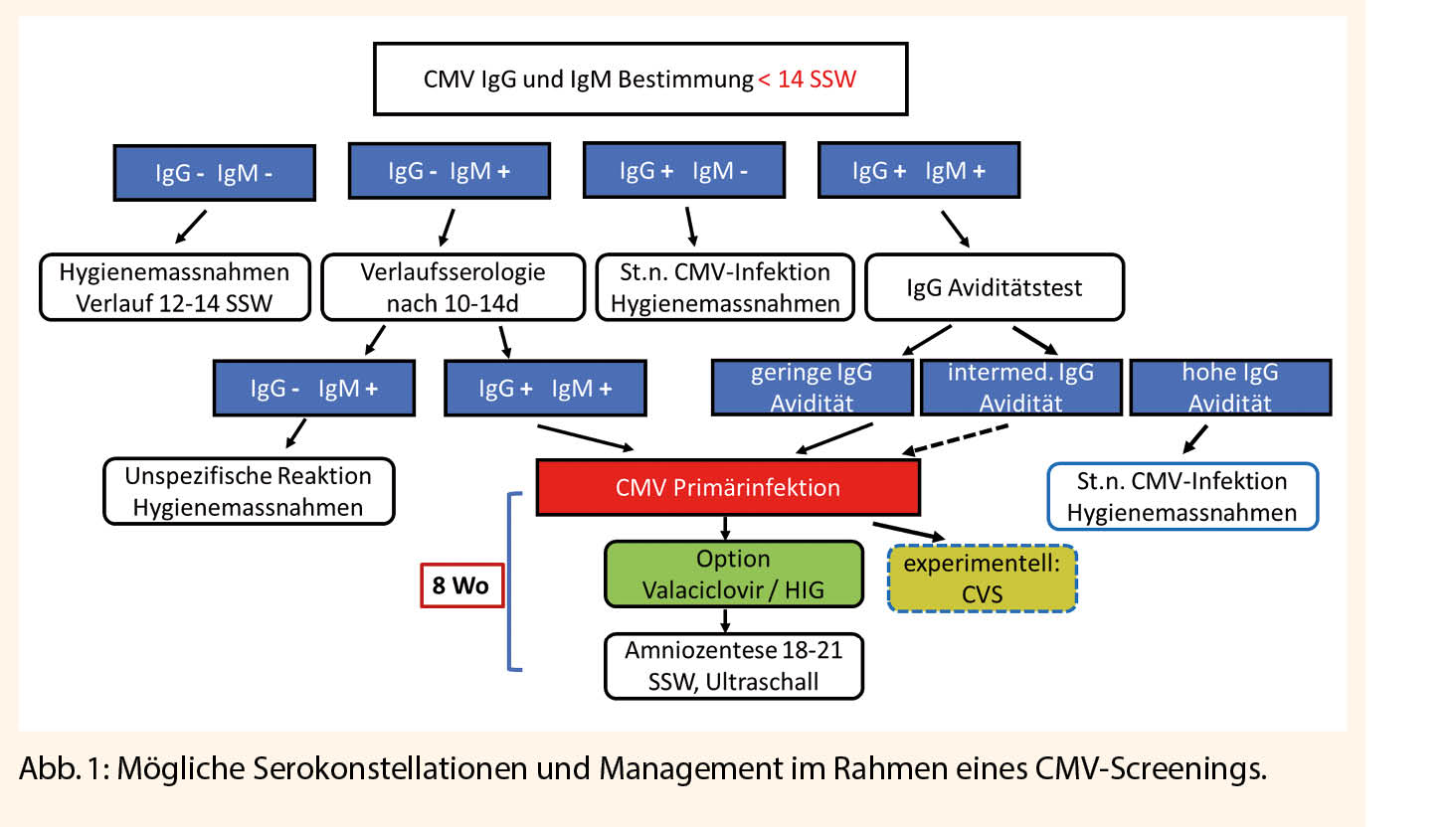
Da über 90% der primären CMV-Infektionen bei Schwangeren asymptomatisch oder unspezifisch verlaufen, ist die frühzeitige Erkennung einer mütterlichen CMV-Infektion eine Herausforderung und kann praktisch nur über die Bestimmung der Serologien erkannt werden. Typischerweise wird die Primärinfektion durch eine Serokonversion des CMV IgG diagnostiziert. Dies setzt jedoch voraus, dass ein negativer Serostatus vorbekannt ist. Da mit der perikonzeptionellen Phase und dem ersten Trimenon ein verhältnismässig kurzes Zeitintervall für eine Schädigung relevant ist, können eine Reihe von Immunglobulin-Konstellationen vorliegen, die interpretiert werden müssen, um die Wahrscheinlichkeit einer relevanten Primärinfektion abschätzen zu können. Wenn eine Risikoeinschätzung erfolgen soll, muss daher ein Serostatus so früh wie möglich bei der ersten Schwangerschaftskontrolle oder bereits präkonzeptionell erhoben werden. Bei negativem Serostatus in der Frühschwangerschaft sollte bei 12-14 SSW erneut eine Serobestimmung stattfinden, um das gesamte erste Trimenon abzudecken. Zu beachten ist, dass der alleinige Nachweis von CMV IgM nicht diagnosesichernd für eine frische CMV-Infektion ist, da unspezifische Kreuzreaktionen vorliegen können und es sollte zunächst eine Verlaufsserologie nach 10-14 Tagen durchgeführt werden. Erst wenn es dann zu einem IgG Nachweis kommt ist eine frische CMV-Infektion gesichert. Bei positivem IgG und negativem IgM ist mit hoher Wahrscheinlichkeit von einer bereits früher stattgehabten CMV-Infektion auszugehen und eine erneute Bestimmung in der Schwangerschaft ohne Verdachtsmoment ist nicht empfohlen. Wenn sowohl IgG als auch IgM nachweisbar sind, muss der Zeitpunkt der Infektion besser eingegrenzt werden, da IgM für lange Zeit persistieren kann. Dies geschieht mit der Bestimmung der Ig G Avidität als Mass für den Maturitätsgrad des Antikörpers. Eine geringe Avidität spricht für eine kürzlich stattgefundene CMV-Infektion. Schwierig ist die Interpretation, wenn eine intermediäre Avidität vorliegt. Hier zeigen noch unpublizierte Daten, dass in etwa 10% es zu einer fetalen Infektion kommen kann, was bedeutet, dass diese Fälle am ehesten wie eine Primärinfektion behandelt werden sollten. Die möglichen Serokonstellationen sind in Abb. 1 zusammengestellt. Eine verlässliche Erkennung von nicht-primären Infektionen durch Re-Infektion oder Re-Aktivierung ist hingegen nicht möglich und eine weiterführende CMV-Diagnostik sollte nur bei begründetem Verdacht erfolgen.
Behandlungsoptionen bei frühzeitiger Infektionserkennung
Eine frühzeitige Erkennung einer mütterlichen CMV-Primärinfektion ist dann sinnvoll, wenn daraus therapeutische Optionen abgeleitet werden können, mit Hilfe derer eine vertikale Transmission auf den Feten verhindert werden. Hierfür stehen derzeit das Virustatikum Valaciclovir sowie Hyperimmunglobuline zu Verfügung. Beide Substanzen werden im «off-label use» angewendet. In einer aktuellen randomisierten, doppel-blind, placebo-kontrollierte Studie konnte bei Schwangeren mit einer perikonzeptionell- oder im ersten Trimenon stattgefundenen CMV-Serokonversion als Zeichen einer Primärinfektion mittels hochdosiertem Valaciclovir (8g/d) eine signifikante Reduktion der vertikalen Transmission bis zum Zeitpunkt der Amniozentese bei 21 SSW um 70% erreicht werden (11% vs. 30% in der Plazebogruppe) (9). Die Datenlage für die Hyperimmunglobuline (HIG) ist bisher uneinheitlich, während in 2 randomisierten, plazebo-kontrollierten Studien keine signifikante Transmissionsreduktion festgestellt werden konnte (10), zeigte eine aktuelle nicht-randomisierte Beobachtungsstudie mit optimierten Behandlungsmodalitäten hinsichtlich des Behandlungsbeginns, der Dosis und des Applikationsintervalls deutlich seltener eine fetale CMV-Infektion bei der Amniozentese bei 20 SSW (6.5% vs. 35.2% beim historischen Kontrollkollektiv) (11).
Ist ein Screening auf CMV sinnvoll?
Um eine effektive Transmissionsprophylaxe betreiben zu können muss eine mütterliche Primärinfektion so früh wie möglich erkannt werden, damit die transplazentare Infektion verhindert werden kann. Somit stellt sich die Frage, ob ein mütterliches Screening auf CMV in der frühen Schwangerschaft sinnvoll ist und angeboten werden sollte.
Ein systematisches Screening macht nur in Populationen mit verhältnismässig geringer Seroprävalenz, wie sie v.a. in Zentraleuropa vorliegt, Sinn. Einige Gründe sprechen für ein Screening auf CMV in der Schweiz. Etwa die Hälfte aller Schwangeren trägt ein Risiko für eine primäre CMV-Infektion. Die kongenitale CMV-Infektion ist ein relevantes Gesundheitsproblem und ein geeignetes Testverfahren (Serostatus) ist vorhanden mit einer hohen Sensitivität von 93-96% für die neuesten IgG-Aviditätstests für die Erkennung einer primären CMV-Infektion innerhalb der letzten 3 Monate (12). Ferner steht eine Behandlung zur Verfügung, die eine signifikante Risikoreduktion bewirkt. Somit sind zentrale, von der WHO aufgestellte Kriterien, welche an ein Screening gestellt werden, erfüllt (13).
Ob die Evidenz aus den bisherigen Studien hinsichtlich der Transmissionsprophylaxe ausreichend ist, um diese als anerkannte Therapie in Anlehnung an die WHO-Kriterien einzustufen und ob die mit einem Screening verbundenen Kosten in einem ausgewogenen Verhältnis zu den möglichen Kosten der medizinischen Versorgung bei kongenitalen CMV-Infektionen insgesamt steht, bleibt aktuell offen. In der Tat ist ein generelles Screening auf CMV aller Schwangeren im ersten Trimenon international umstritten und bisher in keiner nationalen Guideline empfohlen (14). Argumente gegen ein generelles Screening sind die begrenzte Datenlage hinsichtlich der therapeutischen Optionen für eine Transmissionsprophylaxe (Virustatika, Hyperimmunglobulin s.o.), eine teilweise schwierige Interpretation bei Seropositivität im Hinblick auf Primär- vs. Nicht-Primärinfektion bzw. den Zeitpunkt der Primärinfektion und damit der Risikoeinschätzung. Die Thematik wird mit zunehmender Datenlage zu Diagnostik und Therapie aber aktuell bleiben. So wurden bereits die Daten zur Valaciclovir Behandlung in einer weiteren Analyse bestätigt.
Primärprävention
Die Primärprävention ist nach wie vor die wichtigste Massnahme zum Schutz vor einer CMV-Infektion. Diese besteht in der Aufklärung über die schwangerschaftsspezifischen Risiken und Infektionswege des CMV. Mehrere Studien haben gezeigt, dass das Bewusstsein für das Risiko einer CMV-Infektion sowohl bei den medizinischen Versorgern wie auch bei den Schwangeren begrenzt ist, was dazu führt, dass Hygienemassnahmen nicht oder zu spät durchgeführt werden und somit das Risiko einer mütterlichen Serokonversion steigt. Dass Hygienemassnahmen effektiv sein können, wurde verschiedentlich gezeigt. In einer randomisierten Studie bei seronegativen Schwangeren konnte das Risiko einer Infektion um 85% gesenkt werden (15). Die Hygieneempfehlungen sind in Abb. 1 zusammengefasst. Da jedoch viele Schwangerschaften ungeplant eintreten und die erste Schwangerschaftskontrolle üblicherweise bei 6-9 SSW stattfindet, ist ein grosser Teil der vulnerablen Phase bereits überschritten, sodass diese Massnahmen zu spät kommen könnten, insbesondere wenn das Bewusstsein in der Bevölkerung hierzu gering ist.
Risikoadaptiertes Screening?
Während eine Empfehlung für ein generelles Screening noch nicht abschliessend getroffen werden kann, könnte ein risikoadaptiertes Screening zielführend sein. Dieses betrifft v.a. die Hauptrisikopopulation der Schwangeren mit Kleinkindern im Haushalt und Kleinkindbetreuerinnen in Kindertagesstätten. Nicht ausser Acht zu lassen ist auch das Recht der Schwangeren auf eine informierte Entscheidung im Sinne der Patientenautonomie. Dies setzt voraus, dass einerseits eine Einschätzung der individuellen Risikokonstellation stattfindet und andererseits über die diagnostischen Möglichkeiten inklusive deren potentiellen Unsicherheiten sowie über die Konsequenzen bzw. Optionen im Falle des Verdachts bzw. Nachweises einer Primärinfektion informiert wird. Hierfür ist ein entsprechendes Hintergrundwissen des Aufklärenden notwendig, denn ein wichtiges Argument von Gegnern eines Screening ist, dass dieses zu vermehrten Schwangerschaftsabbrüchen führen könnte, da eine Prognoseeinschätzung im ersten Trimenon schwierig ist und unklare Serologien dazu führen könnten, dass die Schwangerschaft zum Ausschluss der Eventualität einer fetalen Schädigung zu einem frühen Zeitpunkt ohne eine weitere konfirmatorische Diagnostik (Verlaufsserologie, Fruchtwasser) abzuwarten unnötig abgebrochen wird. Eine differenzierte Interpretation der Serologien und eine hohe Expertise bei der Besprechung auffälliger Resultate können dabei zu einer signifikanten Reduktion voreiliger Abbrüche führen (16).

Die fetale Infektion im ersten Trimenon wird üblicherweise durch eine Amniozentese mit PCR auf CMV im Fruchtwasser nachgewiesen, diese sollte mindestens 8 Wochen nach vermuteter Primärinfektion, aber frühestens ab 18 SSW durchgeführt werden. Dies bedeutet eine lange zum Teil für die Eltern schwer erträgliche Phase der Unsicherheit und Sorge. Ein neuer, noch nicht etablierter Ansatz ist, per Chorionzottenbiopsie bereits bei 12-14 SSW durch den CMV-Nachweis in Chorionzotten eine erste Einschätzung zu machen (17). Dies könnte insbesondere in Fällen, bei denen bereits ein Abbruch der Schwangerschaft im Raum steht, bei fehlendem CMV-Nachweis eine Entwarnung geben, dass der Fet zum Zeitpunkt der Vulnerabilität nicht infiziert war. Die Schweizerische Akademie für feto-maternale Medizin hat die Empfehlungen im neuen Expertenbief der SGGG vom Februar 2021 zu CMV in der Schwangerschaft überarbeitet, damit die Schwangere eine informierte Entscheidung treffen kann. Dies könnte auch zu einer verstärkten Sensibilisierung für die Primärprophylaxe durch Hygienemassnahmen führen. Eine vergleichbare Empfehlung wurde im Juli 21 in der kanadischen Guideline publiziert (18).
Copyright bei Aerzteverlag medinfo AG
Klinik für Geburtshilfe und Pränataldiagnostik
Kantonsspital Baden AG
Im Ergel
5404 Baden
leonhard.schaeffer@ksb.ch
Der Autor hat keine Interessenkonflikte in Zusammenhang mit diesem Artikel.
◆ Eine Primärprophylaxe mittels Information und Hygienemassnahmen ist die Basis zum Schutz vor kongenitalen CMV-Infektionen und muss jeder Frau in der Frühschwangerschaft oder optimalerweise präkonzeptionell vermittelt werden.
◆ Eine individuelle Risikoeinschätzung und ein Angebot zur Erhebung des Serostatus im Sinne eines «risikoadaptierten Screenings» sollte jeder Schwangeren im Sinne einer informierten Entscheidung zu Verfügung gestellt werden.
◆ Unklare Serologiekonstellationen und Serokonversionen im ersten Trimenon bedürfen einer zeitnahen differenzierten Beratung mit dem Ziel, durch Aufzeigen der möglichen Behandlungsoptionen, der weiteren Diagnostik und der Prognoseeinschätzung voreilige Konsequenzen (für die laufende Schwangerschaft) zu verhindern.
Messages à retenir
◆ Chaque femme doit recevoir, en début de grossesse ou mieux encore avant la conception, comme prévention primaire, les informations et instructions sur les mesures d’hygiène qui sont la base de la protection contre une infection congénitale à CMV.
◆ Chaque femme enceinte devrait recevoir une évaluation de son risque individuel et l’offre d’établir son status sérologique dans le sens d’un «screening adapté au risque » pour lui permettre de prendre ses décisions en toute connaissance de cause.
◆ Une constellation sérologique ambigüe ou la séroconversion pendant le premier trimestre nécessitent un conseil différencié sans délai exposant les possibilités thérapeutiques, les mesures diagnostiques complémentaires et le pronostic, dans le but d’éviter des conclusions hâtives (pour la grossesse en cours).
1. Hyde TB, Schmid DS, Cannon MJ. Cytomegalovirus seroconversion rates and risk factors: implications for congenital CMV. Rev Med Virol. September 2010;20(5):311–26.
2. Leruez-Ville M, Guilleminot T, Stirnemann J, Salomon LJ, Spaggiari E, Faure-Bardon V, u. a. Quantifying the Burden of Congenital Cytomegalovirus Infection With Long-term Sequelae in Subsequent Pregnancies of Women Seronegative at Their First Pregnancy. Clin Infect Dis Off Publ Infect Dis Soc Am. 23. Oktober 2020;71(7):1598–603.
3. Manicklal S, Emery VC, Lazzarotto T, Boppana SB, Gupta RK. The „silent“ global burden of congenital cytomegalovirus. Clin Microbiol Rev. Januar 2013;26(1):
86–102.
4. Chatzakis C, Ville Y, Makrydimas G, Dinas K, Zavlanos A, Sotiriadis A. Timing of primary maternal cytomegalovirus infection and rates of vertical transmission and fetal consequences. Am J Obstet Gynecol. Dezember 2020;223(6):870-883.e11.
5. Faure-Bardon V, Magny J-F, Parodi M, Couderc S, Garcia P, Maillotte A-M, u. a. Sequelae of Congenital Cytomegalovirus Following Maternal Primary Infections Are Limited to Those Acquired in the First Trimester of Pregnancy. Clin Infect Dis Off Publ Infect Dis Soc Am. 15. Oktober 2019;69(9):1526–32.
6. Britt WJ. Congenital Human Cytomegalovirus Infection and the Enigma of Maternal Immunity. J Virol. 1. August 2017;91(15).
7. Simonazzi G, Curti A, Cervi F, Gabrielli L, Contoli M, Capretti MG, u. a. Perinatal Outcomes of Non-Primary Maternal Cytomegalovirus Infection: A 15-Year Experience. Fetal Diagn Ther. 2018;43(2):138–42.
8. Mussi-Pinhata MM, Yamamoto AY. Natural History of Congenital Cytomegalovirus Infection in Highly Seropositive Populations. J Infect Dis. 5. März 2020;221(Suppl 1):S15–22.
9. Shahar-Nissan K, Pardo J, Peled O, Krause I, Bilavsky E, Wiznitzer A, u. a. Valaciclovir to prevent vertical transmission of cytomegalovirus after maternal primary infection during pregnancy: a randomised, double-blind, placebo-controlled trial. Lancet Lond Engl. 12. September 2020;396(10253):779–85.
10. Revello MG, Lazzarotto T, Guerra B, Spinillo A, Ferrazzi E, Kustermann A, u. a. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med. 3. April 2014;370(14):1316–26.
11. Kagan KO, Enders M, Hoopmann M, Geipel A, Simonini C, Berg C, u. a. Outcome of pregnancies with recent primary cytomegalovirus infection in first trimester treated with hyperimmunoglobulin: observational study. Ultrasound Obstet Gynecol Off J Int Soc Ultrasound Obstet Gynecol. April 2021;57(4):560–7.
12. Sarasini A, Arossa A, Zavattoni M, Fornara C, Lilleri D, Spinillo A, u. a. Pitfalls in the Serological Diagnosis of Primary Human Cytomegalovirus Infection in Pregnancy Due to Different Kinetics of IgM Clearance and IgG Avidity Index Maturation. Diagn Basel Switz. 26. Februar 2021;11(3).
13. Wilson JMG, Junger G. Principles and practice of screening for disease. Public Health papers No. 34, Word Health Organization. 1968.
14. Hui L, Shand A. Is it time to adopt routine CMV screening in pregnancy? No! Am J Obstet Gynecol MFM. 22. März 2021;100355.
15. Revello MG, Tibaldi C, Masuelli G, Frisina V, Sacchi A, Furione M, u. a. Prevention of Primary Cytomegalovirus Infection in Pregnancy. EBioMedicine. September 2015;2(9):1205–10.
16. Guerra B, Simonazzi G, Banfi A, Lazzarotto T, Farina A, Lanari M, u. a. Impact of diagnostic and confirmatory tests and prenatal counseling on the rate of pregnancy termination among women with positive cytomegalovirus immunoglobulin M antibody titers. Am J Obstet Gynecol. März 2007;196(3):221.e1-6.
17. Faure-Bardon V, Fourgeaud J, Guilleminot T, Magny J-F, Salomon LJ, Bernard J-P, u. a. First-trimester diagnosis of congenital cytomegalovirus infection after maternal primary infection in early pregnancy: feasibility study of viral genome amplification by PCR on chorionic villi obtained by CVS. Ultrasound Obstet Gynecol Off J Int Soc Ultrasound Obstet Gynecol. April 2021;57(4):568–72.
18. Boucoiran I, Yudin M, Poliquin V, Caddy S, Gantt S, Castillo E. Guideline No. 420: Cytomegalovirus Infection in Pregnancy. J Obstet Gynaecol Can JOGC J Obstet Gynecol Can JOGC. Juli 2021;43(7):893–908.
info@gynäkologie
- Vol. 11
- Ausgabe 5
- Oktober 2021