- Beitrag der Neuro-Bildgebung bei der Diagnose von kognitiven Störungen
Die kognitive Beeinträchtigung ist ein weit verbreiteter Zustand mit Behinderungen, die erhebliche Auswirkungen auf die öffentliche Gesundheit haben. Im diagnostischen Prozess können bildgebende Verfahren und nuklearmedizinische Techniken die Ätiologie des kognitiven Verfalls oft feststellen und so eine bessere, individualisierte und angepasste Pflege ermöglichen. In diesem Artikel fassen wir die Indikationen und den Beitrag der verschiedenen bildgebenden Verfahren zusammen, die in der klinischen Praxis eingesetzt werden.
Angesichts einer alternden Bevölkerung sind kognitive Störungen zu einem vorrangigen Problem der öffentlichen Gesundheit geworden, mit einer Prävalenz in der Schweiz im Jahr 2019 von 154 700 Personen und fast 29 500 neuen Fällen pro Jahr (Quelle: BAG). Die wirtschaftlichen Auswirkungen sind sehr wichtig, mit fast 11,8 Milliarden Franken Ausgaben im Jahr 2017, gemäss einer Studie aus dem Jahr 2019 im Auftrag der Alzheimer-Gesellschaft, wobei die Verluste im Zusammenhang mit den vorzeitigen Rücktritten von Arbeitskräften nicht eingerechnet sind. Angesichts dieser Tatsache sind Untersuchungsstrategien zur Erstellung einer korrekten Diagnose wichtig, um einen frühzeitigen und korrekten auf diese Patienten abgestimmten Zugang zu medizinischer und sozialer Versorgung zu ermöglichen.
Dies kann eine personalisierte Begleitung beinhalten, aber auch das Bereitstellen von Behandlungen, um den fortschreitenden Abbau zu verlangsamen und die Symptome zu verringern.
Das klinische Bild allein, ohne bildgebende Untersuchung, ermöglicht bei einem kognitiven Verfall keine präzise Unterscheidung, ob dieser beispielsweise durch eine Depression oder eine neurodegenerative Erkrankung verursacht wird. Zu den Hauptursachen der Demenz gehören die neurodegenerative Alzheimer-Krankheit (AD), die nur zwei Drittel der Fälle betrifft, die vaskuläre Demenz, die Lewy-Körper-Demenz und die frontotemporale Demenz.
Die Erstdiagnose einer kognitiven Beeinträchtigung basiert auf der klinischen und neuropsychologischen Beurteilung, nach deren Durchführung ätiologische Hypothesen erst aufgestellt werden können, die dann dank Bildgebung bestätigt oder verworfen werden können. Tatsächlich ist es nun möglich, dank des technologischen Fortschritts der anatomischen und der molekularen Neuro-Bildgebung, die sich gegenseitig ergänzen, in der Mehrheit der Fälle eine genaue ätiologische Diagnose zu stellen (1).
Anatomische-Bildgebung mit MRT
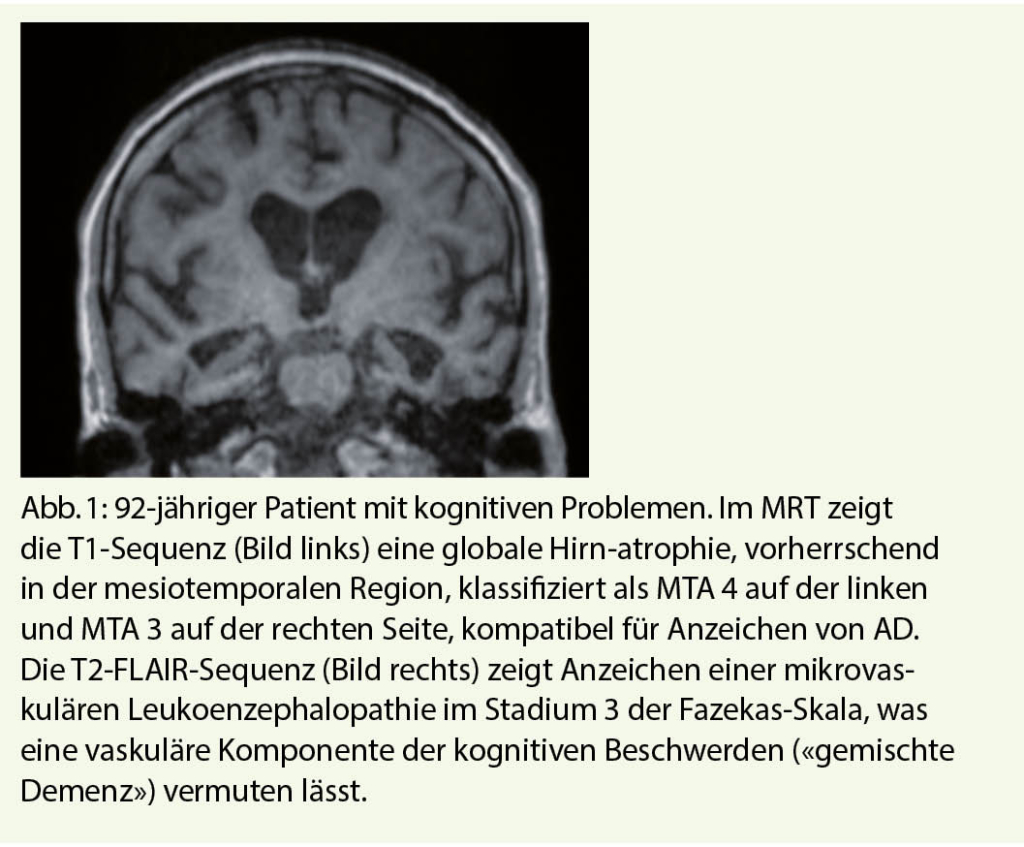
Das primäre Ziel der anatomischen Bildgebung ist der Ausschluss einer behandelbaren Ursache, chirurgisch oder nicht chirurgisch, welche die kognitive Beeinträchtigung erklärt (z.B. Hämatom, Epi-/Subduralhämatom, Hydrozephalus, Tumor, Enzephalitis). Sie ermöglicht eine gezielte Diagnose, insbesondere durch die Suche nach einer generalisierten oder auf eine Region des Gehirns beschränkten Hirnatrophie, die mit einer primären degenerativen Demenz kompatibel ist, sowie die Suche nach vaskulären Läsionen, wie z.B. die Folgeerscheinungen nach Infarkt oder Signalanomalien der weissen Substanz. Das zuerst empfohlene Bildgebungsverfahren ist die MRT, die empfindlicher ist als das CT, mit einem Protokoll bestehend aus den in Tabelle 1 (2) zusammengefassten Sequenzen (Abb. 1).
Fortschrittliche MRT-Techniken, die in der klinischen Routine nicht verwendet werden, die aber zur Diagnose einer Demenz beitragen können, sind DTI (diffusion tensor imaging), ASL-Perfusion (arterial spin labeling) und Resting State-functional-MRI (funktionelle MRT).
MRT-Untersuchungen können leicht wiederholt werden zur Überwachung der Progressionsrate einer neurodegenerativen oder vaskulären Erkrankung, oder um die Wirkung einer begonnenen Behandlung zu beurteilen. Wiederholte MRTs sind auch nützlich, um Nebenwirkungen von Anti-Amyloid-Behandlungen wie ARIA (amyloid-related imaging anomalies) auszuschliessen. Wenn eine MRT-Untersuchung nicht verfügbar oder kontraindiziert ist, oder bei wenn Patienten klaustrophobisch sind oder die eine Untersuchung von einer gewisser Dauer nicht ertragen können, kann ein CT ohne Injektion von Kontrastmittel angeboten werden. Dies erlaubt insbesondere, die zerebrale Trophik und das Vorhandensein vaskulärer Folgeerscheinungen abzuschätzen, auch wenn der Kontrast zur MRT geringer ist.
Molekulare Bildgebung mit PET und SPECT
Bei einer klinisch atypischen oder sich schnell entwickelnden Form kognitiver Beeinträchtigung bei jungen Patienten (<65 Jahre), oder bei allen Fällen, bei denen der Arzt sich nicht genügend auf die klinische, neuropsychologische und psychosoziale Bewertung und morphologische Bildgebung abstützen kann, ist die molekulare Bildgebung ein wertvolles ergänzendes Werkzeug (3). Mehrere Bildgebungsmodalitäten mit verschiedenen Radiotracern sind derzeit dazu im Einsatz. Unter ihnen sind die Positronen-Emissions-Tomographie (PET) mit 18F-Fluorodeoxyglukose (18F-FDG), Amyloid-PET und die SPECT (Einzelphotonen-Emissionscomputertomographie) mit 123I-Ioflupan (DaT-Scan).
Ein PET-Scan des Gehirns mit 18F-FDG ermöglicht es, eine Bildgebung des Hirnstoffwechsels durchzuführen, unter Verwendung eines Radiotracers bestehend aus einem Glukosemolekül, an dem eine Hydroxylgruppe durch 18-Fluor ersetzt ist. Der Radiotracer wird in die Zellen durch Glukosetransporter transportiert und danach phosphoryliert, wodurch er in den Zellen festgehalten wird und so die Untersuchung des regionalen Stoffwechsels der Zellen ermöglicht. Die Untersuchung wird mit Hybridgeräten durchgeführt, welche die PET-Erfassung mit einer CT-Bildgebung (PET/CT) kombinieren. Da das Gehirn glukoseabhängig und stoffwechselaktiv ist, reflektiert die Kartographie des zerebralen Kohlenhydratstoffwechsels das Spiegelbild der neuronalen Aktivität und ermöglicht so eine topographische Erkennung der hypo- oder hyperfunktionellen Zonen, die einem synaptischen Verlust oder einer synaptischen Dysfunktion entsprechen.
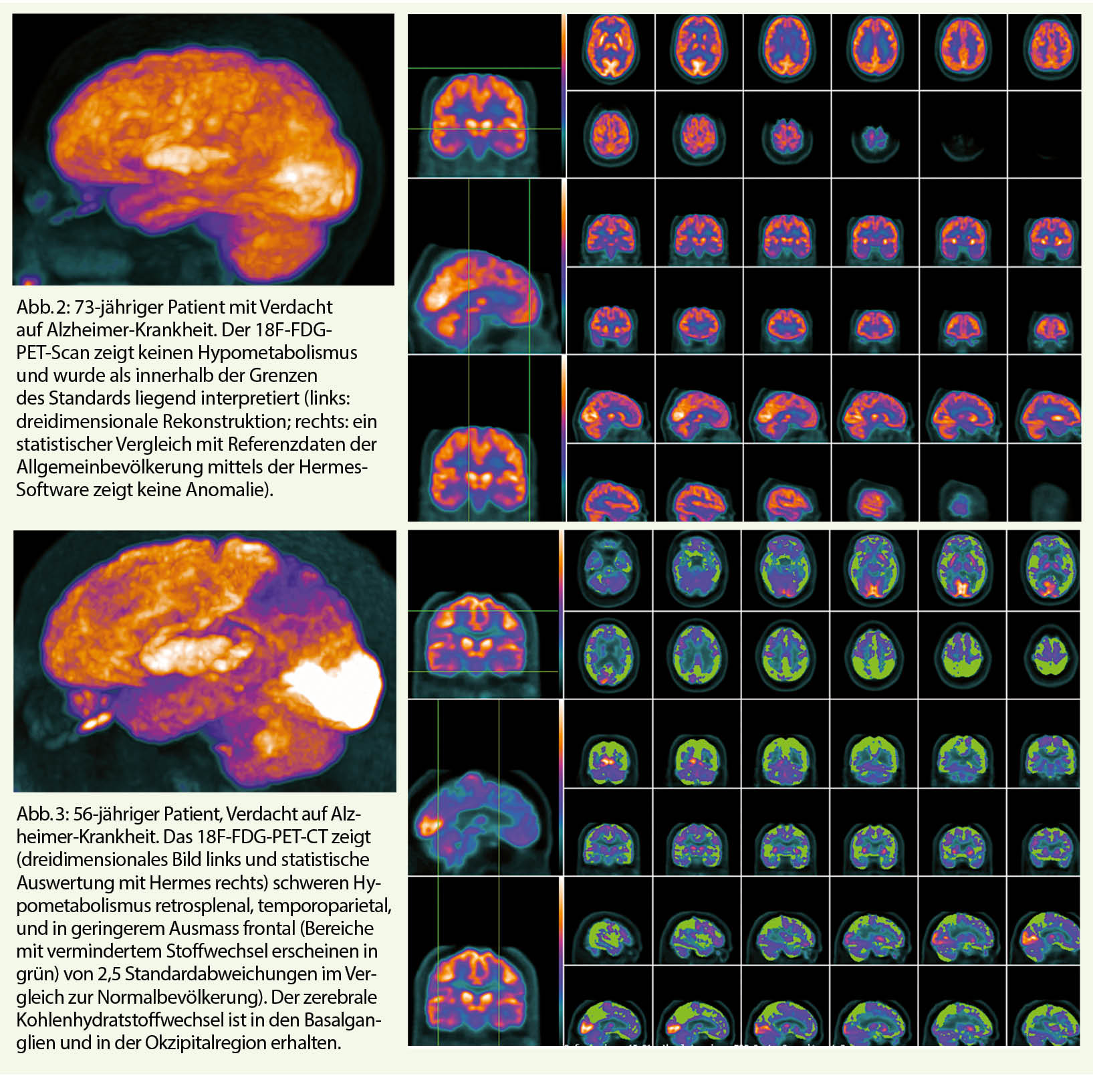
Bei Hypometabolismus, der je nach neurodegenerativer Erkrankung eine unterschiedliche Topographie hat, ist die PET F18-FDG zur Unterscheidung nützlich (4) (Abb. 2, 3).
Zum Beispiel zeigt das visualisierte topografische Muster des Stoffwechsels bei AD einen eher posterioren Hypometabolismus in der Region des temporoparietalen Neokortex und ebenfalls des posterioren cingulären Kortex, ohne Beeinträchtigung der primären Bereiche des Kleinhirns und der zentralen grauen Kerne, mit einer Sensitivität von 80% und einer Spezifität von 90% für AD im Stadium der Demenz. Diese Untersuchung wird derzeit gemäss Krankenpflege-Leistungsverordnung (KLV) im folgenden Rahmen übernommen: «…zur Abklärung von Demenz: als weiterführende Untersuchung in unklaren Fällen, nach inkonklusiver Liquordiagnostik oder wenn eine Lumbalpunktion nicht möglich oder kontraindiziert ist, nach interdisziplinärer Vorabklärung und nach Verordnung durch Fachärzte und Fachärztinnen für Allgemeine Innere Medizin mit Schwerpunkt Geriatrie (Weiterbildungsprogramm vom 1. Januar 2000, revidiert am 21. Juni 2018 …), Psychiatrie und Psychotherapie oder Neurologie; bis zum vollendeten 80. Altersjahr, bei einem Mini-Mental-Status-Test (MMST) von mindestens 10 Punkten und einer Dauer der Demenz von maximal 5 Jahren, keiner vorausgegangenen Untersuchung mit PET oder SPECT (Single Photon Emission Computed Tomography).» (KLV, Anhang 1, Änderungen per 1.1.2021, S. 6/12).
Amyloid-Radiotracer haben das Studium der Alzheimer-Krankheit revolutioniert
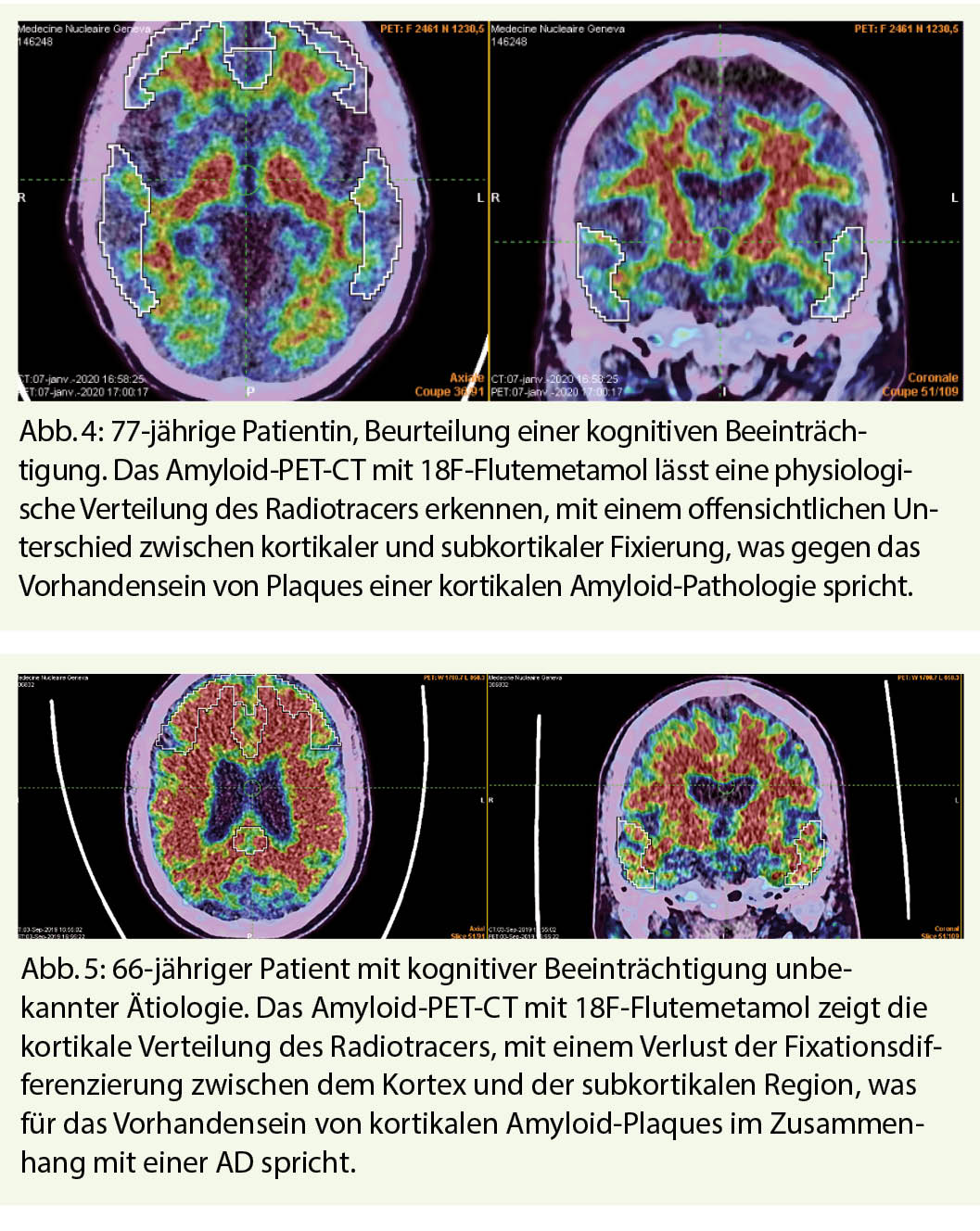
Eine neuere Gruppe von Radiotracern hat die Untersuchung der AD revolutioniert durch die Möglichkeit, die Präsenz von extrazellulären kortikalen Beta-Amyloid Plaques, einen der beiden erforderlichen molekularen Marker für die neuropathologische Diagnose von AD, mit höherer Sensitivität und Spezifität zu messen. 18F-Flutemetamol, 18F-Florbetaben und 18F-Florbetapir wurden von Swissmedic für diese Indikation zugelassen. Der Mechanismus dieser Tracer ist, dass sie an die Amyloid-Plaques binden. Sie stellen somit einen pathophysiologischen Tracer dar. Dadurch zeigt die Analyse der Bilder eine physiologische Fixierung der weissen Substanz in einem negativen Fall. Demgegenüber wird eine Zunahme der Fixierung im kortikalen Bereich als positiv für die Ablagerung von Amyloid-Plaques betrachtet. Eine negative Bildgebung ermöglicht es, die Diagnose AD auszuschliessen (hohe Spezifität). Eine positive Bildgebung hingegen – insbesondere in Verbindung mit einem Neurodegenerationsmarker wie temporomesiale Atrophie oder posteriorer Hypometabolismus – erlaubt es, unter den Probanden solche mit leichter kognitiver Beeinträchtigung (MCI) und solche, die wahrscheinlich zu einem Demenzstadium der AD fortschreiten zu differenzieren (5) (Abb. 4, 5). Die Erfassung in der frühen Phase unmittelbar nach Injektion des Radiotracers ermöglicht die Abschätzung der zerebralen Perfusion und liefert ähnliche Informationen wie die mit dem 18F-FDG-PET-Scanner erhaltenen, so dass beide Informationen mit der gleichen Untersuchung dank einer mehrphasigen Erfassung kombiniert werden können.
PET-Scans mit Amyloid-Tracern werden gemäss KLV mit den gleichen Indikationen und Einschränkungen wie für PET-Scans mit 18-FDG übernommen.
Da die Untersuchung nach einer zuvor erfolgten Prüfung durch PET 18F-FDG nicht zulässig ist, kann dem Patienten derzeit nur ein PET-Scan, entweder für FDG oder Amyloid, vorgeschlagen werden, der im Rahmen der obligatorischen Krankenversicherung rückerstattet wird. Beide Überprüfungen liefern jedoch Informationen, die sich ergänzen, und die von verschiedenen wissenschaftlichen Gesellschaften vorgeschlagenen Entscheidungsdiagramme empfehlen, beide Überprüfungen durchzuführen, um eine schlüssige Diagnose gemäss dem klinischen Bild und dem Testresultat zu erhalten.
DaT-Scan
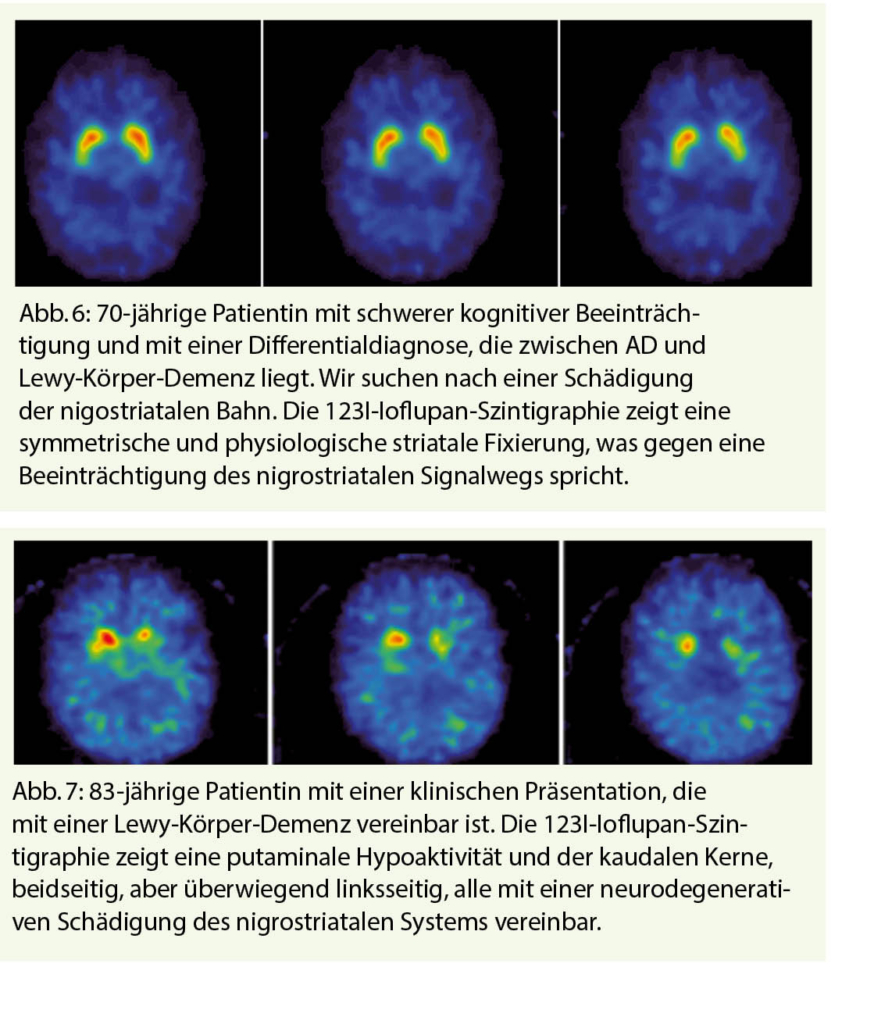
Die 123I-Ioflupan SPECT (DaT-Scan) ermöglicht eine Analyse der synaptischen Endigungen dopaminerger Neuronen, die speziell bei der Lewy-Körper-Demenz, der Parkinson-Demenz, und bei anderen Parkinson-Syndromen, die mit einer Demenz einhergehen können, wie z. B. die progressive supra-nukleäre Lähmung, die multisystemische Atrophie und die kortikobasale Degeneration, betroffen sind. Diese Neuronen, die hauptsächlich in der Substantia nigra zu finden sind, haben Axone, die in das Striatum hineinreichen. Daher ist ihre Funktion auf die Freisetzung von Dopamin angewiesen. Der Radiotracer zielt auf den Dopamin-Transporter (Dopamin-Transporter, DaT). Im nigrostriatalen System kommt es daher zu einer verminderten oder gar fehlenden Anreicherung des Radiotracers. Der DaT-Scan hilft bei der Differenzialdiagnose, insbesondere zwischen Lewy-Body-Demenz und AD (7). Diese Indikation wird derzeit nicht von den gesetzlichen Krankenkassen übernommen.
Tau-Radiotracer
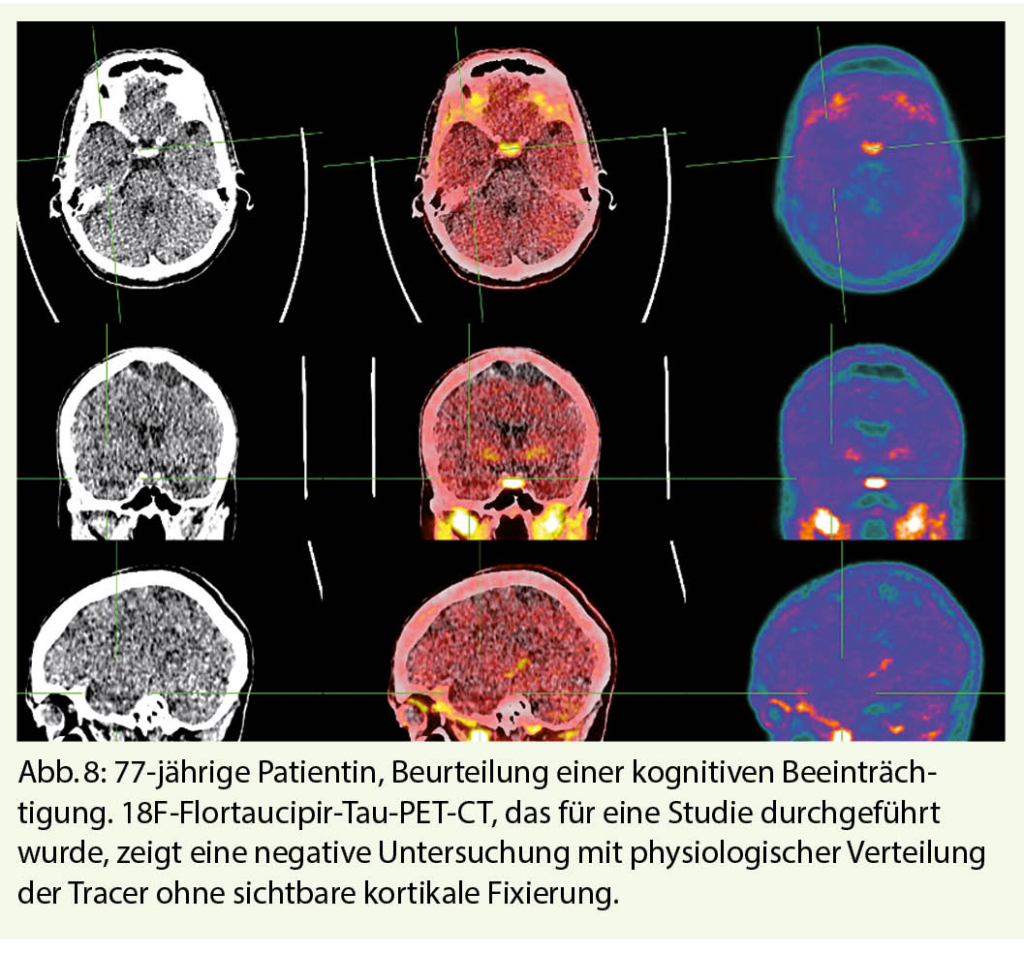
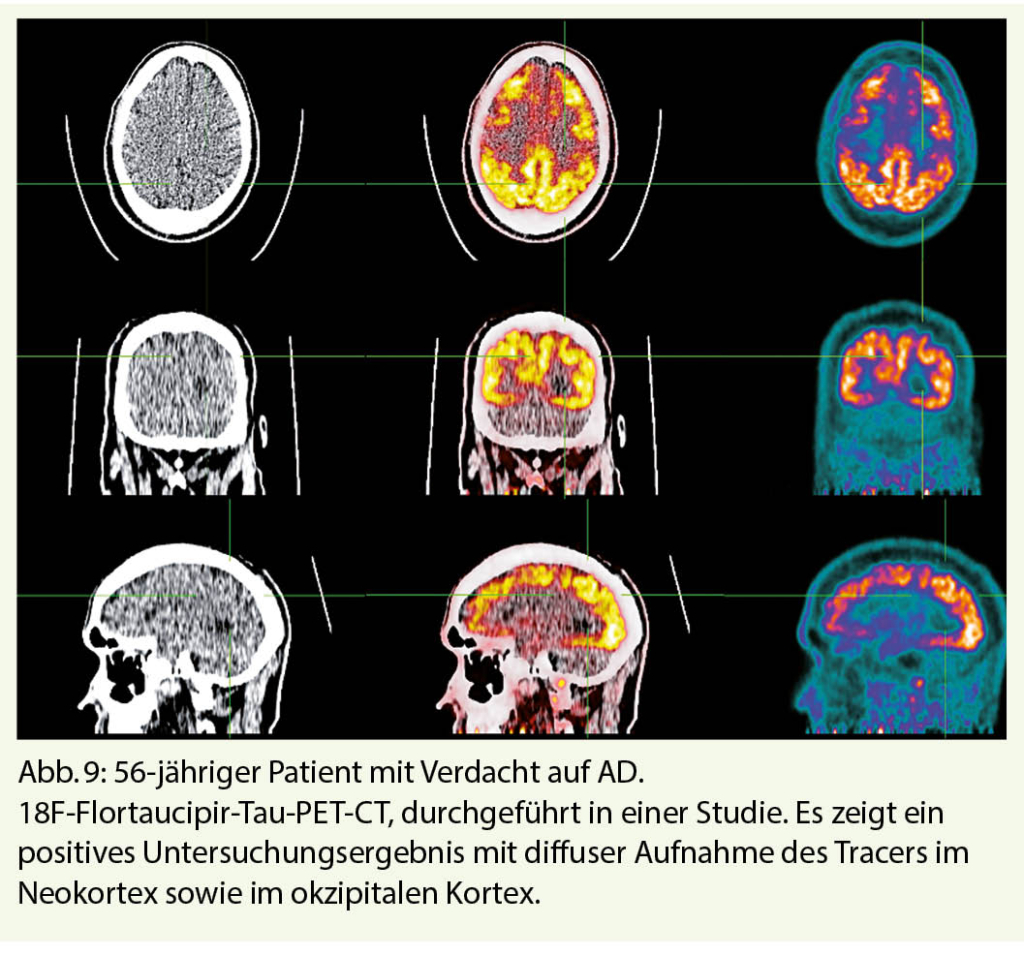
Zu den neuesten pathophysiologischen Radiotracern, die für die Diagnostik der AD entwickelt wurden, gehören schliesslich die Tau-Radiotracer, von denen 18F-Flortaucipir der am weitesten verbreitetste ist (8). Hyperphosphorylierung und abnorme intrazelluläre Aggregation von Tau-Proteinen bilden den zweiten molekularen Marker der AD, in Verbindung mit extrazellulären Amyloid-Plaques. Die Tracer binden somit selektiv an die neurofibrillären Cluster und ermöglichen es, die fortschreitende Akkumulation des Radiotracers in verschiedenen Hirnregionen entsprechend den topographischen Mustern der Braak-Stadien, wie sie in neuropathologischen Studien gefunden werden, sichtbar zu machen. Diese Tracer haben ein grosses Potenzial für das Staging und die Überwachung der AD, aber auch für die Unterscheidung der AD von Nicht-AD-Pathologien, da sie eine präzise Messung der fortgeschrittenen neuropathologischen Stadien der AD ermöglichen, die fast ausnahmslos mit dem Vorhandensein von Amyloid-Plaques verbunden sind (Abb. 8, 9). Die Tau-PET-Bildgebung hat im Mai 2020 einen wichtigen Meilenstein für den Einsatz in der klinischen Praxis erreicht, indem sie die FDA-Zulassung in den USA für diese Indikation erhalten hat. In der Schweiz wird diese Bildgebungsmodalität in Forschungsstudien eingesetzt, ist aber noch nicht für die klinische Anwendung zugelassen.
Zusammenfassend lässt sich sagen, dass die Diagnose von kognitiven Störungen ein wichtiges Thema in der aktuellen Medizin ist, sowohl für die Anpassung der Behandlung dieser Patienten als auch für die Umsetzung und Entwicklung neuer Behandlungen. Um dies zu erreichen, wird die Minimalbeurteilung eine neuropsychologische Bewertung beinhalten, aber auch eine zerebrale Bildgebung, von der die MRT die Untersuchung der ersten Wahl ist. Die molekulare Neuro-Bildgebung kann ein wertvolles diagnostisches Werkzeug sein, da sie durch die Verwendung von topographischen Radiotracern wie 18F-FDG und pathophysiologischen Radiotracern wie den dopmaninergen Amyloid- und Tau-Tracern erlaubt, der «anatomisch-pathologischen» Diagnose in vivo näher zu kommen.
Übersetzung des Originalartikels aus «la gazette médicale» 07_2020
Copyright Aerzteverlag medinfo
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
elsa.hervier@hcuge.ch
Service de Radiologie, Département Diagnostique, Hôpitaux Universitaires de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
Die Autoren erklären, dass sie keine Interessenskonflikte in Bezug auf den Inhalt dieses Artikels haben. VG hat Forschungsgelder vom Schweizerischen Nationalfonds und der Verlux-Stiftung erhalten sowie Gelder für Forschung und wissenschaftliche Präsentationen durch ihre Institution von Siemens Healthineers, GF Healthcare, Life Molecular Imaging, Cerveau Technologies, Roche und Merck.
◆ Bei Patienten mit kognitiver Beeinträchtigung lässt sich anhand des klinischen Bildes allein die Ätiologie des kognitiven Verfalls nicht mit zufriedenstellender Präzision differenzieren.
◆ Derzeit umfasst die Minimalbeurteilung bei Patienten eine neuropsychologische Beurteilung und eine bildgebende Untersuchung des Gehirns, wobei die MRT, in der Regel ohne Kontrastmittelinjektion, die Erstuntersuchung ist.
◆ Das molekulare Neuroimaging ist ein ergänzendes und sehr nützliches Diagnosewerkzeug für Patienten, deren Diagnose nach der ersten Beurteilung unsicher bleibt, denn es ermöglicht eine «anatomisch-pathologische» Diagnose in vivo.
1.Scheltens, P., Blennow, K., Breteler, M.M., de Strooper, B., Frisoni, G.B., Salloway, S., Van der Flier, W.M., 2016. Alzheimer’s disease. Lancet. 388, 505-17.
2. Park, M., Moon, W.J., 2016. Structural MR Imaging in the Diagnosis of Alzheimer’s Disease and Other Neurodegenerative Dementia: Current Imaging Approach and Future Perspectives. Korean J Radiol. 17, 827-845.
3. Frisoni, G.B., Boccardi, M., Barkhof, F., Blennow, K., Cappa, S., Chiotis, K., Demonet, J.F., Garibotto, V., Giannakopoulos, P., Gietl, A., Hansson, O., Herholz, K., Jack, C.R., Jr., Nobili, F., Nordberg, A., Snyder, H.M., Ten Kate, M., Varrone, A., Albanese, E., Becker, S., Bossuyt, P., Carrillo, M.C., Cerami, C., Dubois, B., Gallo, V., Giacobini, E., Gold, G., Hurst, S., Lonneborg, A., Lovblad, K.O., Mattsson, N., Molinuevo, J.L., Monsch, A.U., Mosimann, U., Padovani, A., Picco, A., Porteri, C., Ratib, O., Saint-Aubert, L., Scerri, C., Scheltens, P., Schott, J.M., Sonni, I., Teipel, S., Vineis, P., Visser, P.J., Yasui, Y., Winblad, B., 2017. Strategic roadmap for an early diagnosis of Alzheimer’s disease based on biomarkers. Lancet Neurol. 16, 661-676.
4. Nobili, F., Arbizu, J., Bouwman, F., Drzezga, A., Agosta, F., Nestor, P., Walker, Z., Boccardi, M., 2018. European Association of Nuclear Medicine and European Academy of Neurology recommendations for the use of brain (18) F-fluorodeoxyglucose positron emission tomography in neurodegenerative cognitive impairment and dementia: Delphi consensus. Eur J Neurol. 25, 1201-1217.
5. Chiotis, K., Saint-Aubert, L., Boccardi, M., Gietl, A., Picco, A., Varrone, A., Garibotto, V., Herholz, K., Nobili, F., Nordberg, A., 2017. Clinical validity of increased cortical uptake of amyloid ligands on PET as a biomarker for Alzheimer’s disease in the context of a structured 5-phase development framework. Neurobiol Aging. 52, 214-227.
6. Boccardi, M., Nicolosi, V., Festari, C., Bianchetti, A., Cappa, S., Chiasserini, D., Falini, A., Guerra, U.P., Nobili, F., Padovani, A., Sancesario, G., Morbelli, S., Parnetti, L., Tiraboschi, P., Muscio, C., Perani, D., Pizzini, F.B., Beltramello, A., Salvini Porro, G., Ciaccio, M., Schillaci, O., Trabucchi, M., Tagliavini, F., Frisoni, G.B., 2020. Italian consensus recommendations for a biomarker-based aetiological diagnosis in mild cognitive impairment patients. Eur J Neurol. 27, 475-483.
7. Vaamonde-Gamo, J., Flores-Barragan, J.M., Ibanez, R., Gudin, M., Hernandez, A., 2005. [DaT-SCAN SPECT in the differential diagnosis of dementia with Lewy bodies and Alzheimer’s disease]. Rev Neurol. 41, 276-9.
8. Dodich, A., Mendes, A., Assal, F., Chicherio, C., Rakotomiaramanana, B., Andryszak, P., Festari, C., Ribaldi, F., Scheffler, M., Schibli, R., Schwarz, A.J., Zekry, D., Lovblad, K.O., Boccardi, M., Unschuld, P.G., Gold, G., Frisoni, G.B., Garibotto, V., 2020. The A/T/N model applied through imaging biomarkers in a memory clinic. Eur J Nucl Med Mol Imaging. 47, 247-255.
der informierte @rzt
- Vol. 11
- Ausgabe 10
- Oktober 2021