- CAR-T-Zell Therapie
Seit der Zulassung der ersten CAR-T-Therapie in der Schweiz im Oktober 2018 und der schweizweit ersten Behandlung am Inselspital im Januar 2019 wurden bis zum Januar 2021 hierzulande 110 dieser Behandlungen durchgeführt (SBST, Bern Januar 2021). In diesem Übersichtsartikel besprechen wir die aktuelle Datenlage dieser neuen Therapieoption und kommentieren sie mit unseren eigenen Erfahrungen von bisher ca. 80 PatientInnen, welche wir bei aggressivem B-Zell-Lymphom, akuter lymphatischer Leukämie, Mantelzelllymphom und multiplem Myelom behandelt haben.
Depuis l’autorisation de la première thérapie CAR-T en Suisse en octobre 2018 et le premier traitement en Suisse à l’Insel-spital en janvier 2019, 110 de ces traitements ont été réalisés dans notre pays d’ici janvier 2021 (SBST, Berne janvier 2021). Dans cet article de synthèse, nous discutons des données actuelles sur cette nouvelle option thérapeutique et nous la commentons à l’aide de notre propre expérience d’environ 80 patients que nous avons traités jusqu’à présent pour un lymphome agressif à cellules B, une leucémie aiguë lymphoblastique, un lymphome à cellules du manteau et un myélome multiple.
Einführung, Indikationen
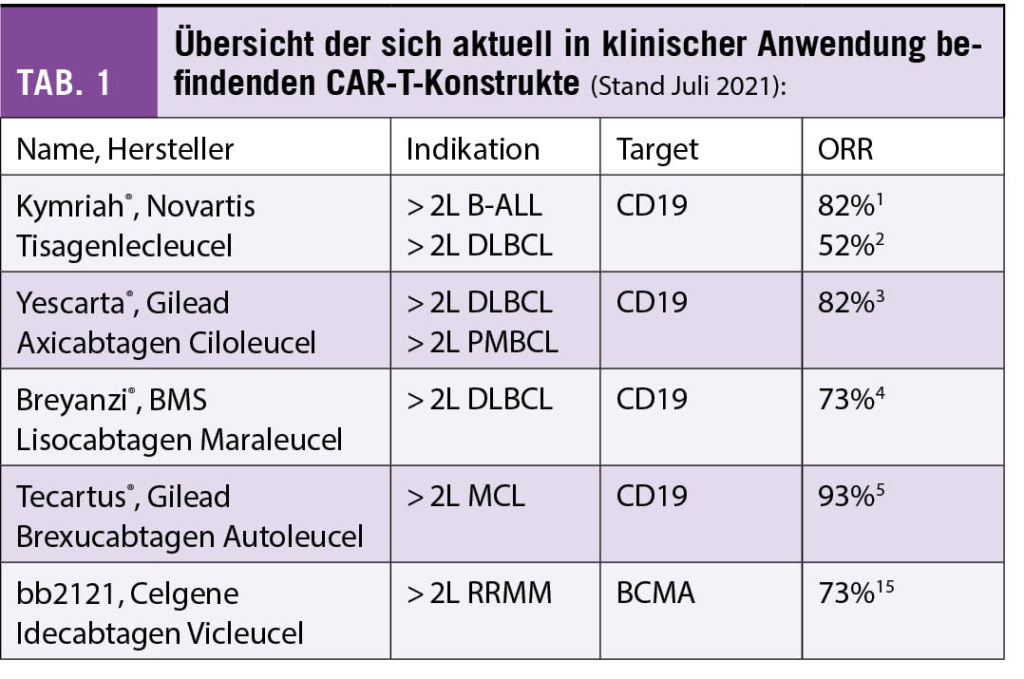
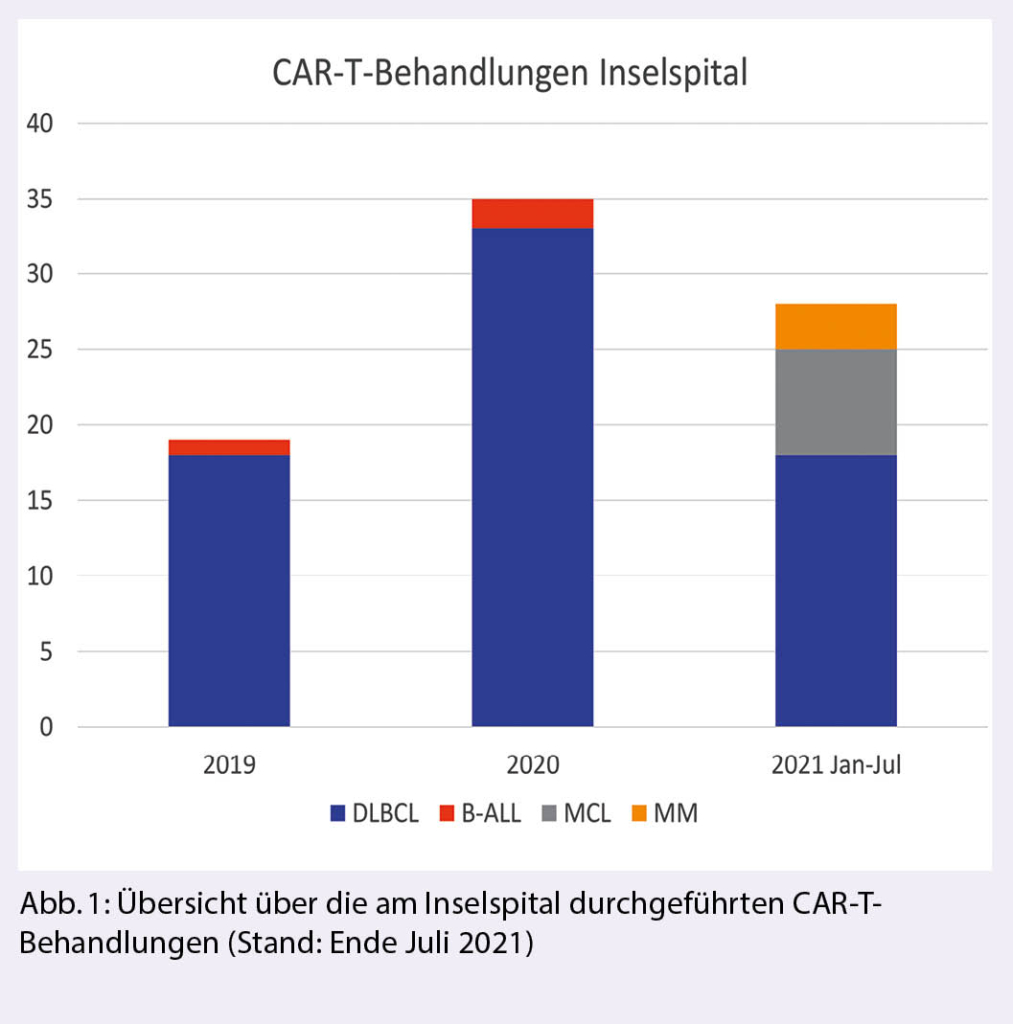
Die Zulassung der ersten CAR-T-Therapie (Kymriah®, Tisagenlecleucel, Novartis) zur Behandlung von rezidivierender oder refraktärer B-ALL (1) und rezidivierendem diffusem grosszelligem B-Zell-Lymphom (DLBCL) (2), in beiden Fällen nach mindestens zwei Vortherapien, erfolgte in der Schweiz im Oktober 2018. Im April 2019 wurde auch Yescarta® (Axicabtagen Ciloleucel, Gilead) zur Behandlung von rezidivierendem DLBCL oder primär mediastinalem grosszelligem B-Zell-Lymphom (PMBCL) nach zwei vorgegangenen Therapielinien zugelassen (3). Breyanzi® (Lisocabtagen Maraleucel, BMS) wurde Anfang 2021 durch die FDA aufgrund der Resultate der Transcend-Studie (4) ebenfalls für die Behandlung von DLBCL nach zwei Therapielinien zugelassen, die Zulassung in der Schweiz steht derzeit noch aus. Das Inselspital hat an einer Phase II und einer Phase-III-Studie mit diesem Produkt teilgenommen. Weiter verabreichten wir PatientInnen mit rezidivierendem Mantelzelllymphom (MCL) nach zwei Therapielinien inklusive Versagen von Ibrutinib das CAR-T-Präparat Tecartus® (Brexucabtagen Autoleucel, Kite) (5) im Rahmen eines Early Access Programmes. Im Frühling/Sommer 2021 wurden zudem die ersten drei PatientInnen mit dem anti-BCMA CAR-T-Konstrukt «bb2121» von BMS/Celgene bei rezidivierendem multiplem Myelom (RRMM) im Rahmen der Phase-III-Studie KarMMa-3 behandelt. Der aktuelle Stand der Zulassungen ist in Tabelle 1 zusammengefasst. Bis zum 2. August 2021 haben wir am Inselspital Bern total 82 CAR-T-Behandlungen durchgeführt. Während aggressive Lymphome weiterhin den grössten Teil der Behandlungen ausmachen, nimmt die Zahl der Behandlungen in den weiteren Indikationen stetig zu (Abb. 1).
Ablauf
Auf Zuweisung hin werden die PatientInnen, die für eine CAR-T-Therapie in Frage kommen, zu einem Vorgespräch gesehen. Die Indikationsstellung zur CAR-T-Behandlung erfolgt interdisziplinär am Lymphom-, Myelom- oder Leukämie-Tumorboard. Neben der Medizinischen Onkologie, der Radiologie und der Pathologie sind auch die SpezialistInnen der Hämatologie und des Hämatologischen Zentrallabors beteiligt, welche sowohl diagnostische (Morphologie, Flowzytometrie, molekulare Diagnostik) Aufgaben übernehmen als auch die Apherese, die initiale Präparation für das Kymriah-Produkt, den Export und Import der Zellen, die Lagerung und die Reinfusion der CAR-T-Zellen durchführen. Im Rahmen der Indikationsstellung zur CAR-T-Zell-Therapie fordern wir eine bioptische Verifizierung des vermuteten Lymphomprogresses oder Rezidivs, da sich hier auch Zweitmalignome gezeigt haben, und damit die Indikation zur CAR-T-Behandlung entfällt. Auch wenn die Voraussetzungen für eine Kostenübernahme der Behandlung klar geregelt sind, machen wir nicht selten die Erfahrung, dass die Erteilung der Kostengutsprache durch die Krankenkassen immer noch mit viel Mühe und Arbeit verbunden ist, und dies die Behandlung weiter verzögern kann. Im Rahmen einer Dissertation haben wir eine durchschnittliche Bearbeitungsdauer auf Seiten der Krankenkasse von 34 Tagen (1-70 Tage) ermittelt. Dieser Zeitrahmen und die verbleibenden Möglichkeiten für die Bridging-Therapie müssen bei der Indikationsstellung für eine CAR-T-Zell-Therapie berücksichtigt werden.
Während für die Behandlung in CAR-T Studien strikte Einschlusskriterien weit über den Zulassungstext hinaus gelten, haben wir die Erfahrung gemacht, dass die CAR-T Therapie auch von älteren PatientInnen und solchen mit gewissen Komorbiditäten, welche für eine Studienbehandlung nicht qualifiziert hätten, gut toleriert wird. Wenn immer möglich und falls noch nicht durchgeführt, sollten die PatientInnen, bei welchen eine CAR-T-Zell Therapie vorgesehen ist, gegen Covid-19 geimpft sein.
Erster Schritt in Richtung Behandlung mit CAR-T-Zellen ist die Lymphapherese, welche in der Regel die Einlage eines Dialysekatheters erfordert. Die Modalitäten der Sammlung sind für alle Produkte unterschiedlich, und die Komplexität zu deren Implementierung im Rahmen der Zertifizierung durch die Firmen sind nicht zu unterschätzen (6). Nach erfolgter Sammlung werden die T-Zellen je nach Produkt bei Raumtemperatur oder, nach einer Aufarbeitung durch das Stammzelllabor, tiefgefroren an den Hersteller verschickt. Der Produktionsprozess umfasst die Isolation der T-Zellen aus dem Lymphapheresat, die Aktivierung der isolierten T-Lymphozyten, die Transfektion der T-Zellen mit dem spezifischen Genkonstrukt, sodass diese den entsprechenden chimären T-Zell-Rezeptor exprimieren, und die abschliessende Vermehrung der transfizierten T-Lymphozyten. Der ganze Prozess ist von den Behörden zugelassen, d.h. Modifikationen können ohne grossen Aufwand der involvierten Firmen nicht vorgenommen werden. Für Aussenstehende ist die Produktion weitgehend eine Blackbox, und detaillierte Informationen zum individuellen Produkt liegen nicht vor. Das gefrorene Endprodukt wird anschliessend zurück in unser Stammzelllabor gesandt, wo es bis zur finalen Verwendung bei -170°C in Stickstoff gelagert wird. Zwischen der Sammlung und der Lieferung vergehen gewöhnlich 3-4 Wochen. Wir haben für beide kommerziellen CARs auch Produktionsversager verzeichnen müssen, was mehrere Lymphapheresen zur Herstellung eines finalen Produktes erforderlich gemacht hat. In einzelnen Fällen haben wir auch «out-of-specification» Produkte verabreichen müssen.
Eine meist erfolgreiche Produktion vorausgesetzt, werden die PatientInnen anschliessend für die eigentliche CAR-T-Therapie hospitalisiert. Dies ist gesetzlich gefordert, da die Vergütung derzeit nur im stationären Setting möglich ist. Gewöhnlich ist mit einer Aufenthaltsdauer von 3 Wochen zu rechnen. Wenn nicht kürzlich erfolgt, wird bei Therapiebeginn eine radiologische Standortbestimmung mittels CT Hals-Thorax-Abdomen und Schädel-MRI durchgeführt. Diese dienen neben dem Therapiemonitoring auch dazu, bei Auftreten von Nebenwirkungen eine initiale Vergleichsuntersuchung zur Verfügung zu haben. Während die Lymphodepletion per se nicht kardiotoxisch ist, gehört eine kardiologische Standortbestimmung inklusive EKG und Echokardiographie, wenn nicht kürzlich erfolgt, zum Workup ebenso dazu wie definierte Laboruntersuchungen. Zudem werden vor der Aufnahme der Therapie wie auch an verschiedenen Zeitpunkten im Verlauf Blut- und ggf. Knochenmarksproben für unsere Biobank abgenommen.
Die lymphodepletierende Chemotherapie mit Fludarabin und Cyclophosphamid wird über drei Tage durchgeführt und meist gut toleriert. Für beide kommerziellen Produkte verwenden wir hierzu Fludarabin und Cyclophosphamid mit den Dosierungen der Zulassungsstudien, lediglich für beide Medikamente etwas höhere Dosierungen vor der Applikation von Yescarta® (30 statt 25 mg/m2 Fludarabin und 500 statt 250 mg/m2 Cyclophosphamid). Die wichtigsten Nebenwirkungen dieser lymphodepletierenden Therapie umfassen Müdigkeit, Übelkeit, Erbrechen, Diarrhoe und eine vorübergehende Myelosuppression. Da die PatientInnen in der Regel umfangreich vorbehandelt sind und es durch die Lymphodepletion längerfristig zu einer relevanten B-Zell-Depletion kommt, verabreichen wir an den Tagen -2 und +7 Immunglobuline. Zur Verkürzung der möglichen Neutropenie erhalten die PatientInnen einmalig peg-Filgrastim, da infektiöse Trigger das Auftreten von Nebenwirkungen begünstigen können.
Nach der CAR-T-Reinfusion, in der Regel 1-2 Tage nach Ende der Lymphodepletion, müssen die PatientInnen mindestens 14 Tagen stationär überwacht werden. Nach dieser Zeit ist das Auftreten von Nebenwirkungen unwahrscheinlich. Eine Betreuung im ambulanten Setting ist schon nur aus regulatorischen Gründen nicht möglich. Wir haben aber auch PatientInnen behandelt, bei welchen die Betreuung aus rein medizinischer Sicht sicherlich im ambulanten Setting möglich gewesen wäre.
Nebenwirkungen und deren Management
Im Allgemeinen ist die CAR-T-Therapie gut verträglich und kann somit auch bei älteren PatientInnen zum Einsatz kommen. Schwerwiegende Nebenwirkungen, vor allem das Cytokine Release Syndrom (CRS) und das Immunoeffektorzell-assoziierte Neurotoxizitätssyndrom (CAR-Related Encephalopathy Syndrome (CRES) oder Immune Effector Cell-Associated Neurotoxicity Syndrome (ICANS)), mit potentiell letalem Ausgang sind jedoch möglich; in der Literatur wird dies mit 1-2 % angegeben (7). Prospektiv validierte Screeninginstrumente fehlen, sodass für den Einzelfall nicht zuverlässig vorausgesagt werden kann, bei welchen PatientInnen stärkere Nebenwirkungen zu erwarten sind. Dennoch wurden in den bisherigen Studien Risikofaktoren identifiziert, welche Anhaltspunkte für die Entwicklung höhergradiger CRS geben können. So sind eine hohe Tumorlast, ein reduzierter Allgemeinzustand und die frühe Entwicklung eines CRS in den ersten drei Tagen nach der T-Zell-Reinfusion mit schweren Verläufen assoziiert (8,9). Mit zunehmender klinischer Erfahrung der Zentren und früherer medikamentöser Intervention hat die Inzidenz von schweren CRS über die Zeit abgenommen (10–12).
Während bei Hochdosischemotherapie mit autologer Stammzelltransplantation infektiöse Komplikationen während der Aplasiephase im Vordergrund stehen, sind die Nebenwirkungen von CAR-T-Behandlungen vor allem auf Immunphänomene, ausgelöst durch die Zytokinfreisetzung, zurückzuführen. Da aufgrund der lymphodepletierenden Chemotherapie eine relevante Myelosuppression eintritt, gehört eine Infektfokussuche und ggf. –Behandlung aber in jedem Fall zum Workup bei Fieber im Rahmen der CAR-T-Therapie dazu.
Cytokine release syndrome (CRS)
Durch aktivierte oder lysierte Effektorzellen (CAR-T-Zellen, Makrophagen) können grosse Mengen proinflammatorischer Zytokine wie IFN-Gamma, TNF-Alpha, IL-6 und IL-1 freigesetzt werden. Diese Zytokinfreisetzung führt zu einer weiteren Aktivierung des Immunsystems und zu Symptomen wie Fieber, Hypotonie und Hypoxämie. Weiter kann es zu einer Endothelaktivierung mit «capillary leak» und disseminierter intravaskulärer Gerinnung kommen.
Die Häufigkeit von CRS in allen Schweregraden wird in den Zulassungsstudien mit einer Frequenz von 40 bis 80% angegeben (13).Neben Unterschieden im Nebenwirkungsprofil der verschiedenen CAR-Konstrukte erschweren auch verschiedene Methoden der Gradierung des CRS die Vergleichbarkeit zwischen den Studien. Wir verwenden die Gradierung nach Lee et al (14).
Mit der Einführung neuer CAR-T-Konstrukte mit neuen Zielen wandeln sich auch die Häufigkeit und vor allem das zeitliche Auftreten der Nebenwirkungen. Während Zytokin-vermittelte Nebenwirkungen bei mit Anti-CD19-CARs behandelten PatientInnen gewöhnlich um den 3.- 6. Tag nach Infusion der Zellen auftreten (2, 3), entwickeln PatientInnen, die mit Anti-BCMA-CARs therapiert werden tendenziell früher CRS, häufig bereits am 1. und 2. Tag nach der Infusion (15). Auch hier deckt sich unsere bisher beschränkte Erfahrung mit den Daten aus den Zulassungsstudien.
Die Behandlung des CRS umfasst neben Antipyretika zur Fiebersenkung und intravenöser Volumengabe zur Stabilisierung des Kreislaufes auch Medikamente, welche in den Zytokinstoffwechsel eingreifen. Etabliert hat sich einerseits die Anwendung von Tocilizumab, welches mit hoher Affinität an den IL-6-Rezeptor bindet und diesen blockiert. Am Inselspital verabreichen wir Tocilizumab nach erstmaligem Auftreten von Fieber nach der CAR-T-Reinfusion und nach Prämedikation mit Dexamethason. In refraktären Fällen kommt auch der lösliche IL-6-Rezeptor Siltuximab zum Einsatz. Durch frühe Intervention und den niederschwelligen Einsatz von Tocilizumab und Steroiden kann die Entwicklung eines höhergradigen CRS verhindert werden, ohne dass dadurch der Therapieerfolg negativ beeinflusst wird (11, 12, 16). Dennoch kann bei schweren Symptomen eine intensivmedizinische Behandlung nötig werden. In einem Fall haben wir ein letal verlaufendes Makrophagenaktivierungssyndrom am Tag 43 gesehen.
Aufgrund der Immunsuppression müssen auch infektiöse Ursachen von Fieber und Hypotonie ausgeschlossen bzw. proaktiv adäquat behandelt werden, zumal auch infektiöse Trigger schwere CRS-Verläufe auslösen oder begünstigen können (7). Etwa jeder vierte Patient erleidet im Rahmen der CAR-T-Behandlung einen Infekt, meist sind dies Bakteriämien und virale Atemwegsinfekte (17). Die immunsuppressive Wirkung von Tocilizumab scheint hier nicht die primäre Ursache zu sein (18).
Neben der klinischen Überwachung können auch verschiedene Laborparameter Anhaltspunkte zum Verlauf des CRS liefern, so z.B. das im Serum gemessene IL-6 oder das Ferritin. Es muss jedoch beachtet werden, dass die Aussagekraft der gemessenen Werte durch die zytokinhemmende Therapie verfälscht werden kann, insbesondere nach Verabreichung von Siltuximab, welches das freie IL-6 bindet. So kann es unter dieser Behandlung zu relevanten Infekten bei normwertigem CRP kommen.
CAR-related encephalopathy syndrome (CRES)/ Immune effector cell-associated neurotoxicity syndrome (ICANS):
Die Ursache der Neurotoxizität der CAR-T-Zellen ist nicht vollständig geklärt. Die CAR-T-Zellen scheinen Zytokine auszuschütten, welche das Endothel aktivieren und so eine Störung der Blut-Hirn-Schranke bewirken. In der Folge können einerseits T-Zellen das Hirngewebe infiltrieren und so direkt entzündliche Reaktionen auslösen, andererseits kommt es durch die Störung der Blut-Hirn-Schranke zu einem Ödem (19). PatientInnen mit ZNS-Lymphom waren unter anderem aufgrund der Befürchtung, häufiger Neurotoxizität zu entwickeln, für die erwähnten Zulassungsstudien nicht zugelassen. Fallserien legen jedoch nahe, dass weder die Rate noch die Intensität der Neurotoxizität exzessiv hoch sind (20, 21). Hingegen scheint die Remissionsdauer bei diesen PatientInnen kürzer zu sein (21).
In den meisten Fällen (>90%) geht dem Auftreten eines ICANS ein CRS voran, die Entwicklung von neurologischen Nebenwirkungen ohne CRS ist selten (22). Das Risiko von neurologischen Nebenwirkungen hängt nicht zuletzt auch vom eingesetzten CAR-T-Produkt ab: In den Zulassungsstudien wurden ICANS aller Schweregrade mit Kymriah® während den ersten 8 Wochen nach der Infusion in 39% der PatientInnen beobachtet (2), bei Yescarta® aber in 64% (3). Diese Zahlen decken sich mit unseren Erfahrungen. Das Risiko von Neurotoxizität bei der Behandlung von Myelomen mit dem Anti-BCMA-Produkts bb2121 scheint mit 18% in der Phase-2-Studie etwas kleiner zu sein (15).
Die mediane Zeit bis zum Auftreten von neurologischen Symptomen lag in den Studien bei Anti-BCMA-CARs bei 2 Tagen, bei Yescarta® waren es 5 Tage und bei Kymriah® 6 Tage, gefolgt von einer kompletten Remission der Symptome nach 3, 17 und 14 Tagen nach der Infusion des jeweiligen CAR-T-Produktes (2, 3, 15).
Zum Monitoring der kognitiven und exekutiven Funktionen wird der ICE (Immune Effector Cell Encephalopathy) Score oder CARTOX-Test verwendet, welcher täglich zwei Mal durchgeführt wird. Neben der zeitlichen und örtlichen Orientierung und einer einfachen Rechenübung wird das Schriftbild geprüft, welches oft erste Anzeichen für eine sich entwickelnde Neurotoxizität liefert. Die Symptome des ICANS reichen von Kopfschmerzen, Schriftbildveränderungen und Desorientiertheit über Vigilanzstörungen und epileptische Anfälle bis hin zu motorischen Ausfällen wie Hemi- und Paraparesen. Schwere derartige Verläufe haben wir bisher glücklicherweise nur ganz vereinzelt gesehen.
Bei klinischen Hinweisen für eine Neurotoxizität erfolgen weitere Abklärungen, einerseits die Wiederholung der Bildgebung, um Blutungen oder Ischämien als Ursache auszuschliessen. In unserer bisherigen Kohorte sind spezifische radiologische Befunde selten. Ein EEG führen wir bei Verdacht auf ein ICANS regelmässig durch, um iktale Ereignisse auszuschliessen, allerdings behandeln wir alle PatientInnen bei Auftreten eines ICANS prophylaktisch anti-epileptisch.
Die Behandlung von PatientInnen mit ICANS erfordert eine interdisziplinäre Zusammenarbeit. Bei schweren Verläufen ist eine intensivmedizinische Überwachung zwingend und ggf. eine Schutzintubation nötig. Bei erhöhtem Hirndruck erfolgt die Anlage einer externen Ventrikeldrainage zum Monitoring und zur Therapie. Die medikamentöse Therapie umfasst neben der zytokinhemmenden Behandlung und der Gabe von Antiepileptika auch den Einsatz hochdosierter Steroide. Während in den Zulassungsstudien der Anti-CD19-CARs vor allem Methylprednisolon zum Einsatz kam, findet in unserem klinischen Alltag aufgrund der guten ZNS-Gängigkeit vor allem Dexamethason Anwendung. Bei klinischer Besserung können die Steroide schrittweise ausgeschlichen, und in der Folge auf eine perorale Verabreichung umgestellt werden. In seltenen Fällen ist eine längerdauernde Steroidbehandlung, d.h. auch nach Austritt notwendig. Gerade bei älteren PatientInnen ist die Beurteilung einer neurologischen Verschlechterung häufig erschwert, da die Abgrenzung zwischen ICANS und Delir schwierig sein kann. Dies ist insbesondere auch bei PatientInnen zu berücksichtigen, welche unter Steroidtherapie erneut neurologische Symptome zeigen.
Prolongierte Zytopenien und Infektionen:
Bei bis zu einem Drittel der behandelten PatientInnen verläuft die hämatologische Erholung nach der CAR-T-Therapie verzögert, bei vielen über mehrere Monate, wobei insbesondere Neutro- und Thrombopenien auftreten (23, 24). Diesbezüglich sei auf die kürzlich erschienene Zusammenstellung zur beobachteten Hämatotoxizität der Deutschen Kollegen hingewiesen (25). Während die frühe Hämatotoxizität durch die lymphodepletierende Chemotherapie gut erklärt ist, sind die Ursachen der protrahierten Erholung (definiert als persistierende Zytopenien >28 Tage nach CAR-T-Therapie) weniger gut verstanden. Eine mögliche Erklärung ist, dass die PatientInnen in der Regel umfangreich vorbehandelt und zu einem Teil bereits stammzelltransplantiert sind, sodass die Knochenmarkreserven eingeschränkt sind. Weiter scheinen aber auch durch die CAR-T-Zellen ausgelöste Immun- und Entzündungsphänomene eine Rolle zu spielen. Hierfür spricht auch, dass prolongierte Zytopenien bei PatientInnen mit höhergradigem CRS häufiger auftreten (26). Diesbezüglich zu beachten ist, dass der Einsatz von Tocilizumab bei rheumatologischen PatientInnen ebenfalls zu Zytopenien geführt hat, sodass eine medikamentöse Genese nicht gänzlich ausgeschlossen werden kann (27).
Neben der Neutropenie erhöhen auch eine prolongierte B-Zell-Aplasie und Hypogammaglobulinämie das Risiko infektiöser Komplikationen, sodass eine adäquate Prophylaxe gegen Herpesviren, Pneumozystis und Pilzinfektionen nötig ist. Valaciclovir, Trimpetoprim/Sulfometoxazol und Fluconazol oder Posaconazol haben ihren festen Platz in der Infektprophylaxe bei aplasierenden Chemotherapien, und sind auch im Rahmen der CAR-T-Behandlung essentiell. Die supportive Therapie ist derzeit individuell und in Analogie zum Usus im autologen und allogenen Setting. Wir würden uns wünschen, dass die Evidenz hierzu mit akademischen Studien erarbeitet würde.
Einfluss von Nebenwirkungen und deren Behandlung auf das Outcome:
Aus der klinischen Erfahrung mit Checkpoint-Inhibitoren gibt es immer mehr Evidenz dafür, dass das Auftreten von immunvermittelten Nebenwirkungen ein Therapieansprechen anzeigt und mit einer besseren Prognose assoziiert ist (28). Ob dies auch für die CAR-T-Therapie gilt, ist derzeit noch unklar. Die aktuellen Daten weisen eher darauf hin, dass die Entwicklung von CRS und ICANS ein Surrogatmarker für eine hohe Tumorlast und so eher mit einem schlechten Outcome assoziiert sind (29). Frühe Studien zeigten einen negativen prognostischen Effekt der Behandlung von CRS und ICANS mit Steroiden9,30, sodass aktuell primär Tocilizumab zum Einsatz kommt. In neueren Untersuchungen konnte aber gezeigt werden, dass auch der Gebrauch von hochdosierten Steroiden primär einen Einfluss auf die Nebenwirkungen hat, ohne dabei die Aktivität der CAR-T-Zellen zu beeinträchtigen (11, 31). Es ist also möglich, Steroide zur Behandlung von Nebenwirkungen früher einzusetzen.
Zusammenfassung und Ausblick:
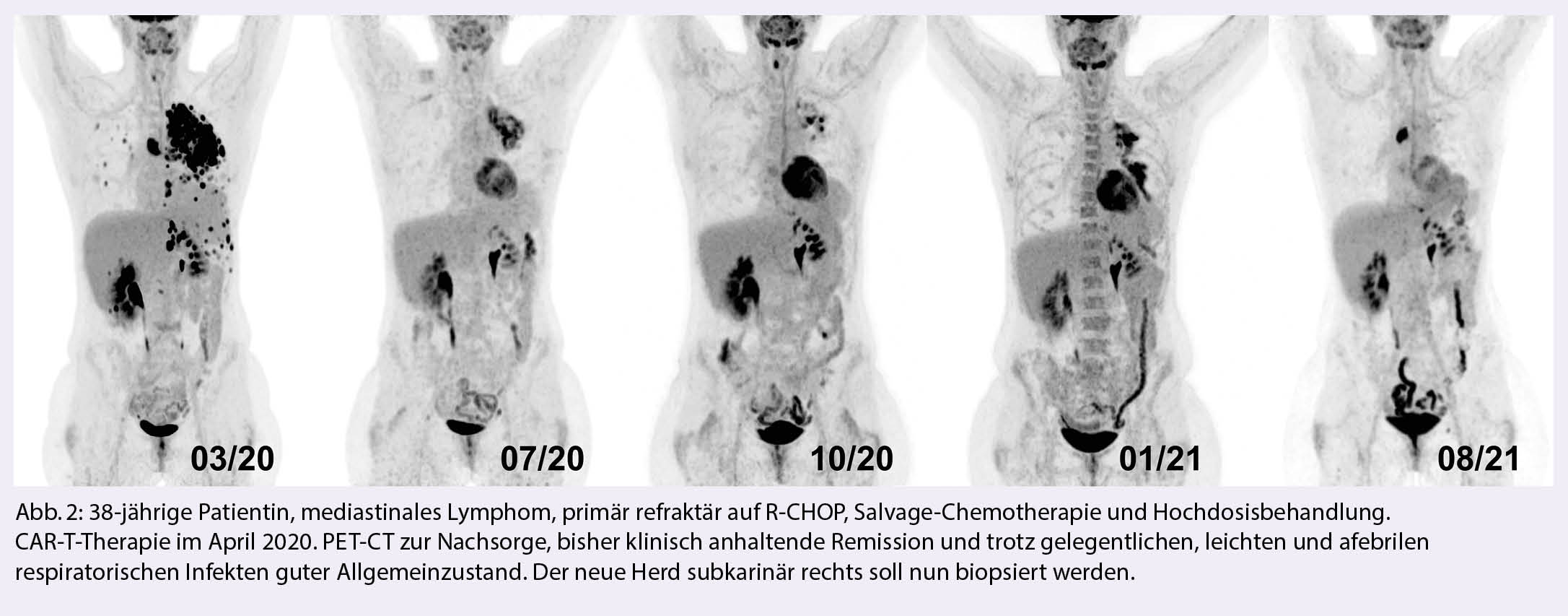
Unsere Erfahrung aus der Behandlung von bisher ca. 80 CAR-T-PatientInnen ist grösstenteils positiv. Die Anzahl an PatientInnen ist für Schweizer Verhältnisse gross, aber international immer noch vergleichsweise klein, und wir lernen mit jeder Behandlung dazu. Wie in den Zulassungsstudien zeigen sich bei diesem, teils intensiv vorbehandelten Kollektiv sehr gute Ansprechraten und auch langanhaltende Remissionen. Da die CAR-T-Zell-Therapie in kurativer Absicht durchgeführt wird, haben wir unser Programm auch während der Covid-19 Pandemie ohne wesentliche Einschränkung fortgesetzt.
Wie bereits aus anderen Ländern berichtet, haben auch wir einige PatientInnen mit aggressiven Lymphomen erfolgreich mit der CAR-T-Zelltherapie behandelt, welche die Einschlusskriterien der Studien z. B. aufgrund von Komorbiditäten nicht erfüllt hätten (10). Trotzdem scheinen sich die Ergebnisse mit den Zulassungsstudien mindestens zu decken und die Toleranz – wahrscheinlich durch die frühe, niederschwellige Behandlung von CRS und ICANS – sogar besser zu sein (12, 32–35). Die enge Patientenselektion für die Studienbehandlung ist insbesondere bei der KarMMa-3-Studie (für das Multiple Myelom) problematisch. Die Optionen für eine Bridging-Therapie sind durch die Studie sehr limitiert, sodass bei raschem Myelomprogress die Wartezeit bis zur eigentlichen CAR-T-Therapie zu lang sein kann. Hier werden die kommerziellen Produkte andere Möglichkeiten eröffnen. Wir haben auch Erfahrungen mit Hepatitis-B-positiven PatientInnen und solchen mit Lymphommanifestionen im ZNS sammeln können, allesamt Ausschlusskriterien für eine Studienbehandlung. Über diese Fälle sowie die klinischen Resultate an unserem Zentrum werden wir in wissenschaftlichen Publikationen ebenso berichten wie über den Prozess zur Erteilung der Kostengutsprachen. Die CAR-T-Produkte für LymphompatientInnen unterscheiden sich von der Lymphapherese bis zum Nebenwirkungsprofil. Wir sind daher angehalten, die Produkte in unsere Algorithmen einzubauen, und haben hierzu eine Initiative unter Einbezug der EMBT gestartet.
Die CAR-T-Therapie hat die Behandlung von fortgeschrittenen lymphoiden Neoplasien revolutioniert. Auch die bisherigen Studienergebnisse bei der Behandlung des multiplen Myeloms und anderen indolenten Lymphomen sind vielversprechend (15, 36).Die Voraussetzungen wären also gegeben, die CAR-T-Therapie für andere Krankheiten, insbesondere auch solide Tumoren, weiterzuentwickeln. Die Hürde hierfür ist jedoch gross: Während die malignen Zellen bei lymphoiden Neoplasien in der Regel in grösserer Zahl im Blutstrom vorliegen und die CAR-T-Zellen so aktiviert werden können, ist bei soliden Tumoren zuerst eine Migration ins Gewebe nötig. Zusätzlich besitzt das Tumormikromilieu meist eine immunsuppressive Wirkung, sodass die Aktivität von CAR-T-Zellen hier abgeschwächt werden kann. Aktuell läuft eine Vielzahl von Phase I/II-Studien mit verschiedenen CAR-T-Konstrukten in soliden Tumoren, deren Ergebnisse mit Spannung erwartet werden.
Dr. med. Alexander D. Heini1, Dr. med. Marie-Noëlle Kronig/1,
Dr. med. Barbara Jeker1, Dr. med. Myriam Legros/2,
PD Dr. med. Michael Daskalakis/3,4,
Prof. Dr. med. Ulrike Bacher/3,
Prof. Dr. med. Thomas Pabst/1,
Prof. Dr. med. Dr. phil. nat. Sacha Zeerleder/3,
Prof. Dr. med. Urban Novak/1, urban.novak@insel.ch
1/Universitätsklinik für Medizinische Onkologie, Inselspital, Universitätsspital Bern, 3010 Bern
2/Zentrum für Labormedizin, Inselspital, Universitätsspital Bern, 3010 Bern
3/Universitätsklinik für Hämatologie und Hämatologisches Zentrallabor, Inselspital, Universitätsspital Bern, 3010 Bern
4/Department of BioMedicalResearch (DMBR), Universität Bern, Murtenstrasse 40, 3008 Bern
Copyright bei Aerzteverlag medinfo AG
Universitätsklinik für Medizinische Onkologie
Inselspital, Universitätsspital Bern
3010 Bern
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
urban.novak@insel.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Am Inselspital sind die Erfahrungen aus der Behandlung von bisher
ca. 80 CAR-T-PatientInnen grösstenteils positiv.
◆ Einige PatientInnen mit aggressiven Lymphomen, welche die
Einschlusskriterien der Studien z. B. aufgrund von Komorbiditäten
nicht erfüllt hätten, wurden mit der CAR-T-Zelltherapie erfolgreich behandelt.
◆ Die CAR-T-Therapie hat die Behandlung von fortgeschrittenen
lymphoiden Neoplasien revolutioniert. Auch die bisherigen Studien-ergebnisse bei der Behandlung des multiplen Myeloms und anderen indolenten Lymphomen sind vielversprechend.
◆ Die Voraussetzungen wären gegeben, die CAR-T-Therapie auch
für andere Krankheiten, insbesondere solide Tumoren, weiterzu-
entwickeln, auch wenn die Hürden hierfür gross sind.
◆ Aktuell läuft eine Vielzahl von Phase I/II-Studien mit verschiedenen CAR-T-Konstrukten in soliden Tumoren.
Messages à retenir
◆ À l’Inselspital, l’expérience tirée du traitement d’environ 80 patients CAR-T jusqu’à présent a été largement positive.
◆ Certains patients atteints de lymphomes agressifs qui n’auraient pas satisfait aux critères d’inclusion des études, par exemple en raison de comorbidités, ont été traités avec succès grâce à la thérapie par cellules CAR-T.
◆ La thérapie CAR-T a révolutionné le traitement des néoplasmes lymphoïdes avancés. Les résultats des études menées à ce jour dans le traitement du myélome multiple et d’autres lymphomes indolents sont également prometteurs.
◆ Les conditions seraient réunies pour poursuivre le développement de la thérapie CAR-T pour d’autres maladies, notamment les tumeurs solides, même si les obstacles à surmonter pour y parvenir sont importants.
◆ Un grand nombre d’essais de phase I/II sont actuellement en cours avec différentes constructions CAR-T dans les tumeurs solides.
1. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018. doi:10.1056/nejmoa1709866
2. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019. doi:10.1056/nejmoa1804980
3. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017. doi:10.1056/nejmoa1707447
4. Abramson JS, Palomba ML, Gordon LI, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet. 2020. doi:10.1016/S0140-6736(20)31366-0
5. Wang M, Munoz J, Goy A, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. N Engl J Med. 2020. doi:10.1056/nejmoa1914347
6. Korell F, Laier S, Sauer S, et al. Current Challenges in Providing Good Leukapheresis Products for Manufacturing of CAR-T Cells for Patients with Relapsed/Refractory NHL or ALL. Cells. 2020. doi:10.3390/cells9051225
7. Fajgenbaum DC, June CH. Cytokine Storm. N Engl J Med. 2020. doi:10.1056/nejmra2026131
8. Maude SL, Frey N, Shaw PA, et al. Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia. N Engl J Med. 2014;371(16). doi:10.1056/nejmoa1407222
9. Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med. 2014;6(224):224ra25-224ra25. doi:10.1126/scitranslmed.3008226
10. Nastoupil LJ, Jain MD, Feng L, et al. Standard-of-care axicabtagene ciloleucel for relapsed or refractory large B-cell lymphoma: Results from the US lymphoma CAR T consortium. J Clin Oncol. 2020. doi:10.1200/JCO.19.02104
11. Topp M, Van Meerten T, Houot R, et al. Earlier Steroid Use with Axicabtagene Ciloleucel (Axi-Cel) in Patients with Relapsed/Refractory Large B Cell Lymphoma. Blood. 2019. doi:10.1182/blood-2019-126081
12. Riedell PA, Walling C, Nastoupil LJ, et al. A Multicenter Retrospective Analysis of Clinical Outcomes, Toxicities, and Patterns of Use in Institutions Utilizing Commercial Axicabtagene Ciloleucel and Tisagenlecleucel for Relapsed/Refractory Aggressive B-Cell Lymphomas. Blood. 2019. doi:10.1182/blood-2019-127490
13. Garcia Borrega J, Gödel P, Rüger MA, et al. In the eye of the storm: Immune-mediated toxicities associated with car-t cell therapy. HemaSphere. 2019;3(2). doi:10.1097/HS9.0000000000000191
14. Lee DW, Gardner R, Porter DL, et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 2014. doi:10.1182/blood-2014-05-552729
15. Munshi NC, Anderson LD, Shah N, et al. Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. N Engl J Med. 2021. doi:10.1056/nejmoa2024850
16. Gardner R, Leger KJ, Annesley CE, et al. Decreased Rates of Severe CRS Seen with Early Intervention Strategies for CD19 CAR-T Cell Toxicity Management. Blood. 2016. doi:10.1182/blood.v128.22.586.586
17. Hill JA, Li D, Hay KA, et al. Infectious complications of CD19-targeted chimeric antigen receptor-modified T-cell immunotherapy. Blood. 2018. doi:10.1182/blood-2017-07-793760
18. Frigault MJ, Nikiforow S, Mansour MK, et al. Tocilizumab not associated with increased infection risk after CAR T-cell therapy: Implications for COVID-19? Blood. 2020. doi:10.1182/BLOOD.2020006216
19. Titov A, Petukhov A, Staliarova A, et al. The biological basis and clinical symptoms of CAR-T therapy-associated toxicites. Cell Death Dis. 2018. doi:10.1038/s41419-018-0918-x
20. Frigault MJ, Maus M V., Dietrich J, et al. Tisagenlecleucel CAR T-cell therapy in secondary CNS lymphoma. Blood. 2019. doi:10.1182/blood.2019001694
21. Ghafouri S, Timmerman J, Larson S, Mead MD. Axicabtagene Ciloleucel CAR T-cell therapy for relapsed/refractory secondary CNS non-Hodgkin lymphoma: comparable outcomes and toxicities, but shorter remissions may warrant alternative consolidative strategies? Bone Marrow Transplant. 2021. doi:10.1038/s41409-020-01099-4
22. Yáñez L, Sánchez-Escamilla M, Perales MA. CAR T cell toxicity: Current management and future directions. HemaSphere. 2019. doi:10.1097/HS9.0000000000000186
23. Fried S, Avigdor A, Bielorai B, et al. Early and late hematologic toxicity following CD19 CAR-T cells. Bone Marrow Transplant. 2019. doi:10.1038/s41409-019-0487-3
24. Jain T, Knezevic A, Pennisi M, et al. Hematopoietic recovery in patients receiving chimeric antigen receptor T-cell therapy for hematologic malignancies. Blood Adv. 2020. doi:10.1182/bloodadvances.2020002509
25. Rejeski K, Perez A, Sesques P, et al. CAR-HEMATOTOX: A model for CAR T-cell related hematological toxicity in relapsed/refractory large B-cell lymphoma. Hematol Oncol. 2021. doi:10.1002/hon.82_2879
26. Penack O, Koenecke C. Complications after cd19+ car t-cell therapy. Cancers (Basel). 2020. doi:10.3390/cancers12113445
27. Shetty A, Hanson R, Korsten P, et al. Tocilizumab in the treatment of rheumatoid arthritis and beyond. Drug Des Devel Ther. 2014. doi:10.2147/DDDT.S41437
28. Fiala O, Sorejs O, Sustr J, Kucera R, Topolcan O, Finek J. Immune-related adverse effects and outcome of patients with cancer treated with immune checkpoint inhibitors. Anticancer Res. 2020. doi:10.21873/anticanres.14063
29. Westin JR, Tam CS, Borchmann P, et al. Correlative Analyses of Patient and Clinical Characteristics Associated with Efficacy in Tisagenlecleucel-Treated Relapsed/Refractory Diffuse Large B-Cell Lymphoma Patients in the Juliet Trial. Blood. 2019. doi:10.1182/blood-2019-129107
30. Brentjens RJ, Davila ML, Riviere I, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci Transl Med. 2013. doi:10.1126/scitranslmed.3005930
31. Liu S, Deng B, Yin Z, et al. Corticosteroids do not influence the efficacy and kinetics of CAR-T cells for B-cell acute lymphoblastic leukemia. Blood Cancer J. 2020. doi:10.1038/s41408-020-0280-y
32. Kochenderfer JN, Dudley ME, Feldman SA, et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood. 2012. doi:10.1182/blood-2011-10-384388
33. Faramand R, Jain M, Staedtke V, et al. Tumor Microenvironment Composition and Severe Cytokine Release Syndrome (CRS) Influence Toxicity in Patients with Large B-Cell Lymphoma Treated with Axicabtagene Ciloleucel. Clin Cancer Res. 2020. doi:10.1158/1078-0432.CCR-20-1434
34. Pasquini MC, Locke FL, Herrera AF, et al. Post-Marketing Use Outcomes of an Anti-CD19 Chimeric Antigen Receptor (CAR) T Cell Therapy, Axicabtagene Ciloleucel (Axi-Cel), for the Treatment of Large B Cell Lymphoma (LBCL) in the United States (US). Blood. 2019. doi:10.1182/blood-2019-124750
35. Jaglowski S, Hu Z-H, Zhang Y, et al. Tisagenlecleucel Chimeric Antigen Receptor (CAR) T-Cell Therapy for Adults with Diffuse Large B-Cell Lymphoma (DLBCL): Real World Experience from the Center for International Blood & Marrow Transplant Research (CIBMTR) Cellular Therapy (CT) Registry. Blood. 2019. doi:10.1182/blood-2019-130983
36. Jacobson C, Chavez JC, Sehgal AR, et al. Primary Analysis of Zuma-5: A Phase 2 Study of Axicabtagene Ciloleucel (Axi-Cel) in Patients with Relapsed/Refractory (R/R) Indolent Non-Hodgkin Lymphoma (iNHL). Blood. 2020. doi:10.1182/blood-2020-136834
info@onco-suisse
- Vol. 11
- Ausgabe 5
- Oktober 2021