- Infection à streptocoques
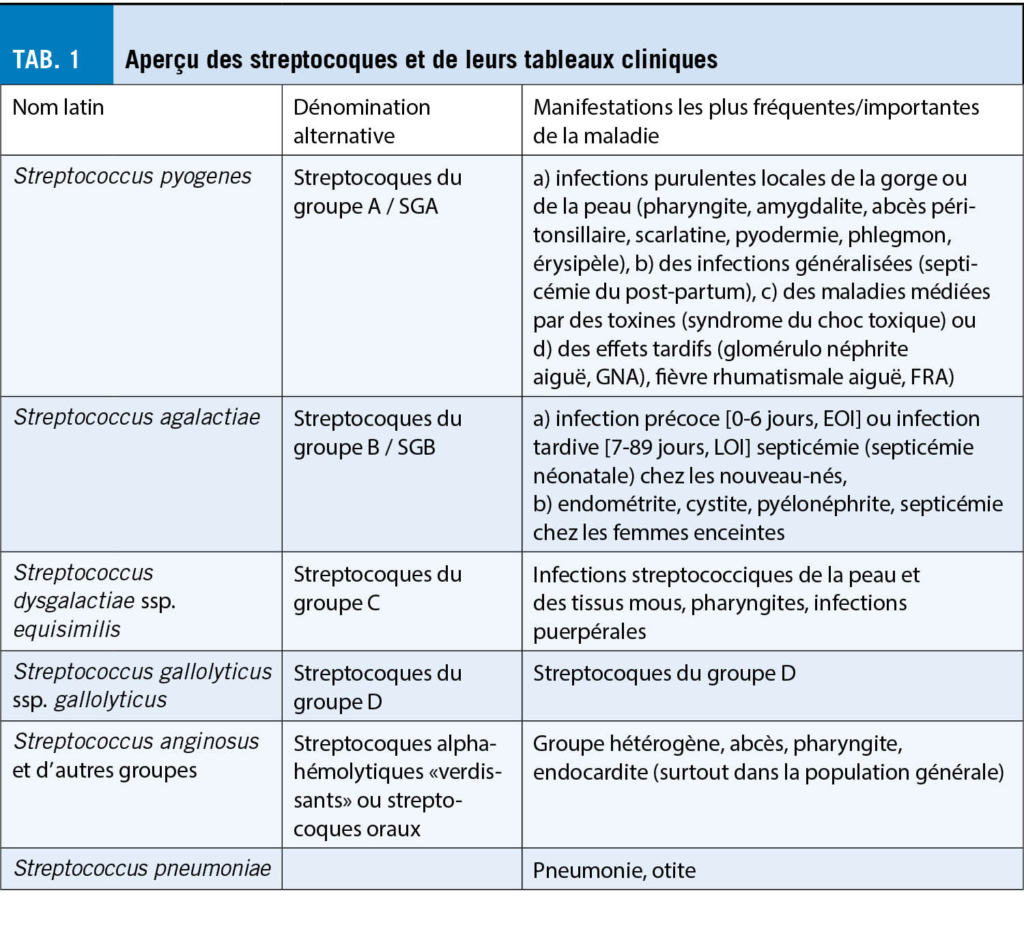
Les streptocoques comprennent plus de 100 espèces décrites, dont certaines présentent un grand intérêt médical. Ces bactéries à Gram positif, souvent disposées en chaînettes, sont rencontrées dans une grande variété de tableaux cliniques et font certainement partie des agents pathogènes les plus importants dans la pratique médicale quotidienne. La littérature disponible est en conséquence très abondante. Dans cette revue, les recommandations internationales disponibles sont discutées pour des tableaux cliniques sélectionnés (l’ amygdalo-pharyngite causée par Streptococcus pyogenes, la «méningite infantile» causée par Streptococcus agalactiae et l’ endocardite causée par des streptocoques du groupe D).
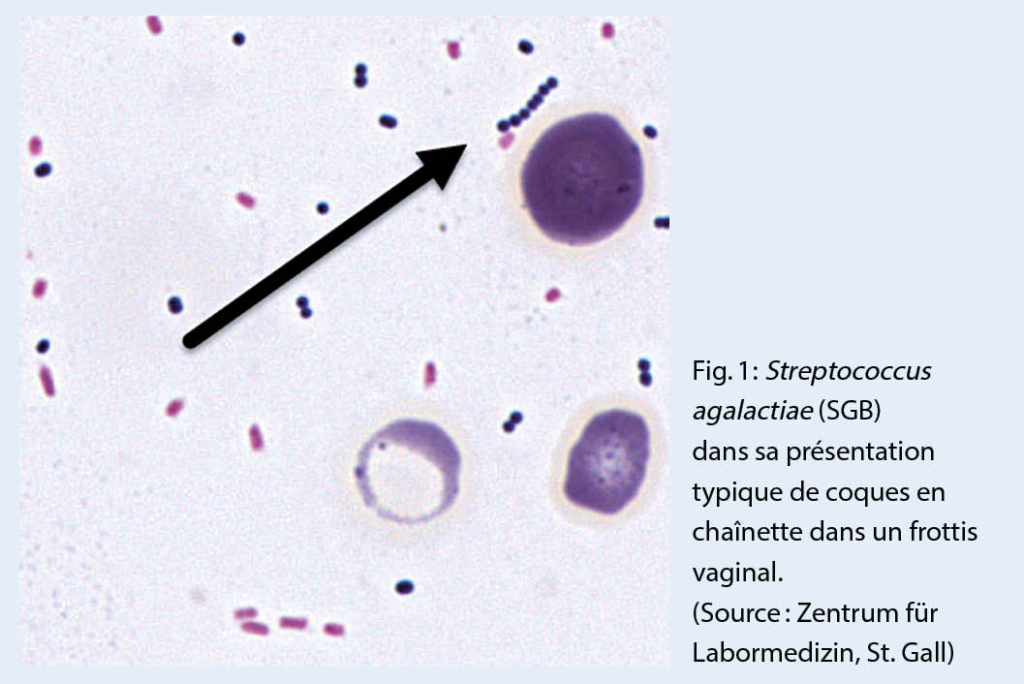
Les genres Streptococcus et Enterococcus sont taxonomiquement regroupés avec les genres anaérobies de la famille des Streptococcaceae. Leur caractéristique est leur aspect microscopique sous forme de coques à Gram positif en chaînette (fig. 1). Le genre Streptococcus comprend actuellement 109 espèces valablement décrites, dont seule une petite partie joue un rôle significatif en tant qu’ agents infectieux en médecine humaine (tab. 1).
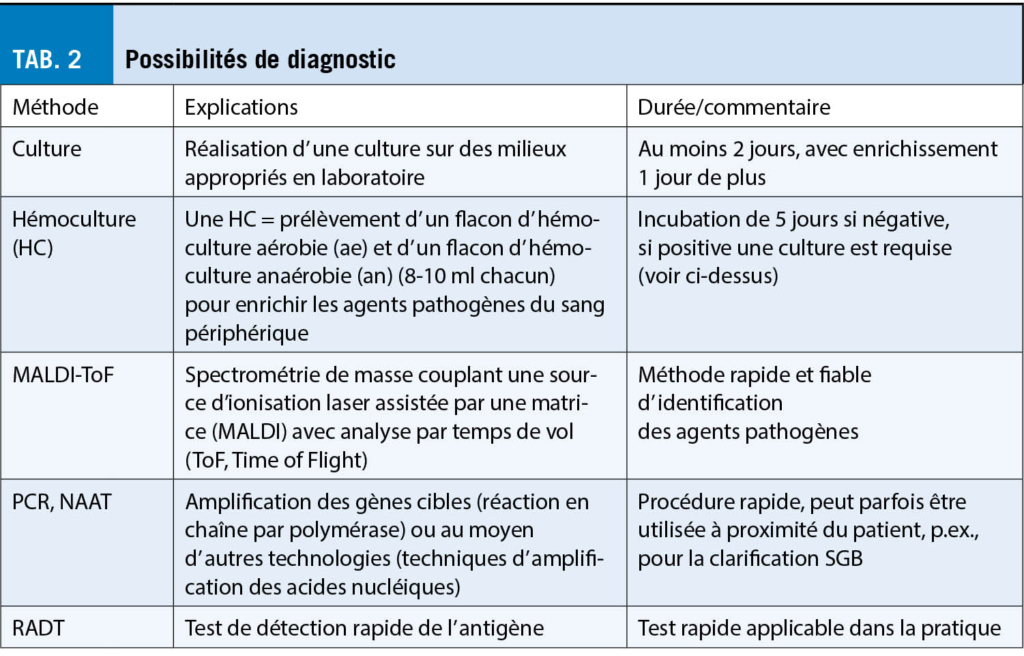
Historiquement, les streptocoques ont d’ abord été distingués sur la base de leur hémolyse sur des milieux de culture contenant du sang. Lancefield a ensuite divisé les streptocoques hémolytiques en groupes basés sur les antigènes capsulaires. Les désignations de streptocoques du groupe A (SGA) pour Streptococcus pyogenes et de streptocoques du groupe B (SGB) pour Streptococcus agalactiae ont persisté jusqu’ à ce jour et sont souvent utilisées comme synonymes des noms scientifiques latins. Si le SGA et le SGB sont relativement faciles à distinguer en laboratoire à l’ aide de méthodes de spectrométrie de masse (MALDI-ToF, tab. 2), l’ identification exacte de l’ espèce dans le groupe des streptocoques buccaux ou verdissants n’ est pas toujours aisée. Sur le plan microbiologique, ces streptocoques, qui résident principalement dans l’ espace oropharyngé, sont divisés en pneumocoques (Streptococcus pneumoniae) et en six sous-groupes.
Nous constatons une grande variabilité des infections associées aux streptocoques non seulement sur le plan microbiologique, mais aussi en ce qui concerne les tableaux cliniques qu’ elles provoquent (tab. 1), c’ est pourquoi les directives actuelles doivent être considérées avec une certaine réserve. Les recommandations internationales concernant l’ amygdalopharyngite aiguë (APA), le dépistage des SGB pour la prévention de la septicémie/méningite précoce du nouveau-né et les lignes directrices sur l’ endocardite avec une attention particulière sur les streptocoques oraux en tant qu’ agents pathogènes sont discutées et résumées ci-dessous.
Amygdalo-pharyngite à SGA
La manifestation de loin la plus courante du SGA est l’ amygdalo-pharyngite aiguë (APA), qui présente une certaine saisonnalité (1) et peut survenir à tout âge, mais dont l’ incidence est la plus élevée chez les enfants d’ âge scolaire (2).
La distinction entre pharyngite, amygdalite et amygdalopharyngite n’ est pas facile dans de nombreux cas, et la gravité des symptômes peut varier considérablement. Le symptôme classique de l’ amygdalite exsudative, avec des amygdales hypertrophiées et rougies et un exsudat purulent, peut souvent manquer (3). Les complications tardives sont désormais rares en Europe (4). Lorsque la scarlatine survient en association avec l’ APA, la principale préoccupation est la réponse immunitaire systémique aux exotoxines pyrogènes avec les symptômes associés. Les évolutions graves sont la fasciite nécrosante et le syndrome de choc toxinique streptococcique (5).
La Société américaine des maladies infectieuses (IDSA) (2) et le groupe de travail sur le mal de gorge aigu de la Société européenne de microbiologie clinique et d’ infectiologie (ESCMID) (6) ont publié des lignes directrices sur le bilan diagnostique et la prise en charge de l’ APA SGA, et en Angleterre le National Institute for Health and Care Excellence (NICE) (7) a émis des lignes directrices sur l’ antibiothérapie du mal de gorge aigu.
Dans les directives, le système d’ évaluation clinique selon Centor (CSS) ou McIsaac (MSS), les tests de détection rapide de l’ antigène (RADT) et la culture d’ enrichissement classique sont discutés pour le diagnostic du GAS-ATP (tab. 2). La détection par NAAT/PCR ne semble pas adéquate compte tenu des coûts comparativement élevés (7). Les méthodes de détection sérologique – à l’ exception de l’ exclusion de la nécrose aiguë de la rétine (ARN) et des fimbriae agrégatives (AGF) – n’ ont pas de rôle en clinique.
La différenciation entre les véritables infections et le statut du porteur (jusqu’ à 25% de la population) (8) constitue un obstacle majeur et n’ est pas possible à l’ aide des RADT et des NAAT ; l’ évaluation clinique a donc un poids plus important. En utilisant le CSS, des points sont attribués pour des symptômes définis. Avec un maximum de 4 points, la probabilité d’ une culture positive du SGA est de 56 %, alors qu’ avec le score minimum, elle n’ est que de 2,5 % (9). Le score de MSS, structuré de manière similaire, inclut par contre la probabilité plus élevée d’ une infection par le SGA chez les enfants (10).
Il existe un consensus sur le fait que l’ évaluation clinique selon le CSS ou le MSS n’ est pas suffisante pour le diagnostic. Seuls les scores cliniques élevés (au moins 3 points) doivent être confirmés par des RADT ou une culture. Les RADT sont préférables en raison du temps d’ attente très court jusqu’ à ce que le résultat soit disponible, tout en accordant une grande importance à l’ instruction correcte du personnel et à la mise en œuvre. Un prélèvement de suivi après le traitement n’ est pas indiqué (2).
L’ évolution spontanée de l’ APA est autolimitée après quelques jours. Même avec une bonne compliance thérapeutique, l’ administration d’ antibiotiques ne raccourcit la durée de la maladie que de 16 heures chez 20 % des patients traités (1). La pénicilline et l’ amoxicilline sont les agents de choix chez les patients gravement malades ou présentant des complications. Indépendamment de l’ antibiothérapie, des anti-inflammatoires non stéroïdiens doivent être utilisés pour soulager les symptômes. En matière de recommandations et d’ options thérapeutiques détaillées pour les personnes souffrant d’ allergies, veuillez-vous référer aux directives mentionnées précédemment.
Dépistage du SGB chez les femmes enceintes
Les SGB font partie de la flore intestinale normale (11). Le taux de colonisation vaginale des femmes enceintes en Allemagne est d’ environ 16 % (12). Des infections graves sous forme de septicémie, de méningite et/ou de pneumonie surviennent chez 1 à 2 % des nouveau-nés matures et surtout prématurés colonisés par des SGB (13, 15) (tab. 1). La ligne directrice S2k AWMF recommande le dépistage des SGB chez les femmes enceintes au moyen d’ un frottis rectal et vaginal combiné entre 35 + 0/7 et 37 + 0/7 semaines de grossesse (13). Les frottis vaginaux profonds et les frottis cervicaux sont déconseillés (13, 14). Pour le diagnostic de laboratoire, les directives recommandent l’ utilisation de bouillons d’ enrichissement de SGB avec mise en culture ultérieure (15, 16, 18).
L’ objectif du dépistage est de prévenir ou de réduire les infections (tab. 1) et leurs conséquences chez les nouveau-nés. Le taux de mortalité néonatale pour l’ EOI et la LOI est de 9,4 %, le taux de mortalité pour les nouveau-nés matures est de 6 % et pour les prématurés de 18 % (14). La décision sur la nécessité d’ une IAP (antibioprophylaxie intra-partum) est prise sur la base d’ un risque accru d’ EOI (14, 17). Les facteurs de risque incluent la colonisation de la femme enceinte au moment de l’ accouchement, une bactériurie à SGB pendant la grossesse, une rupture prématurée de la poche des eaux (≥ 18 h avant l’ accouchement), un accouchement prématuré, un précédent accouchement avec un enfant atteint de SGB, une CRP maternelle élevée (> 20mg/L), des signes d’ infection intra-partum dont une chorioamnionite chez la femme enceinte (12, 13, 14, 17).
Les symptômes cliniques de l’ EOI sont divers chez les nouveau-nés et souvent plus subtils chez les nouveau-nés prématurés. Environ 95% des EOI à SGB surviennent dans les 48 premières heures après la naissance (13, 19). Si des symptômes sont présents, la détection de l’ agent pathogène avec une antibiothérapie ultérieure (aminoglycoside associé à l’ amoxicilline) est recommandée (19). Pour le diagnostic de l’ EOI, en particulier de la septicémie, la détection des agents pathogènes à partir des hémocultures (HC) et/ou du liquide céphalorachidien est nécessaire. Seul une HC aérobie est recommandée, qui doit être inoculée avec au moins 1 ml de sang (13). Chez les nouveau-nés asymptomatiques, la surveillance de l’ infection à 48h n’ est recommandée qu’ en présence de facteurs de risque de SGB ou chez les mères présentant des signes de chorioamnionite (19).
L’ utilité des paramètres de laboratoire est particulièrement importante pour l’ évaluation de l’ arrêt du traitement après 36-48h (13, 19). En plus du diagnostic par hémoculture, la détermination de la CRP, de l’ IL-6 ou de l’ IL-8 du nouveau-nés et une numération sanguine différentielle sont recommandés (13), car un traitement trop long (>5 jours) a entraîné une augmentation des décès et des entérocolites nécrosantes chez les nouveau-nés (19).
Endocardite
L’ endocardite infectieuse (EI) n’ est pas une entité homogène, ni sur le plan clinique ni en ce qui concerne les agents pathogènes responsables (20). Sur le plan microbiologique, les Streptococcaceae dominent dans un large spectre d’ agents pathogènes (21). En tant qu’ espèce unique, Streptococcus gallolyticus subsp. gallolyticus (anciennement Streptococcus bovis) est probablement l’ une des plus importantes espèces étiologiques de l’ EI (22).
Des lignes directrices pour la prise en charge de l’ endocardite ont été publiées par la Société européenne de cardiologie (ESC), pour la dernière fois en 2015 (23), et par l’ American Heart Association (AHA) dans la version révisée de 2017 (24). En outre, il existe d’ autres directives émanant de sociétés professionnelles européennes et américaines, dont certaines sont spécialisées, et qui ne seront pas abordées ici. Il convient de se référer à la version très récemment révisée de la directive sur l’ antibioprophylaxie pour la Suisse par le groupe d’ experts «Infective Endocarditis Prevention» (25).
Les streptocoques buccaux verdissants sont parmi les germes les plus fréquemment associés à l’ EI. Le simple fait de se brosser les dents le matin suffit à provoquer une bactériémie streptococcique orale transitoire. Les interventions dentaires ne sont donc responsables que d’ une faible proportion des EI. La prophylaxie antimicrobienne (PA), bien que discutée, n’ est systématiquement recommandée que pour les interventions chez les patients à haut risque ou pour les procédures dentaires associées à un tel risque (23, 25, 26). Chez les patients à risque modéré ou élevé, il est recommandé de traiter des urémies ou des infections cutanées chroniques, et on relèvera l’ intérêt d’ une antibiothérapie dans les infections bactériennes connues comme prévention d’ une endocardite bactérienne (23).
Le diagnostic de l’ agent pathogène fait partie d’ un bilan diagnostique complet (20, 23). L’ hémoculture est la méthode de choix pour la détection des agents pathogènes en cas de suspicion d’ EI. Le principal critère de diagnostic est la mise en évidence du pathogène dans deux paires d’ hémocultures périphériques séparées. Il est recommandé de collecter trois paires d’ HC (chacune ae et an) dans un intervalle de 30 min. avant de débuter une antibiothérapie (23), la probabilité de détection du germe augmentant avec le nombre de paires et atteignant 100% avec la collecte de 4 paires (27). Puisque l’ état bactériémique reste constant pendant l’ EI, il n’ est pas nécessaire d’ attendre une phase fébrile pour collecter les HC (23), et il n’ y a pas de différence entre la collecte individuelle et la collecte collective des paires d’ HC (28). Avec les systèmes automatisés modernes, une incubation prolongée (14 ou 21 jours) n’ est plus nécessaire ; une incubation de 5 jours est généralement suffisante pour la détection des germes à croissance lente (p.ex. Cutibacterium sp., anciennement Propionibacterium). Dans de rares cas, une prolongation de 5 à 7 jours peut être envisagée. En revanche il est important de respecter les exigences pré-analytiques concernant le nombre et le volume de remplissage des flacons (ni surremplissage, ni sous-remplissage) (28).
L’ EI à culture négative (BCNIE) peut se produire dans environ 1/3 des cas, selon les études. En ce qui concerne les streptocoques discutés dans cette revue, les BCNIE se produisent généralement lorsque la collecte des HC a eu lieu après le début de l’ antibiothérapie. Dans de tels cas, la PCR eubactérienne peut être utile (23). Cependant, notre propre expérience suggère que celle-ci ne doit pas être effectuée à partir des flacons d’ HC, mais à partir de sang EDTA prélevé séparément à cette fin.
Étant donné que les agents pathogènes courants des EI, y compris les staphylocoques, font également partie des contaminants fréquents des HC positives, l’ évaluation critique d’ un résultat d’ HC positif en termes de différenciation d’ une éventuelle contamination peut être difficile. Par conséquent, seule la détection d’ agents pathogènes typiques tels que S. gallolyticus ssp. gallolyticus ou appartenant aux streptocoques viridans dans deux HC indépendantes représente un critère majeur (23). La présence d’ une seule hémoculture positive, surtout sans la présence d’ autres critères principaux, doit être considérée avec prudence. Le fait de trouver (à plusieurs reprises) dans les urines d’ un patient suspect d’ endocardite un germe du groupe des streptocoques oraux ou du groupe D (S. gallolyticus ssp. gallolyticus), généralement classé comme contaminant, peut renforcer la signification d’ une HC positive. Si les HC avec le même agent pathogène restent positives 48-72 heures après l’ initiation d’ un traitement réellement efficace, cela représente un critère de pronostic défavorable.
En relation avec le traitement chirurgical de l’ endocardite, la recherche et l’ élimination de foyers infectieux sont importantes. Par conséquent, un examen dentaire, une coloscopie chez les patients atteints d’ une EI causée par S. gallolyticus ssp. gallolyticus, ou la recherche d’ infections au niveau de la colonne vertébrale telles que la spondylodiscite sont recommandés (29).
Cet article est une traduction de l’ article original paru dans « der informierte arzt » 06_2021.
Copyright Aerzteverlag medinfo AG
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
oliver.nolte@zlmsg.ch
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
salome.seiffert@zlmsg.ch
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
patrick.kindle@zlmsg.ch
Les auteurs déclarent qu’ il n’ y a pas de conflit d’ intérêts en rapport avec cet article.
◆ Le genre Streptococcus comprend plus de 100 espèces, dont peu sont d’ une grande importance en tant qu’ agents infectieux.
◆ Les streptocoques du groupe A sont la cause bactérienne la plus fréquente de l’amygdalopharyngite aiguë, mais il est difficile de distinguer entre une infection et le statut de porteur par des méthodes diagnostiques. Ainsi l’évaluation clinique revêt-elle une grande importance. L’évolution spontanée est généralement favorable, les antibiotiques doivent être utilisés avec retenue.
◆ Les streptocoques du groupe B constituent une menace potentielle, notamment pour les nouveau-nés. Des mesures appropriées (dépistage des SGB et IPA) peuvent prévenir ou réduire les infections graves de la mère et du nouveau-né (notamment l’ EOI) ainsi que leurs conséquences.
◆ Les streptocoques, en particulier les streptocoques oraux et S. gallolyticus ssp. gallolyticus, dominent dans un large spectre en tant qu’ agents pathogènes de l’ endocardite. Sur le plan microbiologique, l’ hémoculture représente le pilier essentiel du diagnostic, la préanalyse correcte (nombre et volume de remplissage des flacons) étant d’ une grande importance.
1. Toepfner N, Berner R. Gruppe-A-Streptokokken-Infektionen im Kindesalter. Monatsschr Kinderheilkd 2011;159:775-786
2. Shulman ST. et al. Clinical Practice Guideline for the Diagnosis and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Disease Society of America Clin Inf Dis 2012;55(10):e86-e102
3. Block SL. Streptococcal Pharyngitis: Guidelines, Treatment Issues, and Sequelae. Pediatr Ann 2014;43(1) 116
4. Gewitz HM. et al. Revision of the Jones Criteria for the Diagnosis of Acute Rheumatic Fever in the era of Doppler Echocardiography: A Scientific Statement from the American Heart Association. Circulation 2015;131(20):1806-18
5. Berner R. et al. S2k-Leitlinie 017/024: Therapie entzündlicher Erkrankungen der Gaumenmandeln – Tonsillitis. AWMF 8/2015
6. Pelucchi C. et al. ESCMID Guideline for the Management of Acute Sore Throat. Clin Microbiol Infect 2012; 18:1-28
7. NICE guideline Sore throat (acute): antimicrobial prescribing. 2018; NICE guideline NG84
8. Luo R. et al. Diagnosis and Management of Group a Streptococcal Pharyngitis in the United States, 2011-2015. BMC Infect Dis 2019;19(1):193
9. Centor RM. et al. The diagnosis of strep throat in adults in the emergency room. Med Decis Making 1981;1(3):239-46⁄
10. McIsaac WJ. et al. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. CMAJ 1998;158(1):75-83
11. Shabayek S, Spellerberg B. Group B Streptococcal Colonization, Molecular Characteristics, and Epidemiology. Front. Microbiol. 2018;9:437.
12. Podbielski A, Mauch H, Kniehl E, et al. MIQ 11a: Genitalinfektionen Teil II Infektionserreger: Bakterien. ELSEVIER, 2011.
13. Zemlin M, Berger A, Franz A, et al. Leitlinie: Bakterielle Infektionen bei Neugeborenen 2021;4.2 [https://www.awmf.org/leitlinien/detail/ll/024-008.html]
14. Astbury C. Clinical Guideline for: The Management of Women known to be carriers of Group B Streptococcus, 2021; 6.3 [https://www.nnuh.nhs.uk/publication/download/women-carriers-of-group-b-streptococcus-io9-v6-3/]
15. Filkins L et al. American Society for Microbiology provides 2020 guidelines for detection and identification of group B Streptococcus. J Clin Microbiol 2021; 59:e01230-20.
16. American College of Obstetricians and Gynecologists. Prevention of group B streptococcal early-onset disease in newborns. ACOG Committee Opinion No. 797. Obstet Gynecol 2020;135:e51–72.
17. Hughes RG, Brocklehurst P, Steer PJ, et al. on behalf of the Royal College of Obstetricians and Gynaecologists. Prevention of early-onset neonatal group B streptococcal disease. Green-top Guideline No. 36. BJOG 2017;124:e280–e305.
18. Filkins L, Hauser J, Robinson-Dunn B, et al. Guidelines for the Detection and Identification of Group B Streptococcus. American Society for Microbiology., 2020. [https://asm.org/Guideline/Guidelines-for-the-Detection-and-Identification-of]
19. Arbeitsgruppe der Schweizerischen Gesellschaft für Neonatologie und der Pädiatrischen Infektiologiegruppe Schweiz. Empfehlungen zur Prävention und Therapie von Termin- und knapp frühgeborenen Kindern (> 34 SSW) mit erhöhtem Risiko einer perinatalen bakteriellen Infektion (early-onset Sepsis), Paediatrica. 2013;24: 1.
20. Sonderegger B, Führer U, Portmann S et al. Infektiöse Endokarditis–Update. Teil 1. Swiss Medical Forum. 2012;12(3132).
21. Mainardi JL, Utili R. Endocarditis. In: CORNAGLIA G et al eds. : European Manual of Clinical Microbiology 1st Ed. 2012
22. Corredoira J, Alonso MP, Coira A et al. Characteristics of Streptococcus bovis endocarditis and its differences with Streptococcus viridans endocarditis, European Journal of Clinical Microbiology & Infectious Diseases 2008;27:285-91
23. Habib G, Lancellotti P, Antunes MJ, et al. ESC guidelines for the management of infective endocarditis: the task force for the management of infective endocarditis of the European Society of Cardiology (ESC) endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). European Heart Journal 2015;36(44):3075-3128.
24. Nishimura RA, Otto CM, Bonow RO, et al. AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Journal of the American College of Cardiology 2017;70(2):252-289.
25. Sendi P, Hasse B, Frank M, et al. Infektiöse Endokarditis: Prävention und Prophylaxe. Empfehlungen der Expertengruppe «Infective Endocarditis Prevention» Swiss Med Forum. 2021;21(0506):84-89
26. Thornhill MH, Dayer M, Lockhart B, et al. Guidelines on prophylaxis to prevent infective endocarditis. British Dental Journal 2016;220(2):51-56.
27. Lee A, Mirrett S, Reller LB, et al. Detection of bloodstream infections in adults: how many blood cultures are needed? Journal Clinical Microbiology 2007;45:3546–3548.
28. Lamy B, Dargère S, Arendrup MC, et al. How to optimize the use of blood cultures for the diagnosis of bloodstream infections? A state-of-the art. Frontiers in microbiology 2016;7:697
29. Pettersson GB, Coselli JS, Hussain ST, et al. The American Association for Thoracic Surgery (AATS) consensus guidelines: surgical treatment of infective endocarditis: executive summary. The Journal of Thoracic and Cardiovascular Surgery 2017;153(6):1241-1258
la gazette médicale
- Vol. 10
- Ausgabe 6
- Dezember 2021