- Der primäre Hyperparathyreoidismus
Als primären Hyperparathyreoidismus (pHPT) bezeichnet man den Zustand einer chronisch erhöhten, inadäquaten Sekretion von Parathormon (PTH) ohne erkennbaren physiologischen Stimulus. Der pHPT ist nach dem Diabetes mellitus und Schilddrüsenerkrankungen die dritthäufigste endokrine Erkrankung des Menschen und stellt die häufigste Ursache für eine ambulant entdeckte Hyperkalzämie dar.
Epidemiologie
Der primäre Hyperparathyreoidismus ist eine der häufigsten endokrinen Erkrankungen. Grundsätzlich kann der primäre Hyperparathyreoidismus in jeder Altersstufe auftreten, wobei Menschen über 50 Jahre und postmenopausale Frauen am häufigsten betroffen sind. Die Inzidenz wird in westlichen Industrienationen auf etwa 25-30/ 100 000 Einwohner/ Jahr geschätzt, was einer Prävalenz von 1-7/ 1000 Menschen in der Allgemeinbevölkerung entspricht (1-5).
Ätiologie
In 85% – 90% der Fälle handelt es sich um einen sporadisch auftretenden pHPT durch ein solitäres autonomes Nebenschilddrüsenadenom.
Hyperplasien mehrerer oder aller vier Nebenschilddrüsen kommen in bis zu 6% der Fälle vor (6) und können auch hinweisend auf eine genetische Ursache sein. Bei der genetischen Ursache muss insbesondere bei jungen Patienten mit einer multiglandulären Erkrankung an eine multiple endokrine Neoplasie (MEN) vom Typ 1 aber auch Typ 2a gedacht werden. Auch Lithium-haltige Medikamente und Thiaziddiuretika können die Entwicklung einer Mehrdrüsenerkrankung begünstigen. Sehr selten liegt ein Nebenschilddrüsenkarzinom vor (< 1% der Fälle).
Anatomie
Beim Menschen liegen in der Regel vier, selten auch fünf oder sechs, gelegentlich auch nur drei Nebenschilddrüsen (NSD, Epithelkörperchen) vor. Sie wiegen 20-50 mg bei einer Grösse von etwa 5 x 3 x 1 mm. Grundsätzlich sind NSD sehr variabel in Form, Grösse, Gewicht, Farbe und Konsistenz. Topographisch liegen die NSD in der Regel der Schilddrüsenkapsel auf, wobei die kranialen Nebenschilddrüsen meist dorsal des N. laryngeus recurrens und die kaudalen Nebenschilddrüsen ventral der Nerven liegen.
Pathophysiologie
Der Kalziumspiegel wird im Blut durch das Parathormon (PTH) und Vitamin D3 konstant zwischen 2.0 und 2.6 mmol/l gehalten, was für zahlreiche Körperfunktionen unentbehrlich ist (z.B. Muskelkontraktionen, Nervenleitung, Zellstoffwechsel). PTH wird von den Hauptzellen der NSD produziert und sezerniert. Die Regulation erfolgt dabei über sog. Kalzium-Sensing-Rezeptoren (CaSR), die auf der Oberfläche der NSD lokalisiert sind. Sie registrieren z.B. einen Abfall des ionisierten Kalziums im Blut und steigern die Produktion und Sekretion des PTH.
Zu den Wirkungen des PTH zählen:
1. eine verstärkte renale Kalziumrückresorption und Phosphatausscheidung
2. ein verstärkter Kalziumabbau am Knochen durch Aktivierung der Osteoklasten
3. eine verstärkte Absorption von Kalzium aus dem Darm durch gesteigerte Synthese von 1,25-Dihydroxy-Vitamin D aus 25-Hydroxyvitamin D3 durch Aktivierung der renalen 1α-Hydroxylase
Klinik
Bereits durch eine sorgfältige Anamnese können wertvolle Hinweise auf das Vorliegen wesentlicher Differentialdiagnosen gewonnen werden, wobei die Leitsymptome des primären Hyperparathyreoidismus meist recht unspezifisch sind. Die Symptome können zusammengefasst werden mit «Stein, Bein und Magenpein». Dies könnte ergänzt werden mit «Seelenkummer obendrein». Dabei steht das «Stein» für Nierensteine. Renal kann zudem eine Polyurie imponieren (7-12). «Bein» steht für Osteoporose. Klinisch imponieren dabei oft Knochen- bzw. Gelenkschmerzen, selten kommt es zu pathologischen Frakturen (11, 12). Zudem kann der Gastrointestinaltrakt betroffen sein mit peptischen Ulzera des Duodenums und Magens aber auch Pankreatitiden. Zuletzt können auch in bis zu 20% neuropsychologische Symptome vorliegen. Dies können depressive Verstimmungen, oder kognitive Veränderungen sowie auch vermehrte Müdigkeit, Konzentrationsstörungen und Stimmungsschwankungen sein (13, 14, 15). Nicht selten liegt eine asymptomatische Hyperkalzämie vor.
Diagnostisches Vorgehen
Labordiagnostik
Ein pHPT wird durch den Nachweis eines erhöhten oder hochnormalen intakten Parathormons (PTH) und gleichzeitig bestehendem erhöhtem Albumin-korrigierten Gesamt-Kalzium oder ionisiertem Serumkalzium gestellt. Es ist also eine Diagnose, die primär laborchemisch gestellt wird. Andere Ursachen einer Hyperkalzämie bzw. ein erhöhter Wert des Parathormons sollten ausgeschlossen werden. Z.B. bei einer Paraneoplasie, einer Medikamentennebenwirkung, einer Niereninsuffizienz, einem Vitamin D-Mangel oder einer familiären hypokalziurischen Hyperkalzämie.
Die Bestimmung von Kreatinin und Harnstoff sowie der Kreatinin-Clearance dienen dem Ausschluss einer Niereninsuffizienz-bedingten Nebenschilddrüsenüberfunktion (sekundärer HPT), während die Bestimmung der Kalzium- und Kreatinin-Clearance im Spot-urin einen milden pHPT von einer familiären hypokalziurischen Hyperkalzämie (FHH) ohne Krankheitswert differenzieren kann. Dies ist deshalb so wichtig, weil eine FHH keine Therapie benötigt.
Die häufigste Ursache für einen reaktiv erhöhten PTH-Wert bei Normokalzämie ist ein Vitamin-D-Mangel, der durch Bestimmung des 25-Hydroxy-Vitamin D aufgedeckt werden kann.
Lokalisationsdiagnostik
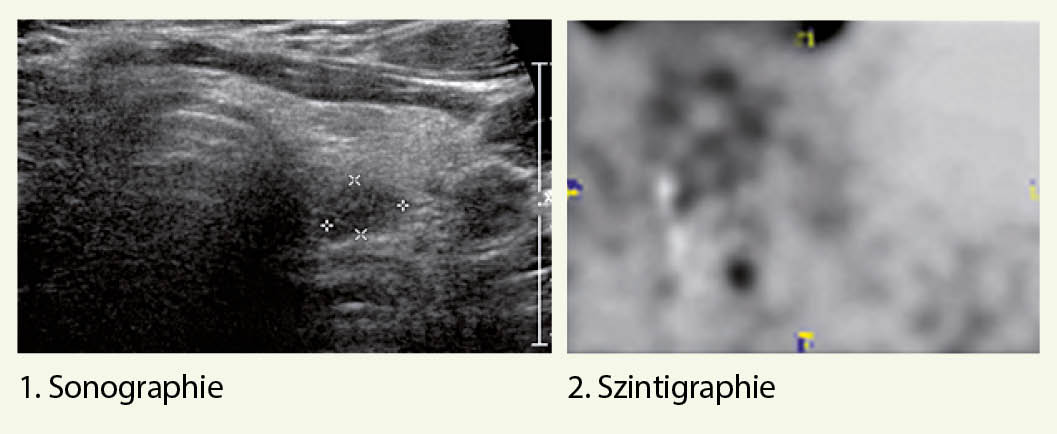
Eine erfolgreiche Lokalisationsdiagnostik ermöglicht einen fokussierten und dadurch auch minimal-invasiven operativen Zugangsweg (16) und schliesst als Optionen 1. die zervikale Sonographie und 2. die Sestamibi-Szintigraphie bzw. Sestamibi-SPECT/ CT-Untersuchung mit ein.
Bei fehlender Lokalisation in der Sonographie und Szintigraphie oder auch bei diskordanten Befunden, steht neuerdings das Cholin-PET zu Verfügung, das eine erhöhte Sensitivität hat und entsprechend eine tiefere falsch-negative Rate (17).
Therapeutisches Vorgehen
Bei laborchemisch diagnostiziertem pHPT und typischer Symptomatik, einem sogenannten symptomatischen pHPT, ist eine chirurgische Therapie in Form einer Parathyreoidektomie klar indiziert. Aber auch bei asymptomatischen Patienten ist die Operationsindikation oft gegeben, weil auch sogenannt asymptomatische Patienten postoperativ häufig über eine Verbesserung ihrer Lebensqualität berichten, und der pHPT auch bei asymptomatischen Patienten einen nachteiligen Effekt z.B. auf den Knochen hat und bei einem gewissen Prozentsatz dieser Patienten binnen zehn Jahren auch zu Symptomen führt. Empfohlen wird eine Operation grundsätzlich bei asymptomatischen Patienten, wenn die Hyperkalzämie sehr ausgeprägt ist, wenn eine Niereninsuffizienz vorliegt, oder auch wenn die Patienten jünger als 50 Jahre alt sind. Auch eine Osteoporose kann eine Operationsindikation sein. Hier geht es immer um eine Nutzen Risiko-Abwägung, die idealerweise von einem Endokrinologen mitabgewogen werden sollte.
Alternativ zur chirurgischen Therapie, insbesondere bei asymptomatischen Verlaufsformen des pHPT, sollten regelmässig Kontrollen durchgeführt werden. Zudem müssen die Patienten dazu angehalten werden ausreichend zu trinken und eine Immobilisation zu vermeiden.
Präoperatives Management
- Vitamin D3
Patienten mit einem pHPT haben häufig einen Vitamin-D-
Mangel. Vitamin-D3-Mangel ist v.a. im Winter stark verbreitet. Da ein Vitamin-D3-Mangel die Parathormonsekretion
stimuliert, sollte vor einer Operation bei Vorliegen eines Vitamin-D3-Mangels eine Supplementation erfolgen (18, 19). Dabei sind kurzfristige Kontrollen des Serumkalziums erforderlich. Aktuell wird eine Vitamin D Gabe von 800 bis 1000 IU/Tag bei Erwachsenen empfohlen (20). - Laryngoskopie
Eine prä- und postoperative Laryngoskopie mit Dokumentation der Stimmlippenbeweglichkeit soll bei allen Patienten mit einem pHPT aus Qualitätszwecken erfolgen. Dies, weil v.a. die kranialen Nebenschilddrüsen sehr nah am N. laryngeus recurrens liegen und dieser bei einer Operation geschädigt werden kann. Dies hätte eine Stimmbandfunktionseinschränkung mit Heiserkeit beim Patienten zur Folge.
Operation
Das chirurgische Vorgehen unterscheidet sich wesentlich zwischen Ersteingriffen und Rezidiveingriffen und ist von der zugrundeliegenden Ätiologie abhängig. Im Folgenden wird aus Gründen der Übersicht das Vorgehen eines Ersteingriffes beschrieben. Voraussetzung für alle operativen Verfahren ist die Notwendigkeit einer exakten Kenntnis der Anatomie der Nebenschilddrüsen und ihrer potentiell ektopischen Lagevariationen.
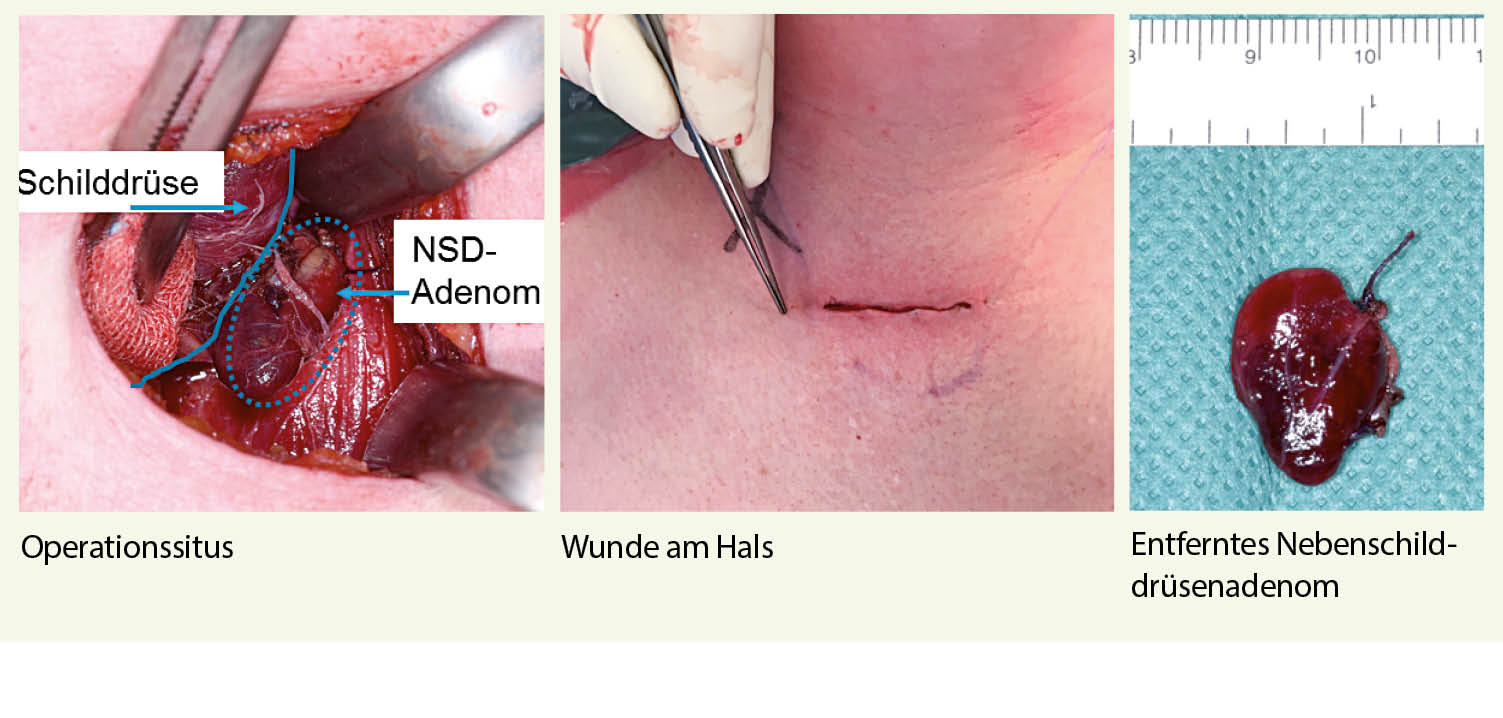
Besteht aufgrund der Lokalisationsdiagnostik präoperativ der Verdacht auf ein singuläres Nebenschilddrüsenadenom, kann eine fokussierte Parathyreoidektomie und damit potentiell auch eine minimalinvasive Operationstechnik avisiert werden. Bei Verdacht auf einen multiglandulären Befall wird je nach Lokalisation eine uni- oder bilaterale Halsexploration durchgeführt.
Die Operation erfolgt in der Regel in Vollnarkose. Die konventionelle, offene Entfernung eines Nebenschilddrüsenadenoms erfolgt über einen vorderen oder lateralen Zugang. Der vordere Zugang entspricht dem üblichen Zugang für die Thyreoidektomie, kann aber durch eine kleinere Inzision durchgeführt werden (20).
Da das Parathormon eine sehr kurze Halbwertszeit von weniger als 5 Minuten aufweist, ermöglicht die intraoperative PTH-
Bestimmung nach Entfernung des betroffenen Nebenschilddrüsenadenoms eine unmittelbare Erfolgskontrolle noch während des Eingriffes (19). Dabei wird zu verschiedenen Zeiten perioperativ Parathormon bestimmt, meist vor der Operation, zum Zeitpunkt der Adenomentfernung sowie 10 bis 20 Minuten nach Adenom-entfernung. Bei nicht adäquatem Abfall des Parathormonwertes kann dann die operative Strategie entsprechend angepasst werden, d.h., wenn das Parathormon nicht mindestens 50% abfällt binnen
10 Minuten nach Entfernung des Nebenschilddrüsenadenoms, muss nach einer weiteren erkrankten Nebenschilddrüse gesucht werden. Der Eingriff muss also erweitert werden. Auch ein intraoperativer Schnellschnitt kann hilfreich sein, insbesondere, wenn die Identifizierung des Nebenschilddrüsenadenoms aspektmässig nicht einwandfrei möglich ist.
Ein intraoperatives Neuromonitoring kann helfen die Stimmbandnerven zu identifizieren und wird regelhaft eingesetzt (21). Besteht eine Indikation zur Schilddrüsenoperation wird empfohlen, diese zusammen mit der Nebenschilddrüsenoperation durchzuführen.
Grundsätzlich sind Komplikationen nach Nebenschilddrüsenoperationen selten. Durch exakte anatomische Kenntnisse und vorsichtige Präparationstechnik können die wesentlichen Komplikationen auf ein Minimum reduziert werden. Zu den möglichen Komplikationen zählen:
1. Stimmbandnervlähmung (sog. Rekurrensparese)
2. Nachblutung
3. Persistenz und Rezidiv
Zur Beurteilung der postoperativen Nebenschilddrüsenfunktion sollte eine Bestimmung des Albumin- korrigierten Serumkalziums und des intakten Parathormons am 1. postoperativen Tag erfolgen, um das Risiko einer therapierelevanten postoperativen Hypokalz-ämie zu erfassen. Nach erfolgreicher Parathyreoidektomie werden in 1,8% – 42% der Fälle erniedrigte Serumcalciumwerte gemessen (24, 25). Dies entspricht durchaus einem regelhaften postoperativen Verlauf und ist zunächst nicht als postoperative Komplikation zu werten.
Eine Bestimmung insbesondere des Albumin-korrigierten Serumkalziums, fakultativ auch des PTHs sollte, auch bei unkompliziertem Verlauf, nach 6 Monaten durchgeführt werden, um eine Persistenz bzw. ein Rezidiv des pHPT zu erfassen.
Nachblutungen sind eine seltene, aber potenziell lebensbedrohliche Komplikation nach Nebenschilddrüsenoperation. Sie treten meist innerhalb der ersten 24 h postoperativ auf und erfordern eine unverzügliche operative Revision mit vordringlicher Sicherung der Atemwege. Aus diesem Grunde sind Nebenschilddrüsenoperationen auch weiterhin keine ambulanten Eingriffe.
Eine Persistenz und oder ein Rezidiv eines Hyperparathyreoidismus wird definiert als anhaltende Hyperkalzämie binnen bzw. nach 6 Monaten und findet sich in 2-5% (22, 23).
Copyright bei Aerzteverlag medinfo AG
Spital Männedorf AG, Chirurgische Klinik, Asylstrasse 10, 8708 Männedorf
Spital Männedorf AG, Chirurgische Klinik,
Asylstrasse 10, 8708 Männedorf
UniversitätsSpital Zürich, Klinik für Endokrinologie,
Rämistrasse 100, 8091 Zürich
Spital Männedorf AG, Chirurgische Klinik,
Asylstrasse 10, 8708 Männedorf
Universitäts Spital Zürich, Klinik für Viszeralchirurgie,
Rämistrasse 100, 8091 Zürich
diana.vetter@usz.ch
Die Autorinnen haben im Zusammenhang mit diesem Artikel keine Interessenkonflikte deklariert.
◆ Die Diagnose eines primären Hyperparathyreoidismus wird laborchemisch gestellt.
◆ Zur Diagnose des pHPT sollte eine wiederholte Bestimmung des Albumin-korrigierten Serumkalziums und des intakten Parathormons erfolgen und eine sekundäre Komponente durch Bestimmung des Kreatinins und des 25(OH)- Vitamin D ausgeschlossen werden. Gegebenenfalls soll Vitamin D substituiert werden.
◆ Die Bestimmung der Calcium Clearance im Spoturin dient dem Ausschluss einer familiären hypokalziurischen Hyperkalzämie, welche nicht therapiebedürftig ist.
◆ Die Operation ist die bisher einzige ursächliche Therapie.
1. Wilhelm SM, Wang TS, Ruan DT, Lee JA, Asa SL, Duh QY, et al. The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperparathyroidism. JAMA Surg. 2016; 151(10):959-68
2. Abood A, Vestergaard P. Increasing incidence of primary hyperparathyroidism in Denmark. Dan Med J 2013; 60(2): A4567
3. Griebeler ML, Kearns AE, Ryu E, Hathcock MA, Melton LJ 3rd Wermers RA. Secular trends in the incidence of primary hyperparathyroidism over five decades (1965-2010). Bone 2015; 73:1-7
4. Nilsson IL. Primary hyperparathyroidism: should surgery be performed on all patients? Current evidence and residual uncertainties. J Intern Med 2019; 285(2):149-164
5. Siilin H, Lundgren E, Mallmin H, Mellström, Ohlsson C, Karlsson M, Ljunggren O. Prevalence of primary hyperparathyroidism and impact on bone mineral density in elderly men: MrOs Sweden. World J Surg 2011; 35(6):1266-1272
6. Ruda JM, Hollenbeak CS, Stack BC Jr, A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003, Otolaryngol Head Neck Surg. 2005;132(3):359.
7. Suh JM, Cronan JJ, Monchik JM. Primary hyperparathyroidism: is there an increased prevalence of renal stone disease? AJR Am J Roentgenol. 2008; 191(3):908-911
8. Rejnmark L, Vestergaard P, Mosekilde L. Nephrolithiasis and renal calcifications in primary hyperparathyroidism. J Clin Endocrinol Metab. 2011;96(8):2377-2385
9. Ejlsmark-Svensson H, Bislev LS, Rolighed L, Sikjaer T, Rejnmark L. Predictors of renal function and calcifications in primary hyperparathyroidism: A nested case-control study. J Clin Endocrinol Metab 2018; 103(9):3574-3583
10. Tay YD, Liu M, Bandeira L, Bucovsky M, Lee JA, Silverberg SJ, Walker MD. Occult urolithiasis in asymptomatic primary hyperparathyroidism. Endocr Res 2018; 43(2):106-115
11. Reid LJ, Muthukrishnan B, Patel D, Seckl JR, Gibb FW. Predictors of nephrolithiasis, osteoporosis, and mortality in primary hyperparathyroidism. J Clin Endocrinol Metab 2019; 104(9):3692-3700
12. Castellano E, Attanasio R, Boriano A, Pellegrino M, Garino F, Gianotti L, Borretta G. Sex difference in the clinical presentation of primary hyperparathyroidism: Influence of menopausal status. J Clin Endocrinol Metab 2017; 102(11):4148-4152
13. Blanchard C, Mathonnet M, Sebag F, Caillard C, Hamy A, Volteau C et al. Surgery for ‘asymptomatic’ mild primary hyperparathyroidism improves some clinical symptoms postoperatively. Eur J Endocrinol 2013; 169(5):665-672
14. Murray SE, Pathak PR, Schaefer SC, Chen H, Sippel RS. Improvement of sleep disturbance and insomnia following parathyroidectomy for primary hyperparathyroidism. World J Surg 2014; 38(3):542- 548
15. Weber T, Eberle J, Messelhauser U, Schiffmann L, Nies C, Schabram J et al. Parathyroidectomy, elevated depression scores, and suicidal ideation in patients with primary hyperparathyroidism: results of a prospective multicenter study. JAMA Surg 2013; 148(2):109-115
16. Bergenfelz AO, Hellman P, Harrison B, Sitges-Serra A, Dralle H. Positional statement of the European Society of Endocrine Surgeons (ESES) on modern techniques in pHPT surgery. Langenbecks Arch Surg 2009; 394(9):761-764
17. Lezaic L, Rep S, Jensterle SM, Hocevar M, Fettich J. 18F-fluorocholine PET/CT for localization of hyper functioning parathyroid tissue in primary hyper-parathyroidism: a pilot study. Eur J Nucl Med Mol Imaging. 2014; 41:2083–9
18. Marcocci C, Bollerslev J, Khan AA, Shobach DM. Medical management of primary hyperparathyroidism: Proceedings of the Fourth International Workshop on the Management of Asymptomatic Primary Hyperparathyroidism. J Clin Endocrinol Metab 2014; 99(10):3607-3618
19. Eastell R, Brandi ML, Costa AG, D’Amour P, Shoback DM, Thakker RV. Diagnosis of asymptomatic primary hyperparathyroidism: Proceedings of the Fourth International Workshop. J Clin Endocrinol Metab 2014; 99(10):3570-3579
20. Udelsman R, Lin Z, Donovan P. The superiority of minimally invasive parathyroidectomy based on 1650 consecutive patients with primary hyperparathyroidism. Ann Surg2011; 253(3):585-591
21. Lin HS, Terris DJ. An update on the status of nerve monitoring for thyroid/parathyroid surgery. Curr Opin Oncol2017; 29(1):14-19
22. Guerin C, Paladino NC, Lowery A, Castinetti F, Taieb D, Sebag F. Persistent and recurrent hyperparathyroidism. Updates Surg 2017; 69:161-169
23. Bagul A, Patel HP, Chadwick D, Harrison BJ, Balasubramanian SP. Primary hyperparathyroidism: ananalysis of failure of parathyroidectomy. World J Surg 2014; 38(3):534-541
24. Allendorf J, DiGorgi M, Spanknebel K, Inabnet W, Chabot J, Logerfo P. 1112 consecutive bilateral neck explorations for primary hyperparathyroidism. World J Surg 2007; 31 (11): 2075-2080
25. Mittendorf EA, Merlino Jl, McHenry CR. Post-parathyroidectomy hypocalcemia: incidence, risk factors, and management. Am Surg. 2004; 70(2):114-119
der informierte @rzt
- Vol. 11
- Ausgabe 12
- Dezember 2021