- Pollenallergie: Pathogenese, Klinik und Diagnostik
Der sogenannte «Heuschnupfen» ist die häufigste atopische Erkrankung in den Industrieländern und verursacht enorme direkte und indirekte Kosten für die Wirtschaft und das Gesundheitswesen. Die globale Erwärmung sowie die Zunahme anthropogener Umweltschadstoffe, die als hochreaktive, entzündungsfördernde Substanzen unser Immunsystem überstimulieren, tragen am meisten zu seiner Verbreitung bei. Viele Pollenallergiker sind auf mehrere Pollenarten (Bäume, Gräser, Kräuter) sensibilisiert, entweder durch multiple Primärsensibilisierungen oder durch Kreuzreaktionen aufgrund der hohen Sequenzhomologie zwischen Proteinen (Major- und Minorallergene) verschiedener Arten mit diagnostischer Relevanz. Die allergologische Untersuchung basiert auf einer ausführlichen Anamnese, Hauttests und der Bestimmung von Gesamt- und spezifischem Immunglobulin E (IgE) gegen die entsprechenden Allergene. Dieser Artikel erscheint in zwei Teilen: Im ersten Teil wird die Pathogenese, die Epidemiologie, die verschiedenen Pollinosis-Typen und ihre Diagnostik thematisiert, im zweiten die Behandlung der Pollenallergie.
The so-called «hay fever» is the most common atopic disease in industrialized countries and causes enormous direct and indirect costs for the economy and the health care system. Global warming as well as the increase of anthropogenic environmental pollutants, which overstimulate our immune system as highly reactive pro-inflammatory substances, are the main contributors to its spread. Many pollen allergy sufferers are sensitized to several types of pollen (trees, grasses, herbs) either through multiple primary sensitizations or due to cross-reactions because of the high sequence homology between proteins (major and minor allergens) of different species with diagnostic relevance. The allergological investigation is based on a detailed anamnesis, skin tests and determination of total and specific Immunoglobulin E (IgE) against the corresponding allergens. This article is published in two parts: The first part focuses on the pathogenesis, epidemiology, different types of pollinosis and their diagnosis, the second on the treatment of pollen allergy.
Key Words: hay fever, pollen allergy, pharmacological treatments, allergen-specific immunothera
Heuschnupfen, im Fachbegriff Rhinitis pollinosa (RP) bezeichnet, ist eine saisonale rezidivierende entzündliche Erkrankung der Nasenschleimhaut, die bei sensibilisierten Personen bei Exposition via inhalierte Pollen-Allergene durch eine Typ-I-Überempfindlichkeitsreaktion induziert wird (1). Typischerweise reichen die Symptome von juckenden Augen, Niesattacken bis zu laufender oder verstopfter Nase. Das klinische Bild ändert sich aber trotzdem je nach dem Schwergrad sehr, wobei man die Beteiligung von Nase und Augen als Rhinokonjunktivitis bezeichnen müsste. Anstrengungsasthma oder sogar Atemnot können dazu kommen, falls die Erkrankung progressiv die unteren Atemwege befallen hat. Häufigere und stärkere Symptome mit asthmatischer Komponente sind Ausdruck einer chronischen und nicht mehr medikamentös kontrollierbaren Krankheitsprogression. Die Krankheit per se wird seitens des Patienten meist unterbewertet und daher nicht adäquat therapiert. Beim Wort «Heuschnupfen» besteht generell die kollektive Vorstellung, dass es sich um eine harmlose und transitorische Erkrankung mit selbstlimitierenden Symptomen handelt, doch dem ist nicht so. Terminologisch ist der Begriff «Heuschnupfen» obsolet, dessen Herkunft um die Wende des 19. Jahrhunderts auf John Bostock und seine Vorgänger zurückgeführt werden kann. Bei eigenen Patienten vermutete der Engländer bereits, dass das damalige «hay fever» durch Grasblüten oder Gräserpollen und nicht durch Heu verursacht wurde, weshalb sich im Nachhinein der Begriff Pollinosis oder Pollenallergie als treffender herausstellte.
Pathogenese der allergischen Rhinitis
Aus pathogenetischer Sicht entwickelt sich eine Atemwegsallergie nach Aktivierung einer durch Th2-Lymphozyten IgE-vermittelten Reaktion mit Entzündung der respiratorischen Schleimhaut, die durch luftdispergierte Moleküle induziert wird. Inhalative Allergene werden als saisonale (Pollen von Bäumen, Gräsern und Kräutern) und ganzjährige (Hausstaubmilben, Haustiere, Schimmelpilze) eingeteilt. Die Sensibilisierung entspricht der ersten Phase bei der Entzündung, die schliesslich zur Initiierung von Früh- und Spätphasenreaktionen führt (2). Die erneute Exposition gegenüber einem Allergen, gegen das eine Person bereits sensibilisiert ist, löst durch eine allosterische Aktivierung zwischen IgE-Antikörpern und Mastzellen (ansässige Zelltypen in der Nasenschleimhaut) die Freisetzung von neuroaktiven und vasoaktiven Substanzen aus, wobei darunter Histamin, Prostaglandin D2 und Leukotriene die wichtigsten sind. Diese chemischen Mediatoren sind für die nasalen Symptome verantwortlich, welche innerhalb weniger Minuten auftreten. Es kommt zur Polarisation naiver CD4 + T-Lymphozyten in Effektorzellen, die TH2-ähnliche Eigenschaften annehmen und eine lokale IgE-Produktion induzieren. TH2-Lymphozyten sekretieren IL-4, IL-13 und IL-21 und fördern IgE+ B-Zellen (2-3) (Abb. 1). Die Frühphasenreaktionen (EPR; Early Phase) finden bis zu 60 Minuten nach der nasalen Allergen-Exposition (NAC) statt. Während der EPR erreicht der Tryptasespiegel 5 Minuten post-inflammatorisch einen signifikanten Höchstwert in der Nasenflüssigkeit. Diese Erhöhung wird von schwerer Rhinorrhoe, Niesen, Juckreiz und nasaler Obstruktion begleitet. Die Spätphasenreaktionen treten 4 bis 12 h später nach der Allergenbelastung auf und sind im Allgemeinen durch die Geweberekrutierung von eosinophilen TH2-Zellen gekennzeichnet. Lokal rekrutierte Eosinophile sezernieren toxische Mediatoren, vor allem eosinophiles kationisches Protein (ECP) und Eotaxin, die bei Persistenz das Nasenepithel irreversibel schädigen können (4-5). Dazu wird die entzündete Schleimhaut reaktiver sowohl gegenüber dem ursächlichen Allergen als auch anderen Allergenen oder sogar nicht-allergenen Reizen gegenüber wie Reizstoffen (Tabakrauch, Haarsprays, Gerüche usw.), indem sie unspezifische nasale Hyperaktivität provoziert (6).
Epidemiologie
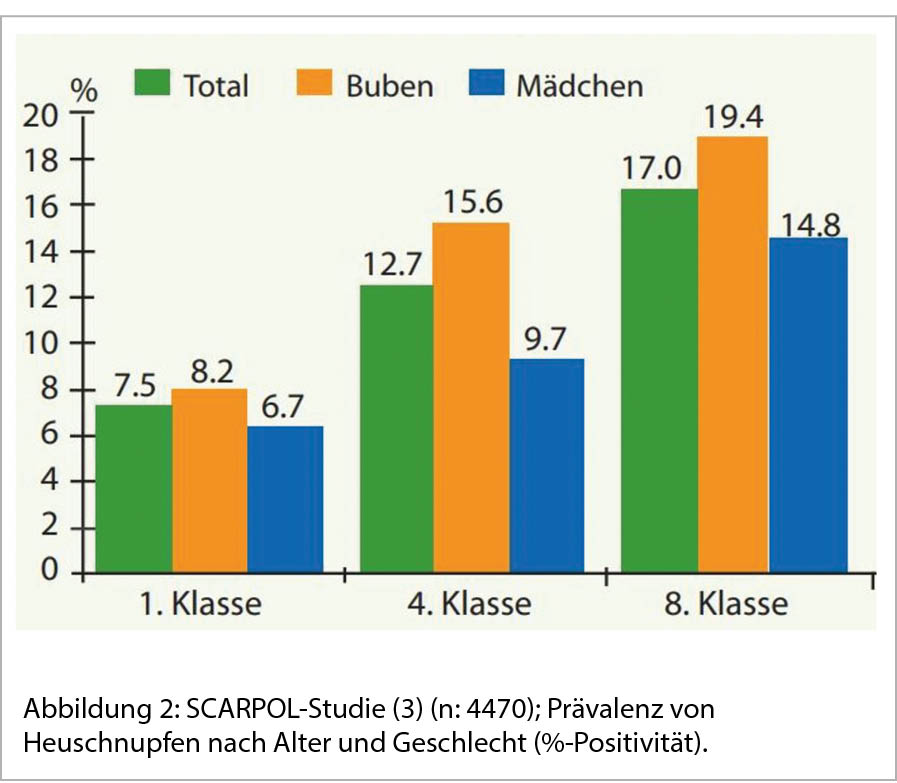
Gemäss ARIA-Nachforschungen (Allergic Rhinitis and its Impact on Asthma) liegt die Prävalenz bestätigter Pollinosis bei Erwachsenen in Europa zwischen 17 % und 28,5 % und15 % bis 38 % dieser Patienten leiden auch an Asthma bronchiale. Dazu präsentieren zwischen 6 bis zu 85% der asthmatischen Patienten nasale Symptome (7-8). Man schätzt, dass mindestens 500 Millionen Menschen weltweit an allergischer Rhinitis leiden, mit steigender Prävalenz in den letzten 20 Jahren (2). Im Vergleich zu anderen Erkrankungen erscheint die Pollenallergie nicht schwerwiegend, da sie nicht mit schwerer Morbidität und Mortalität verbunden ist. Die Pollinosis geht auch mit sozioökonomischen Folgen einher: Die Arbeitsproduktivität wird stark eingeschränkt, bei Kinder zeigen sich erhebliche Auswirkungen auf die Schulleistung sowie auf das soziale Leben. Nicht zuletzt ist die Schlafqualität und die Leistung von Spielaktivitäten im Freien stark beeinträchtigt, was zu einer Verschlechterung ihrer Lebensqualität führt (2). Kinder mit allergischer Rhinitis erleiden häufiger wiederkehrende Ohrinfektionen und Adenotonsillitiden als Nicht-Allergiker. Epidemiologische Studien belegten eine generelle Zunahme der Pollinose-Prävalenz, hierzulande von 0,8% im Jahre 1926 auf 9,6% im Jahre 1986 bis zurzeit mit ungefähr 20%. Gemäss der SCARPOL-Studie erfolgt ein Anstieg der Pollinose-Prävalenz bei Kindern von der ersten Klasse bis zur Pubertät, wobei Knaben häufiger betroffen sind (9) (Abb. 2). Die Pollinosis geht auch mit evidenten finanziellen Kosten weltweit einher. Man schätzt, dass pro Jahr das Schweizer Gesundheitswesen mit etwa 50-150 Millionen CHF belastet wird, beim Asthma liegt diese Ziffer 6- oder sogar 7-fach höher (10).
Pollenallergene in der Schweiz
Der Pollenkalender ist für Pollenallergiker ein nützliches Hilfsmittel, um den Kontakt mit den allergenen Pollen zu begrenzen und somit die Symptome zu minimieren. In der Schweiz lassen sich grundsätzlich drei Zeitperioden bzgl. des allergenen Pollenfluges unterscheiden (Abb. 3).
Baumpollen im Frühjahr (Januar-April)
Gräserpollen im Frühsommer (Mai-Juli)
Kräuterpollen im Spätsommer (Juli-September)
Frühjahrspollinose
In den ersten Monaten des Jahres dominieren die Pollen der Baumgewächse, unter diesen zuerst die der Erle, der Birken- (Betulaceae) und Haselnussgewächse (Corylaceae). Später erscheinen die Pappelpollen der Weidengewächse (Salicaceae) (in der Schweiz ohne grössere Bedeutung) und vor allem Birken- und Eschenpollen. Esche gehört zu den Ölbaumgewächsen. Kommt ein Eschen-Allergiker z.B. in Mittelmeerländern in Kontakt mit Pflanzen der Oleaceae-Familie (Oliven, Liguster, Flieder, Oleander, Jasmin), können allergische Symptome infolge hoher Kreuzreaktivität auftreten. Es ist daher sinnvoll, Esche stets zusätzlich zu testen und gegebenenfalls eine Immuntherapie in Erwägung zu ziehen. Die Birke ist angesichts ihrer Kreuzreaktivität innerhalb der Betulaceae-Familie und mit Frischobst (Apfel, Kirschen usw.), Haselnuss und Frischgemüse (Sellerie, Karotten usw.) von grossem allergologischen Interesse (sogenannte Birkenpollen-assoziierte Nahrungsmittelallergien).
Frühjahrsommerpollinose
Pollen der am weitest verbreiteten Gräserfamilien (Gramineae, auch Poaceae) verursachen weltweit die häufigste pollenbedingte Symptomatik. In der Schweiz sind Gräser wichtige Pollenallergene mit klinisch relevanter Sensibilisierung bei ca. 20% der Bevölkerung. Etwa 200 Gräserarten sind hierzulande identifiziert worden, bei denen das Wiesen-Lieschgras (Phleum pratense) und der Roggen (Secale cereale) als «Haupttäter» zu nennen sind. Ihre Blütezeit reicht von Ende April bis Ende August, mit dem höchsten Pollenflug zwischen Mai und Mitte Juli. Es besteht auch eine Kreuzreaktivität mit verschiedenen Nahrungsmitteln (Sojamehl, Erdnuss, Kartoffel, Tomate, Bohnen, Erdbeeren und Linsen), auch wenn ihre klinische Häufigkeit nicht so im Vordergrund steht wie bei der Birkenpollernallergie.
Spätsommerpollinose
Beifuss und Ambrosia gehören zur Familie der Korbblütler (Compositae) und sind die Ursache der Symptomatik in den Monaten Ende Juli bis Frühherbst. Die Beifusspollenallergie zeigt eine hohe Kreuzreaktivität innerhalb der Familie der Asteraceae (Kamille, Aster, Margerite, Chrysantheme, Sonnenblume) sowie mit verschiedenen Nahrungsmitteln wie Sellerie Karotten, Gurke, Gewürzen (Anis, Muskat, Pfeffer, Zimt, Ingwer) (vgl. «Beifuss-Sellerie-Gewürz-Syndrom) (11). Ambrosia (Ragweed), versehentlich aus Nordamerika eingeführt, hat sich als Ruderalpflanze schnell in Europa verbreitet. Der Pollenflug ist vor allem im August, aber er breitet sich bis im September aus. Die Verbreitung der Ambrosia wird durch menschliche Aktivitäten begünstigt, insbesondere durch landwirtschaftliche Nutzpflanzen der Frühjahrsaussaat (Sonnenblume), Vogelfutter und Autoverkehr (Pollen haften an den Autoreifen). Klinisch ist Ambrosia ein potenter Allergieauslöser, vor allem im Tessin und im Kanton Genf, mit minimaler Beteiligung in der Restschweiz (12). Bei 40-60% der Ambrosiaallergiker entwickelt sich mit den Jahren ein Asthma bronchiale (13).
Diagnostisches Verfahren
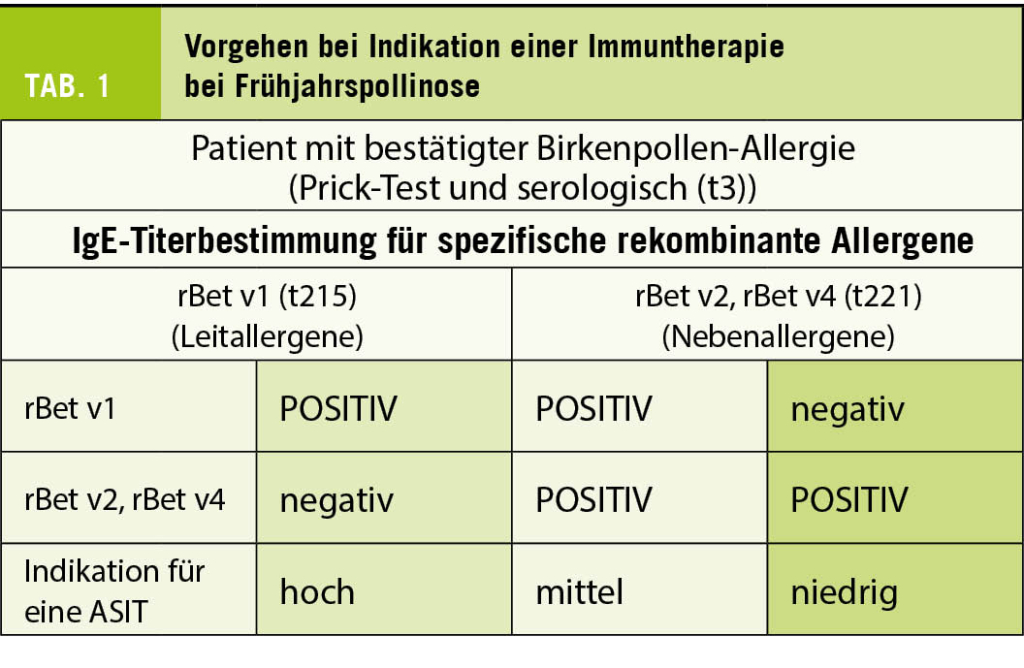
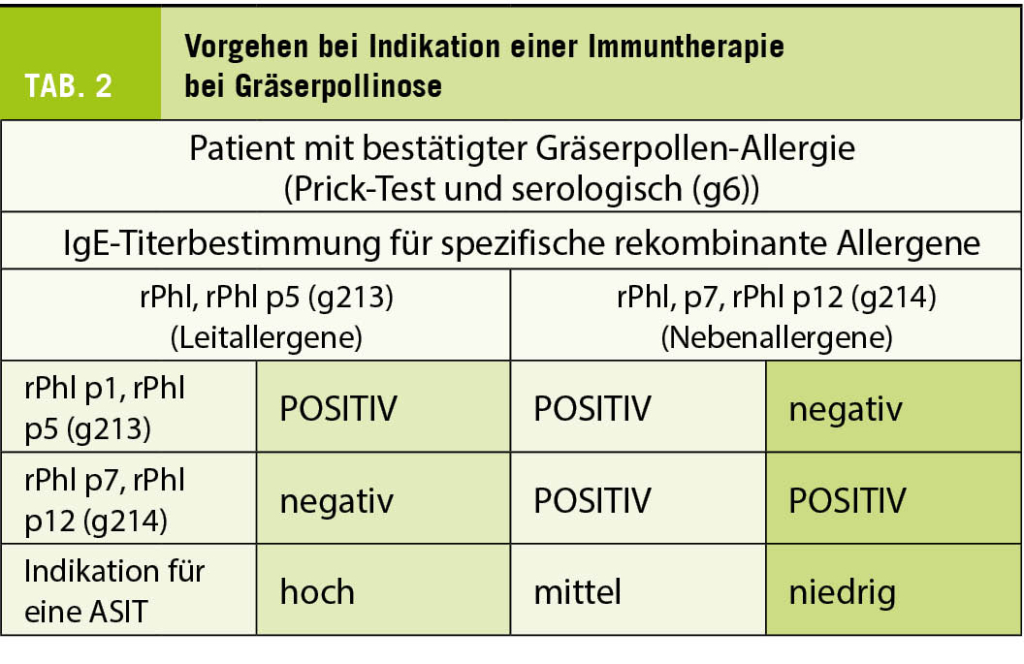
Im Hinblick auf eine spezifische Immuntherapie sollte die genaue Diagnostik dem Allergologen oder einem erfahrenen Spezialisten (Dermatologe, Pneumologe, ORL- oder Kinder-Arzt) überlassen werden, welcher dem praktischen Arzt den Patienten wieder mit genauen Angaben zum weiteren Prozedere (Extraktzusammenstellung, häufig auf Grund der Bestimmung von IgE auf rekombinante Pollenalleregene und Therapieverfahren bzgl. subkutaner oder sublingualer Immuntherapie) instruiert (siehe Tabl. 1 und Tabl. 2).
Copyright bei Aerzteverlag medinfo AG
HautZentrum Zürich
Schaffhauserstrasse 355
8050 Zürich
lopresti.roberto@outlook.com
Facharzt FMH für Allergologie und Immunologie
Facharzt FMH für Dermatologie
Langjähriger Leiter der Allergiestation am Universitätsspital Zürich
8125 Zollikerberg
bs.wuethrich@bluewin.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Terminologisch ist der Begriff «Heuschnupfen» obsolet, man sollte von Rhinitis pollinosa oder, da die Bindehäute sehr häufig befallen sind, von einer Rhinokonjunktivitis pollinosa sprechen.
◆ Da häufig nebst Augen und Nase andere Organe befallen werden können, wäre der Begriff «Pollinosis» oder «Pollinose» zutreffender.
◆ Die Prävalenz einer Pollinosis bei Erwachsenen in Europa beträgt
zwischen 17 % und 28,5 %, von den Betroffenen leiden auch 15 % bis 38 % der an Asthma bronchiale.
◆ Pathogenetisch handelt es sich bei der Pollinosis um eine durch Th2-Lymphozyten IgE-vermittelten Reaktion, die zu einer Früh- und einer Spätphasen-Reaktion führt.
◆ In der Schweiz lassen sich grundsätzlich drei Zeitperioden von
Pollinosis unterscheiden: eine Frühjahrspollinose, eine Frühjahrsommerpollinose und eine Spätsommerpollinose.
◆ Die Diagnose einer Pollenallergie benötigt eine ausführliche Anamnese, richtige diagnostische Tests (kutan und serologisch) in Kombination mit einer passender Patientenklinik, unter Berücksichtigung der Symptomatik und ihrem Ausbruch je nach dem Pollenkalender. Die primärere Abklärung sollte immer durch einen Spezialisten (Allergologen, Dermatologen, Pneumologen, ORL- oder Kinder-Arzt) erfolgen.
1. Greiner AN, Hellings PW, Rotiroti G, Scadding GK. Allergic rhinitis. Lancet. 2011;378(9809):2112–22.
2. Drazdauskaite G. et al. Mechanisms of Allergen Immunotherapy in Allergic Rhinitis. Current Allergy and Asthma Reports (2021) 21:2.
3. Gowthaman U, Chen JS, Zhang B, Flynn WF, Lu Y, Song W, et al. Identification of a T follicular helper cell subset that drives anaphylactic IgE. Science. 2019;365(6456): eaaw6433.
4. Scadding GW, Eifan A, Penagos M, Dumitru A, Switzer A, McMahon O, et al. Local and systemic effects of cat allergen nasal provocation. Clin Exp Allergy. 2015;45(3):613–23.
5. Blanchard C, Rothenberg ME. Biology of the eosinophil. Adv Immunol. 2009;101:81-121.
6. Wheatley LM, Togias A. Allergic rhinitis. N Engl J Med 2015;372:456-63.
7. Brozek JL et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines—2016 revision. J Allergy Clin Immunol. 2017 Oct;140(4):950-958.
8. Bauchau V, Durham SR. Prevalence and rate of diagnosis of allergic rhinitis in Europe. Eur Respir J 2004;24:758-64.
9. Fahrlander C.B., Wüthrich B. et al. Validation of a rhinitis symptom questionnaire (ISAAC core questions) in a population of Swiss school children visiting the school health services. SCARPOL-team. Swiss Study on Childhood Allergy and Respiratory Symptom with respect to Air Pollution and Climate. International Study of Asthma and Allergies in Childhood. Pediatr Allergy Immunol. 1997 May;8(2):75-82.
10. Szucs TD, Anderhub HP, Rutishauser M. Determinants of health care costs and patterns of care of asthmatic patients in Switzerland. Schweiz Med Wochenschr 2000; 130: 305 – 13.
11. Hofer T, Wüthrich B. [Food allergy. II. Prevalence of organ manifestations of allergy-inducing food. A study on the basis of 173 cases, 1978-1982]. Schweiz Med Wochenschr. 1985 Oct 12;115(41):1437-42.
12. Wüthrich B., Leuenberger P., et al. Atopische Sensibilisierung, Luftverschmutzung und respiratorische Erkrankungen in der Schweiz (SAPALDIA Studie). Allergologie, Jahrgang 22, Nr. 5/1999, S. 267-274
13. Tosia A., Wüthrich B. et al. Time lag between Ambrosia sensitisation and Ambrosia allergy. Swiss Med Wkly. 2011 Oct 9;141:w13253.
der informierte @rzt
- Vol. 12
- Ausgabe 2
- Februar 2022