- Herpes Zoster Ophthalmicus – zuerst Hautausschlag oder Kopfschmerzen?
Herpes Zoster wird durch die Reaktivierung und Vermehrung des Varizella-Zoster-Virus (VZV) ausgelöst und betrifft die sensorischen Hirnnerven- und Spinalnervenganglien, die peripheren Nerven und die Haut. Ein Herpes Zoster Ophthalmicus (HZO) wird durch eine VZV-Reaktivierung im Ganglion trigeminale ausgelöst und kann mit oder ohne Augenbeteiligung auftreten. HZ ist durch einen in der Regel auf ein Dermatom beschränkten unilateralen Ausschlag mit Bläschen gekennzeichnet. Einseitige Schmerzen im vom sensorischen Ganglion versorgten Bereich sind typisch (1). Im von der VZV Reaktivierung betroffenen Ganglion tritt eine intensive Entzündung mit hämorrhagischer Nekrose auf, was einen Nervenzellverlust und die Fibrose der afferenten Nervenfasern zur Folge hat. Deshalb gehen die Schmerzen dem Ausschlag normalerweise voraus oder begleiten diesen (2).
Herpes zoster is caused by reactivation and multiplication of the varicella zoster virus (VZV) and affects the sensory cranial and spinal ganglia, peripheral nerves, and skin. Herpes zoster ophthalmicus (HZO) is caused by VZV reactivation in the trigeminal ganglion and may occur with or without ocular involvement. HZ is characterized by a unilateral rash with vesicles usually confined to one dermatome. Unilateral pain in the area supplied by the sensory ganglion is typical (1). Intense inflammation with hemorrhagic necrosis occurs in the ganglion affected by VZV reactivation, resulting in nerve cell loss and fibrosis of afferent nerve fibers. Therefore, pain usually precedes or accompanies the rash.
Key Words: Herpes zoster, ganglion, hemorrhagic necrosis
Anamnese
Die notfallmässige Vorstellung eines 71-jährigen Patienten erfolgte aufgrund stärkster rechtsseitiger, stechender Kopfschmerzen seit drei Tagen. Die Dynamik der Kopfschmerzen charakterisierten sich mit schlagartigem Auftreten mehrmals am Tag und in der Nacht, unilateral mit einer Dauer von weniger als 1-2 Stunden. In der Eintrittsanamnese erwähnte der Patient ein gerötetes rechtes Auge mit vermehrter Epiphora (Tränenfluss) und kontinuierlichem okulären Druckgefühl, begleitet von persistierender Nausea. Er beklagte Schmerzintensivierung beim Öffnen des rechten Auges, eine Zunahme bei körperlicher Belastung oder ein Ruhebedürfnis wurde nicht angegeben. Als Triggerfaktor bestand eine leichte Photophobie. Lärmempfindlichkeit und Zeichen einer Aura wurden verneint. Bei chronischem Alkoholkonsum von einigen Gläsern Wein täglich wurde seit Beginn der Kopfschmerzen kein Alkohol konsumiert. Der Nikotinkonsum (kumulativ 30py) war ebenfalls in den letzten Tagen sistiert.
Eine Bedarfsanalgesie mit Metamizol und Paracetamol brachte keine Besserung.
Relevante persönliche Anamnese: Zustand nach Exzision eines gut differenzierten, invasiven, verhornenden Plattenepithelkarzinoms der Ohrhelix rechts (pT1 L0 Pn0 R0 G1) im November 2015. Anamnestisch fand im Oktober 2016 eine erneute Exzision einer solitären Lymphknotenmetastase eines mässig/wenig differenzierten verhornenden Plattenepithelkarzinoms zervikal Level V rechts statt. Ein Fuorodeoxyglucose (FDG)-Ganzkörper- PET/CT und die Nachkontrolle 2017 zeigten kein Rezidiv.
Als regelmässige Medikamente wurden ein Antihypertensivum (Candesartan cilexetil), Betablocker (Propranolol Hydrochlorid), Acetylsalicylsäure sowie ein Protonenpumpen-Inhibitor (PPI) eingenommen. Es wurde von Allergien durch Bienen- und Wespengift berichtet.
Status und Befunde
Bei der Erstvorstellung präsentierte sich ein 71-jähriger, afebriler (Temperatur 36.0°), schmerzgeplagter Patient in deutlich reduziertem Allgemeinzustand, der zeitlich, örtlich, situativ und zur eigenen Person orientiert war, mit einem GCS von 15 Punkten. Der Blutdruck war mit 155/113 mmHg hyperton und der Puls mit 101 bpm grenzwertig tachykard. Neurologisch zeigten sich keine Auffälligkeiten bis auf einen druckdolenten Bulbus oculi rechts und starkem Schmerz beim Blick nach oben rechts. Der restliche neurologische Status der Hirnnerven war unauffällig. Nackensteifigkeit und Zeichen eines Meningismus bestanden nicht. Die übrige körperliche Untersuchung war inklusive Lymphknoten unauffällig. Es zeigten sich eine leichte okuläre Injektion rechts und eher trockene Schleimhäute. Es zeigten sich keine Hautveränderungen am Kopf und im Gesicht.
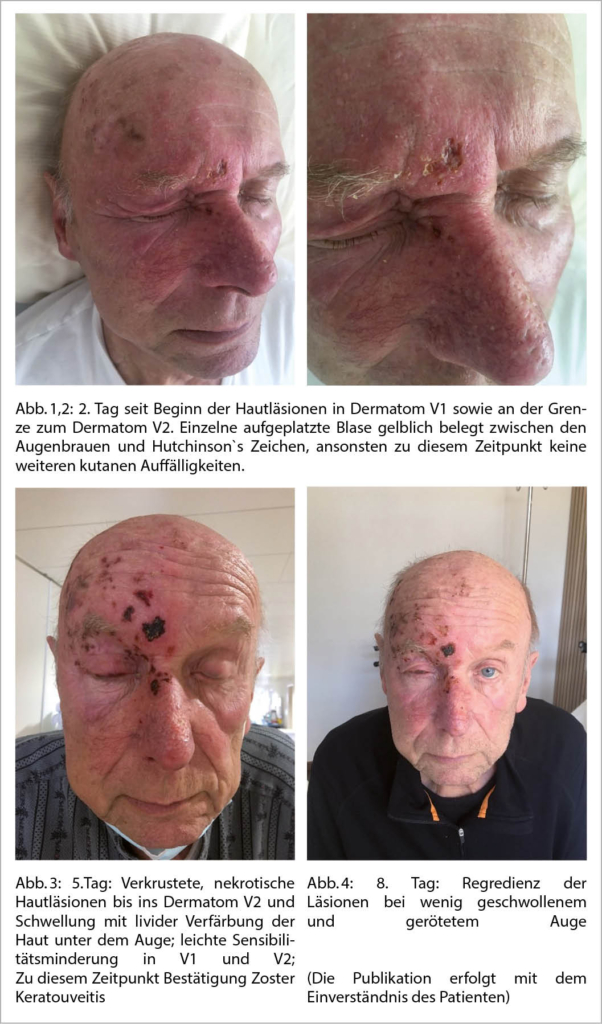
Die Leukozyten, CRP und BSR waren normwertig. Es bestanden eine leichte normochrome, normozytäre Anämie mit einem Hb von 130 g/l (Norm 120-160 g/l), sowie eine moderate Hyponatri-ämie (Natrium 128 mmol/l, Norm 135-150 mmol/l) und eine leichte Hypokaliämie (Kalium 3.4 mmol/l, Norm3.5-5.5 mmol/l). Für eine diagnostische Liquorpunktion zeigte sich der Patient zurückhaltend. Initial wurden computertomographisch eine intrakranielle Blutung sowie eine akute territoriale Ischämie ausgeschlossen. Bei hochgradigem Verdacht auf ein Tumorrezidiv oder Metastasen bei Status nach Plattenepithelkarzinom der Ohrhelix wurde ergänzend eine unauffällige Magnetresonanztomographie (MRT) des Neurokraniums durchgeführt. Der Patient wurde unter symptomatischer Therapie mit Analgetika und Opioiden stationär aufgenommen. Unter der Differentialdiagnose eines Clusterkopfschmerzes wurde Sauerstoff bei Bedarf eingesetzt. Am ersten Tag der Hospitalisation präsentierte er eine zunehmende Photophobie sowie zunehmende stechende, blitzartige Schmerzen beim Öffnen des rechten Auges, begleitet von okulärer Injektion. Erst in den folgenden Tagen der Hospitalisation traten ausgeprägte, wasserklare, vesikuläre Haut-effloreszenzen auf erythematösem Grund zwischen den Augenbraunen im Bereich der ersten Trigeminusastes V1 und an der Grenze des Trigeminusastes V2 rechts auf. Zudem waren der rechte Lidrand und die rechte Seite des Nasenrückens (Hutchinson-Zeichen positiv) betroffen und es zeigte sich eine Ptose des rechten Oberlides.
Diagnose
Das klinisch nun eindeutige Zustandsbild eines HZO konnte durch den Nachweis von VZV in der PCR aus dem Bläscheninhalt gesichert werden. Die VZV-Serologie war, wie zu erwarten, positiv (VZV IgG 206 IU/L, Referenzbereich >100 IU/l).
Eine zeitnahe ophthalmologische Mitbeurteilung ergänzte die bereits bestätigte Diagnose mit Konjunktivitis und epithelialer Zoster-Keratitis («Pseudodendritica»). Eine intraokuläre Beteiligung im Sinne einer Uveitis oder Keratitis konnte ausgeschlossen werden.
Therapie und Verlauf
Therapeutisch etablierten wir eine antivirale systemische Behandlung mit Valacyclovir 1000 mg 3x/24h p.o. für insgesamt 10 Tage, lokal Acyclovir Augensalbe sowie eine lokale antibiotische Therapie mit Ofloxacin Augensalbe 3x/tägl. für ebenfalls 10 Tage. Mittels einer analgetischen Therapie mit Oxycodon und Pregabalin konnten die Schmerzen suffizient kontrolliert werden. Leichter Schwindel und Benommenheit besserten sich nach Pregabalin -Dosisreduktion von 150 mg auf 125 mg pro Tag.
Die Elektrolytstörung wurde im Rahmen eines Syndroms der inadäquaten ADH-Sekretion bei akuter HZ-Infektion interpretiert sowie im Verlauf entsprechend korrigiert. Die leichte normochrome, normozytäre Anämie normalisierte sich spontan im Verlauf.
In der ophthalmologischen Verlaufskontrolle nach drei Tagen bestätigte sich eine beginnende Zoster-Keratouveitis, weswegen die Therapie mit topischen Steroiden (Pred forte Gtt Opht 1%) ergänzt wurde. Die Photophobie, der heftige Druck okulär rechts sowie die streng unilateralen Kopfschmerzen nahmen an Intensität ab und waren bis zum Austritt komplett regredient.
Die Zoster-Uveitis zeigte sich innert drei Wochen nach Beginn der Lokaltherapie komplett regredient, ebenso zeigte die Oberlidptose eine langsame Regredienz innert Wochen. Auffällig blieb eine bis dato persistierende Mydriase, welche am ehesten ein Ausdruck der herpesvirus-assoziierten Irisatrophie sein dürfte. Nach Absetzen der lokalen Steroidtherapie (zwei Monate nach der Erkrankungsepisode) trat ein Uveitisrezidiv auf, welches eine erneute Lokaltherapie mit Prednison sowie eine systemische Therapie mit Valacyclovir erforderlich machte. Rezidivierende Uveitiden sowie Keratitiden sind im Zusammenhang mit Herpesviren keine Seltenheit und weisen auf eine prolongierte Persistenz von Virusantigen in der Hornhaut und den sonstigen okulären Strukturen hin. Lange andauernde Verläufe mit Rezidivepisoden sind leider keine Seltenheit.
Diskussion:
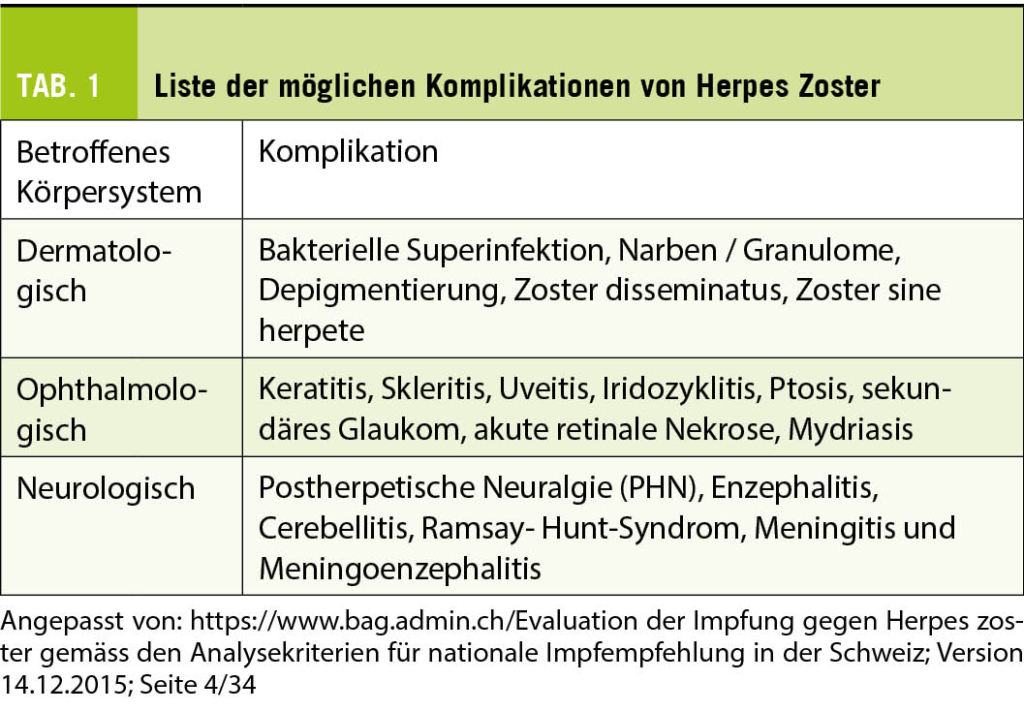
Beim vorliegenden Fall handelt es sich um eine typische klinische Manifestation des Herpes Zoster ophtalmicus. Bei der HZ-Infektion besteht keine saisonale Prävalenz. Jährlich erkranken mehr als 1.7 Millionen Menschen in Europa an HZ, wobei zwei Drittel der Erkrankten älter als 50-jährig sind (3). In der Schweiz zeigten sich im Rahmen des schweizerischen Sentinella-Meldesystems von 1998 bis 2001 ca. 17 000 Fälle pro Jahr (9). Die HZO-Fälle betragen etwa 10-20 % aller HZ-Erkrankungen. Das Lebenszeitrisiko für die Entwicklung einer HZO-Infektion beträgt ca. 1 % (5). Eine frühe Diagnose und Therapie ist wichtig, um schwerwiegende Komplikationen wie die postherpetische Neuralgie (PHN), oder auch ophthalmologische Komplikationen zu vermeiden (siehe Tabelle 1).
Der typische Hautausschlag beim beschriebenen Fall kam am 4. Tag nach Beginn der akuten Kopfschmerzen. Die ophthalmologischen Komplikationen im Sinne einer Zoster-Keratouveitis traten am 9. Tag auf. Im vorliegenden Fall kam es zu drei okulären Befunden (Uveitis, Keratitis, Irisatrophie/persistierende Mydriase). Die typischen Augenkomplikationen für HZO können auch ohne sichtbaren Ausschlag auftreten (d.h. Zoster sine herpete) (4).
Die Diagnose bei dieser Krankheit stützt sich vor allem auf das phänomenologische Bild sowie den klinischen Verlauf. Die Diagnose wird durch die VZV-PCR Untersuchung aus dem Bläschenabstrich bestätigt. VZV kann ausserdem mittels PCR in der Hornhaut und den Tränen auch ohne Augensymptome oder Hautausschläge nachgewiesen werden (5, 6). Die Serologie ist hierfür weniger gut geeignet, da sie bei durchgemachten Windpocken ohnehin positiv ist für VZV-IgG (ev. kann ein erneuter Titeranstieg bei einer Reaktivierung des HZO die Diagnose weiter bestätigen, ist aber nicht üblich).
Eine antivirale Therapie mit Beginn innerhalb der ersten 72 Stunden kann das Risiko von schweren Verläufen reduzieren (8). Der Frühbeginn einer kombinierten Schmerztherapie aus verschiedenen Medikamenten (Analgetika, Opioide, Antikonvulsiva, trizyklische Antidepressiva) ist wichtig, um das Risiko einer Chronifizierung der neuropathischen Schmerzen zu verringern. Im Falle einer eingetretenen Chronifizierung können die oben genannten Therapien nur in rund 50 % der Fälle eine zufriedenstellende Schmerzlinderung bewirken (10).
Zur Prävention von rezidivierenden HZ/HZO-Episoden und Komplikationen gibt es seit einigen Jahren in der Schweiz einen attenuierten Lebendimpfstoff (Zostavax®). Für die Impfung ist nur eine Impfdosis erforderlich. Dieser Impfstoff wird zurzeit noch nicht von der obligatorischen Krankenpflegeversicherung zurückerstattet und kostet ca. 160.- CHF. Der Impfstoff gegen Gürtelrose enthält das VZV in sehr starker Dosierung. Dadurch soll die Immunität der Personen reaktiviert werden, die in der Vergangenheit an Varizellen erkrankt waren. Gemäss Bundesamt für Gesundheit (BAG) wird die Impfung bei den folgenden 2 Zielgruppen empfohlen:
1.) Immunkompetente Personen im Alter von 65 bis 79 Jahren und 2.) Patienten im Alter von 50 bis 79 Jahren, die in naher Zukunft voraussichtlich bzw. wahrscheinlich immungeschwächt sein werden (9). Durch die Impfung werden ungefähr 51 % der Herpes-zoster-Fälle und 67 % der PHN-Fälle bei gesunden 60-jährigen oder älteren Personen für einen Zeitraum von drei Jahren vermieden, danach nimmt die Wirksamkeit weiterhin stetig ab (Shingles Prevention Study) (10). Alternativ zu Zostavax® gibt es einen Totimpfstoff (Shingrix ®), welcher sogar eine höhere und länger andauernde Wirksamkeit (90%) aufweist und auch an immunsupprimierten Patienten verabreicht werden kann (11,12). Dieser Impfstoff braucht 2 Dosen und wird vom Bundesamt für Gesundheit BAG und die Eidgenössische Kommission für Impffragen EKIF für gesunde Personen ab 65 Jahren sowie für Patientinnen und Patienten mit Immundefizienz ab 50 bzw. mit schwerer Immundefizienz ab 18 Jahren empfohlen. Shingrix® wurde durch Swissmedic im Oktober 2021 in der Schweiz zugelassen, seit dem 1. Januar ist der Impfstoff in der Schweiz verfügbar und seit 1. Februar wird die Impfung von der obligatorischen Krankenkasse erstattet. Die bisherigen Empfehlungen vom November 2017 für den Lebendimpfstoff Zostavax® gelten nur noch für Personen im Alter von 65 bis 79 Jahren ohne Immundefizienz, die Zostavax® gegenüber Shingrix® vorziehen.
Aufgrund des Alters unseres Patienten (71-jährig) und des Tumorleidens mit in Zukunft nicht ganz auszuschliessender Immunsuppression ist in dieser Situation deshalb eine HZ-Impfung emfpehlenswert.
Dr. med. Borislava Spasova , Department of internal Medicine, Klinik Arlesheim, Arlesheim Switzerland
Dr. med. Jens Oliver Krüger, Augenzentrum Bahnhof Basel, Basel, Switzerland
Dr. med. Stefan Erb, Praxengemeinschaft Warteckhof, Basel, Switzerland
Copyright bei Aerzteverlag medinfo AG
Klinik Arlesheim
Pfeffingerweg 1
4144 Arlesheim
b_spasova@yahoo.com
Die Autoren deklarieren keine Interessenskonflikte oder finfanziellen Support im Zusammenhang mit diesem Artikel.
◆ HZO wird in erster Linie klinisch diagnostiziert, sobald der Hautausschlag aufgetreten ist. Vor dem Auftreten eines Hautausschlags und in atypischen Fällen kann die Diagnose durch eine PCR-Analyse gesichert werden.
◆ Eine ophthalmologische Mitbeurteilung sollte aufgrund des hohen Risikos ophthalmologischer Komplikationen unbedingt und zu einem möglichst frühen Zeitpunkt erfolgen.
◆ Mit einer frühzeitig begonnenen systemischen, antiviralen Therapie bei Patienten mit HZ/HZO können 1) okuläre Spätschäden verhindert, 2) Schweregrad und Dauer der Schmerzen im Rahmen der akuten Neuritis und PHN verringert und 3) eine schnellere Heilung der Hautläsionen erreicht werden.
◆ Die Zoster-Impfung Zostavax® reduziert das Risiko eines HZ und/oder einer PHN um 51%, rsp. 67% bei gesunden 60-jährigen oder älteren Personen innerhalb der ersten 3 Jahre.
1. Oxman MN. Zoster vaccine: current status and future prospects. Clinical infectious diseases an official publi-cation of the Infectious Diseases Society of America 2010;2010(51(2)):197–213.
2. Kimberlin DW, Whitley RJ. Varicella-zoster vaccine for the prevention of herpes zoster. New England Journal Med 2007;2007(356(13)):1338–43.
3. Pinchinat S., Cebrián-Cuenca A.M. et al.. Similar herpes zoster incidence across Europe: results from a sys-tematic literature review. BMC Infectious Disease 2013.
4. Liesegang T. (2008) Herpes zoster ophthalmicus natural history, risk factors, clini cal presentation, and morbidity. Ophthalmology 115: S3–S12.
5. Pitkaranta A., Piiparinen H., Mannonen L., Vesaluoma M., Vaheri A. (2000) Detection of human herpesvirus 6 and varicella-zoster virus in tear fluid of patients with Bell’s Palsy by PCR. J Clin Microbiol 38: 2753–2755.
6. Van Gelderen B., Van der Lelij A., Treffers W., van der Gaag R. (2000) Detection of herpes simplex virus type 1, 2 and varicella zoster virus DNA in recipient corneal buttons. Br J Ophthalmol 84: 1238–1243.
7. Herpes zoster epidemiology, management, and disease and economic burden in Europe: a multidisciplinary perspective: Robert W. Johnson, Marie-José Alvarez-Pasquin, Marc Bijl, Elisabetta Franco, Jacques Gaillat, João G. Clara, Marc Labetoulle, Jean-Pierre Michel, Luigi Naldi, Luis S. Sanmarti, and Thomas Weinke; Therapeutic Advences in Vaccines 2015 Jul; 3(4): 109–120.
8. https://www.uptodate.com/
9. https://www.bag.admin.ch/ Evaluation der Impfung gegen Herpes zoster gemäss den Analysekriterien für nationale Impfempfehlung in der Schweiz; Version 14.12.2015; Seite 4/34; Empfehlungen zur Impfung gegen Herpes Zoster 47/17
10. Shingles prevention study Oxman MN, Levin M and the Shingles Prevention Study Group. Vaccination against Herpes Zoster and Postherpetic Neuralgia. J Infect Dis. 2008 Mar 1;197 Suppl 2:S228-36. doi: 10.1086/522159. www.ncbi.nlm.nih.gov/pubmed/18419402
11. Schmader KE1, Oxman MN, Levin MJ et al. Persistence of the efficacy of zoster vaccine in the shingles prevention study and the short-term persistence substudy. Clin Infect Dis. 2012 Nov 15;55(10):1320-8. doi: 10.1093/cid/cis638. www.ncbi.nlm.nih.gov/pubmed/22828595
12. Morrison VA, Johnson GR, Schmader KE, et al. Long-term persistence of zoster vaccine efficacy. Clin Infect Dis. 2015 Mar 15;60(6):900-9. doi: 10.1093/cid/ciu918. www.ncbi.nlm.nih.gov/pubmed/25416754
der informierte @rzt
- Vol. 12
- Ausgabe 3
- März 2022