- Optimierungsstudie des diffusen, grosszelligen B-Zell-Lymphoms: Eskalation von R-CHOP mit Acalabrutinib bei spezifischen Mutationen und Deeskalation von R-CHOP in Abhängigkeit von zirkulierender Tumor-DNA und PET/CT.
Das diffuse, grosszellige B-Zell-Lymphom (DLBCL) ist das häufigste Non-Hodgkin-Lymphom. Rund 60% aller Patienten mit einem DLBCL können mit der Standardtherapie R-CHOP geheilt werden. Dennoch gibt es immer noch Patienten, die mit dieser Therapie einen Rückfall erleiden, so dass neue Behandlungsmöglichkeiten erforderlich sind. Ob sich die Heilungsrate mit der Zugabe von Acalabrutinib zu R-CHOP bei Patienten mit spezifischen Mutationen erhöhen oder bei ungenügendem Ansprechen auf die Standardtherapie verbessern lässt, wird in der Studie SAKK 38/19 geprüft.
Zusätzliche Gabe von Acalabrutinib
In der Studie SAKK 38/19 wird untersucht, ob die Zugabe des Wirkstoffs Acalabrutinib zu einer R-CHOP-Behandlung (A-R-CHOP) die Wirksamkeit bei spezifischen Mutationen (Gruppe A) verbessern kann. Ausserdem werden Sicherheit und Verträglichkeit der Behandlung mit A-R-CHOP geprüft. Acalabrutinib wird zweimal täglich als Tablette eingenommen. Der Wirkstoff ist in der Schweiz zur Therapie bisher unbehandelter chronisch-lymphatischen Leukämie zugelassen.
Unterschiedliche Therapien – je nach Ansprechen
Bei den Studienteilnehmenden von SAKK 38/19 wird zudem die Art und Dauer der Behandlung an die Untersuchungsergebnisse angepasst (zirkulierende Tumor-DNA [ctDNA] und PET-CT), die während der Therapie erhoben werden. Das Ziel besteht darin, durch Therapie-Eskalation (Zugabe von Acalabrutinib) oder -Deeskalation (Reduktion von R-CHOP Zyklen) die Wirksamkeit und Verträglichkeit der Behandlung zu verbessern.
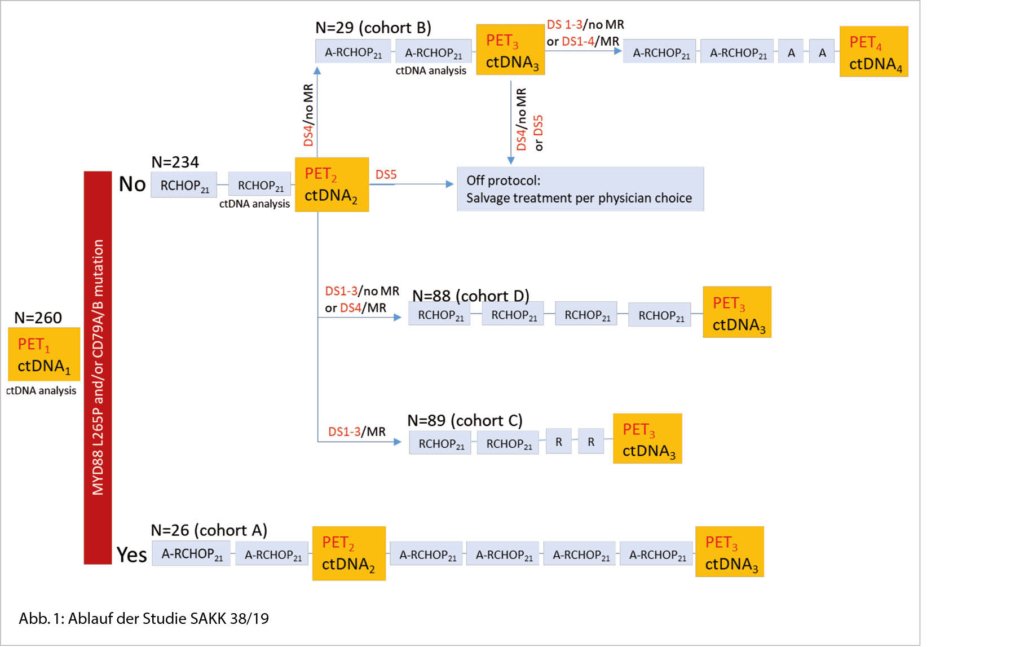
An der Studie können rund 260 therapienaive Patientinnen und Patienten mit einer bestätigten Diagnose eines DLBCL teilnehmen. Bei allen Teilnehmenden werden vor Therapiestart ein erstes PET-CT (PET1), eine erste Testung der ctDNA (ctDNA1) und eine Testung auf die Genmutationen MYD88 L265P und/oder CD79A/B durchgeführt.
- Patienten mit einer Mutation oder beiden Mutationen werden in die Gruppe A eingeteilt. Diese Patienten erhalten 2 Zyklen A-R-CHOP. Danach erfolgen die Untersuchungen PET2 und ctDNA2. Zeigt sich ein Krankheitsprogress, wird die Studienteilnahme abgebrochen und die Patienten erhalten eine andere Therapie. Alle anderen Patienten der Gruppe A werden weiter mit 4 Zyklen A-R-CHOP behandelt.
- Patienten ohne Mutationen erhalten 2 Zyklen R-CHOP. Danach erfolgen die Untersuchungen PET2 und ctDNA2. Aufgrund der Untersuchungsergebnisse werden die Patienten in die Gruppen B, C und D eingeteilt:
– Gruppe B sind Patienten mit residueller Krankheit in PET2 und ohne molekulare Response. Sie erhalten 2 Zyklen A-R-CHOP. Danach erfolgen die Untersuchungen PET3 und ctDNA3. Bei gutem Ansprechen folgen 2 weitere Zyklen A-R-CHOP und 2 Zyklen nur mit Acalabrutinib. Hat die Krankheit gemäss PET3 oder ctDNA3 nicht gut angesprochen, wird die Studientherapie beendet und die Patienten erhalten eine Salvage-Therapie.
– Gruppe C sind Patienten mit negativem PET2 und molekularer Response. Sie erhalten 2 weitere Zyklen R-CHOP und
2 Zyklen nur mit Rituximab.
– Gruppe D sind Patienten mit residueller Krankheit in PET2 und molekularer Response oder negativem PET2 und ohne molekulare Response. Sie erhalten 4 weitere Zyklen R-CHOP (Abb. 1).
Nach Abschluss der Studientherapie finden alle drei Monate klinische Kontrollen statt, und in den Monaten 12, 18 und 24 nach Beginn der Therapie werden nochmals PET-CT-Untersuchungen durchgeführt. Nach 24 Monaten finden die Kontrolluntersuchungen noch alle 6 Monate statt, nach 60 Monaten seit Beginn der Studientherapie enden die Kontrollen.
Diese Studie wird unterstützt vom Nachlass Frau Hubacher-Gugler
Studienname: Assessing a ctDNA and PET-oriented therapy in patients with DLBCL. A multicenter, open-label, phase II trial.
Teilnehmende Zentren: An dieser Studie nehmen mehrere Zentren in der Schweiz und im Ausland (in Planung) teil. Bitte finden Sie weitere Informationen hierzu auf der SAKK Webseite: https://www.sakk.ch/de/studien
Coordinating Investigator: PD Dr. med. Anastasios Stathis, Onkologisches Institut der Italienischen Schweiz (IOSI), anastasios.stathis@eoc.ch
Supporting Coordinating Investigator: Prof. Dr. med. Davide Rossi, Onkologisches Institut der Italienischen Schweiz (IOSI), davide.rossi@eoc.ch
PD Dr. med. Felicitas Hitz, Kantonsspital St.Gallen, felicitas.hitz@kssg.ch
Prof. Dr. med. Urban Novak, Inselspital Bern, urban.novak@insel.ch
Clinical Project Manager: Jana Musilova, SAKK Koordinationszentrum Bern, jana.musilova@sakk.ch
Winterthur
SAKK Präsident
miklos.pless@ksw.ch