- Hypomagnésémie pour le praticien
L’ hypomagnésémie est fréquente chez les patients ambulatoires et hospitalisés. Chez certains patients à risque, elle entraîne d’ importantes atteintes cérébrales, cardiovasculaires et biologiques. Une anamnèse détaillée et complétée par des examens de laboratoire simples permet d’ établir dans la plupart des cas un diagnostic. Le but de cet article est de proposer une approche pratique du diagnostic et de la prise en charge des carences en magnésium.
Hypomagnesemia is common in ambulatory and hospitalized patients. In some at-risk patients, it leads to significant cerebral, cardiovascular and biological damage. A detailed history, together with simple laboratory tests, allows a diagnosis to be made in most cases. The aim of this article is to propose a practical approach to the diagnosis and management of magnesium deficiency.
Key Words: Hypomagnesemia, TRPM6 and TRPM7 transporters
Le magnésium (Mg) est le second cation intracellulaire le plus abondant après le potassium (K). Le Mg joue un rôle central dans de nombreuses voies de signalisation intracellulaire et extracellulaire. Il participe aux réactions enzymatiques, à la conduction nerveuse, à l’excitabilité neuromusculaire et à la réponse immunitaire (1). L’ hypomagnésémie est très fréquente. On la retrouve chez environ 14% de la population en général et jusqu’à 8% des patients hospitalisés (2, 3).
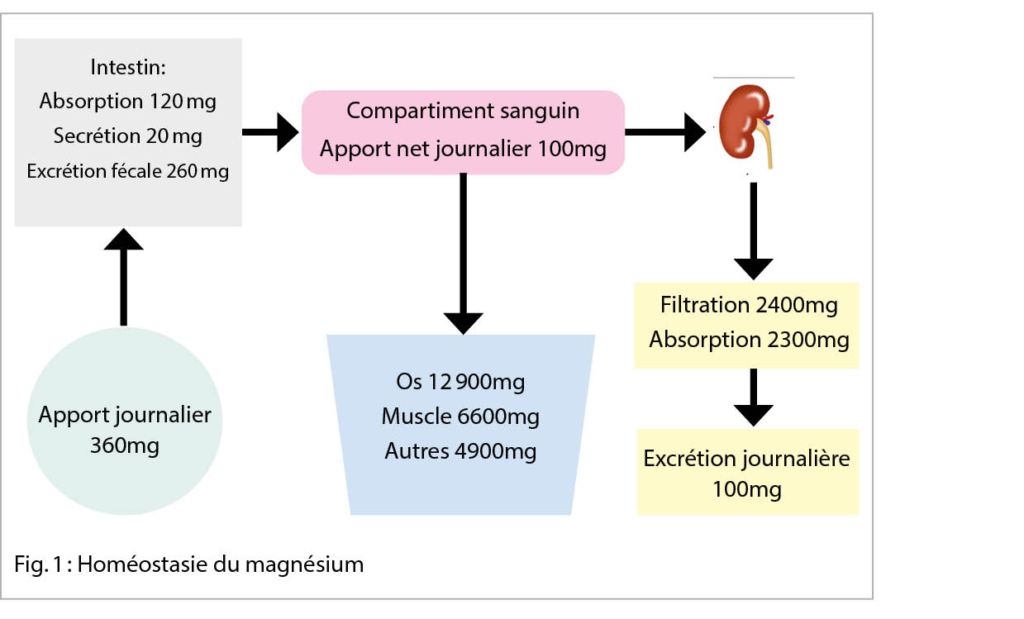
Homéostasie du magnésium (Fig 1)
L’ organisme contient environ 25g de magnésium, majoritairement en intracellulaire. Son stockage se fait entre 50-60 % dans le tissu osseux, entre 25-30 % dans les cellules musculaires, entre 20-25 % dans les autres tissus, et 1 % dans le milieu extracellulaire (4). Le Mg sérique représente 0.3 % du Mg total avec une infime partie du Mg libre participant aux activités cellulaires. Il existe sous trois formes : libre et ionisé constituant la forme active (55 % à 70 %), une forme liée aux protéines (30 %) et une petite partie (5 % à 15 %) sous forme complexe liée au phosphate, bicarbonate, citrate ou sulfate (5). La concentration plasmatique du Mg se situe entre 0.7 et 1.1 mmol/l (4).
Un adulte ingère entre 360mg et 420mg de Mg par jour. L’ absorption d’ environ 120mg de Mg se fait majoritairement au niveau de l’ intestin grêle distal, de manière passive par le passage paracellulaire, ou active par le passage transcellulaire via certains transporteurs comme le TRPM6 et le TRPM7 (4).
La régulation du Mg se fait au niveau rénal avec une magnésurie entre 4 à 5 mmol / 24h. Chaque jour le rein filtre jusqu’ à 2,4 g de Mg avec une excrétion de 5 % dans les urines et une réabsorption par le néphron de 95 % de la quantité de Mg restante. Au niveau du tube contourné proximal, 15 à 20 % du Mg sont réabsorbés. La majorité de l’ absorption, soit 65 à 75 %, se fait au niveau de la branche ascendante de l’ anse de Henlé où le transport paracellulaire est favorisé par le gradient électrique transépithélial. Les jonctions intercellulaires composées des protéines de la famille Claudin (16 et 19) jouent un rôle déterminant dans le transfert du Mg. Au niveau du tube contourné distal la fraction d’ excrétion du magnésium (FeMg) final est définie. La réabsorption de 5 % à 10 % de la totalité du Mg se fait par voie active transcellulaire (transporteur TRPM6) au niveau du pôle apical cellulaire. Le mécanisme de transport semble peu clair à travers la face basolatéral de la cellule. Il dépend de la cycline M2 et d’ une pompe Na-K-ATPase sensible à la concentration en Mg (4, 5).
Symptômes et complications
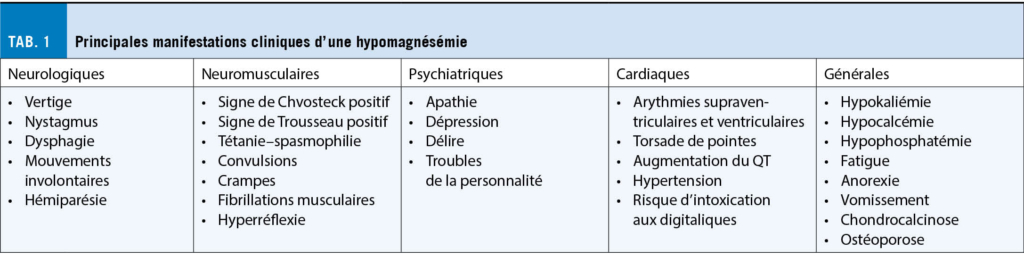
Les symptômes d’ une hypomagnésémie sont aspécifiques et variés (Tableau 1). En cas d’ hypomagnésémie modérée, le patient peut présenter une fatigue, une irritabilité, une agitation ou une dépression. En cas d’ hypomagnésémie sévère, des troubles rythmiques, des crises convulsives ou des troubles de la personnalité peuvent survenir. Les complications sont surtout biologiques, avec une hypocalcémie suite à l’ inhibition de la sécrétion de la parathormone et une hypokaliémie réfractaire à la supplémentation potassique. Une chondrocalcinose peut se développer par accumulation de pyrophosphate inorganique (6).
Étiologie
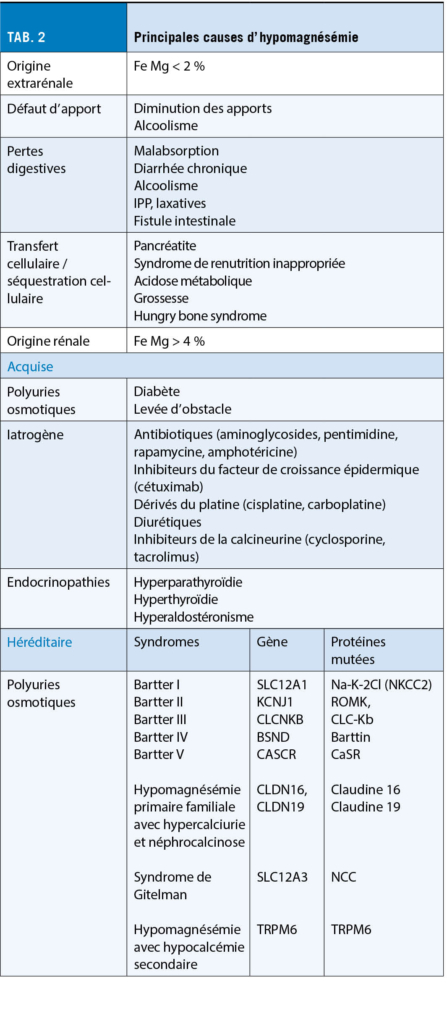
Les causes d’ une hypomagnésémie sont en général classées en origine rénale et extrarénale. Les principales étiologies sont énumérées dans le Tableau 2.
Diminution des apports
Les apports nécessaires journaliers sont de 360 mg pour une femme et 420 mg pour un homme.
Selon le bulletin nutritionnel Suisse de 2021, la majorité de la population de plus de 18 ans n’ atteint pas les apports journaliers recommandés. Chez les personnes de plus de 65 ans les apports sont environ 15% inférieurs à la moyenne de référence (7).
Le régime alimentaire moderne avec diminution de la consommation des oléagineux et des céréales complètes contribue à la diminution des apports (8). La consommation d’ alcool participe à une carence en Mg par malnutrition.
Pertes digestives
Les pathologies induisant une malabsorption ou une augmentation des pertes digestives entraînent une carence en magnésium.
Causes iatrogéniques
Dans une méta-analyse sortie en 2019 avec 16 études observationnelles regroupant 130 000 patients ambulatoires et hospitalisés, une hypomagnésémie a été retrouvée chez 19,4 % des utilisateurs d’ inhibiteur de la pompe à proton (IPP) contre 13.5% des personnes sans IPP. Un lien entre la dose d’ IPP et la survenue d’ une hypomagnésémie a également été mis en évidence (9).
Parmi les autres médicaments, on retrouve les diurétiques, les inhibiteurs de la calcineurine, les dérivés du platine, les antibiotiques et le cétuximab (10).
Shift et séquestration cellulaire
Un transfert intracellulaire du Mg peut survenir en présence d’ un syndrome de renutrition inappropriée. Lors d’ une acidose métabolique un transfert intracellulaire peut avoir lieu. Une pancréatite aiguë cause une hypomagnésémie par saponification au niveau des tissus graisseux nécrotiques. D’ autres pathologies plus rares existent comme le « Hungry bone syndrome » visible à la suite d’ une parathyroïdectomie par augmentation de l’ absorption cellulaire du Mg au niveau osseux. Lors des grossesses on observe un passage transplacentaire du Mg (11).
Pertes rénales
L’ hyperglycémie, les nécroses tubulaires aiguës, et les réhydratations intensives causent une hyperfiltration rénale du Mg. La réabsorption rénale du Mg est compromise lors de lésions directes tubulaires, comme dans le cas du syndrome de Fanconi ou dans les toxicités médicamenteuses (12). Les anomalies héréditaires à l’ origine des pertes en Mg sont nombreuses. Les principales sont l’ hypomagnésémie familiale avec hypercalciurie et néphrocalcinose, le syndrome de Bartter (V types) et le syndrome de Gitelman (13). Une mutation du gène codant pour la protéine TRPM6, présente au niveau du colon et du tube contourné distal, se manifeste par une profonde hypomagnésémie dès le plus jeune âge (hypomagnésémie avec hypocalcémie secondaire) (14).
Détermination d’ une hypomagnésémie
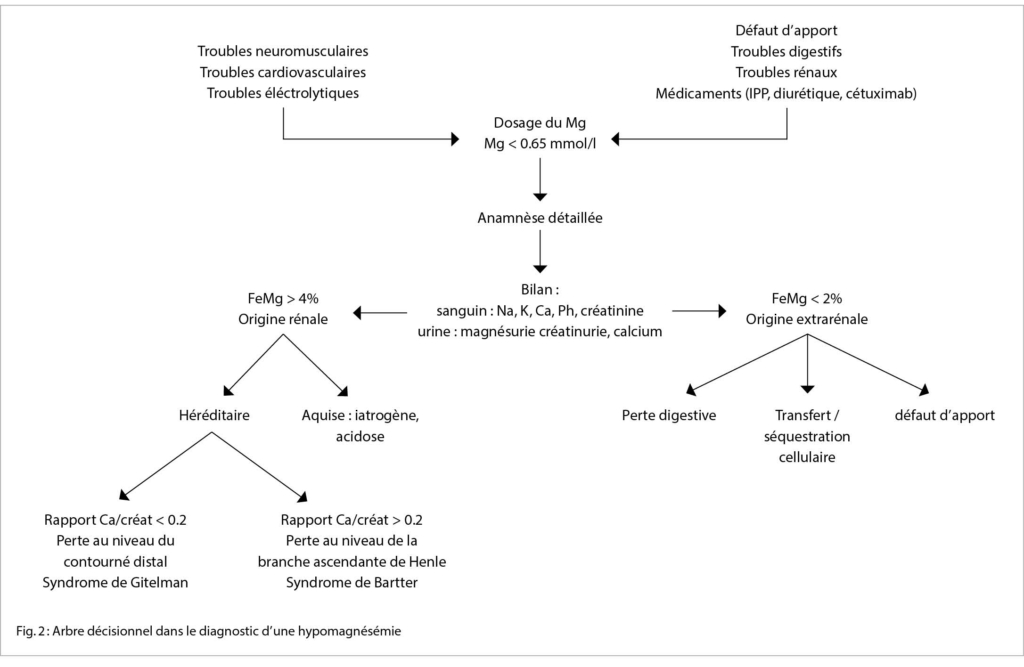
La mesure du Mg sérique est simple et peu coûteuse. Une hypomagnésémie est définie par un taux de Mg sérique inférieur à
0.65 mmol/l. Elle est sévère à partir d’ un Mg inférieur à 0.5 mmol/l. Le Mg sérique ne reflète que 1% de la totalité des réserves en Mg. Les réserves intracellulaires en Mg n’ étant pas prises en compte dans l’ estimation du Mg sérique, il peut exister une hypomagnésémie en dépit d’ une magnésémie normale. La magnésémie varie également en fonction des stocks en albumine (15).
Le dosage du Mg intraérythrocytaire pourrait être une valeur plus précise du statut en Mg mais son utilité clinique n’ a jamais été prouvée. Les études faites sur le sujet ont très peu évalué les valeurs du Mg intraérythrocytaire après une substitution ou une déplétion au long cours. De plus le dosage du Mg intraérythrocytaire n’ évalue pas le stock du Mg intramusculaire remettant en question l’ idée d’ un outil plus précis (16).
En cas de doute, une évaluation concomitante du Mg urinaire et sérique permet de confirmer ou d’ infirmer la perte rénale. L’ analyse se fait sur des urines fraîches en calculant la fraction d’ excrétion du magnésium selon la formule ci-après.
Formule de la fraction d’ excrétion en Mg
FeMg = Mg(U) x Cr (S) / (Mg (S) x 0.7 x Cr (U)) x 100
La concentration du Mg est multipliée par 0.7 en raison de sa concentration sous forme libre dans le plasma (70 %) et donc filtrée par le rein.
FeMg : Fraction d’ excrétion du magnésium
U = urinaire , Cr = créatinine , S = sérique.
Selon une analyse de 74 patients avec une hypomagnésémie par perte rénale, la fraction d’ excrétion médiane du Mg était de 15 % (intervalle entre 4-48 %) (17). Ainsi, la plupart des auteurs définissent une perte rénale en magnésium dans le cas de FeMg supérieur à 4 % et une perte extrarénale en cas de FeMg inférieure à 2 % avec une zone grise se situant entre 2 % et 4 %.
Une récolte urinaire sur 24h est également possible mais rarement utilisée. Une excrétion de plus de 2 mmol/24h oriente vers une fuite rénale en Mg.
La méthode la plus précise pour évaluer le statut global en Mg consiste à recourir à un test de charge en perfusant du Mg et à mesurer la concentration en magnésium sur des urines de 24h. Le taux de Mg retenu par l’ organisme augmente en cas de déplétion (18). Cette méthode reste toutefois coûteuse, longue et réservée à la recherche scientifique.
Afin de mieux identifier quelle partie du tubule rénal est en cause dans la perte de Mg, le ratio calcium-créatinine (mmol/mmol) peut être demandé. Cela permet de différencier par exemple le syndrome de Bartter (ratio supérieur à 0.2) du syndrome de Gitelman (ratio inférieur à 0.2) (19) (Fig 2).
Traitement
La base du traitement dépend de la sévérité des symptômes. La première étape consiste à corriger les causes sous-jacentes. Lors d’ hyperaldostéronisme secondaire, l’ ajout d’ un épargneur potassique favorise la réabsorption du magnésium au niveau du tubule distal et du canal collecteur et diminue le risque de torsade de pointe (20).
Pour les symptômes légers à modérés, une substitution orale suffit. Il existe plusieurs préparations à base de Mg avec une charge en magnésium pouvant varier de 5 % à 60 % et une biodisponibilité variant de 4 à 12 % selon les préparations (21). Dans le commerce, on retrouve les sels organiques de Mg (gluconate, aspartate, citrate, carbonate) qui sont mieux tolérés et assimilés que les sels inorganiques (sulfate, chlorure) (21). En l’ absence de recommandations claires pour la substitution orale en magnésium, un traitement de 12 à 15 mmol/j en 2 à 3 fois par jour peut être proposé (22). Les effets indésirables cliniques sont un inconfort abdominal avec nausée et vomissement ainsi que des diarrhées. Cela peut limiter la prise du traitement oral et justifier une substitution par voie intraveineuse. Les indications d’ un traitement intraveineux sont : une hypomagnésémie sévère symptomatique (Mg<0.5 mmol/l), des diarrhées persistantes, une intolérance au traitement oral ou des troubles électrolytiques réfractaires à une substitution orale. La forme la plus utilisée est le sulfate de magnésium (MgSO4). Une dose de 1g de MgSO4 contient environ 4 mmol de Mg induisant une augmentation de la magnésémie d’ environ 0.15 mmol/l. Le (MgSO4) existe sous différentes concentrations de 10 %, 20 % ou 50 % à diluer avec du NaCl 0.9 % ou du glucose 5 % (23).
En cas d’ urgence vitale (torsade de pointes, pré-éclampsie), un bolus de 2g à 4g à diluer avec du NaCl ou du G5 est administré, suivi d’ un traitement de maintenance entre 1 à 3g/h. Dans les autres cas nécessitant une substitution intraveineuse, un consensus existe sur l’ administration de 1g à 2g de MgSO4 en bolus sur 1h, suivie de l’ administration de 4g à 8g sur 12-24h (24). Un suivi selon la sévérité de l’ hypomagnésémie se fera jusqu’ à normalisation des valeurs au laboratoire.
Doit-on toujours explorer et substituer une hypomagnésémie?
Depuis plusieurs années on utilise le Mg pour des cures énergisantes, pour les crampes musculaires, pour le stress. Dans la population jeune et en bonne santé, le rein va s’ adapter et diminuer l’ excrétion du magnésium urinaire. Un dosage et un traitement per os n’ est donc pas utile. Le dosage du Mg doit faire partie du bilan chez les patients souffrant de pathologie ou sous traitement susceptible de générer une carence.
Une anamnèse détaillée associée à un bilan biologique simple permet de retrouver la cause d’ une carence en Mg. Les patients avec une hypomagnésémie doivent bénéficier d’ une supplémentation prudente afin d’ éviter les effets indésirables limitant la compliance thérapeutique.
Copyright Aerzteverlag medinfo AG
Cheffe de clinique adjointe
Service de gériatrie
Hôpital Fribourgeois
Site de Riaz
Rue de l’ Hôpital 9
1632 Riaz
karen.rizk@h-fr.ch
Médecin-chef
Service de la gériatrie aiguë et réadaptation gériatrique
HFR-Riaz
Case postale 70
1632 Riaz
FMH en Médecine Interne
CAS en recherche clinique, MSc in EBHC,
Oxford, Médecin-chef de site – Clinique de Médecine interne, HFR Riaz
hoaphong.phamhuuthien@h-fr.ch
Les auteurs déclarent n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
◆ L’ hypomagnésémie doit être suspectée chez les patients avec un défaut d’ apport, des troubles digestifs et rénales, un traitement à risque ou en cas de manifestation clinique et biologique.
◆ Une anamnèse détaillée associée à des examens de laboratoires
simples permet de retrouver l’ origine de l’ hypomagnésémie. En cas
de doute, les analyses urinaires permettent de différencier une origine rénale d’ une origine extrarénale.
◆ La substitution en Mg varie en fonction de la sévérité des symptômes. Avant toute substitution, la correction de l’ étiologie sous-jacente doit être faite.
1. Huang CL, Kuo E. Mechanism of hypokalemia in magnesium deficiency. J Am Soc Nephrol. 2007 Oct;18(10):2649-52.
2.Schimatschek HF, Rempis R. Prevalence of hypomagnesemia in an unselected German population of 16,000 individuals. Magnes Res. 2001 Dec;14(4):283-90
3. Catalano A, Bellone F, Chilà D, Loddo S, Morabito N, Basile G, Benvenga S, Corica F. Rates of hypomagnesemia and hypermagnesemia in medical settings. Magnes Res. 2021 Feb 1;34(1):1-8
4. De Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. 2015 Jan;95(1):1-46
5. Liamis G, Hoorn EJ, Florentin M, Milionis H. An overview of diagnosis and management of drug-induced hypomagnesemia. Pharmacol Res Perspect. 2021 Aug;9(4):e00829.
6. Fatemi S, Ryzen E, Flores J, Endres DB, Rude RK. Effect of experimental human magnesium depletion on parathyroid hormone secretion and 1,25-dihydroxyvitamin D metabolism. J Clin Endocrinol Metab. 1991 Nov;73(5):1067-72
7.Wäfler M, Zuberbuehler CA (2021) Les apports en micronutriments de la population suisse sont-ils satisfaisants ? Bulletin nutritionnel suisse: pages 115-134
8. Anses (2016) Actualisation des repères du PNNS : Élaboration des références nutritionnelles. Rapports d’ expertise collective. Édition scientifique
9. Srinutta, Thawin MDa; Chewcharat, Api MDa; Takkavatakarn, Kullaya MDa; Praditpornsilpa, Kearkiat MDa; Eiam-Ong, Somchai MDa; Jaber, Bertrand L. MD, MSb,c; Susantitaphong, Paweena MD, PhDa,d,∗ Proton pump inhibitors and hypomagnesemia, Medicine: November 2019 – Volume 98 – Issue 44 – p e1778
10. Türkmen Tugce, Schneider Taverna Christina, Krause Martin Hypomagnésémie induite par le cétuximab Forum Med Suisse. 2021;21(3940):686-688
11. Morton A. Hypomagnesaemia and pregnancy. Obstet Med. 2018;11(2):67-72. doi:10.1177/1753495X17744478
12. Pham PC, Pham PA, Pham SV, Pham PT, Pham PM, Pham PT. Hypomagnesemia: a clinical perspective. Int J Nephrol Renovasc Dis. 2014 Jun 9;7:219-30
13. Viering DHHM, de Baaij JHF, Walsh SB, Kleta R, Bockenhauer D. Genetic causes of hypomagnesemia, a clinical overview. Pediatr Nephrol. 2017 Jul;32(7):1123-1135. doi: 10.1007/s00467-016-3416-3. Epub 2016 May 27.
14. Schlingmann KP, Sassen MC, Weber S, Pechmann U, Kusch K, Pelken L, Lotan D, Syrrou M, Prebble JJ, Cole DE, Metzger DL, Rahman S, Tajima T, Shu SG,Waldegger S, Seyberth HW, Konrad M (2005) Novel TRPM6 mutations in 21 families with primary hypomagnesemia and secondary hypocalcemia. J Am Soc Nephrol 16:3061–3069
15. Kroll MH, Elin RJ. Relationships between magnesium and protein concentrations in serum. Clin Chem. 1985 Feb;31(2):244-6.
16.Workinger JL, Doyle RP, Bortz J. Challenges in the Diagnosis of Magnesium Status. Nutrients. 2018;10(9):1202. Published 2018 Sep 1.
17. Elisaf M, Panteli K, Theodorou J, Siamopoulos KC. Fractional excretion of magnesium in normal subjects and in patients with hypomagnesemia. Magnes Res. 1997 Dec;10(4):315-20.
18.Bielinski RW. Magnésium et activité physique [Magnesium and exercise]. Rev Med Suisse. 2006 Jul 26;2(74):1783-6.
19.Blanchard A, Bockenhauer D, Bolignano D, Calò LA, Cosyns E, Devuyst O, Ellison DH, Karet Frankl FE, Knoers NV, Konrad M, Lin SH, Vargas-Poussou R. Gitelman syndrome: consensus and guidance from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2017 Jan;91(1):24-33
20.Gao X, Peng L, Adhikari CM, Lin J, Zuo Z. Spironolactone reduced arrhythmia and maintained magnesium homeostasis in patients with congestive heart failure. J Card Fail. 2007 Apr;13(3):170-7
21.Mohammad Tinawi. Disorders of Magnesium Metabolism: Hypomagnesemia and Hypermagnesemia. Archives of Clinical and Biomedical Research 4 (2020): 205-220.
22.Minetto D, Serratrice J, Stirnemann J. Le magnésium dans la pratique clinique quotidienne [Magnesium in daily practice]. Rev Med Suisse. 2016 Oct 19;12(535):1761-1765
23.Ayuk J, Gittoes NJ. How should hypomagnesaemia be investigated and treated? Clin Endocrinol (Oxf). 2011 Dec;75(6):743-6.
24.Hansen BA, Bruserud Ø. Hypomagnesemia in critically ill patients. J Intensive Care. 2018 Mar 27;6:21.
la gazette médicale
- Vol. 11
- Ausgabe 3
- Mai 2022