- Chronische Nierenkrankheit
Niereninsuffizienz ist ein wichtiger kardiovaskulärer Risikofaktor, welcher in der neuesten ESC- und AGLA-Risikobeurteilung direkt unabhängig von anderen Risikofaktoren für ein hohes (eGFR 30-60), respektive sehr hohes Risiko (eGFR <30 ml/min/1.73m2) klassifiziert. Die Früherkennung, Identifikation und Progressionshemmung eines Nierenschadens ist deshalb nicht nur wichtig für die Vermeidung einer Nierenersatztherapie, sondern auch zur Vermeidung einer entsprechenden kardiovaskulären Morbidität und Mortalität. Nach der länger zurückliegenden Einführung der ACE-I und ARB kam zur Progressionsverlangsamung in den 2010er Jahren die Korrektur der Azidose hinzu; in der aktuellen Dekade sind nun weitere vielversprechende Substanzklassen auf dem Markt verfügbar: die SGLT2I und ein nichtsteroidaler Mineralokortikoidrezeptor-Antagonist.
Renal insufficiency is an important cardiovascular risk factor, which in the most recent ESC and AGLA risk assessment is classified as high (eGFR 30-60) or very high risk (eGFR <30 ml/min/1.73m2), independent of other risk factors. Early detection, identification, and progression of renal damage is therefore important not only for avoiding renal replacement therapy but also for preventing related cardiovascular morbidity and mortality. Following the more recent introduction of ACE-I and ARB, correction of acidosis was added to progression slowing in the 2010s; in the current decade, additional promising classes of agents are now available on the market: the SGLT2I and a nonsteroidal mineralocorticoid receptor antagonist
Key Words: Renal insufficiency, SGLT inhibitor, nonsteroidal mineralocorticoid receptor antagonist
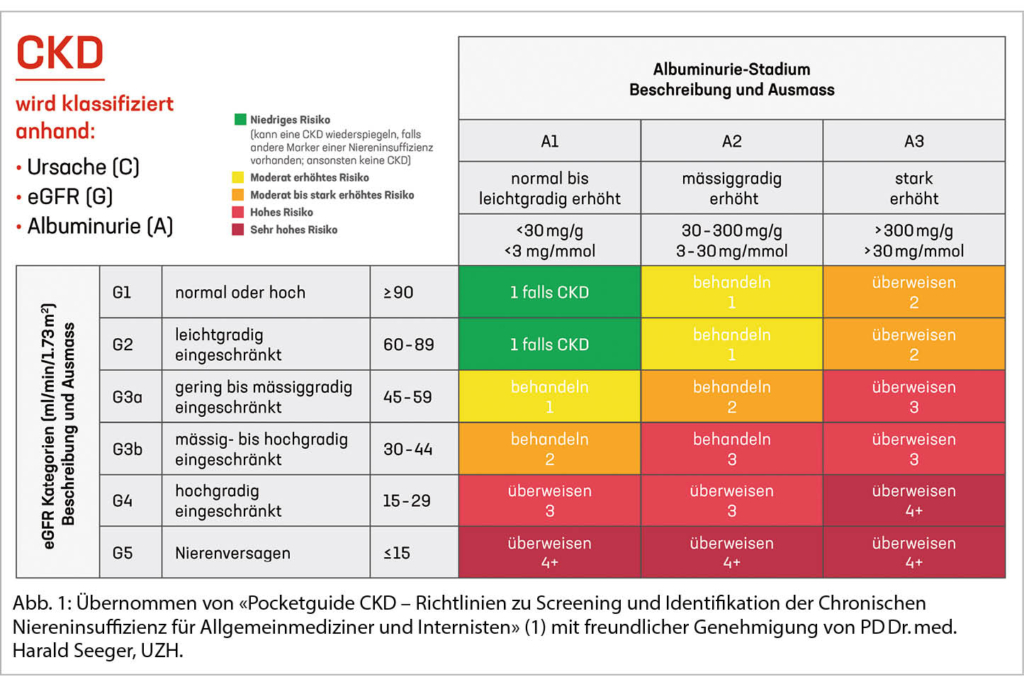
Die Schweizerische Gesellschaft für Nephrologie publizierte neulich einen Pocketguide zum Screening und Identifikation einer CKD. Besonders gefährdete Personen mit arterieller Hypertonie, Diabetes mellitus und Herz Kreislauf Erkrankungen sollten mindestens einmal jährlich auf das Vorliegen einer CKD getestet werden (1). Die CKD Diagnose ist bestätigt, wenn über 3 Monate eine eGFR <60 ml/min/1.73 m2 und/oder eine mässig erhöhte Albuminurie (ACR >30 mg/mmol) nachgewiesen werden kann. Die Abbildung 1 zeigt die CKD-Kategorien anhand von eGFR und Albuminurie, farblich codiert das Risiko für das Fortschreiten der CKD, die Kontrollfrequenz sowie ob eine Überweisung zur nephrologischen Abklärung empfohlen wird.
Da es im Falle einer akuten Nierenschädigung, bei Fieber oder extremer körperlicher Anstrengung zum eGFR-Abfall oder zur reversiblen Proteinurie/Albuminurie kommen kann, wird durch die Frist von mindestens drei Monaten eine frühzeitige CKD-Diagnosestellung vermieden. Bei einem raschen eGFR Verlust oder massiver Proteinurie sollte die Zuweisung zur fachärztlichen Beurteilung jedoch nicht verzögert werden.
Proteinurie und Albuminurie Bestimmung
Traditionell versteht sich unter der Nierenfunktion die glomeruläre Filtration. Die Klassifikation der chronischen Nierenkrankheit basiert jedoch nicht nur auf der renalen Filtrationsfähigkeit, sondern beinhaltet auch den Marker eines glomerulären Schadens, die Albuminurie. Sie ist einer der wichtigsten Prädiktoren für eine Verschlechterung der Nierenfunktion und des Nierenfunktionsverlusts (2). Aus diesem Grund sollte für das Screening und die richtige Einstufung in die CKD-Risiko-Kategorie immer eine Albuminurie quantifiziert werden. Da die 24h Urinsammlung für Patienten aufwändig und oft wegen ungenauer Sammlung schwer zu interpretieren ist, ist empfohlen, die Albuminurie in einer Urinportion gleichzeitig mit Urin-Kreatinin zu messen. Die Albumin-Kreatinin Ratio liefert eine für den klinischen Alltag gut anwendbare Abschätzung der Albuminurie und kann aufgrund der konstanten täglichen Kreatininausscheidung auch zur Verlaufsbeurteilung hinzugezogen werden. Im Falle einer konsistent stark erhöhten Albuminurie (ACR >300mg/mmol) wird eine Überweisung an Nephrologen/in empfohlen.
Bei Abklärung einer Nierenerkrankung lohnt sich immer auch, die gesamt Proteinurie (PCR – Protein-Kreatinin Ratio) analog zur Albumin-Kreatinin Ratio zu bestimmen. Eine grosse Abweichung von diesen zwei Werten weist auf eine nicht-glomeruläre Proteinurie hin, die weiter abgeklärt werden sollte (vor allem wenn PCR >> ACR und PCR >100 mg/mmol).
Metabolische Azidose
Die Aufrechterhaltung des Säuren-Basen-Haushalts ist eine der wichtigsten Rollen der Nieren. Bei chronischer Nierenerkrankung resultiert die verminderte Fähigkeit Säuren auszuscheiden zu einer positiven H+ Bilanz. Der Grund dafür ist vor allem die verminderte renale Ammoniak Ausscheidung; die Ausscheidung von titrierbarer Säure ist erst bei stark eingeschränkter Nierenfunktion (eGFR <15 ml/min/1.73 m2) reduziert (3). Die Prävalenz einer metabolischen Azidose steigt bei eGFR Abnahme <40 ml/min/1.73 m2 (4), wenn die kompensatorische Ammoniak Produktion der verbleibenden Nephrone nicht mehr ausreicht.
Eine metabolische Azidose ist bei CKD-Patienten mit einem erhöhten Todesrisiko sowie anderen negativen Outcomes verbunden (Fortschreiten der CKD, Knochen- und Muskelabbau, Hyperkaliämie). Aus diesem Grund wird gemäss Richtlinien vorgeschlagen, bei CKD eine Behandlung mit oralem Bicarbonat zu etablieren um die Serum Bicarbonat Konzentration >22 mmol/l aufrechtzuhalten (5). Der Benefit einer Behandlung basiert jedoch nur auf Daten kleinerer Studien, es fehlt immer noch an guter Evidenz von grossen randomisierten klinischen Studien. Einige Observationsstudien weisen sogar auf eine U Beziehung zwischen Serum Bicarbonat und Mortalität hin, sodass übermässig hohe Bicarbonat-Werte vermieden werden sollten (6).
Neue renoprotektive Pharmakotherapie
SGLT2I
Der Durchbruch von Hemmern des Natrium-Glukose Transporters 2 (SGLT2I) änderte in den letzten Jahren die Richtlinien in vielen Fachdisziplinen; die Praxisänderung ist vergleichbar mit dem Einzug der Angiotensin-Konvertase Hemmer und Angiotensin-Rezeptorblocker. Bei Personen mit Diabetes mellitus Typ 2 (T2D), CKD und GFR >30 ml/min/1.73 m2 werden SGLT2I als Erstlinientherapie zusammen mit Metformin universell empfohlen (5). Der protektive Effekt von SGLT2I scheint auch bei eGFR <30 ml/min/1.73 m2 erhalten zu bleiben (obwohl im kleineren Ausmass) – im Gegenteil zu Metformin, müssen SGLT2I bei CKD Progression deshalb nicht abgesetzt werden. Der kardiovaskuläre und renoprotektive Effekt von SGLT2I ist durch die bessere Diabetes Einstellung alleine nicht erklärbar. So zeigte die DAPA-CKD Studie, dass auch Patienten ohne T2D profitieren: in dieser Studie wurden Patienten mit CKD (Durchschnitts eGFR 43 ml/min/1.73 m2, median ACR 107 mg/mmol) mit oder ohne T2D (32.5%) für entweder Dapagliflozin oder Placebo randomisiert. Nach einem medianen Follow-up von 2.4 Jahren wurde die Studie wegen klarer Wirksamkeit frühzeitig gestoppt. Dapagliflozin führte zu einem 39% tieferen Risiko (absolute Risikoreduktion 5.3%) des kombinierten primären Endpunktes (eGFR Abnahme um 50%, Nierenfunktionsverlust, Tod aus renalen oder kardiovaskulären Ursachen). Man musste nur 19 Patienten behandeln, um einen primären Endpunkt zu verhindern (Anzahl der notwendigen Behandlungen – NNT (7). Aufgrund dieser überzeugenden Daten wurde Dapagliflozin neulich auch bei Personen mit CKD (eGFR >25 ml/min/1.73 m2) mit/ohne Diabetes als Ergänzungstherapie zu einer maximal tolerierten Dosis von ACE-I oder ARB zugelassen, die Listung auf der Spezialitätenliste wird in Kürze erwartet. Ähnlich wie bei ACE-I oder ARB können SGT2I initial einen leichten eGFR Abfall verursachen; dieser ist meistens funktionell, hämodynamisch bedingt und deshalb reversibel und sollte nicht zum Absetzen von SGLT2I führen. Zu den häufigsten Nebenwirkungen von SGLT2I zählen genitale Mykosen; einige Studien haben auch ein erhöhtes Risiko von Amputation der unteren Extremitäten aufgezeichnet. Eine seltene Komplikation der SGLT2I-Therapie ist die (euglykämische) diabetische Ketoazidose, die vor allem bei Stresszuständen mit einer verminderten Kohlenhydratzufuhr vorkommen kann (CAVE Operationen), weshalb bei SGLT2I, wie auch bei Metformin «sick day rules» gelten und die Therapie vorübergehend pausiert werden sollte.
Finerenon
Der nichtsteroidale Antagonist des Mineralokortikoidrezeptors Finerenon hat sich als ein neues Medikament zur Verzögerung der CKD Progression bei Patienten mit T2D in zwei grossen doppelt-randomisierten Studien bewährt (FIDELIO-DKD und FIGARO-DKD). In FIDELIO-DKD führte Finerenon zu einem um 18% reduzierten Risiko (absolute Risikoreduktion 3.3%) den primären renalen Endpunkt zu erreichen (Nierenversagen, eGFR Abnahme von 40% und Tod aus renaler Ursache). Die Anzahl der notwendigen Behandlungen (NNT) um einen primären Endpunkt zu verhindern beträgt 30 (7). In der am kardiovaskulären Risiko orientierten FIGARO-DKD Studie zeigte die Finerenon Gruppe ein um 13% tieferes Risiko (absolute Risikoreduktion 1.8%) eines kombinierten primären Endpunktes (kardiovaskulärer Tod, nicht-fataler Myokard Infarkt und Schlaganfall oder Hospitalisation für Herzversagen). Die Anzahl der notwendigen Behandlungen (NNT) um einen primären Endpunkt zu verhindern beträgt hier 56 (8). Erwartungsgemäss wurde in der Finerenon Gruppe öfters eine Hyperkaliämie beobachtet. Eine Listung auf der Spezialitätenliste durch das BAG ist noch nicht erfolgt.
Abkürzungen:
ACE-I: Angiotensin-Converting-Enzym-Hemmer
ACR: Albumin-Kreatinin Ratio
ARB: Angiotensin 1-Rezeptorblocker
CKD: Chronic Kidney Disease, chronische Nierenkrankheit
eGFR: estimated Glomerular Filtration Rate
NNT: Number Needed to Treat, Anzahl der notwendigen Behandlungen
PCR: Protein-Kreatinin Ratio
SGLT2I: Hemmer des Natrium-Glukose Transporters 2
T2D: Diabetes mellitus Typ 2
Copyright bei Aerzteverlag medinfo AG
Assistenzarzt
Klinik für Nephrologie und Transplantationsmedizin
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
dusan.harmacek@kssg.ch
Leitender Arzt
Klinik für Nephrologie und Transplantationsmedizin
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
christian.bucher@kssg.ch
Die Klinik für Nephrologie und Transplantationsmedizin war Untersuchungszentrum der beiden Finerenone-CKD Studien und empfing Beratungshonorare von Astra Zeneca AG. C.B. vertrat die Klinik (Advisoryboard Dapagliflozin), empfing keine Gelder.
◆ Es ist wichtig, das Auftreten einer CKD zu verhindern, eine CKD
frühzeitig zu erkennen und Patienten mit CKD optimal zu betreuen.
◆ Zur Diagnose einer CKD und zum Screening bei Risikopersonen wird neben der eGFR immer eine Albuminurie mitbestimmt.
◆ Etablierte Therapien um das Fortschreiten einer CKD zu verhindern respektive zu verlangsamen: RAAS-Blocker bei ACR >3 mg/mmol
und NaBicarbonat zur Korrektur der Azidose bei Serumbicarbonat
<22 mmol/l.
◆ Neu soll bei eGFR >25 ml/min ein für CKD zugelassener SGLT2I
eingesetzt werden mit oder ohne Diabetes mellitus Typ 2.
◆ Finerenon kann bei Typ 2 Diabetikern erwogen werden.
1. Seeger H, de Seigneux S, Cippà P. Pocketguide CKD – Richtlinien zu Screening und Identifikation der Chronischen Niereninsuffizienz für Allgemeinmediziner und Internisten [Internet]. 2021; [Abgerufen am 06.03.2022].
Erhältlich unter: https://www.swissnephrology.ch/wp/wp-content/uploads/
2021/11/161121_SGN_Pocketguide_CKD_Web_A4_d.pdf
2. Packham DK, Alves TP, Dwyer JP, Atkins R, de Zeeuw D, Cooper M, et al. Relative Incidence of ESRD Versus Cardiovascular Mortality in Proteinuric Type 2 Diabetes and Nephropathy: Results From the DIAMETRIC (Diabetes Mellitus Treatment for Renal Insufficiency Consortium) Database. Am J Kidney Dis. 2012 Jan;59(1):7
5–83.
3. Raphael KL. Metabolic Acidosis in CKD: Core Curriculum 2019. Am J Kidney Dis. 2019 Aug;74(2):263–75.
4. Moranne O, Froissart M, Rossert J, Gauci C, Boffa J-J, Haymann JP, et al.
Timing of Onset of CKD-Related Metabolic Complications. J Am Soc Nephrol. 2009 Jan;20(1):164–71.
5. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management
of Chronic Kidney Disease. Kidney Int Suppl. 2013 Jan;3(1):1–150.
6. Kovesdy CP, Anderson JE, Kalantar-Zadeh K. Association of serum bicarbonate
levels with mortality in patients with non-dialysis-dependent CKD. Nephrol Dial Transplant. 2008 Dec 4;24(4):1232–7.
7. Heerspink HJL, Stefánsson B V., Correa-Rotter R, Chertow GM, Greene T,
Hou F-F, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl
J Med. 2020 Oct 8;383(15):1436–46.
8. Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, et al. Effect of
Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl
J Med. 2020 Dec 3;383(23):2219–29.
9. Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl
J Med. 2021 Dec 9;385(24):2252–63.
der informierte @rzt
- Vol. 12
- Ausgabe 6
- Juni 2022