- Eindrücke und Highlights vom ASCO Chicago 2022
Wichtige Highlights aus den tausenden Abstracts und hunderten von Präsentationen sind bereits in den Topjounals wie dem NEJM erschienen, wo sie ja nicht uneigennützig und durchaus börsenwirksam zeitgleich zur ASCO in den ersten Juni Ausgaben publiziert wurden. Als Gesamteindruck ist mir noch aufgefallen, dass die Diskussionen teilweise etwas harmlos und kürzer als früher waren (wobei wir nicht wussten, was noch im Netz an Fragen anstand) und viele Sitzungen von Frauen verschiedenster Provenienzen und eher jüngeren Alters sehr eloquent und fair geführt wurden. Die Zeit der Dominanz der alten immer gleichen weissen Onkologen ist endgültig vorbei und dies ist eine erfreuliche Entwicklung des ASCO.
Auch ist gegenüber früher die Vielzahl von randomisierten Phase 2 Studien auf Kosten der klassischen randomisierten Phase 3 Studien mit klinisch relevanten Endpunkten wie Overall Survival aufgefallen. Nicht unerwartet ist dann das Verdikt der Kommentatorinnen zur Frage «is it practice changing?»: mehrheitlich «no or may be!». Firmen erobern den Markt immer mehr mit frühen unreifen Daten und Surrogatmarkern und die aufwändigen teuren Phase 3 Studien werden zunehmend der akademischen klinischen Forschung überlassen.
In der sonntäglichen Plenary Session an Pfingsten wurde wie gewohnt eine ausgewogene Selektion von wichtigen klinischen Daten präsentiert und kompetent kommentiert. So wurde der japanische PARADIGM Trial mit dem Titel:
«LBA1: Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial.»
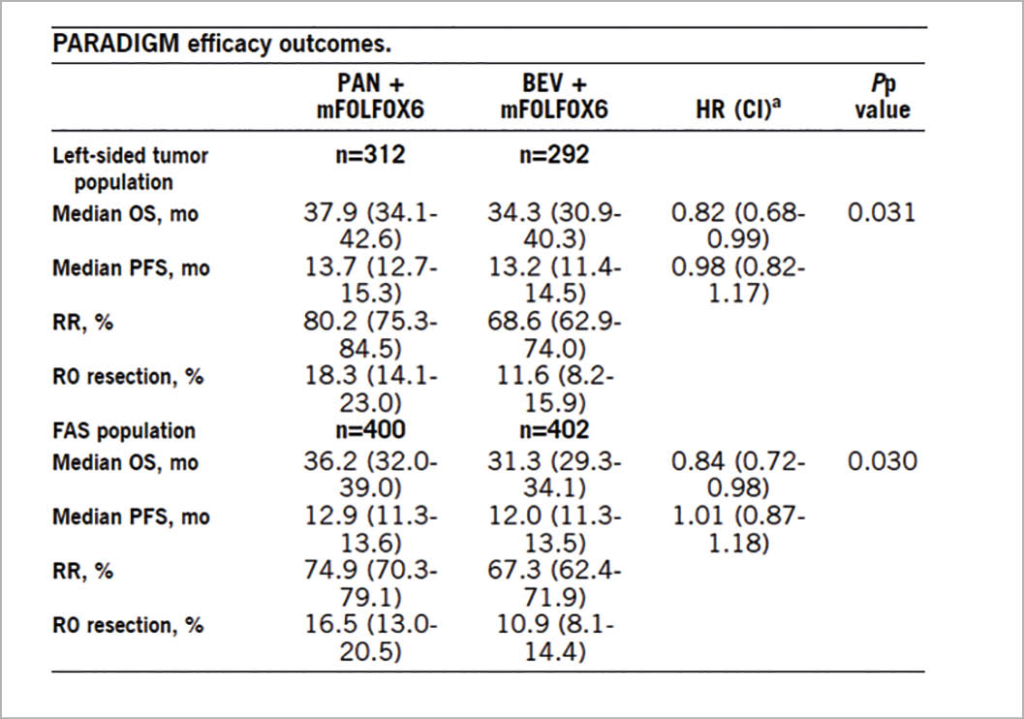
vorgestellt, bei dem 823 Patienten mit lokal fortgeschrittenem oder metastasierendem kolorektalem Karzinom mit RAS Wild Typ in einer grossen Phase 3 Studie randomisiert wurden in Panitumumab mit mFOLFOX6 oder Bevazizumab mit mFOLFOX6. OS war der primäre Endpunkt und sekundär wurden PFS, OR und die kurative Resektionsrate (R0) untersucht. Der mediane Follow-Up betrug 61 Monate. Die Auswertung für die linksseitigen Karzinome und die Gesamtpopulation sind in der folgenden Tabelle zusammengefasst:
Die Autoren fassten zusammen, dass zwar das PFS in beiden randomisierten Gruppen, also sowohl linksseitige wie alle Fälle keinen Unterschied zwischen den beiden Behandlungen zeigte, dass aber im Panitumumab Arm Patienten mit einem linksseitigen Kolonkarzinom ein besseres Ansprechen und eine höhere Resektionsrate zeigten. Auch war das OS in der Panitumumab Gruppe um knapp 4 Monate besser für Patienten mit linksseitigem Primärtumor und dieser Vorteil war auch für die Gesamtpopulation der mit Panitumumab behandelten Patienten noch vorhanden. Da aber >70% der untersuchten Patienten mit linksseitigem Primärtumor eingeschlossen wurden, ist der OS Vorteil für die kleine Gruppe mit rechtseitigem Primärtumor als Teil der Gesamtpopulation statistisch nicht gesichert. Es wird somit empfohlen, Patienten mit linksseitigem Kolonkarzinom und RAS Wild Typ zukünftig mit der Kombination Panitumumab + mFOLFOX6 zu behandeln.
Die Kinderonkologen haben eine internationale Phase 3 Studie für Kinder und Jugendliche mit einem rezidivierenden oder refräktären Ewingsarkom vorgestellt, wo sie Hochdosis Ifosfamid und Topotecan/Cyclophosphamid vorgestellt haben. Der Titel der Studie lautet:
«LBA2: Phase III assessment of topotecan and cyclophosphamide and high-dose ifosfamide in rEECur: An international randomized controlled trial of chemotherapy for the treatment of recurrent and primary refractory Ewing sarcoma (RR-ES).»
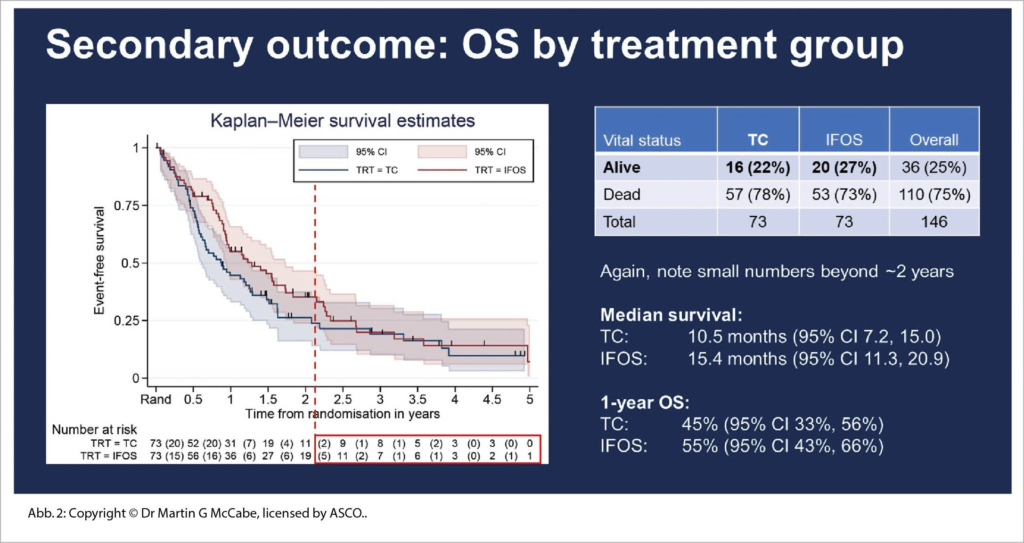
Während 10 Jahren wurden diese Fälle weltweit akquiriert, dokumentiert und ausgewertet und schon dies ist eine tolle Leistung der akademisch-pädiatrischen klinischen Forschung. Patienten (4-50 Jahre) konnten eingeschlossen werden. Multiple paarweise wurden verglichen Topotecan/Cyclophosphamid (TC), Irinotecan/Temozolomid (IT), Gemcitiabine/Docetaxel (GD) versus High-Dose Ifosfamide. Primärer Endpunkt war das EFS, sekundäre Endpunkte waren OS, QoL und Toxizität. Durch multiples Testen wurde bald gezeigt, dass das Ansprechen bei IT und GD inferior war zu TC und HD-Ifos. So wurde die Phase 3 verglichen mit TC versus HD-Ifos. Hier zeigte sich ein klarer 5 Monate OS Gewinn für HD-Ifos (Abb. 2).
Spannend war auch die Phase 3 Studie, welche für sehr viele Patienten mit verschiedenen Her2 niedrig exprimierenden Malignomen ein Therapiefenster öffnet, welches sich für viele Patienten mit HER2-niedrig Expression als wertvoll erweisen könnte. Bereits am ESMO wurde die DESTINY-Breast03 Studie vorgestellt, welche bei rezidivierten oder resistenten HER2+ Patientinnen eine eindrückliche Wirksamkeit gezeigt hatte (HR=0,28; 12-Monats-PFS-Rate 75,8% vs. 34,1%). Trastuzumab Deruxtecan (T-DXd) ist ein therapeutisches Antikörper-Drug-Konjugat (ADC) mit einem Topoisomerase1-Inhibitor Deruxtecan am HER2 Antikörper-linker gekoppelt und ist bereits zugelassen als Monotherapie zur Behandlung von Patientinnen mit inoperablem oder metastasiertem HER2-positivem (HER2+) Brustkrebs, die mindestens 2 Anti-HER2 Therapien erhalten haben.
Die nun am ASCO erstmals vorgestellten DESTINY-Breast04 Studie hat den Titel:
«LBA3: Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): Results of DESTINY-Breast04, a randomized, phase 3 study.»
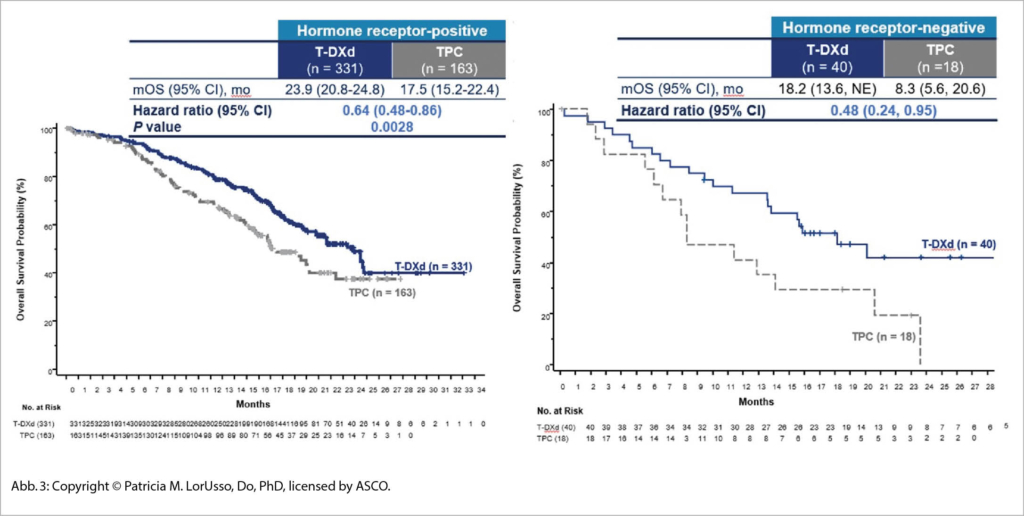
Primärer Endpunkt war das PFS bei Patientinnen mit HR+ HER2-low-Tumoren, weitere sekundäre Endpunkte das PFS bei allen Patientinnen sowie das OS bei HR+ Tumoren und der Gesamtgruppe. Es wurden 557 Patientinnen aus Europa, Amerika und Asien behandelt und 2:1 randomisiert.
Die klinischen Resultate sind eindrücklich mit einem medianen OS Vorteil von +10 Monaten, was am ASCO zu einem langanhaltenden Applaus geführt hat. Immerhin sind ca 55% der Frauen mit metastasierendem Brustkrebs HER2 negativ und exprimieren HER2 nur gering (ICH 1+ oder ICH 2+/ISH- nach ASCO/CAP 2018 Guidelines) mit einem bisher sehr unbefriedigenden Ansprechen auf Chemotherapie. Hier ist nun ein neue sehr wirksame Therapieoption vorhanden in einer klassischen «unmet need» Situation, welche wohl auch vielen anderen HER2 low expressers eine Option bieten könnte, wie laufende Studien aber erst noch zeigen müssen (Abb. 3).
Nausea (73% alle Grade, 5% Grad >3) war die häufigste Nebenwirkung. Lungentoxizität als interstitielle Lungenerkrankung/Pneumonitis (aus der DeSTINY-Breast03 Studie bereits bekannt) zeigte sich in 12,1% der Fälle, davon 3 Todesfälle (0,8%) und ist ein relevantes Problem, welches engmaschige Überwachung und gegebenenfalls frühe Massnahmen erfordert. Hier ist noch einiges zu tun, um diese Lungentoxizität besser zu verstehen und besser angehen oder verhindern zu können.
Die letzte in der Plenary Session vorgestellte Studie betraf das Multiple Myelom, bei dem in den letzten 10 Jahren bereits enorme Fortschritte erzielt werden konnten. Der Titel lautet:
«LBA4: Lenalidomide, bortezomib, and dexamethasone (RVd) ± autologous stem cell transplantation (ASCT) and R maintenance to progression for newly diagnosed multiple myeloma (NDMM): The phase 3 DETERMINATION trial.»
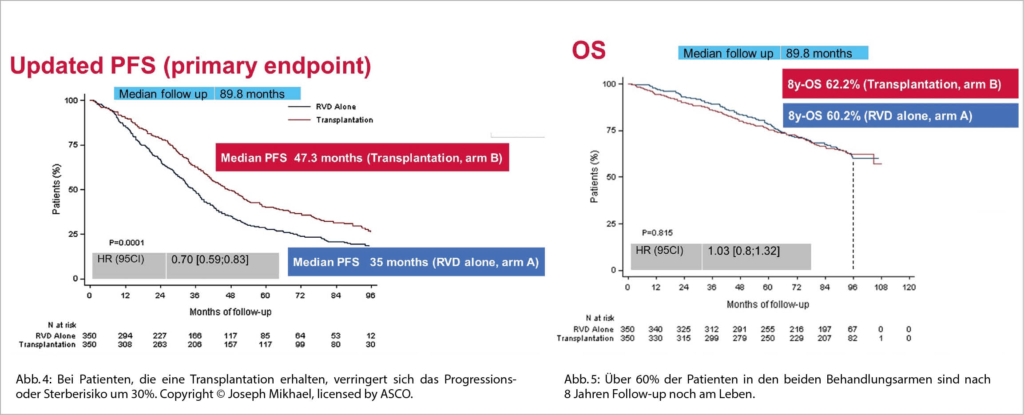
Wir wissen bereits aus der 2017 im NEJM publizierten Studie der IFM, dass nach einer upfront Induktions-Therapie mit RVd + ASCT vs. RVd und einer Erhaltungstherapie mit Revlimid während einem Jahr das PFS verbessert wird durch die ASCT (median, 35.0 vs. 47.3 Monate) aber nach 7 Jahren medianem follow-up zu keiner OS Verbesserung führte. Eine offene Frage wurde nun in dieser US DETERMINATION phase 3 Studie untersucht, nämlich ob eine anhaltende Erhaltungstherapie mit Revlimid bis zur Progression statt nur für ein Jahr doch einen OS Vorteil bewirken würde? Die Resultate wurden parallel im NEJM publiziert.
Es wurden total 722 Patienten, Alter 18-65 Jahre (median 57Jahre in den USA (46 Zentren) eingeschlossen und randomisiert in die beiden Behandlungsarme VRD (2-3 Zyklen VRD, Stammzellmobilisierung und weitere 5 Zyklen VRD; n=357) oder VRD + ASCT (2-3 Zyklen VRD, Stammzellmobilisierung Melphalan 200 mg/m2 + ASCT , dann 2 Zyklen VRD; n=365) und in beiden Fällen mit einer Len-Erhaltungstherapie bis zum Progress oder inakzeptabler Toxizität weiterbehandelt.
Grad 3 Toxizitäten waren im Transplantationsarm erwartet häufiger (94,2% vs. 78,2%), mit vorab 60,5% vs. 89,9% hämatologischen Nebenwirkungen. Während der ASCT verschlechterte sich vorübergehend die Lebensqualität der Patienten für ca 3 Monate. Die Sekundärmalignomen Rate war in beiden Armen vergleichbar (10,81% in der VRD + ASCT- und 9,7% in der VRD-Gruppe) was auch den Daten der IFM2009/DFCI-Studie entspricht. Allerdings wurden nach ASCT mehr sekundäre AML und MDS diagnostiziert.
Die Daten zeigen aber auch, dass das PFS mit einer bis zur Progression durchgeführten Len-Erhaltung gegenüber den Daten der IMF Studie mit nur einem Jahr Lenalidomid deutlich verbessert wurden (Abb. 4 und 5).
Insgesamt stellen sich nun viele Fragen angesichts der vielen neuen hochwirksamen Substanzen und Therapieverfahren, die in hoher Kadenz neu zugelassen wurden: wird die ASCT in Zukunft noch nötig sein? Werden Quadrupeltherapien mit zB Daratumumab upfront oder frühem Einsatz von CART’s bessere OS-Daten liefern? Wird die Erhaltungstherapie noch nötig sein? Welche Rolle spielen die bekannten Risikofaktoren bei den neuen Therapien?
Hier werden viele Jahre vergehen, bis die permutativen Optionen in Phase 3 Studien befriedigend untersucht sind angesichts der immer besseren Prognose der Myelom Patienten. Dies heisst für uns klar: internationale Phase 3 Studien sind die beste Antwort für die
Patienten der Zukunft.
In einer gesonderten Beilage werden wir im Sommer, wie alle Jahre, wieder besonders relevante Abstracts des ASCO 2022 aus allen Gebieten zusammenfassen.
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch