- Therapie von Patienten mit Knochenmetastasen mit Denosumab (XGEVA®)
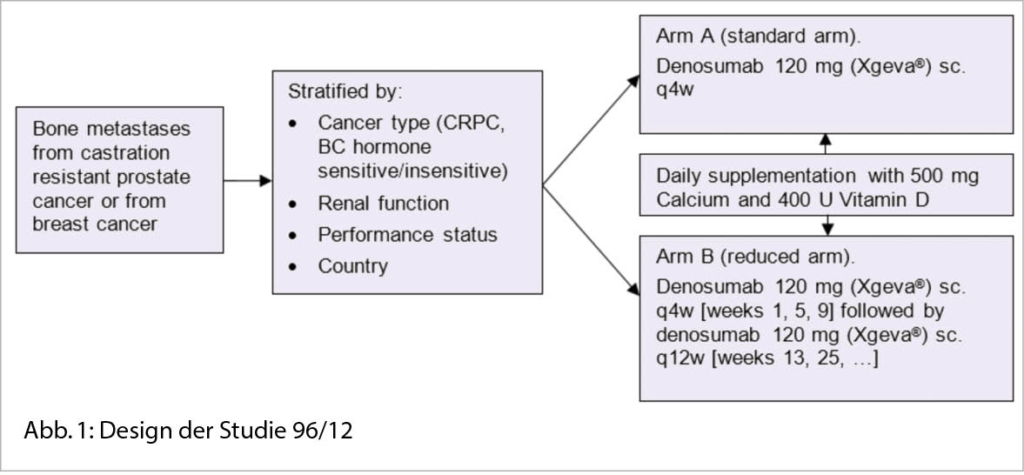
Therapie von Patienten mit Knochenmetastasen mit XGEVA® zur Verhinderung von symptomatischen Komplikationen am Skelett mit Denosumab 120 mg, verabreicht alle 4 Wochen gegenüber alle 12 Wochen.
Knochenmetastasen, die Ausbreitung der Krebserkrankung auf den Knochen, sind eine häufige Komplikation bei Patienten mit fortgeschrittener Krebserkrankung und werden in der Schweiz bei mehr als 5000 Menschen jährlich neu diagnostiziert. Seit der Marktzulassung im Dezember 2011 wird Denosumab (120 mg; XGEVA®) vermehrt für die Therapie von Patienten mit Knochenmetastasen verwendet.
Das Projekt SAKK 96/12 soll zeigen, dass eine weniger häufige Dosierung des Medikaments mindestens gleich wirksam ist wie die zugelassene Standarddosierung. Das Projekt wurde lanciert, weil Studiendaten nahelegen, die zugelassene Therapie mit XGEVA® hinsichtlich Dosierung, Toxizität und Kosten-Nutzen-Verhältnis zu hinterfragen. Neben der Wirksamkeit werden auch Nebenwirkungen und Lebensqualität genau beobachtet, da angenommen wird, dass eine weniger häufige Verabreichung insgesamt zu weniger Nebenwirkungen und somit auch zu einer besseren Lebensqualität führt. Erste Daten haben gezeigt, dass bei der 12 wöchentlichen Gabe deutlich weniger Hypokalziämien auftreten. Aktuell sind 1236 von 1380 Patienten in die Studie eingeschlossen.
Da die steigenden Kosten im Gesundheitswesen und die Kosteneffizienz medizinischer Behandlungen zu immer grösseren gesellschaftlichen Herausforderungen führen, besteht ein weiteres Ziel dieses Projektes darin, gesundheitsökonomische Aspekte zu untersuchen. Das Projekt SAKK 96/12 wird in Zusammenarbeit mit den Krankenversicherern durchgeführt.
Diese Studie wird unterstützt von: Stiftung Krebsbekämpfung, Santésuisse, Helsana, CSS, Swiss Cancer Foundation, Alfred und Anneliese Sutter-Stöttner Stiftung und Staatssekretariat für Bildung, Forschung und Innovation SBFI.
Studientitel: Prevention of Symptomatic Skeletal Events with Denosumab Administered every 4 Weeks versus every 12 Weeks – A Non-Inferiority Phase III Trial
Teilnehmende Zentren: An dieser Studie nehmen mehrere Zentren in der Schweiz und im Ausland teil. Bitte finden Sie weitere Informationen hierzu auf der SAKK Webseite: https://www.sakk.ch/de/studien
Coordinating Investigator: Prof. Dr. med. Roger von Moos, Kantonsspital Graubünden, roger.vonmoos@ksgr.ch.
Clinical Project Manager: Corinne Schär (corinne.schaer@sakk.ch) und Simone Wyss (simone.wyss@sakk.ch), SAKK Kompetenzzentrum Bern.
Direktor Tumor- und Forschungszentrum
Kantonsspital Graubünden
7000 Chur
tumorzentrum@ksgr.ch