- PD-L1 Expression als Biomarker beim Urothelkarzinom: Literaturreview
Immuncheckpoint-Inhibitoren haben die Behandlung des fortgeschrittenen Urothelkarzinoms grundlegend verändert. Über den PD-1/PD-L1 (programmed death protein 1/programmed death-ligand 1) Signalweg entziehen sich Tumorzellen der Antwort des Immunsystems und wachsen ungehindert, weshalb sich PD-L1 als Target für eine Antikörper-Immuntherapie herauskristallisiert hat. Im Zuge dieser Entwicklung hat sich die PD-L1 Expression als möglicher prädiktiver Biomarker angeboten. In diesem Artikel soll die Eignung der PD-L1 Expression als prädiktiver Biomarker beim Urothelkarzinom anhand der Zulassungsstudien [1-12] von Immuncheckpoint-Inhibitoren untersucht werden.
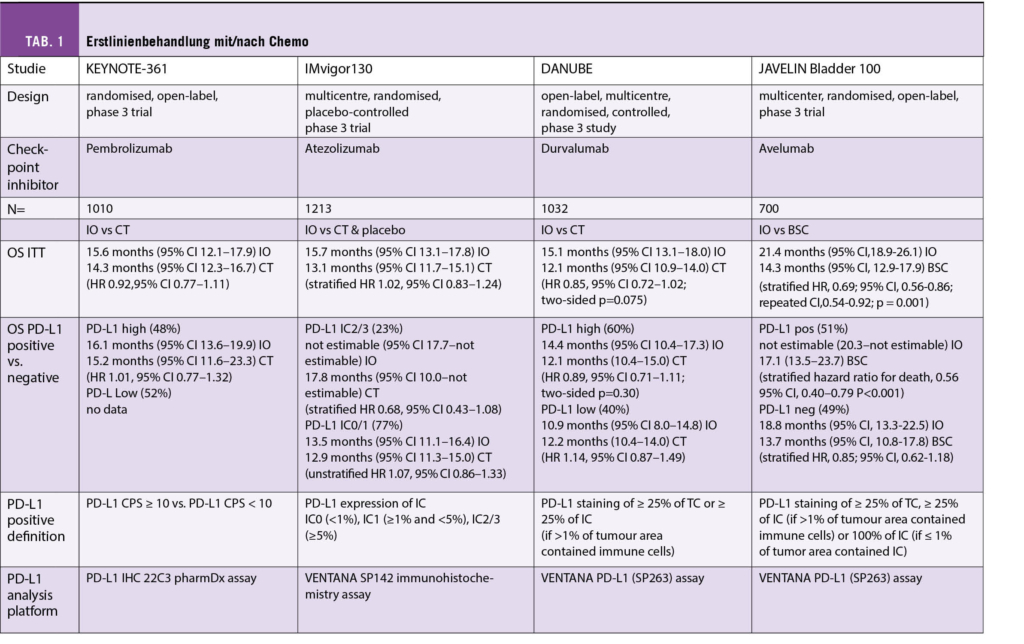
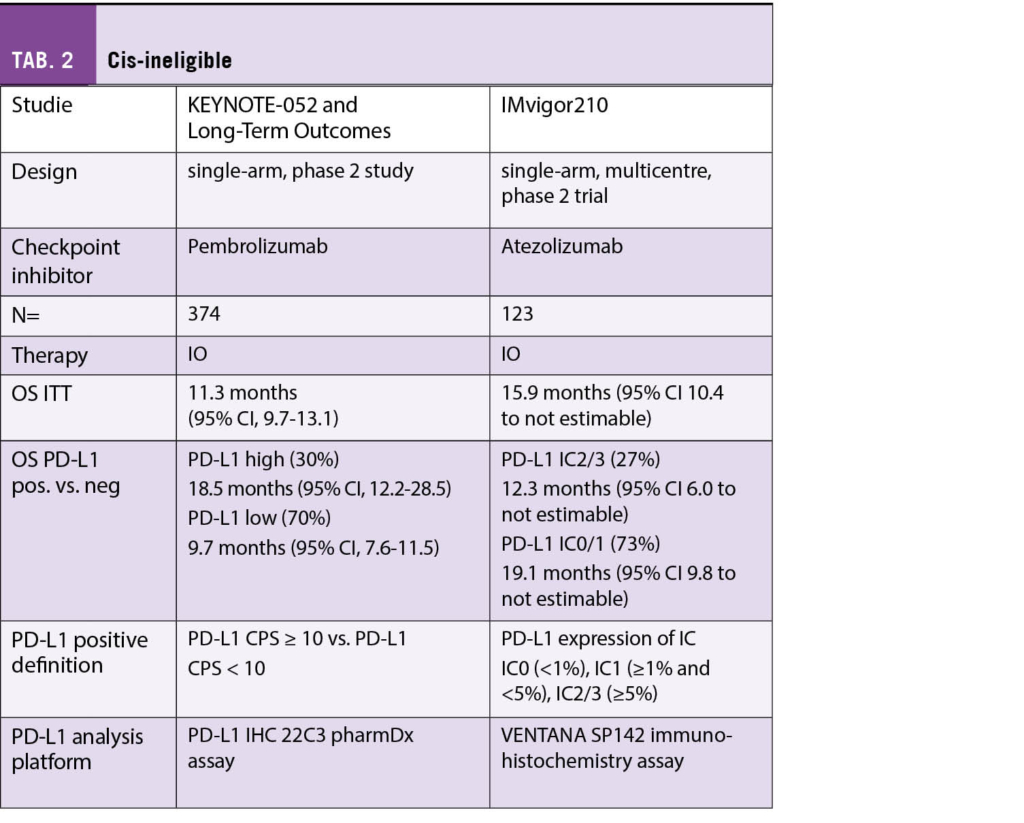
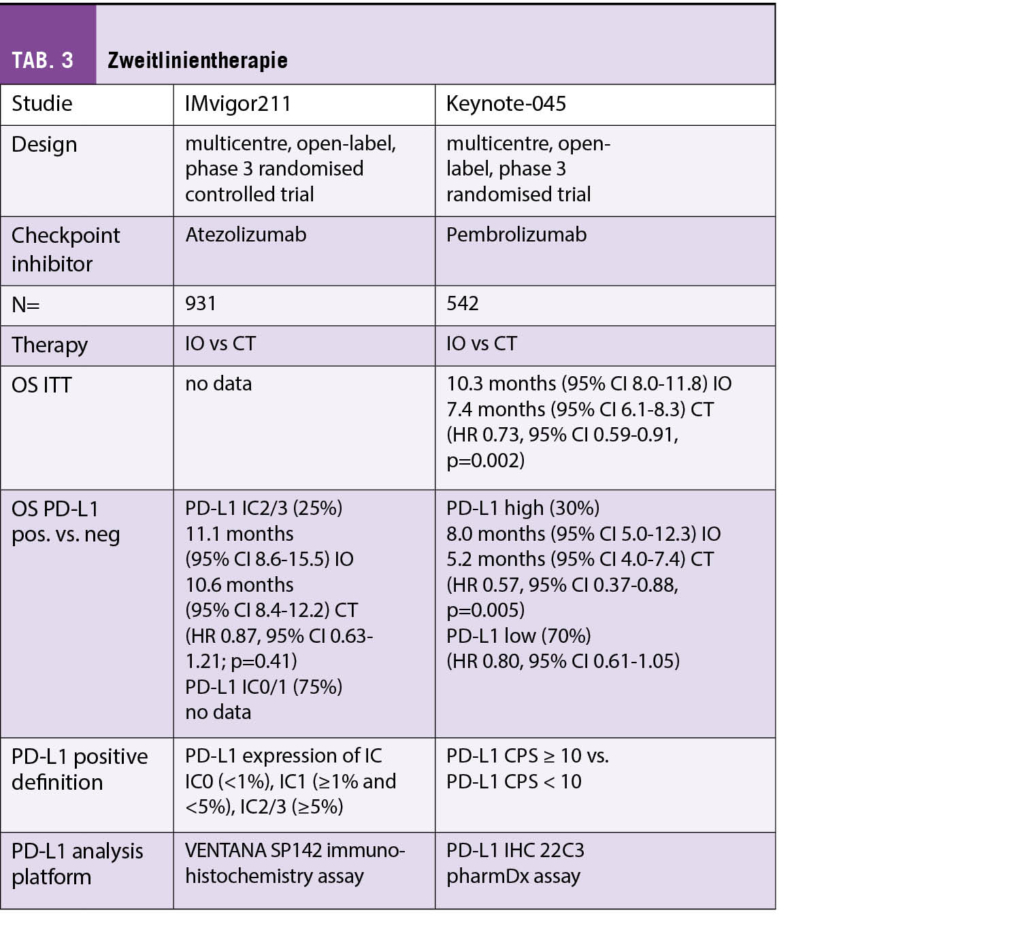
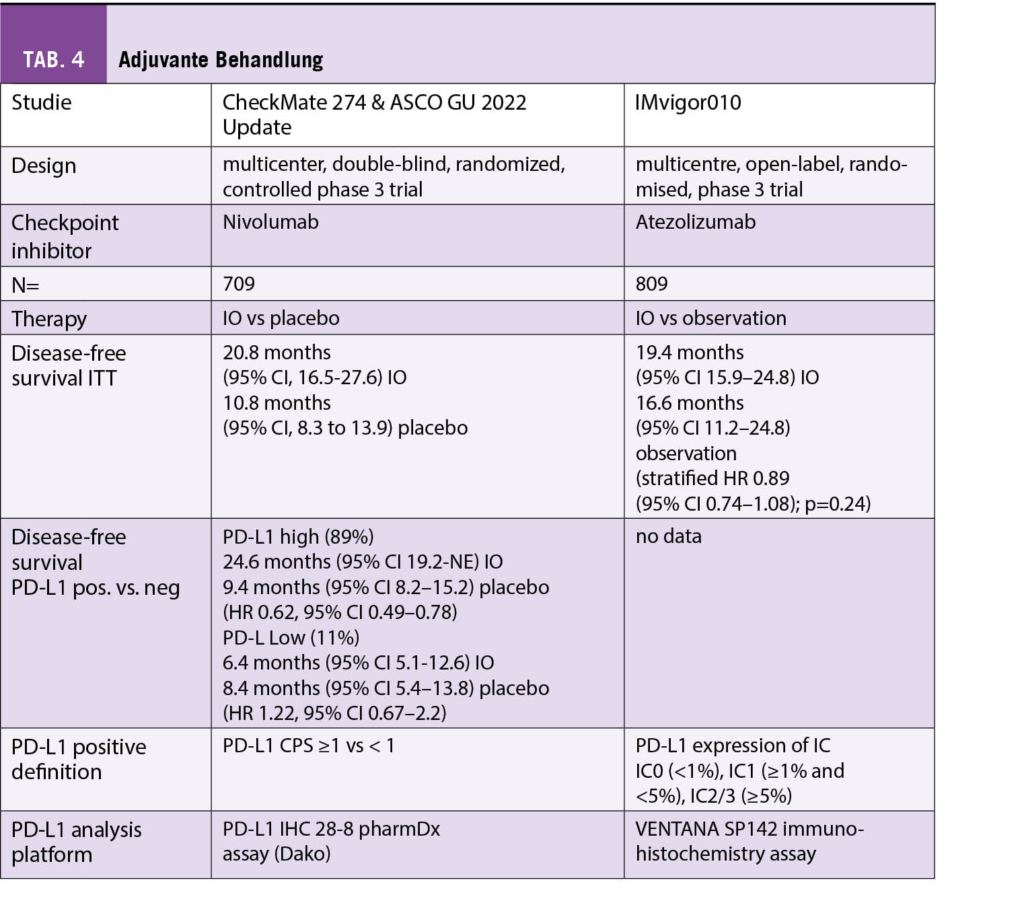
Zur Übersicht sind die verwendeten Studien tabellarisch zusammengefasst. Vorab sei darauf hingewiesen, dass für jeden der geprüften Checkpoint-Inhibitoren (Atezolizumab, Avelumab, Durvalumab, Nivolumab und Pembrolizumab) ein anderes Testkit sowie Definition (Ausmass Positivität von Tumorzellen oder Immunzellen) zur Evaluation des PD-L1 Expressionsstatus verwendet wurde. Die Unterschiede sind in der Tabelle ersichtlich.
Erstlinientherapie
Beim Einsatz der Immuntherapie als Erstlinientherapie (als Monotherapie oder Kombination) im metastasierten Stadium zeigte sich kein signifikanter Vorteil im Hinblick auf das Gesamtüberleben (OS, overall survival) (KEYNOTE-361 [1], IMvigor130 [2], DANUBE [3]). Jedoch konnte die Erhaltungstherapie mit Avelumab einen signifikanten OS Benefit zeigen, wobei die Behandlung nach Ansprechen auf eine vorher durchgeführte Chemotherapie gegeben wurde (JAVELIN Bladder 100 [4]). Patienten mit hoher PD-L1 Expression zeigten sich hinsichtlich des Gesamtüberlebens identisch wie die entsprechende ITT (intention-to-treat) Gruppe. In keiner Studie wurde ein Unterschied zwischen Patienten mit unterschiedlicher PD-L1 Expression gefunden (fehlende Daten für die KEYNOTE 361 Studie) (Tab. 1).
Erstlinientherapie «Cisplatin-ineligible» Patienten
Anders stellt sich die Situation bei Patienten dar, die nicht für eine Therapie mit Cisplatin in Frage kommen: Zwei single-arm Studien zeigten widersprüchliche Resultate; PD-L1 positive Patienten, welche Pembrolizumab [5, 6] erhielten, zeigten ein längeres Überleben als PD-L1 negative Patienten, wohingegen in der Studie, in welcher Atezolizumab [7] verwendet wurde, kein Unterschied festgestellt wurde (Tab. 2).
Zweitlinientherapie
Beim fortgeschrittenen oder metastasierten Urothelkarzinom zeigte Atezolizumab keine Verbesserung hinsichtlich des Gesamtüberlebens für die Gruppe der PD-L1 positiven Patienten [8]. Demgegenüber profitierten Patienten von einer Zweitlinientherapie mit Pembrolizumab im Gesamtüberleben [9, 10]. Der PD-L1 Status spielte dabei jedoch keine Rolle (Tab. 3).
Adjuvante Therapie
Für die untersuchten zwei Studien, welche Immuncheckpoint-Inhibitoren als adjuvante Therapie einsetzten (CheckMate 274 [11], IMvigor010 [12]), liegen keine Gesamtüberlebensdaten vor. Nivolumab zeigte gegenüber Placebo ein längeres krankheitsfreies Überleben in der ITT-Gruppe, der Effekt verstärkte sich in der PD-L1 positiven Patientengruppe. Beim Vergleich einer adjuvanten Behandlung mit Atezolizumab versus reiner Beobachtung konnte in keiner Gruppe ein Unterschied hinsichtlich des krankheitsfreien Überlebens festgestellt werden (Tab. 4).
Diskussion von PD-L1 als prädiktiver Marker
Es zeigt sich, dass eine grosse Variabilität in den betrachteten Studien bezüglich des Test-Kits und des Grenzwertes, ab wann eine PD-L1 Positivität vorliegt, existiert. Zudem kann eine vorhergehende Tumor-Therapie einen Einfluss auf die PD-L1 Expression haben [13] und es ist sicher von einer grossen zeitlichen und räumlichen Heterogenität auszugehen.
Die ersten Daten beim metastasierten Urothelkarzinom, welche 2014 publiziert wurden, deuteten darauf hin, dass Patienten mit einer höheren PD-L1 Expression besser auf eine Therapie mit Checkpoint-Inhibitor (in diesem Fall Atezolizumab) ansprechen würden [14]. Die weiteren Studien haben diese Hypothese jedoch widerlegt. Grundsätzlich kann festgehalten werden, dass keine der randomisierten Studien eine prädiktive Aussagekraft für den PD-L1 Status gezeigt hat. Auffallend ist, dass die Aussagekraft des PD-L1-Status in der Erstlinientherapie bei den Phase 2 Single-Arm Studien (bei Cisplatinineligible Patienten) und bei Phase 3 randomisierten Studien gänzlich unterschiedlich ausgefallen ist. Das ist umso bemerkenswerter, als dabei sowohl die gleichen Antikörper (Atezolizumab bzw. Pembrolizumab) als auch das jeweils gleiche Testkit verwendet wurden. Diese Tatsache ist wohl darauf zurückzuführen, dass der PD-L1 Status wohl eine gewisse prognostische jedoch keine prädiktive Aussagekraft hat. Dies bedeutet, dass Patienten mit PD-L1 positiven Tumoren allenfalls ein besseres Outcome haben, jedoch nicht aufgrund der Therapie mit einem Immuncheckpoint-Inhibitor. Eine Studie, welche die Biomarker der JAVELIN Bladder 100 genauer untersuchte, kam zum Schluss, dass die Kombination von PD-L1 und der Tumormutationslast (tumor mutational burden, TMB) einen gewissen prädiktiven Wert haben. Jeder dieser Biomarker für sich alleine genommen würde jedoch einzelne Patienten-Subgruppen verpassen, welche von einer Behandlung profitieren [15]. Gemäss den vorliegenden Daten hilft die PD-L1 Expressionstestung somit nicht zur Therapieentscheidung, trotzdem ist sie aus regulatorischen Gründen notwendig: so sind Atezolizumab und Pembrolizumab in der Erstlinientherapie für «Cisplatin-bwz. Platin-ineligible» Patienten von der EMA (European Medicines Agency) nur bei Nachweis einer PD-L1-Positivität zugelassen. Ebenso ist die adjuvante Therapie mit Nivolumab nur bei PD-L1-Positivität von der EMA und der Swissmedic zugelassen. Bis dato gibt es also keinen geeigneten Biomarker beim Urothelkarzinom, mit welchem das Ansprechen auf eine Therapie mit einem Immuncheckpoint-Inhibitor zuverlässig vorausgesagt werden kann.
Abkürzungen:
OS overall survival; ITT intention to treat; IO immunotherapy;
CT chemotherapy; ICH immunohistochemistry; HR hazard
ratio; CI confidence interval; IC tumor-infiltrating immune cell
Kantonsspital Graubünden
Onkologie / Hämatologie
Loestrasse 170
7000 Chur
Onkologie/Hämatologie
Kantonsspital Graubünden
Loëstrasse 170
7000 Chur
richard.cathomas@ksgr.ch
Dieser Artikel wurde initiiert und finanziert von Pfizer AG und Merck (Schweiz) AG. Der Inhalt wurde von den Autoren unabhängig verfasst. 06/2022
1. Powles, T., et al., Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a
randomised, open-label, phase 3 trial. Lancet Oncol, 2021. 22(7): p. 931-945.
2. Galsky, M.D., et al., Atezolizumab with or without chemotherapy in metastatic
urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet, 2020. 395(10236): p. 1547-1557.
3. Powles, T., et al., Durvalumab alone and durvalumab plus tremelimumab
versus chemotherapy in previously untreated patients with unresectable, locally advanced or metastatic urothelial carcinoma (DANUBE): a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol, 2020. 21(12): p. 1574-1588.
4. Powles, T., et al., Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med, 2020. 383(13): p. 1218-1230.
5. Balar, A.V., et al., First-line pembrolizumab in cisplatin-ineligible patients with
locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol, 2017. 18(11): p. 1483-1492.
6. Vuky, J., et al., Long-Term Outcomes in KEYNOTE-052: Phase II Study Investigating First-Line Pembrolizumab in Cisplatin-Ineligible Patients With Locally Advanced or Metastatic Urothelial Cancer. J Clin Oncol, 2020. 38(23): p. 2658-2666.
7. Balar, A.V., et al., Atezolizumab as first-line treatment in cisplatin-ineligible
patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet, 2017. 389(10064): p. 67-76.
8. Powles, T., et al., Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet, 2018. 391(10122): p. 748-757.
9. Bellmunt, J., et al., Pembrolizumab as Second-Line Therapy for Advanced
Urothelial Carcinoma. N Engl J Med, 2017. 376(11): p. 1015-1026.
10. Fradet, Y., et al., Randomized phase III KEYNOTE-045 trial of pembrolizumab versus paclitaxel, docetaxel, or vinflunine in recurrent advanced urothelial cancer: results of >2 years of follow-up. Ann Oncol, 2019. 30(6): p. 970-976.
11. Bajorin, D.F., et al., Adjuvant Nivolumab versus Placebo in Muscle-Invasive
Urothelial Carcinoma. N Engl J Med, 2021. 384(22): p. 2102-2114.
12. Bellmunt, J., et al., Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol, 2021. 22(4): p. 525-537.
13. Zhang, J., et al., Biochemical Aspects of PD-L1 Regulation in Cancer Immunotherapy. Trends Biochem Sci, 2018. 43(12): p. 1014-1032.
14. Powles, T., et al., MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature, 2014. 515(7528): p. 558-62.
15. Powles, T., et al., Avelumab maintenance in advanced urothelial carcinoma:
biomarker analysis of the phase 3 JAVELIN Bladder 100 trial. Nat Med, 2021. 27(12): p. 2200-2211.
info@onco-suisse
- Vol. 12
- Ausgabe 4
- Juli 2022