- Die zentrale Rolle des Herz-MRI bei kardiologischen Patienten
Die Magnetresonanztomographie (MRI) des Herzens hat in den letzten Jahrzehnten eine vermehrte klinische Anwendung erfahren und ist eine risikoarme, nicht-invasive Methode zur Diagnosestellung, Risikostratifizierung und Verlaufsbeurteilung kardialer Erkrankungen. Die Echokardiographie ist weiterhin das erste und wichtigste Instrument bei der Beurteilung der Herzfunktion, wo hingegen das Herz-MRI bei selektionierten Patienten komplementäre zusätzliche Informationen liefert. Besondere Stärken des Herz-MRI sind neben der exakten Darstellung der kardialen Anatomie und Funktion, die Möglichkeit zur Gewebedifferenzierung mittels Kontrastmittel Aufnahmen und multiparametrischem Mapping. Dadurch können insbesondere inflammatorische und infiltrative Kardiopathien zuverlässig differenziert werden. Ausserdem wird das Herz-MRI zur funktionellen Beurteilung der koronaren Herzkrankheit, von kongenitalen Herzvitien und zur Abklärung bei Herzinsuffizienz gemäss internationalen Leitlinien empfohlen. Es ist davon auszugehen, dass das Herz-MRI in den kommenden Jahren durch die Einführung von schnelleren Bildsequenzen und moderner neuer Massanalysen wie beispielsweise dem 4D-Fluss weiter an Bedeutung gewinnen wird.
Cardiac magnetic resonance imaging (CMR) is a non-invasive modality that has become a cornerstone in the diagnosis, risk stratification and follow-up of several cardiac diseases in the last decades. Echocardiography continues to be the most important tool in the primary evaluation of cardiac function, whereas CMR provides complementary additional information in selected patients. CMR can depict cardiac anatomy and function with high spatial and temporal resolution. Contrast agent application and multiparametric mapping allow for characterization of myocardial tissue. As recommended by international guidelines, CMR has become an important modality in the evaluation of inflammatory and infiltrative cardiomyopathies, coronary artery disease, congenital heart disease and heart failure. The adoption of new techniques such as 4D flow acquisitions into clinical practice might lead to a further increase of clinical use in the future.
Key Words: cardiac magnetic resonance imaging, late gadolinium enhancement, inflammatory cardiomyopathy, coronary artery disease
Einleitung
Die Magnetresonanztomographie (MRI) des Herzens hat sich in den vergangenen Jahren zu einer unverzichtbaren Modalität bei der Diagnostik von Herzerkrankungen entwickelt. Obwohl die Echokardiographie weiterhin die günstigste und am weitesten verbreitete diagnostische Modalität der Kardiologie darstellt, bietet das Herz-MRI bei selektionierten Patienten wichtige Zusatzinformationen. Neben dem Vorteil, dass das Herz-MRI ohne Strahlenbelastung auskommt, ist die nicht-invasive Darstellung von Weichteilgewebe in beliebigen Schnittebenen mit hoher räumlicher und zeitlicher Auflösung einer der Stärken dieser Modalität. Dank der nun flächendeckend verfügbaren MRI Scanner, kann schweizweit Patienten mit kardialen Erkrankungen Zugang zu dieser wichtigen Methode gewährt werden (1). Das Herz-MRI wird von einer Vielzahl internationaler Leitlinien zur Abklärung kardialer Erkrankungen wie der koronaren Herzkrankheit, inflammatorischer Kardiomyopathien, kongentialer Herzvitien oder der Abklärung von Symptomkomplexen wie Herzinsuffizienz empfohlen. Neben der Diagnostik, dient das Herz-MRI zur Risikostratifizierung und zur Therapieplanung von kardialen Erkrankungen, von denen die Wichtigsten im Folgenden näher beleuchtet werden (2-7).
Grundlagen und Bildsequenzen des Herz-MRI
Physikalische Grundlagen
Grundprinzip des MRI ist die Kernspinresonanz von Wasserstoffatomen, die sich aufgrund ihre Eigendrehung (Kernspin) und ihrer damit verbundenen Dipoleigenschaft durch Anlage eines starken Magnetfeldes ausrichten lassen. Durch Applikation eines Radiofrequenzimpulses lassen sich die im Magnetfeld ausgerichteten Wasserstoffatome aus ihrer Eigendrehung transversal als auch longitudinal auslenken um nach Abschalten des Radiofrequenzimpulses wieder in ihre ursprüngliche Ausrichtung parallel zum Magnetfeld zurückzukehren und dabei ein messbares Hochfrequenzsignal emittieren. Die Zeit für die Rückkehr in die ursprüngliche Ausrichtung wird Relaxationszeit genannt und ist abhängig von den Gewebeeigenschaften und der Verteilung der Wasserstoffatome. Dies stellt einen wesentlichen Unterschied zur Computertomographie (CT) dar, bei der die Signalintensität von der Dichte des Gewebes bestimmt wird. Longitudinale (T1) und transversale (T2) Relaxationszeit können unabhängig voneinander gemessen werden und sind gewebespezifisch. Bei der Aufnahme dynamischer Strukturen wie dem Herz, erfolgt die Bildakquisition gestaffelt über mehrere Herzzyklen über welche die Signale EKG-getriggert retrospektiv gemittelt und zusammengesetzt oder prospektiv getriggert aufgenommen werden (8).
Standardaufnahmen
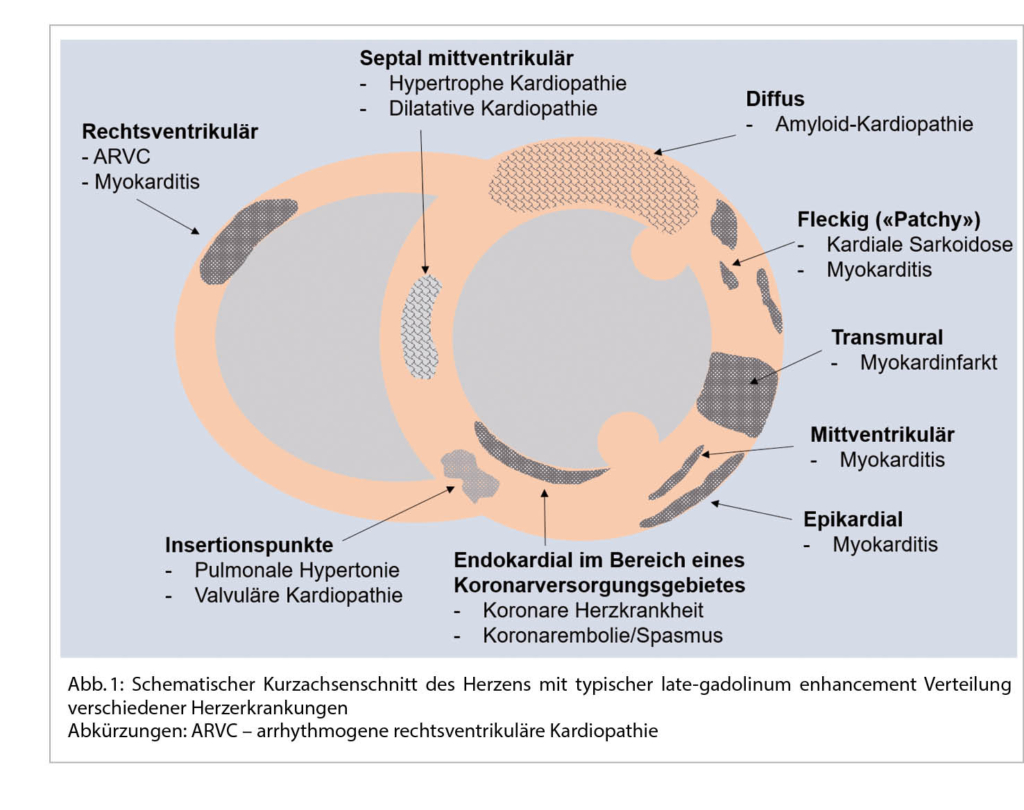
Standardakquisitionen des Herz-MRI sind Ciné-Sequenzen analog zum 2, 3- und 4-Kammer-Blick in der Echokardiographie und eine gestaffelte Kurzachsenaufnahme, die in 10-15 Schichten beide Ventrikel von der Basis bis zum Apex abbildet. Das Herz-MRI ist der Goldstandard für die biventrikuläre Beurteilung der Dimensionen und Funktion. Die Volumina, die linksventrikuläre Masse sowie die Ejektionsfraktionen (EF) des linken und rechten Ventrikels können in der Herz-MRI Untersuchung mit einer hohen Reproduzierbarkeit in den Kurzachsenaufnahmen bestimmt werden (9,10). Neuere und aktuell noch vorwiegend in der Forschung benutzte myokardiale Strainanalysen, z.B. mittels Feature Tracking, erlauben eine noch genauere Beurteilung der Kontraktion des Myokards (11). Kontrastmittel (KM) Aufnahmen werden 10-15 Minuten nach Applikation von Gadolinium-haltigen KM angefertigt. Während es im gesunden Myokard zu einem raschen Auswaschen kommt, reichert sich Gadolinium im Interstitium an, wodurch es bei Fibrose, Narbe oder Inflammation vermehrt nachweisbar ist (sogenanntes late gadolinum enhancement (LGE)). Lokalisation, Verteilung und Ausmass des LGE können Aufschluss über die zugrundeliegende Herzerkrankung geben (Abb. 1).
Parametrisches Mapping (T1- und T2-Maps und ECV)
Konventionelle T1- oder T2 gewichtete Aufnahmen erlauben die Darstellung von Fett und Wassergehalt (Ödem) im Myokard. Da sowohl T1- als auch T2-Relaxationszeiten errechnet werden können, wird beim parametrischen Mapping «quantitativ» jedem Voxel spezifisch eine T1- oder T2-Zeit zugeordnet. Niedrige native T1-Zeiten liegen bei lipomatösen Veränderungen, Eiseneinlagerungen im Myokard oder Morbus Fabry vor, während hohe native T1-Zeiten auf eine Inflammation oder Vernarbung hindeuten können. Besonders hohe T1-Zeiten liegen beim akuten Myokardinfarkt und bei kardialer Amyloidose vor. Die T1-Zeit verkürzt sich zudem gewebsspezifisch durch KM-Applikation, weshalb der Aufnahme von T1-Maps jeweils vor und nach KM-Gabe diagnostische Bedeutung zukommt. Wird eine Verkürzung angenommen die proportional zum Anteil des Extrazellulärvolumens (ECV) des jeweiligen Gewebes und damit zur Anreicherung von Gadolinium ist, so kann mithilfe des Hämatokrits das ECV im Herzmuskel abgeleitet werden. Das errechnete ECV korreliert nicht nur mit dem Ausmass der myokardialen Fibrose bestimmt mittels Myokardbiopsien (12,13), sondern hat auch wichtige prognostische Bedeutung (14). T2-Maps werden in der Regel nur nativ, also vor KM-Gabe angefertigt und sind insbesondere hilfreich zur Darstellung eines Ödems oder Eiseneinlagerungen (T2* Map). Bei ersterem (Wassereinlagerungen) sind T2-Zeiten erhöht, während tiefe T2* Mapping-Werte bei Eisenüberladung beobachtet werden (15).
Perfusion- und Belastungs-MRI
Zur Abklärung hämodynamisch relevanter Stenosen der Koronararterien kann entweder ein Perfusions-Stress-MRI oder ein Dobutamin-Stress-MRI durchgeführt werden. Erstere basiert auf dem Prinzip der Hyperämie und des Steal-Phänomens. Durch Gabe eines Vasodilatators (z.B. Adenosin oder Regadenoson) kommt es zur Koronardilatation gesunder Koronargefässe. Da diese häufig über Kollateralen ischämisches Myokard mitversorgen, wird der Blutfluss während der medikamentösen Vasodilatation nun in Richtung des gesunden Gewebes umgeleitet und das Perfusionsdefizit im Ischämiegebiet kann dargestellt werden. Wird nun KM appliziert, so zeigt sich im gesunden Myokard ein rasches Anfluten mit Aufhellung des Gewebes, während ein Perfusionsdefizit als dunkles Areal sichtbar wird. Relevante aber sehr seltene Nebenwirkungen von Adenosin sind Bronchospasmus und ein höhergradiger AV-Block, welche beim neueren Medikament Regadenoson nicht zu erwarten sind (16). Die Dobutamin-Stress-MRI erlaubt im Gegensatz zum Perfusions-Stress-MRI die Darstellung belastungsabhängiger regionaler Wandbewegungsstörungen, ist aber zeitlich und technisch aufwändiger, für den Patienten in der Regel unangenehmer und mit einer höheren Komplikationsrate assoziiert (17).
Klinische Anwendungsgebiete und Fallbeispiele
Koronare Herzkrankheit (KHK)
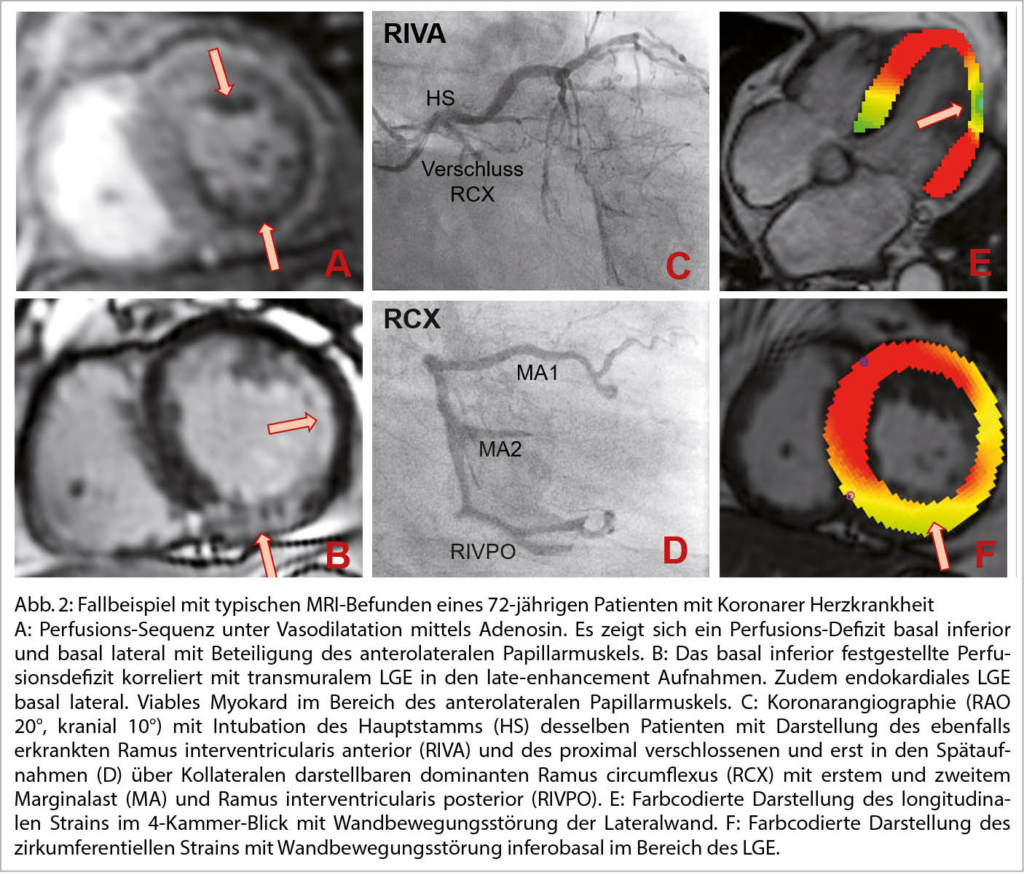
Neben der Koronar-CT, der Stress-Echokardiographie und den nuklearmedizinischen Methoden, hat sich das Stress-MRI zur Diagnostik der KHK etabliert und Einzug in die internationalen Leitlinien erhalten (18). Dank der hohen Sensitivität und Spezifität des Stress-MRI bezüglich der Beurteilung hämodynamisch relevanter Stenosen und folglich Ischämien und Myokardnarben ist es eine ideale Methode bei der Erstdiagnostik aber auch bei bereits bekannter KHK (19). Zu betonen ist, dass es sich beim Stress-MRI um einen funktionellen und nicht um einen anatomischen Test handelt. Hämodynamisch nicht-relevante Stenosen, die bspw. hilfreich bei der Entscheidung für oder gegen die Gabe eines Statins oder Aspirin sind, können im Gegensatz zur Koronar-CT nicht detektiert werden. Deshalb wird das Stress-MRI insbesondere bei intermediärer bis hoher Vortestwahrscheinlichkeit auf eine KHK, vorliegender Symptomatik oder hoher Wahrscheinlichkeit für Gefäss-Kalzifikationen (bspw. bei einer bekannten peripheren arteriellen Verschlusskrankheit) empfohlen. Auch in der Verlaufsbeurteilung nach Myokardinfarkt spielt das Herz-MRI eine wichtige Rolle. Es kann hervorragend dafür eingesetzt werden linksventrikuläre Thromben nach Myokardinfarkt darzustellen (20), mittels Viabilitätsprüfung die Indikation zur Rekanalisation einer hochgradigen Stenose oder chronisch verschlossenen Koronarastes festzulegen (21) oder anhand des Ausmasses der Vernarbung mittels LGE und der LVEF die Indikation für den sekundärprophylaktischen Einsatz eines Implantierbaren Kardioverter Defibrillators (ICD) zu stellen (2). Abbildung 2 zeigt ein Fallbeispiel mit typischen MRI-Befunden bei einem Patienten mit KHK.
Inflammatorische Kardiopathien
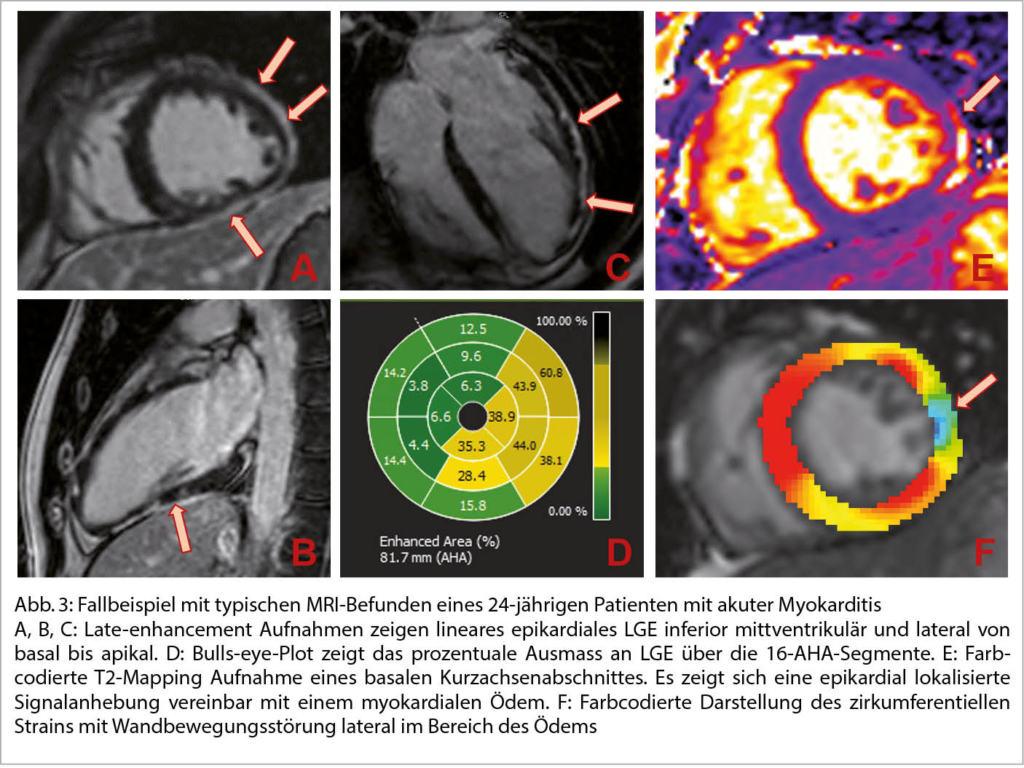
Das Herz-MRI gilt als wichtiges Entscheidungstool zur nicht-invasiven Abklärung bei Verdacht auf inflammatorische Kardiomyopathie wie einer akuten Myokarditis und wird dort häufiger durchgeführt als eine invasive Endomyokardbiopsie. Die Durchführung der Endomyokardbiopsie wird allerdings weiterhin bei der fulminanten Myokarditis empfohlen (22). Neben einer lokalen oder globalen Funktionseinschränkung des LV, zeigen sich in den LGE und T1/T2 Mapping Sequenzen typische Befunde (Abb. 3). So ist typischerweise ein epikardiales lineares oder diffus/fleckig verteiltes, gehäuft lateral lokalisiertes LGE typisch für eine Myokarditis. Bei akuter Inflammation lässt sich zudem häufig eine fokale Erhöhung der T2-Relaxationszeit, vereinbar mit einem Ödem feststellen. Diese Kriterien sind in den sogenannten Lake-Louise-Kriterien festgehalten, zu denen neben LGE, erhöhtem T1 oder ECV mit typischer Lokalisation und Nachweis eines Ödems in der T2-Map, als Nebenkriterien auch eine Funktionseinschränkung des LV und Zeichen einer Perikarditis (Perikarderguss, LGE im Perikard) zählen (23). Im Rahmen einer Myokarditis ist das Herz-MRI auch zur Risikostratifizierung hilfreich. Sowohl das Ausmass der Vernarbung (LGE), als auch der myokardiale longitudinale Strain eignen sich zur Vorhersage von sekundären kardiovaskulären Ereignissen (24-26). Bei Verdacht auf kardiale Sarkoidose kommt das Herz-MRI insbesondere zum Ausschluss, aber auch zur Risikostratifizierung zum Einsatz, häufig in Kombination mit der Positronen-Emissions-Tomographie (27).
Infiltrative Kardiopathien
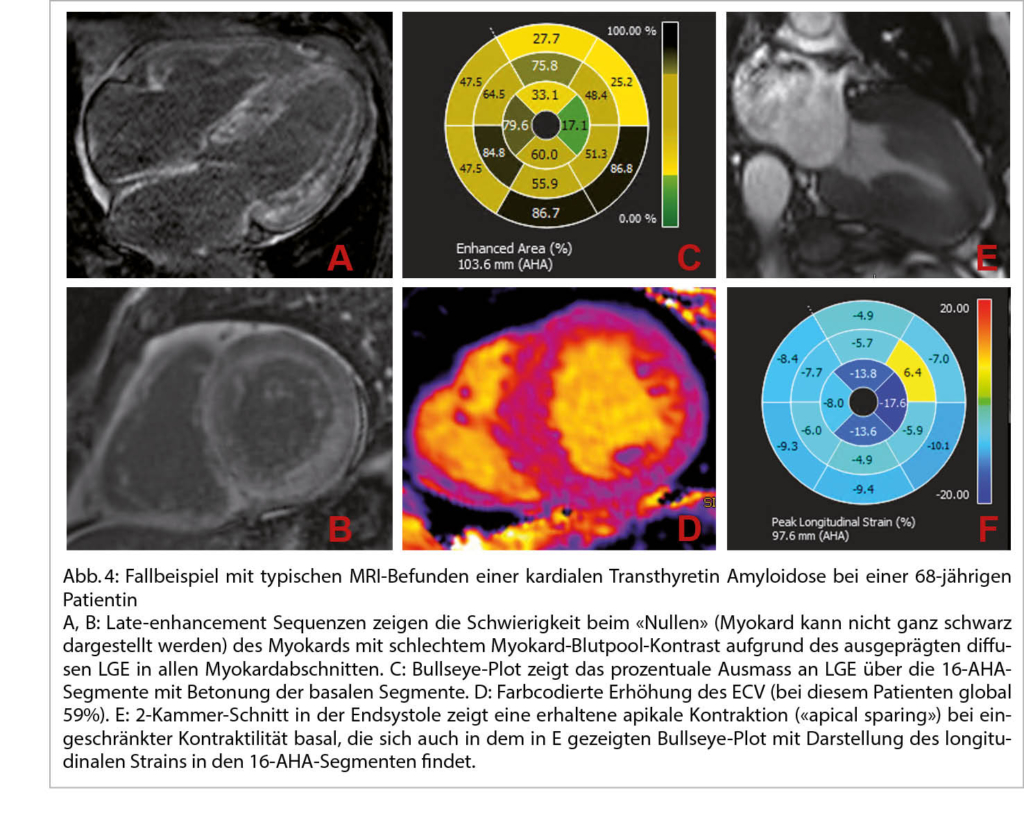
Aufgrund der Möglichkeit zur Gewebecharakterisierung können im Herz-MRI infiltrative Kardiopathien wie die kardiale Amyloidose oder ein Morbus Fabry erkannt werden. Auch wenn der nicht-invasive Goldstandard bei der Abklärung einer Transthyretin Amyloid-Kardiopathie die Knochenszintigraphie ist, wird in der klinischen Praxis häufig vorgängig ein Herz-MRI durchgeführt, da mittels Herz-MRI wichtige Differentialdiagnosen der LV-Hypertrophie wie eine Hypertrophe Kardiomyopathie, das Sportlerherz oder eine hypertensive Kardiopathie mit abgeklärt werden können. Bei relevant erhöhten nativen T1-Werten und stark erhöhtem ECV ist der positiv prädiktive Wert für das Vorliegen einer Amyloid-Kardiopathie zudem sehr hoch, sodass der Verzicht auf eine Knochenszintigraphie diskutiert werden kann (28). Weitere Charakteristika der Amyloid-Kardiopathie sind diffuses LGE in nahezu allen Myokardabschnitten und die schnelle Angleichung von Blut- und Myokardkontrast nach KM-Applikation, die eine Schwierigkeit bei der Bildakquisition darstellt. Mittels Feature-tracking-basierter Bestimmung des globalen longitudinalen Strains lässt sich die erhaltene Kontraktilität des Apex (apical sparing) im Vergleich zu basalen Myokardabschnitten zuverlässig bestimmen (Abb. 4).
Weitere Anwendungsgebiete
Weiteres wichtiges Anwendungsgebiet des Herz-MRI umfasst die Abklärung von dilatativen Kardiopathien oder Funktionseinschränkungen des LV unklarer Genese, im Kontext der Herzinsuffizienz. Das Herz-MRI wird zudem sowohl zur initialen Evaluation als auch zur Verlaufsbeurteilung bei kongentialen Herzvitien empfohlen (29). Besonders hilfreich ist es dabei zur Beurteilung von Shunts (Qp:Qs-Verhältnis) und bei komplexer Anatomie von Herz- und Gefässen (30). Die Möglichkeit zur Gewebecharakterisierung prädestiniert das Herz-MRI auch zur Abklärung von intrakardialen Tumoren, oft in Kombination mit der Positronen-Emissions-Tomographie. Bei der Abklärung valvulärer Kardiopathien ist das Herz-MRI insbesondere hilfreich zur Beurteilung von Klappeninsuffizienzen, während Stenosen nur planimetrisch beurteilt werden können oder indirekt über die maximale Geschwindigkeit, da keine Druckgradienten abgeleitet werden können.
Seltene Kardiopathien wie die arrhythmogene rechtsventrikuläre Kardiopathie (ARVC) oder die LV-Non-Compaction Kardiopathie können ebenfalls diagnostiziert oder ausgeschlossen werden.
Schwächen des Herz-MRI im Vergleich zu anderen Modalitäten
Neben den vielen Vorteilen des Herz-MRI, müssen bei der Entscheidung einen Patienten zu MRI-Untersuchungen zu überweisen auch verschiedene Limitationen bedacht werden. Dazu gehören die höheren Kosten im Vergleich zur Echokardiographie, die längere Bildakquisitionszeit im Vergleich zur CT und Kontraindikationen für die Durchführung eines MRI. Neben Klaustrophobie, Cochlea-Implantaten, Hirnstimulatoren, Insulinpumpen und Metallsplittern sind bei kardiologischen Patienten auch implantierbare Defibrillatoren und Schrittmacher zu berücksichtigen, die selbst wenn sie MRI-kompatibel sind, in der Regel eine vorherige und nachgängige Umprogrammierung benötigen und die Bildqualität einschränken können (31). Jedoch werden bald neuere Sequenzen in der klinischen Routine zur Verfügung stehen um solche Artefakte zu eliminieren. Im Gegensatz zu den in der CT verwendeten Jod-haltigen KM, ist das in der Herz-MRI verwendete Gadolinium gut verträglich und führt nur in seltensten Fällen zu allergischen Reaktionen oder einer Nierenschädigung (32).
Ausblick
Im Gegensatz zur LVEF erlaubt die Bestimmung des globalen longitudinalen Strains eine reproduzierbarere und prognostisch wichtigere Abschätzung der myokardialen Kontraktilität, kann regionale Wandbewegungsstörungen identifizieren und erlaubt zudem eine Abschätzung der diastolischen Funktion (11,24,33). Der globale longitudinale Strain ist bereits ein etablierter Parameter bei der Echokardiographie, aber aktuell noch durch den damit verbundenen hohen Zeitaufwand und die benötigte Expertise im MRI in der klinischen Routine beschränkt. Die zunehmende Verfügbarkeit von künstlicher Intelligenz bei der Strainbestimmung, bspw. im Rahmen der semi-automatischen Konturierung von Epi- und Endokard wird die Bestimmung in Zukunft vereinfachen und wird so zu einer breiteren Anwendung führen.
Neben der Verbesserung und schnelleren Bildakquisition ist der 4D Fluss im MRI eine Phasen-Kontrast Technik der ein stetig wachsendes Interesse entgegengebracht wird. Es erlaubt die Darstellung des Blutflusses in allen 3-Dimensionen des Raumes über die Zeit. Im Gegensatz zu herkömmlichen Sequenzen kann der 4D Fluss Datensatz nachträglich sequenziert werden, sodass der Blutfluss an jeder beliebigen Stelle des Herzgefäss-Systems quantifiziert werden kann. Dies könnte insbesondere bei der Beurteilung von Klappeninsuffizienzen oder Shuntverbindungen hilfreich sein. Von der Bestimmung des wall shear stress, der pulse wave velocity, der kinetischen Energie des Blutflusses und von Turbulenzen wird sich zudem eine klinische Relevanz bei Erkrankungen der Aorta wie der Vorhersage der Progredienz bei Aortenaneurysmata erhofft.
Copyright bei Aerzteverlag medinfo AG
PhD, FESC, FACC, FSCCT, FSCMR
Leiter kardiale Bildgebung
Universitätsklinik für Kardiologie
Inselspital Bern
Freiburgstrasse 18
3010 Bern
christoph.graeni@insel.ch
Prof. Gräni erhielt Forschungsförderung durch die Swiss National Science Foundation und Innosuisse und vom Center for Artificial Intelligence in Medicine Research Project Fund der Universität Bern, unabhängig von der aktuellen Arbeit.
◆ Das Herz-MRI hat sich aufgrund der hohen räumlichen und zeitlichen
Auflösung und der Möglichkeit das Myokardgewebe zu charakterisieren sowohl in der Diagnostik, Risikostratifizierung und Verlaufsbeurteilung
kardialer Erkrankungen als Ergänzung zur Echokardiographie etabliert.
◆ Besondere Stärken des Herz-MRI beinhalten die Möglichkeit der Darstellung des Verteilungsmusters von Ödem, Fibrose und Myokardnarben womit inflammatorische und infiltrative Kardiopathien zuverlässig beurteilt werden können.
◆ Es ist davon auszugehen, dass die Bedeutung des Herz-MRI in den
folgenden Jahren durch die Einführung schnellerer Bildsequenzen und moderner Messmethoden wie beispielsweise dem 4D-Fluss oder der
Vereinfachung der Strainbestimmung mithilfe künstlicher Intelligenz weiter steigen wird.
1. (BFS) BfS. Medizintechnische Ausstattung von Spitälern und Arztpraxen im Jahr 2019. BFS Aktuell (BFS_AKT) 2021.
2. McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European heart journal 2021;42:3599-3726.
3. Otto CM, Nishimura RA, Bonow RO et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology 2021;77:e25-e197.
4. Vahanian A, Beyersdorf F, Praz F et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). European heart journal 2021;43:561-632.
5. Baumgartner H, De Backer J, Babu-Narayan SV et al. 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Adult Congenital Heart Disease (ISACHD). European heart journal 2020;42:563-645.
6. Adler Y, Charron P, Imazio M et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC)Endorsed by: The European Association for Cardio-Thoracic Surgery (EACTS). European heart journal 2015;36:2921-2964.
7. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). European heart journal 2014;35:2733-79.
8. Nacif MS, Zavodni A, Kawel N, Choi EY, Lima JA, Bluemke DA. Cardiac magnetic resonance imaging and its electrocardiographs (ECG): tips and tricks. Int J Cardiovasc Imaging 2012;28:1465-75.
9. Grothues F, Smith GC, Moon JC et al. Comparison of interstudy reproducibility of cardiovascular magnetic resonance with two-dimensional echocardiography in normal subjects and in patients with heart failure or left ventricular hypertrophy. The American journal of cardiology 2002;90:29-34.
10. Myerson SG, Bellenger NG, Pennell DJ. Assessment of left ventricular mass by cardiovascular magnetic resonance. Hypertension 2002;39:750-5.
11. Fischer K, Linder OL, Erne SA et al. Reproducibility and its confounders of CMR feature tracking myocardial strain analysis in patients with suspected myocarditis. European radiology 2022;32:3436-3446.
12. aus dem Siepen F, Buss SJ, Messroghli D et al. T1 mapping in dilated cardiomyopathy with cardiac magnetic resonance: quantification of diffuse myocardial fibrosis and comparison with endomyocardial biopsy. European Heart Journal – Cardiovascular Imaging 2014;16:210-216.
13. Lurz JA, Luecke C, Lang D et al. CMR–Derived Extracellular Volume Fraction as a Marker for Myocardial Fibrosis: The Importance of Coexisting Myocardial Inflammation. JACC: Cardiovascular Imaging 2018;11:38-45.
14. Wong TC, Piehler K, Meier CG et al. Association between extracellular matrix expansion quantified by cardiovascular magnetic resonance and short-term mortality. Circulation 2012;126:1206-16.
15. Messroghli DR, Moon JC, Ferreira VM et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). Journal of cardiovascular magnetic resonance : official journal of the Society for Cardiovascular Magnetic Resonance 2017;19:75.
16. Bruder O, Wagner A, Lombardi M et al. European Cardiovascular Magnetic Resonance (EuroCMR) registry–multi national results from 57 centers in 15 countries. Journal of cardiovascular magnetic resonance : official journal of the Society for Cardiovascular Magnetic Resonance 2013;15:9.
17. Wahl A, Paetsch I, Gollesch A et al. Safety and feasibility of high-dose dobutamine-atropine stress cardiovascular magnetic resonance for diagnosis of myocardial ischaemia: experience in 1000 consecutive cases. European heart journal 2004;25:1230-6.
18. Knuuti J, Wijns W, Saraste A et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European heart journal 2020;41:407-477.
19. Patel AR, Salerno M, Kwong RY, Singh A, Heydari B, Kramer CM. Stress Cardiac Magnetic Resonance Myocardial Perfusion Imaging: JACC Review Topic of the Week. Journal of the American College of Cardiology 2021;78:1655-1668.
20. Allard L, Bernhard B, Windecker S, Valgimigli M, Gräni C. Left ventricular thrombus in ischaemic heart disease: diagnosis, treatment and gaps of knowledge. European heart journal Quality of care & clinical outcomes 2021.
21. Bucciarelli-Ducci C, Auger D, Di Mario C et al. CMR Guidance for Recanalization of Coronary Chronic Total Occlusion. JACC Cardiovascular imaging 2016;9:547-56.
22. Kindermann I, Barth C, Mahfoud F et al. Update on myocarditis. J Am Coll Cardiol 2012;59:779-92.
23. Ferreira VM, Schulz-Menger J, Holmvang G et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. Journal of the American College of Cardiology 2018;72:3158-3176.
24. Fischer K, Obrist SJ, Erne SA et al. Feature Tracking Myocardial Strain Incrementally Improves Prognostication in Myocarditis Beyond Traditional CMR Imaging Features. JACC Cardiovascular imaging 2020;13:1891-1901.
25. Grani C, Eichhorn C, Biere L et al. Prognostic Value of Cardiac Magnetic Resonance Tissue Characterization in Risk Stratifying Patients With Suspected Myocarditis. Journal of the American College of Cardiology 2017;70:1964-1976.
26. Gräni C, Bière L, Eichhorn C et al. Incremental value of extracellular volume assessment by cardiovascular magnetic resonance imaging in risk stratifying patients with suspected myocarditis. The international journal of cardiovascular imaging 2019;35:1067-1078.
27. Greulich S, Deluigi CC, Gloekler S et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovascular imaging 2013;6:501-11.
28. Baggiano A, Boldrini M, Martinez-Naharro A et al. Noncontrast Magnetic Resonance for the Diagnosis of Cardiac Amyloidosis. JACC: Cardiovascular Imaging 2020;13:69-80.
29. Leiner T, Bogaert J, Friedrich MG et al. SCMR Position Paper (2020) on clinical indications for cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance 2020;22:76.
30. Beerbaum P, Körperich H, Barth P, Esdorn H, Gieseke J, Meyer H. Noninvasive quantification of left-to-right shunt in pediatric patients: phase-contrast cine magnetic resonance imaging compared with invasive oximetry. Circulation 2001;103:2476-82.
31. Glikson M, Nielsen JC, Kronborg MB et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). European heart journal 2021;42:3427-3520.
32. Woolen SA, Shankar PR, Gagnier JJ, MacEachern MP, Singer L, Davenport MS. Risk of Nephrogenic Systemic Fibrosis in Patients With Stage 4 or 5 Chronic Kidney Disease Receiving a Group II Gadolinium-Based Contrast Agent: A Systematic Review and Meta-analysis. JAMA Intern Med 2020;180:223-230.
33. Kalam K, Otahal P, Marwick TH. Prognostic implications of global LV dysfunction: a systematic review and meta-analysis of global longitudinal strain and ejection fraction. Heart (British Cardiac Society) 2014;100:1673-80.
info@herz+gefäss
- Vol. 12
- Ausgabe 4
- Juli 2022