- Wert der «Wearables» zur Diagnose von Rhythmusstörungen
Smartwatches verdrängen seit einigen Jahren die traditionellen Armbanduhren beim Verkauf. Die Akzeptanz und Nutzung von tragbaren Geräten nimmt in unserer Bevölkerung zu. In diesem Überblick möchten wir die Technologie, die wissenschaftlichen Daten, die klinischen Implikationen und die Herausforderungen bei der Rhythmusdiagnose mit «Wearables» beschreiben und kommentieren. Wir befassen uns mit den Fortschritten der Technologie in den letzten Jahren, den verschiedenen verfügbaren Geräten, ihrer Verwendbarkeit und ihren Grenzen sowie mit der Erkennbarkeit verschiedener Arrhythmien anhand von mit Wearables aufgezeichneten 1-Kanal-EKGs.
During the past few years, smartwatches have seen a constant increase in sales worldwide as well as in Switzerland. Acceptance and usage of wearable devices in our population is on the rise. In this overview we want to describe and comment on technology, scientific data, clinical implication and challenges in rhythm diagnosis with wearables. We look at the progress of technology in the past years, different available devices, their usability and limitations as well as the detectability of different arrhythmias via single-lead ECGs recorded with wearables.
Key Words: Wearables, Smartwatch, ECG, atrial fibrillation, electrophysiology, new technology, screening, prevention
Historischer Hintergrund
1961 publizierte Holter mit «New method for heart studies» seine Arbeit über den gleichnamigen portablen EKG-Recorder, welcher ausserhalb eines Spitals verwendet werden konnte und legte somit den Grundstein der tragbaren Rhythmusdiagnostik (1). Somit existiert bereits seit mehr als einem halben Jahrhundert die Grundlage für moderne Wearables zur Erfassung und Übertragung von EKG-Daten, wie wir sie heute in verschiedensten Formen kennen. Gegenüber den in der Klinik herkömmlich verwendeten Monitorstrategien, wie Holter oder implantierbaren Loop-Recordern, sind massentaugliche Wearables für Endnutzer günstiger, angenehmer zu tragen und bieten auch einen persönlichen Anreiz durch den (vermeintlichen) Nutzen sowie die Auswertung von erhobenen Daten über den eigenen Körper- oder Trainingszustand. Es ist wahrscheinlich, dass in Zukunft Wearables wie heutzutage Mobiltelefone in der Bevölkerung verbreitet sein werden. Algorithmen können bereits zuverlässig Vorhofflimmern (VHF) detektieren und Wearables sind nun fest in den 2020 Vorhofflimmer ESC-Guidelines verankert (2). Besonders Uhren erfreuen sich enormer Beliebtheit, da diese unauffällig, bequem und in den meisten Alltagssituationen ohne Einschränkungen oder Stigmatisierung getragen und benutzt werden können.
Welche Rhythmusstörungen können wir mit Hilfe dieser Technologie bereits diagnostizieren und worauf dürfen wir in Zukunft durch diese Wearables hoffen?
Verfügbare Wearables
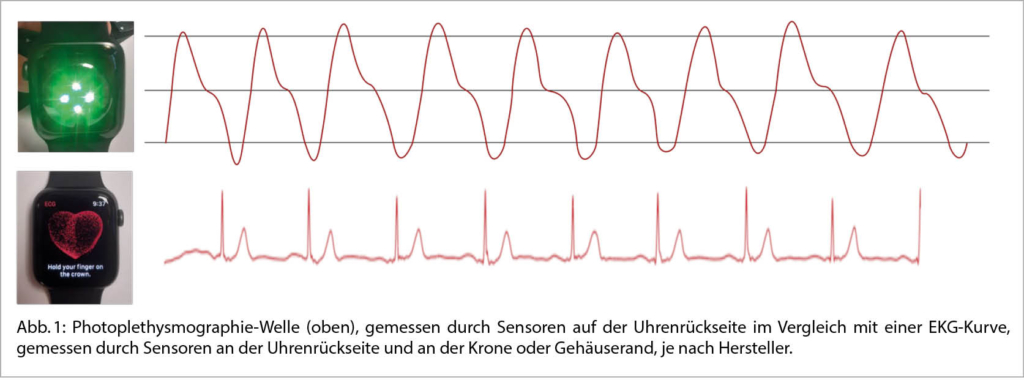
Unterschieden wird bei den Wearables zwischen aktiven und passiven Sensoren: Die meisten verfügbaren Uhren und Fitness-Tracker verwenden Photoplethysmografie (PPG) zur Detektion der Schlag-zu-Schlag Variabilität (Abb. 1). Dies ermöglicht eine kontinuierliche Messung, welche ohne aktives Eingreifen durch den Tragenden erfolgen kann (passive Überwachung). Uhren, welche zusätzlich über die Möglichkeit verfügen, ein EKG aufzuzeichnen, können den Endnutzer, z.B. bei durch PPG festgestellte Variabilität des Pulsrhythmus, auffordern, ein EKG aufzuzeichnen (3). Durch diese aktive Diagnostik kann der Wert zur VHF-Detektion dieser Uhren erhöht werden (4). Für VHF ist eine Kombination von aktiven- und passiven Sensoren geeignet und kombiniert effizient die neusten technologischen Möglichkeiten der Wearables. Wie verhält es sich nun für andere Rhythmusstörungen, bei welchen die Schlag-zu-Schlag Variabilität weniger auffällig ist?
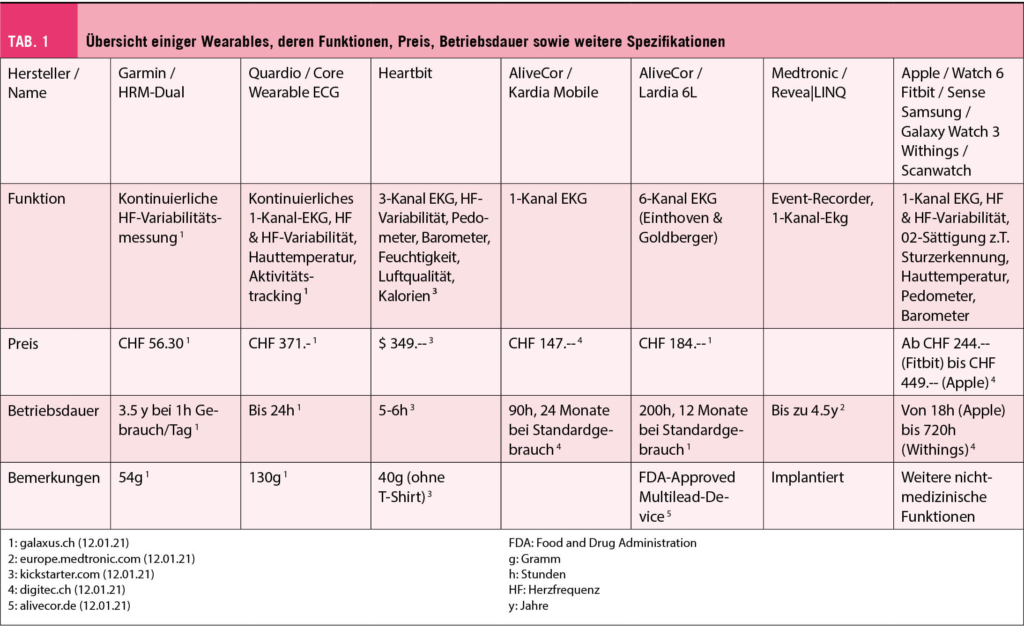
Grundsätzlich müssen auch hier wieder zwei Arten von EKG-fähigen Wearables unterschieden werden: Diejenigen, welche im Stande sind, ein 1-Kanal EKG (Single-lead EKG) aufzuzeichnen und diejenigen, welche ein Mehrkanal EKG (Multilead EKG) aufzeichnen können. Eine Übersicht gängiger, verfügbarer Devices bietet Tabelle 1.
Stellung der Wearables beim Vorhofflimmern
Die meisten Wearables, welche sich um eine Food and Drug Administration (FDA) und/oder Conformité Européenne (CE)-Zulassung bemühen oder dies bereits erhalten haben, zielen darauf ab, Vorhofflimmern zu detektieren. Der Markt dafür ist gegeben: Die häufigste Komplikation dieser Herzrhythmusstörung, der Hirnschlag, lässt sich durch orale Antikoagulation effizient reduzieren (5, 6). Das VHF bleibt bis zum folgeschweren Hirnschlag jedoch in etwa einem Fünftel aller Fälle aufgrund des subklinischen oder gar asymptomatischen Verlaufs unentdeckt (7).
Die Apple Heart Study (8), Fitbit Heart Study (9) und Huawei Studie (10) zielten auf eine breite Bevölkerung ab, um Vorhofflimern mit Hilfe der Photoplethysmografie (PPG) zu detektieren. Die drei Studien ähneln sich: Die Schlag-zu-Schlag Variabilität wurde analysiert, bei einem auffälligen Muster wurde zusätzlich ein Langzeit-EKG z.B. in Form eines Holters oder Patch-EKG verwendet, um eine Diagnose zu stellen. Bewegungsartefakte, kurze Batteriedauer und ein Bias durch junge, gesunde Personen aus der sozialen Mittelschicht lassen an der Aussagekraft dieser grossen Studien zumindest in manchen Bereichen gewisse Zweifel.
Seit der Herausgabe der ESC-Guidelines 2020 ist es möglich die Diagnose Vorhofflimmern neben dem herkömmlichen 12-Kanal EKG auch neuerdings durch ein 1-Kanal EKG über mindestens 30 Sekunden zu bestätigen (2). Die ESC-Guidelines empfehlen zudem ein opportunistisches VHF Screening mit einer Klasse I Empfehlung bei Hypertonikern. Weiter erwägen die Guidelines mit einer Klasse IIa Empfehlung das VHF Screening bei Patienten, welche an einem Schlafapnoe-Syndrom leiden (2).
Obschon die Technologie sowohl im Soft- wie auch im Hardwarebereich rasante Fortschritte macht, ist diese in der VHF Detektion noch nicht in einem solchen Masse ausgereift, sodass sich Endnutzer alleinig auf Algorithmen verlassen könnten. Beispielsweise sind die Algorithmen aktuell meist nur in der Lage Rhythmen mit einer Kammerfrequenz zwischen 50-150 Schlägen pro Minute zu klassifizieren. Ebenso bieten Extrasystolen, Bewegungsartefakte oder das Vorhofflattern oft Anlass für den Algorithmus nach 30 Sekunden Aufzeichnung kein schlüssiges Resultat an den Endnutzenden liefern zu können. Endnutzer, welche ihre Smartwatch regelmässig nutzen, möchten in der Regel bei unklarer Interpretation durch den Computeralgorithmus und/oder Symptomen die Möglichkeit einer Befundung durch eine fachkundige Person nutzen. Ob die Ressourcen im Spital oder in Praxis hierfür gegeben sind, ist zweifelhaft.
Vorhofflattern
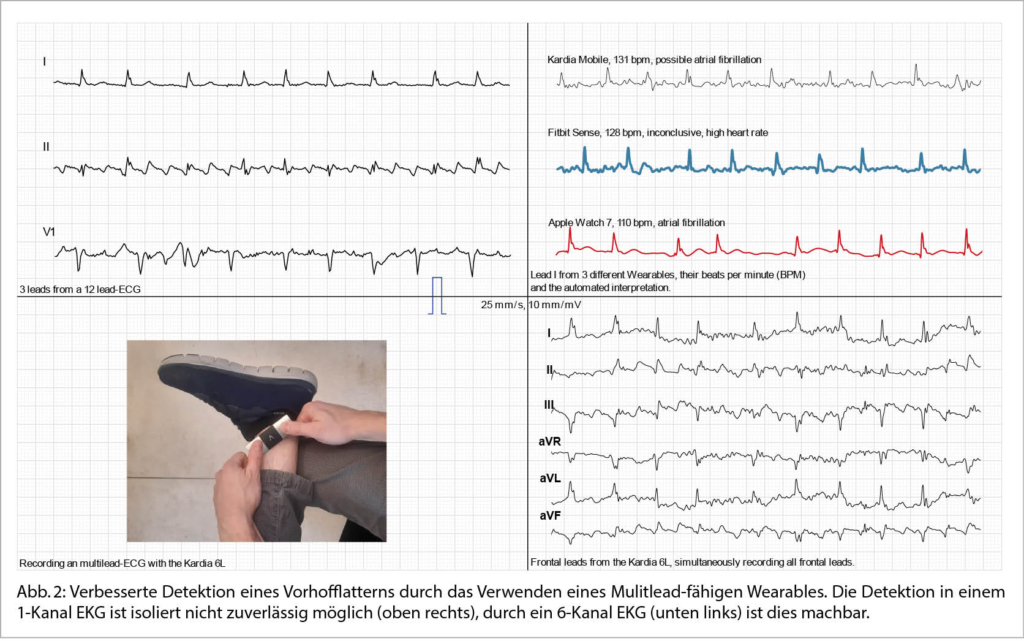
Die Detektion von Vorhofflattern (VHFlat) stellt für Wearables im Bereich der Aufzeichnungsmöglichkeiten keine Schwierigkeit dar, wohl aber im Bereich der Interpretation durch den Algorithmus. Smartwatches zeichnen bei herkömmlicher Nutzung ein 1-Kanal-EKG auf, welches der Ableitung I des konventionellen EKGs entspricht. (Abb. 2). Ein Lösungsansatz bietet eine einfache Anpassung der Tragweise der Uhr: Durch eine Platzierung dieser am linken Knöchel kann ein Derivat der Ableitung II aufgezeichnet werden, welche von der Morphologie derjenigen einer herkömmlichen Einthoven II Ableitung näher kommt (11).
Paroxysmale supraventrikuläre Tachykardie
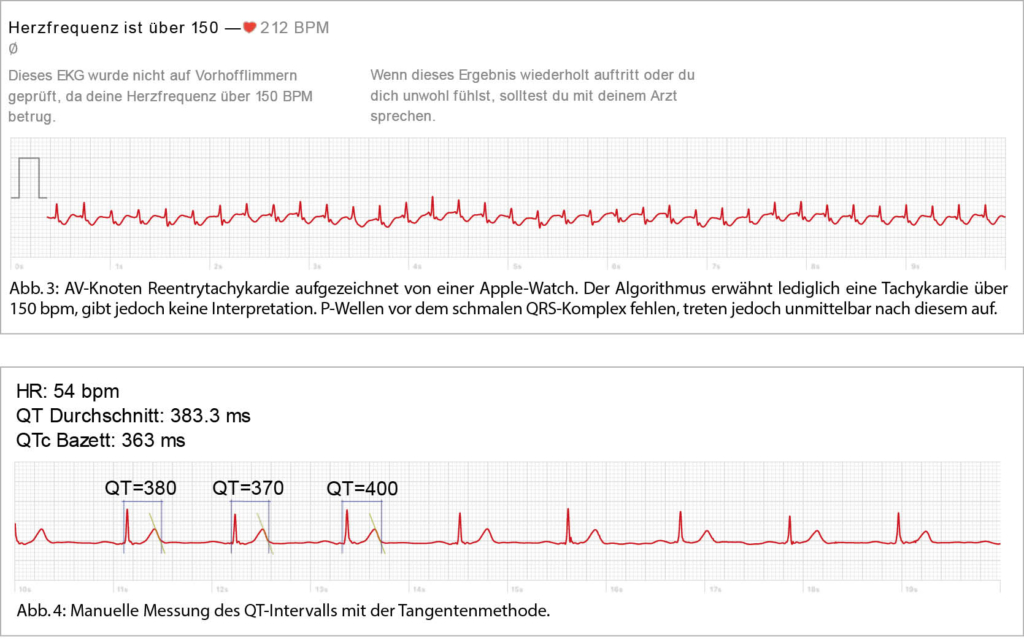
Paroxysmalen supraventrikulären Tachykardien (PSVT) liegen in ca. 60% der Fälle AV-Knoten Reentry Tachykardien (AVNRT), in 30% AV-Reentry Tachykardien (AVRT) und in 10% atriale Tachykardien zugrunde(12). Die Patienten klagen in der Regel über ein plötzlich einsetzendes Herzrasen, welches Minuten bis mehrere Stunden anhalten kann. Obschon die medizinische Versorgung heutzutage sehr gut und zügig funktioniert, kann die Diagnosestellung via EKG sich trotzdem oft schwierig gestalten. Wearables bieten hier eine interessante und vielversprechende Möglichkeit, die «diagnostische Lücke» zu schliessen(13). Vor allem bei jungen Patienten, welche als «digital natives» mit Wearables vertraut sind und diese auch aus intrinsischem Interesse nutzen, bieten diese einen Mehrwert für ärztliches Personal und zu Behandelnde. (Abb. 3).
QTc- Verlängerung
Long QT Syndrome (LQTS) können entweder kongenital oder erworben sein. Die Funktionsstörung der ventrikulären Repolarisation birgt das Risiko für ventrikuläre Arrhythmien (Torsade de pointes) oder des plötzlichen Herztodes (SCD) (14). Erworbene LQTS können auf Elektrolytstörungen (Hypokaliämie u/o Hypomagnesiämie) (15) oder der Einnahme QT-verlängernder Medikamente (16) basieren. Die Einnahme von QT-verlängernder Medikation sollte überwacht werden und diese bei Überschreiten eines gewissen QTc-Intervalls abgesetzt werden(17)(18). Wearables bieten hier eine Möglichkeit, Patienten durch Remote Monitoring zu überwachen. Wearables wurden diesbezüglich bereits erprobt, die Korrelation zwischen den durch 1-Kanal-EKGs erhobenen Zeiten im Vergleich mit denjenigen eines 12-Kanal EKG ist gut (19) (20).
Die QT-Zeiten müssen für alle Wearables bis auf die Withings Scanwatch allerdings manuell ausgemessen werden. (Abb. 4) Die manuelle Erfassung bietet ein hohes Fehlerpotential und kann je nach erfassender Person und deren Erfahrung substantiell variieren (22). Zudem ist zu beachten, dass ein 1-Kanal-EKG nicht die QT-Dispersion eines 12-Kanal EKG erfassen kann, möglicherweise also die QTc Zeit über- oder unterschätzt. Aktuell besitzt das Kardia 6L als Multilead-Device als einziges Handheld Device eine FDA-Zulassung zur Messung des QT-intervals. Die Autoren stehen dem Einsatz der Wearables für diese Indikation aufgrund der aktuellen Datenlage allerdings noch zurückhaltend gegenüber.
Myokardischämie
Das 1-Kanal EKG einer herkömmlichen Smartwatch kann nicht zur Diagnose eines Myokardinfarkts verwendet werden und wird so von den Herstellern auch ausgewiesen. Was für Mediziner:innen selbstverständlich erscheint, ist für ungeschulte Laien ein wichtiger und für die Hersteller ein rechtlich unabdingbarer Hinweis. Theoretisch sollte es möglich sein, aus zahlreichen 1-Kanal-EKGs auch ein Multi- oder gar 12-Kanal-EKG zu erzeugen (23, 24) (25), praktisch
Weitere Krankheitsspezifische EKG-Veränderungen
Die Entwicklung schreitet rasant voran. Neuste Studien zeigten, dass mittels Smartwatch EKG weitere Abnormitäten entdeckt werden können, wie z.B eine Präexzitation im Sinne einer Deltawelle, eine hypertrophe Kardiomyopathie oder ein Brugada-Pattern (26). Aufgrund der geringen Sensititivät und Spezifität eines Einkanal-EKG, müssen diese Beobachtungen aber immer zwingend ein 12-Kanal EKG zur Diagnosesicherung nach sich ziehen. Neben den bereits erwähnten EKG-Veränderungen konnten auch schon Rechts- und Linksschenkelblöcke sowie AV-Blöcke in isolierten 1-Kanal EKGs anhand charakteristischer Veränderungen aufgezeigt werden (27).
Ausblick
Die Möglichkeiten zur Detektion von Herzrhythmusstörungen durch Wearables haben in den letzten Jahren enorm zugenommen. Smartwatches sind längst nicht mehr ein Nischenprodukt oder experimentelles Zubehör für technisch versierte Menschen, sondern in der Gesellschaft breit etabliert. Die attraktivste Eigenschaft der Wearables im Bereich der Rhythmusdiagnostik scheint die Möglichkeit zu sein, Vorhofflimmern zu entdecken. Zwei wichtige Punkte gilt es in diesem Zusammenhang zu beachten:
1. Die automatischen Detektionsalgorithmen der Wearables sind noch nicht ausgereift.
2. Der Nutzen durch Beginn einer oralen Antikoagulation von Smartwatch detektiertem Vorhofflimmern, also eine Senkung von Schlaganfällen, wurde bisher nicht ausreichend untersucht.
Nichtsdestotrotz stehen wir als Mediziner:innen in der Verantwortung Lösungen zu finden, um Wearables sinnvoll in unseren Klinikalltag zu integrieren. Gerade in Zeiten der Pandemie, in welcher die Gesundheitsversorgung der breiten Bevölkerung immer wieder auf zwingend Notwendiges reduziert werden muss(te), bietet diese Technologie enormes Potential.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Basel
Petersgraben 4
4031 Basel
Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
Kardiologische Klinik
Universitätsspital Basel
Petersgraben 4
4031 Basel
Alle Autoren bestätigen, dass kein Interessenskonflikt besteht.
◆ Wearables umfassen neben Smartwatches mit Photoplethysmografie oder EKG-Funktion auch weitere tragbare Geräte oder Sensoren, welche Daten über Nutzende und deren Umgebung aufzeichnen.
◆ Bei paroxysmal auftretenden Rhythmusstörungen kann durch Wearables die Zeit zwischen Auftreten der Arrhythmie und erster EKG Dokumentation auf ein Minimum reduziert werden.
◆ Wearables bieten in Zeiten von Einschränkungen bei Patientenvisiten oder Ressourcen-knappheiten eine Möglichkeit der vereinfachten Rhythmusüberwachung im Zusammenhang mit Vorhofflimmer-Abklärungen oder postoperativer Erfolgskontrolle.
◆ Geringe Batterielaufzeit, komplexe Gerätebedienung und mangelndes Vertrauen in die Technologie sind Hürden, die die Technologie in gewissen Patientengruppen noch überwinden muss.
◆ Automatisierte Algorithmen und Cloudbasierte künstliche Intelligenz sind eine wertvolle Ergänzung zur Kanalisierung und Minderung der Datenflut, sollten jedoch stets kritisch hinterfragt werden. Die Diagnose muss zwingend durch geschultes und fachkundiges Personal erfolgen, welches über die nötige Expertise verfügt.
1. HOLTER NJ. New method for heart studies. Science (New York, NY). 1961 Oct 20;134(3486):1214–20.
2. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). European Heart Journal. 2021 Feb 1;42(5):373–498.
3. Sim I. Mobile Devices and Health. The New England journal of medicine. 2019;381(10):956–68.
4. Avram R, Ramsis M, Cristal AD, Nathan V, Zhu L, Kim J, et al. Validation of an
algorithm for continuous monitoring of atrial fibrillation using a consumer smartwatch. Heart rhythm. 2021;18(9):1482–90.
5. Lloyd-Jones DM, Wang TJ, Leip EP, Larson MG, Levy D, Vasan RS, et al. Lifetime Risk for Development of Atrial Fibrillation. Circulation. 2004 Aug 31;110(9):1042–6.
6. Verheugt FWA, Granger CB. Oral anticoagulants for stroke prevention in atrial fibrillation: current status, special situations, and unmet needs. The Lancet. 2015 Jul;386(9990).
7. Mahajan R, Perera T, Elliott AD, Twomey DJ, Kumar S, Munwar DA, et al. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. European Heart Journal. 2018 Apr 21;39(16).
8. Perez M v, Mahaffey KW, Hedlin H, Rumsfeld JS, Garcia A, Ferris T, et al. Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. The New England journal of medicine. 2019;381(20):1909–17.
9. Lubitz SA, Faranesh AZ, Atlas SJ, McManus DD, Singer DE, Pagoto S, et al. Rationale and design of a large population study to validate software for the assessment of atrial fibrillation from data acquired by a consumer tracker or smartwatch: The Fitbit heart study. American heart journal. 2021;238:16–26.
10. Guo Y, Wang H, Zhang H, Liu T, Liang Z, Xia Y, et al. Mobile Photoplethysmographic Technology to Detect Atrial Fibrillation. Journal of the American College of Cardiology. 2019;74(19):2365–75.
11. Ahmed AS, Golden KM, Foreman JR, Padanilam BJ. Using a smartwatch to identify the morphology of atrial flutter. HeartRhythm case reports. 2020 Oct;6(10):808–9.
12. Trohman RG. Supraventricular tachycardia: implications for the intensivist. Critical care medicine. 2000 Oct;28(10 Suppl):N129-35.
13. Siddeek H, Fisher K, McMakin S, Bass JL, Cortez D. AVNRT captured by Apple Watch Series 4: Can the Apple watch be used as an event monitor? Annals of
Noninvasive Electrocardiology. 2020 Sep 29;25(5).
14. Lane JCE, Weaver J, Kostka K, Duarte-Salles T, Abrahao MTF, Alghoul H, et al. Risk of hydroxychloroquine alone and in combination with azithromycin in the treatment of rheumatoid arthritis: a multinational, retrospective study. The Lancet Rheumatology. 2020 Nov;2(11):e698–711.
15. Benoit SR, Mendelsohn AB, Nourjah P, Staffa JA, Graham DJ. Risk factors for prolonged QTc among US adults: Third National Health and Nutrition Examination Survey. European journal of cardiovascular prevention and rehabilitation:
official journal of the European Society of Cardiology, Working Groups on Epidemiology & Prevention and Cardiac Rehabilitation and Exercise Physiology. 2005 Aug;12(4):363–8.
16. Viskin S, Justo D, Halkin A, Zeltser D. Long QT syndrome caused by noncardiac drugs. Progress in Cardiovascular Diseases. 2003 Apr;45(5):415–27.
17. Roden DM, Harrington RA, Poppas A, Russo AM. Considerations for drug interactions on QTc interval in exploratory COVID-19 treatment. Heart Rhythm. 2020 Jul;17(7):e231–2.
18. Pfizer Inc. Tikosyn (dofetilide) Information. www.pfizerpro.com/products/tikosyn/af. 2021.
19. Muhlestein JB. QTC intervals can be assessed with the AliveCor heart monitor in patients on dofetilide for atrial fibrillation. Journal of electrocardiology. 48(1):10–1.
20. Maille B, Wilkin M, Million M, Rességuier N, Franceschi F, Koutbi-Franceschi L, et al. Smartwatch Electrocardiogram and Artificial Intelligence for Assessing Cardiac-Rhythm Safety of Drug Therapy in the COVID-19 Pandemic. The QT-logs study. International Journal of Cardiology. 2021 May 15;331:333–9.
21. Minguito-Carazo C, Echarte-Morales J, Benito-González T, del Castillo-García S, Rodríguez-Santamarta M, Sánchez-Muñoz E, et al. QT Interval Monitoring with Handheld Heart Rhythm ECG Device in COVID-19 Patients. Global heart. 2021;16(1):42.
22. Viskin S, Rosovski U, Sands AJ, Chen E, Kistler PM, Kalman JM, et al. Inaccurate electrocardiographic interpretation of long QT: the majority of physicians cannot recognize a long QT when they see one. Heart rhythm. 2005 Jun;2(6):569–74.
23. Cobos Gil MÁ. Standard and Precordial Leads Obtained With an Apple Watch. Annals of Internal Medicine. 2020 Mar 17;172(6):436.
24. Spaccarotella CAM, Polimeni A, Migliarino S, Principe E, Curcio A, Mongiardo A, et al. Multichannel Electrocardiograms Obtained by a Smartwatch for the Diagnosis of ST-Segment Changes. JAMA cardiology. 2020;5(10):1176–80.
25. Muhlestein JB, Le V, Albert D, Moreno FLl, Anderson JL, Yanowitz F, et al. Smartphone ECG for evaluation of STEMI: Results of the ST LEUIS Pilot Study. Journal of Electrocardiology. 2015 Mar;48(2):249–59.
26. Nasarre M, Strik M, Daniel Ramirez F, Buliard S, Marchand H, Abu-Alrub S, et al. Using a smartwatch electrocardiogram to detect abnormalities associated with sudden cardiac arrest in young adults. EP Europace. 2021 Sep 1;
27. Witvliet MP, Karregat EPM, Himmelreich JCL, de Jong JSSG, Lucassen WAM, Harskamp RE. Usefulness, pitfalls and interpretation of handheld single lead electrocardiograms. Journal of electrocardiology. 66:33–7.
info@herz+gefäss
- Vol. 12
- Ausgabe 4
- Juli 2022