- Le principe des quatre piliers du traitement moderne de l’ insuffisance cardiaque
Le traitement médicamenteux de l’ insuffisance cardiaque avec fonction systolique réduite (heart failure with reduced ejection fraction, HFrEF) a considérablement évolué au cours des dernières années. Désormais, chez tous les patients avec HFrEF, l’ objectif est d’ instaurer au plus vite un traitement de base dit des quatre piliers qui se compose d’un inhibiteur de l’ enzyme de conversion de l’ angiotensine (IECA), d’ un bêtabloquant, d’ un antagoniste du récepteur des minéralocorticoïdes (ARM) et d’ un inhibiteur du cotransporteur 2 du glucose sodique (SGLT2-I). Ce n’ est que par la suite que l’ on procède au titrage de ces piliers thérapeutiques et qu’ on remplace l’ IECA par l’inhibiteur du récepteur de l’ angiotensine et de la néprilysine (ARNI). En fonction de l’ effet de ces étapes de médication, des options médicamenteuses et non médicamenteuses supplémentaires seront à évaluer. L’ article présent aborde en particulier les aspects pratiques importants de la mise en œuvre des nouvelles directives thérapeutiques.
Drug therapy options for patients with heart failure with reduced ejection fraction (HFrEF) have increased substantially over the past years. The latest proposed therapy concept consists of a basic quadruple therapy including low doses of an angiotensin converting enzyme inhibitor (ACE-I), a betablocker, a mineralocorticoid receptor antagonist (MRA) and a sodium glucose co-transporter-2 inhibitor (SGLT2-I). Only after establishing all four therapy pillars, the drugs are up-titrated, and the ACE-I is changed to an angiotensin receptor neprilysin inhibitor (ARNI). Depending on the response to the quadruple therapy additional therapeutic options need to be considered. This article discusses practical aspects of implementing the new therapeutic guidelines.
Key Words: heart failure with reduced ejection fraction (HFrEF), quadruple therapy
Vignette clinique
Un homme de 48 ans, sans antécédents médicaux et sans médication préalable, se présente au cabinet médical en raison d’ une dyspnée d’ effort progressive depuis quelques semaines. Il a en outre constaté un œdème bilatéral des chevilles et une prise de poids de 3 kg en deux semaines. La tension artérielle mesurée au cabinet médical est à 152/86 mmHg, avec une fréquence cardiaque de 97/min. À l’ examen clinique, des œdèmes des chevilles sont confirmés des deux côtés, et un reflux hépato-jugulaire positif est observé. Des râles crépitants sont présents au niveau pulmonaire basal bilatéral. L’ auscultation cardiaque est sans particularité. L’ électrocardiogramme montre un rythme sinusal avec des troubles discrets de la repolarisation en V4-V6. Le laboratoire révèle une fonction rénale normale avec une créatinine de 96 µmol/l et un potassium normal de 4,1 mmol/l. Le NT-proBNP est élevé à 1075ng/l.
En raison d’ une forte suspicion d’ insuffisance cardiaque avec des signes de surcharge volémique, un traitement diurétique oral est débuté et le patient est adressé au cardiologue pour une échocardio-graphie. Cet examen révèle une fraction d’ éjection du ventricule gauche (FEVG) massivement diminuée à 28 % avec une hypokinésie diffuse et le ventricule gauche dilaté. Il n’ y a pas de lésions valvulaires significatives.
Des causes spécifiques pour l’ insuffisance cardiaque sont ensuite exclues par des examens de laboratoire, une IRM cardiaque et une angio-CT coronarienne. Le patient nie l’ usage de toxines, les antécédents familiaux sont vierges en ce qui concerne des cardiomyopathies. Le diagnostic de cardiomyopathie dilatée d’ étiologie indéterminée est posé et un traitement doit maintenant être mis en place.
Introduction
Le traitement médicamenteux de l’ insuffisance cardiaque dépend de manière décisive de la fraction d’ éjection du ventricule gauche (FEVG), même si celle-ci n’est pas le paramètre optimal pour évaluer la fonction systolique du ventricule gauche.
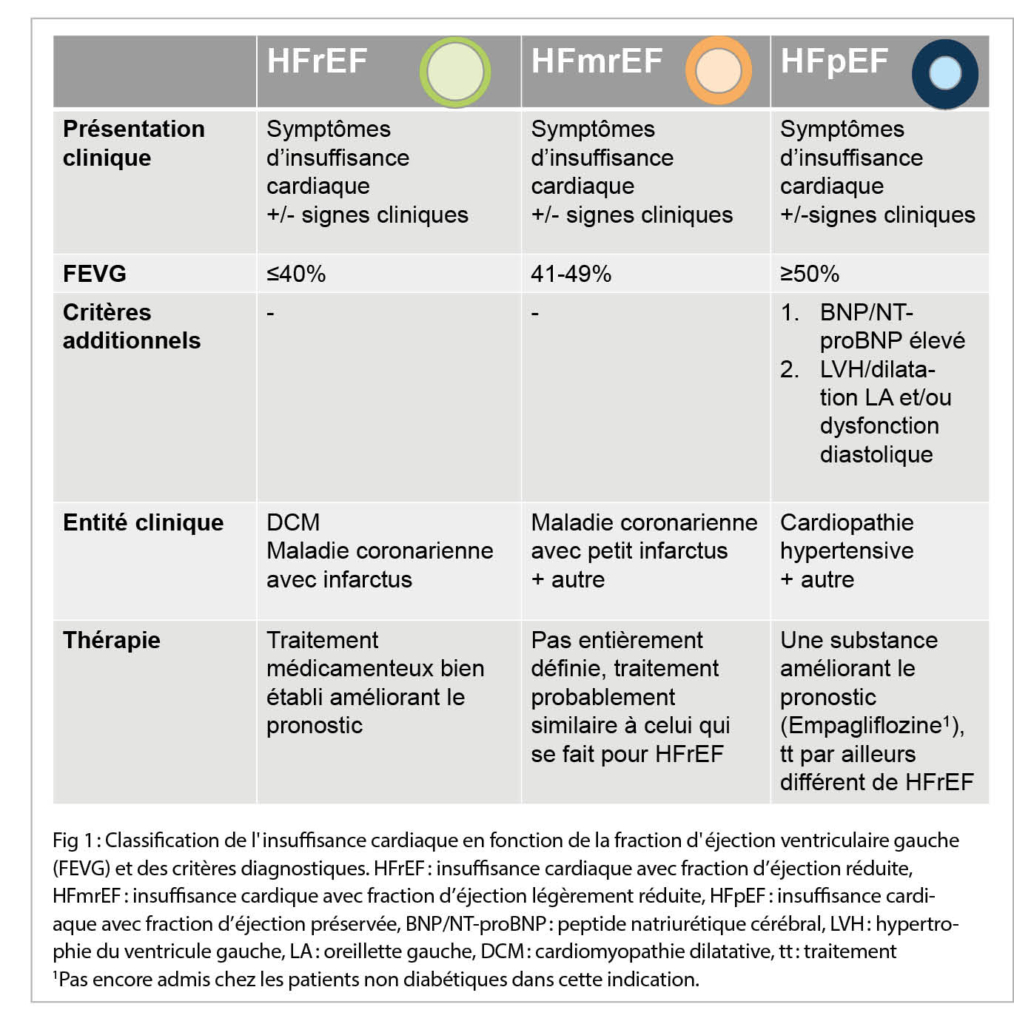
Dans les nouvelles lignes directrices 2021 de la Société Européenne de Cardiologie (ESC) sur l’ insuffisance cardiaque (1), des modifications mineures ont été apportées à la définition des trois phénotypes d’ insuffisance cardiaque précédents (fig. 1). Il convient de noter que des symptômes +/- signes cliniques sont toujours nécessaires pour établir le diagnostic d’ une insuffisance cardiaque. Désormais, les trois phénotypes sont définis comme suit:
1. insuffisance cardiaque avec FEVG réduite ≤40 % (Heart Failure with reduced Ejection Fraction, HFrEF).
2. insuffisance cardiaque avec FEVG légèrement réduite de 41 % à 49 % (Heart Failure with mildly reduced Ejection Fraction, HFmrEF).
3. insuffisance cardiaque avec fraction d’ éjection préservée de ≥50 % et des signes supplémentaires de cardiopathie structurelle et/ou des signes d’ une pression de remplissage augmentée, respectivement d’ une dysfonction diastolique de plus haut degré (Heart Failure with preserved Ejection Fraction (HFpEF).
Par conséquent, une échocardiographie est donc toujours nécessaire pour poser le diagnostic précis d’ une insuffisance cardiaque.
Pour le phénotype HFrEF, il existe de nombreux médicaments qui améliorent le pronostic, mais la thérapie des quatre piliers constitue désormais la base. C’ est elle qui est abordée dans cet article.
Des analyses post hoc d’ « études HFpEF » (incluant typiquement non seulement des patients avec une FEVG ≥50 %, mais aussi des patients avec une FEVG allant jusqu’ à 40 %) indiquent que les médicaments efficaces dans les HFrEF le sont également chez les patients avec HFmrEF.
Une première étude conclusive sur l’ HFpEF publiée récemment (2) a démontré un bénéfice pronostique d’ une thérapie avec l’ empagliflozine (inhibiteur du SGLT2) versus placebo. Le bénéfice était plus important en cas de FEVG « plus basse ». Comme cette étude a été publiée en même temps que les nouvelles directives, elle n’ a pas encore été prise en compte.
Principe du traitement de l’ HFrEF
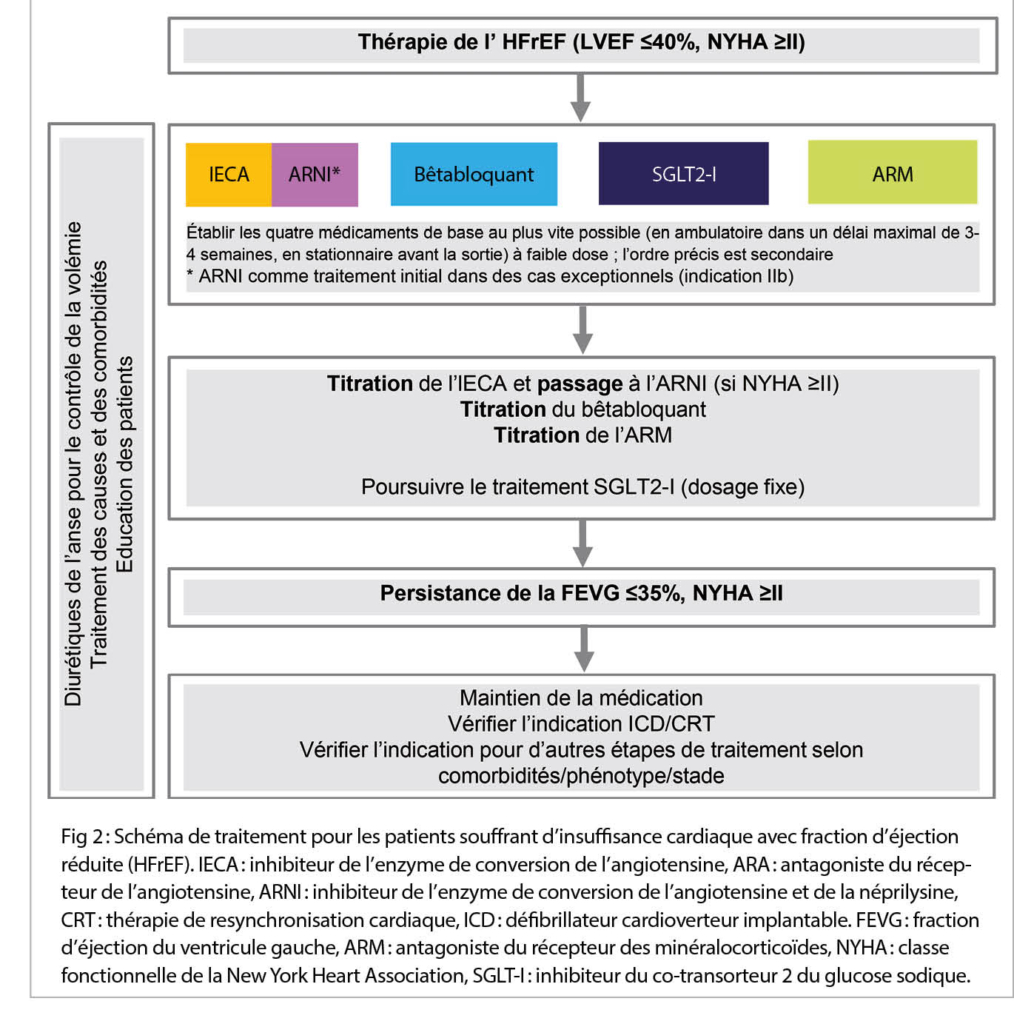
Outre la mise en route d’ un traitement médicamenteux de l’ insuffisance cardiaque, il convient de rechercher et, si possible, de traiter les causes spécifiques de l’ insuffisance cardiaque, comme indiqué dans la vignette clinique (par ex. maladie coronarienne, tachycardie, valvulopathie, hémochromatose, hypothyroïdie, consommation excessive d’ alcool). De plus, une éducation optimale des patients en ce qui concerne la compréhension de la maladie et de la médication ainsi que les changements de comportement sont essentiels pour optimiser l’ observance et le pronostic. Jusqu’ à présent, le traitement médicamenteux de l’ HFrEF suivait un schéma par paliers (3), en utilisant un inhibiteur de l’ enzyme de conversion de l’angiotensine (IECA) (ou un antagoniste du récepteur de l’angiotensine (ARA) en cas d’ intolérance à l’ IECA) et un bêtabloquant. Les doses devaient être titrées si possible jusqu’ à la dose cible. Uniquement si la FEVG ≤35 % et la dyspnée NYHA ≥ II persistaient, on ajoutait comme palier suivant un antagoniste du récepteur aux minéralocorticoïdes (ARM), qui devait alors également être titré jusqu’à la dose cible.
Désormais, à la place de ce schéma clair par paliers, déjà dès le départ et indépendamment de la réponse à l’ IECA et/ou au bêtabloquant, un traitement de base comportant quatre piliers est recommandé. Un inhibiteur du co-transporteur 2 du glucose sodique (SGLT2-I) est inclus en plus des substances citées (IECA, bêtabloquant, ARM) (1). Dans des études à grande échelle contrôlées contre placebo, les deux SGLT2-I dapagliflozine (4) et empagliflozine (5) montraient un bénéfice significatif net sur le critère d’ évaluation combiné décès et hospitalisations pour cause d’ insuffisance cardiaque, ceci principalement en raison d’ une réduction des hospitalisations par rapport au placebo. Un bénéfice significatif pour la mortalité n’ a pu être observé, à proprement parler, que pour la dapagliflozine (4). Ces quatre piliers thérapeutiques – tous avec une recommandation thérapeutique de classe I – sont à administrer en parallèle et à de faibles doses le plus tôt possible à tous les patients HFrEF. Ce n’ est qu’ ensuite que les différents piliers sont titrés et que l’ IECA est remplacé, si possible, par l’ inhibiteur du récepteur de l’ angiotensine et de la neprilysine (ARNI) (fig. 2).
La question de savoir si l’ on ne peut pas aussi commencer directement par l’ ARNI fait souvent l’ objet de controverses. L’ utilisation de l’ ARNI après l’ établissement préalable d’ un IECA correspond à la procédure de l’ étude PARADIGM-HFS (6), qui a démontré le bénéfice de l’ ARNI par rapport à l’ IECA. Un début direct avec un traitement ARNI peut être envisagé chez les patients hospitalisés : Il a été démontré que cette manière de pratiquer produit une réduction plus importante du NT-proBNP que l’ IECA et qu’ elle est sûre (7). Cette étude (PIONEER-HF) était cependant trop petite pour fournir des données significatives sur l’ outcome. Par conséquent et compte tenu des données, il est logique de classifier cette procédure comme une recommandation de classe IIb (« may be considered »). Néanmoins, contrairement aux directives européennes, les directives américaines sur l’ insuffisance cardiaque recommandent l’ ARNI comme traitement de première ligne (8).
En Suisse, il faut également tenir compte du fait qu’ il existe une limitation des assurances maladie de base pour le remboursement de l’ association de l’ ARNI avec un SGLT2-I chez les patients non diabétiques, jusqu’ à l’ automne 2022 au moins. D’ un point de vue médical, cette position est incompréhensible, car rien ne prouve que les inhibiteurs de SGLT-2 soient moins efficaces en cas de traitement de fond par l’ ARNI.
La nouvelle stratégie des quatre piliers repose sur l’ hypothèse disant qu’ il est important d’ inhiber le plus tôt possible les quatre voies physiopathologiques (« pathways »), même si les doses maximales ne devaient pas être atteintes pour toutes les substances (9, 10). Il est important de réaliser que les quatre piliers ne constituent non seulement un traitement des symptômes, mais aussi une thérapie qui améliore fortement le pronostic. Étant donné que l’ insuffisance cardiaque, aujourd’ hui encore, a un mauvais pronostic (parfois même pire que de nombreuses maladies tumorales), la mise en place entière du traitement de l’ insuffisance cardiaque est essentielle (11).
Si, après l’ établissement et le dosage optimal du traitement de base, la FEVG persiste à ≤35 % avec une symptomatologie NYHA ≥ II, d’ autres étapes thérapeutiques entrent en jeu. Il s’ agit notamment de thérapies « à l’ aide de dispositifs » (notamment la thérapie de resynchronisation (CRT) ainsi que les défibrillateurs (ICD)) et d’ autres options médicamenteuses pour le traitement de l’ insuffisance cardiaque jusqu’ à des dispositifs d’ assistance ventriculaire gauche et une transplantation cardiaque en cas d’ insuffisance cardiaque avancée (fig. 2). Si par contre, avec le traitement de base des quatre piliers, la FEVG s’ améliore à >35 % et que le patient ne présente plus de symptômes, il n’ y a aucune indication pour une extension du traitement. Toutefois, le traitement établi ne doit pas être réduit ou même arrêté (sauf en cas d’ effets secondaires). Cela entraînerait une nouvelle aggravation de l’ insuffisance cardiaque dans une proportion importante des patients (12).
La mise en place de la thérapie de base des quatre piliers dans la pratique quotidienne
Les lignes directrices n’ expliquent pas concrètement comment le traitement des quatre piliers doit être mis en place dans la pratique quotidienne. Les experts recommandent de commencer la thérapie avec tous les quatre piliers, et d’ arriver à leur titrage en l’ espace de 6 semaines (13). Cependant, dans la pratique, souvent cela ne peut pas être atteint si rapidement. Nous recommandons d’ administrer, dans la prise en charge ambulatoire, les quatre substances en l’ espace de 3 à 4 semaines au maximum, en commençant par un faible dosage, et d’ augmenter les doses par la suite. En milieu hospitalier, les quatre piliers devraient être établis à la sortie, au moins dans un dosage faible (fig. 2).
La séquence exacte de l’ instauration est également laissée en suspens dans les guidelines. Elle doit se faire en fonction des facteurs spécifiques au patient. Ci-après, quelques exemples de scénarios et les réflexions correspondantes concernant la mise en route du traitement :
1. Tension artérielle normale/haute au départ, fonction rénale et potassium normaux : cela favorise un début de traitement avec une dose déjà relativement élevée d’ un IECA en combinaison avec un ARM. Ensuite, un bêtabloquant à faible dose est administré. Le SGLT2-I peut y être combiné à tout moment.
2. Tension artérielle initialement basse et FEVG très limitée : ici on peut commencer le traitement par un IECA à très faible dose et un SGLT2-I, avant d’ajouter au fur et à mesure un bêtabloquant à très faible dose et l’ ARM.
3. Fonction rénale initialement nettement réduite et FEVG modérément réduite : cela favorise le début du traitement par un SGTL2-I (à condition que eGFR >20ml/min/1.73m2) et un bêtabloquant à faible dose. En fonction de l’ évolution de la fonction rénale et du potassium, un IECA à faible dose et, si possible enfin, un ARM sont ajoutés.
Le patient de la vignette clinique, avec les caractéristiques et les résultats décrits, correspond le mieux à l’ exemple du scénario 1. Par conséquent, son traitement a été initié par un IECA et un ARM pratiquement en même temps pour être complété dans les 10 à 14 jours sans problème avec un bêtabloquant à faible dose et un SGTL2-I.
Titration du traitement de base des quatre piliers et passage de l’ IECA à l’ ARNI dans la pratique quotidienne
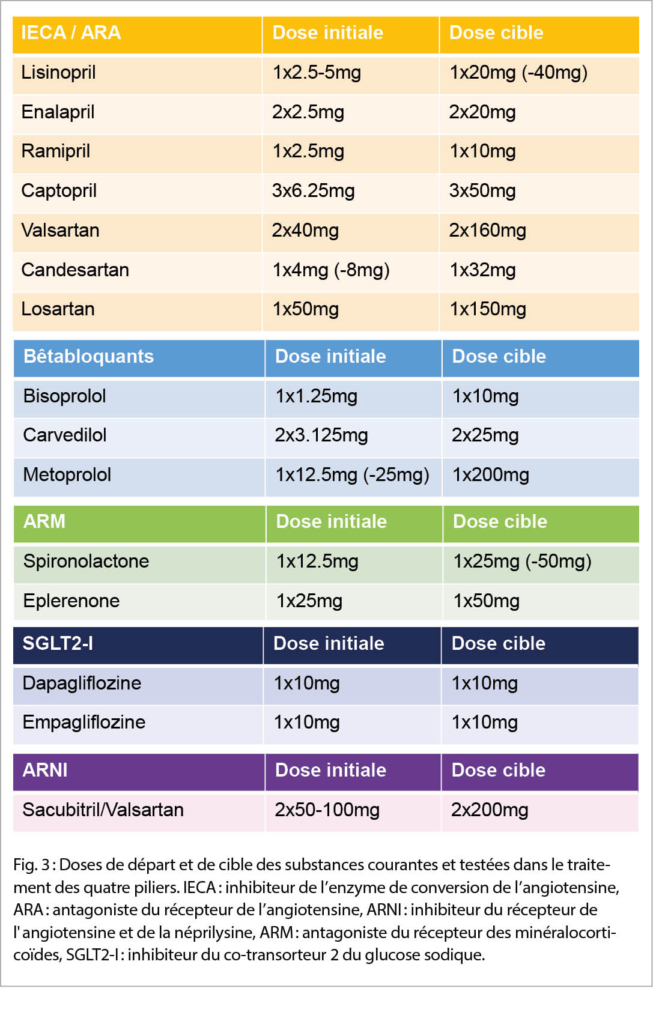
Une fois les quatre piliers thérapeutiques introduits, trois d’ entre eux (l’ IECA, le bêtabloquant, l’ ARM) doivent être titrés jusqu’ aux doses cibles respectives ou à la dose maximale tolérée (fig. 3). Les deux médicaments SGLT2-I autorisés en Suisse, empagliflozine et dapagliflozine, sont administrés à une dose fixe de 10mg/d et ne sont pas à titrer. Mais seulement la dapagliflozine figure sur la liste des spécialités dans cette indication sans diabète sucré présent, (4, 5). L’ objectif est d’ ajuster la posologie de l’ IECA et de l’ ARM en surveillant la clinique, la créatinine et le potassium tous les 14 jours (14).
En milieu hospitalier avec de meilleures possibilités de surveillance, cela doit se faire plus rapidement. Il n’ est pas rare que le titrage de ces deux piliers thérapeutiques ne soit possible que de manière limitée. Les facteurs suivants y jouent un rôle important (14) :
1. L’ hypotension : elle survient surtout chez les patients sans hypertension préexistante et ne doit pas conduire d’ emblée à une réduction du traitement de l’ insuffisance cardiaque. Les valeurs tensionnelles hypotensives asymptomatiques peuvent être admises sans modification de la médication (sauf éventuellement réduction du dosage des diurétiques). En cas d’ hypotension symptomatique, les antihypertenseurs qui n’ apportent aucun bénéfice à l’ insuffisance cardiaque doivent être arrêtés en premier lieu (par ex. l’ amlodipine, les nitrates, les alpha-bloquants), et un éventuel traitement diurétique doit être limité au dosage minimal nécessaire au maintien d’ une normovolémie. Ce n’ est qu’ en cas d’ hypotension symptomatique persistante qu’ une réduction de la dose de l’ IECA/ARM est nécessaire, au moins temporairement. Chez les patients avec indication pour une CRT, un tel appareil doit être implanté précocement, car il peut conduire à une augmentation de la pression artérielle via l’ amélioration du débit cardiaque, et ainsi permettre une extension ultérieure du traitement.
2. L’ Insuffisance rénale : en principe, une augmentation de la créatinine en cas d’ amélioration clinique ne doit pas entraîner une réduction du traitement. Les directives recommandent de tolérer une augmentation de la créatinine de 50 % par rapport à la ligne de base ou jusqu’ à 266 µmol/l (ou eGFR 25 ml/min/1.73 m2) avant de modifier la dose d’ IECA, d’ ARA ou d’ ARNI (1). Si la créatinine est supérieure à 100% de la ligne de base ou à 310 µmol/l (ou eGFR <20 ml/min/1.73 m2), le traitement par IECA, ARA ou ARNI doit être arrêté (1). Il s’ agit-là seulement de valeurs indicatives et la procédure exacte dépend du setting correspondant. Dans tous les cas, le statut volumique doit être clarifié (soit hypovolémie, soit hypervolémie, toutes deux peuvent entraîner une détérioration de la fonction rénale), et d’ éventuels médicaments néphrotoxiques (p. ex. AINS) doivent être remplacés par d’ autres analgésiques.
3. L’ Hyperpotassémie : L’ ARM en particulier peut entraîner une hyperkaliémie importante (surtout en cas d’ insuffisance rénale concomitante). Une augmentation du potassium jusqu’ à 5.5 mmol/l peut être tolérée sous surveillance adéquate. En cas de valeurs de potassium de 5,5-6 mmol/l, il faut réduire la dose de l’ ARM, et si le potassium est >6 mmol/l, il faut l’ arrêter. Par ailleurs, d’ autres stratégies de réduction du potassium doivent également être évaluées. Il s’ agit notamment de remplacer l’ IECA par l’ ARNI (ce dernier entraîne une augmentation légèrement moins importante du potassium (15)), de donner en dose fixe un diurétique de l’ anse (une hypovolémie doit absolument être évitée) ou d’ utiliser de nouveaux chélateurs du potassium comme le patiromère (cave : limitation pour l’ indication) (16) afin de réduire le potassium sérique et permettre un traitement par IECA/ARM maximal.
L’ augmentation du dosage du bêtabloquant doit se faire avec prudence, en particulier chez les patients avec une FEVG sévèrement altérée, afin de minimiser notamment le potentiel effet inotrope négatif. Un doublement de la dose ne devrait pas se faire plus rapidement que toutes les 2 semaines, voire même plus. En principe, il est essentiel aussi pour le bêtabloquant de viser le dosage le plus élevé possible. L’ effet pronostique en cas d’ HFrEF est proportionnel à la réduction de la fréquence cardiaque ou inversement proportionnel à la fréquence cardiaque atteinte sous traitement, la fréquence cardiaque cible au repos étant <70/min. Un effet thérapeutique indépendant de la fréquence cardiaque est toutefois toujours présent. La dose ne doit être réduite que lors d’ apparition sous traitement bêtabloquant d’ une bradycardie symptomatique avec une fréquence cardiaque <50/min (ou un bloc AV de degré supérieur).
Après le titrage des piliers susmentionnés le passage précoce et si possible standard de l’ IECA à l’ ARNI s’ impose, s’ il existe encore au moins une symptomatologie NYHA II. Lors du passage d’ un IECA à l’ ARNI, une pause thérapeutique de 36 heures doit être observée en raison du risque d’ angio-œdème. Lors du passage d’ un ARA à l’ ARNI, cette pause thérapeutique n’ est pas nécessaire. Si un IECA a été toléré à au moins la moitié de la dose cible, on peut commencer par le sacubitril/valsartan 2x100mg/d et passer à 2x200mg après 2 semaines. Sinon, la dose de départ est de 2x50mg/d. La réduction de la pression artérielle sous sacubitril/valsartan peut être plus importante que sous IECA (6). Cependant, même chez les patients avec une pression artérielle relativement basse le changement de médicaments doit être effectué. La réduction absolue du risque de décès cardiovasculaire ou d’ hospitalisation pour insuffisance cardiaque dans ce groupe de patients est particulièrement élevée si l’ ARNI est utilisé avec succès (17). Pourtant, l’ introduction doit se faire à très faible dose et de manière lente.
Chez le patient de la vignette clinique initiale, l’ ensemble du traitement des quatre piliers a pu être mis en œuvre jusqu’ aux doses cible et l’ IECA remplacé avec succès par l’ ARNI. La FEVG s’ est améliorée de manière substantielle. Elle a été évaluée à 40 % lors de l’ échocardiographie de suivi après 6 mois de traitement. Le patient ne présente plus de symptômes cardiaques. La poursuite du traitement sans réduction des doses est maintenant essentielle.
Dr méd. Marc Buser
Dr méd. Christian Gall
Dre méd. Eva Scheler
Pr Dr méd. Hans Rickli
Pr Dr méd. Micha T. Maeder
Clinique de Cardiologie, Hôpital Cantonal de St. Gall
Rorschacherstrasse 95, 9007 St. Gall
Correspondance : micha.maeder@kssg.ch
Article traduit de « der informierte arzt » 04-2022
Copyright Aerzteverlag medinfo AG
Clinique de Cardiologie
Hôpital Cantonal de St. Gall
Rorschacherstrasse 95
9007 St. Gall
Clinique de Cardiologie
Hôpital Cantonal de St. Gall
Rorschacherstrasse 95
9007 St. Gall
micha.maeder@kssg.ch
Les auteurs n’ ont déclaré aucun conflit d’ intérêt en relation avec cet article.
◆ Le traitement médicamenteux moderne de l’ insuffisance cardiaque avec fonction systolique réduite (HFrEF) consiste en un traitement de base à quatre piliers, efficace sur le plan pronostique et symptomatique.
◆ Les quatre piliers thérapeutiques doivent d’ abord être établis en
parallèle à faible dose et ne seront titrés qu’ ensuite à la dose cible
respective. Ensuite, on passe de l’IECA à l’ARNI.
◆ Si la FEVG ≤35 % persiste sous traitement de base établi, avec une dyspnée NYHA ≥II, d’ autres options doivent être envisagées (thérapies à l’ aide de dispositifs, autres possibilités de traitement médicamenteux et non médicamenteux).
1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
2. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, Brunner-La Rocca H-P, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-1461.
3. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200.
4. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008.
5. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-24.
6. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371(11):993-1004.
7. Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med. 2019;380(6):539-48.
8. Maddox TM, Januzzi JL et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10
Pivotal Issues About Heart Failure With Reduced Ejection Fraction. JACC 2021:77; 772-810.
9. Lam CSP, Butler J. Victims of Success in Failure. Circulation. 2020;
142(12):1129-31.
10. Vaduganathan M, Claggett BL, Jhund PS, Cunningham JW, Pedro Ferreira J, Zannad F, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet. 2020;396(10244):121-8.
11. Mamas MA, Sperrin M, Watson MC, Coutts A, Wilde K, Burton C, et al. Do patients have worse outcomes in heart failure than in cancer? A primary care-based cohort study with 10-year follow-up in Scotland. Eur J Heart Fail. 2017;19(9):1095-104.
12. Halliday BP, Wassall R, Lota AS, Khalique Z, Gregson J, Newsome S, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet. 2019;393(10166):61-73.
13. Greene SJ, Butler J, Fonarow GC. Simultaneous or Rapid Sequence Initiation of Quadruple Medical Therapy for Heart Failure-Optimizing Therapy With the Need for Speed. JAMA Cardiol. 2021;6(7):743-4.
14. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: supplementary data. Eur Heart J. 2021;00:1-42
15. Desai AS, Vardeny O, Claggett B, McMurray JJ, Packer M, Swedberg K, et al. Reduced Risk of Hyperkalemia During Treatment of Heart Failure With Mineralocorticoid Receptor Antagonists by Use of Sacubitril/Valsartan Compared With Enalapril: A Secondary Analysis of the PARADIGM-HF Trial. JAMA Cardiol. 2017;2(1):79-85.
16. Meyer P, Lu H, Hullin R. Patiromer and medication optimisation in heart failure with reduced ejection fraction: a Swiss perspective. Swiss Med Wkly. 2020;150:w20362
17. Bohm M, Young R, Jhund PS, Solomon SD, Gong J, Lefkowitz MP, et al. Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017;38(15):1132-43.
la gazette médicale
- Vol. 11
- Ausgabe 4
- Juli 2022