- Best of EHA 2022 Europäischer Hämatologie-Kongress
Editorial

Hybrid Konferenzen als neuer Goldstandard?
Liebe Kolleginnen und Kollegen,
nach zweijähriger Pause bot sich im Juni erstmalig wieder die Gelegenheit, nationale und internationale Kolleginnen und Kollegen im Rahmen des diesjährigen EHA Hämatologie Kongresses in Wien zu treffen. Das Kongresszentrum war recht gut gefüllt und viele nutzten die Chance, den persönlichen Kontakt wieder aufzugreifen. Der Kongress wurde erfreulicherweise parallel durch eine online Plattform im sog. Hybridkonzept unterstützt. Somit war es den einzelnen Teilnehmerinnen und Teilnehmer überlassen, sich entweder vor Ort zu treffen und den persönlichen Austausch zu führen oder doch von zu Hause bzw. dem Büro aus ohne Reisestress und in einer ruhigen Atmosphäre den Inhalten des Kongresses zu folgen. Aus meiner Sicht sollte dieses Konzept in Zukunft beibehalten werden und damit allen Teilnehmerinnen und Teilnehmern eine höhere Flexibilität der persönlichen Fortbildung, interaktiven Kommunikation aber auch, falls gewünscht, Reisetätigkeit in andere Länder ermöglichen.
Der diesjährige EHA Kongress wies ein hohes wissenschaftliches Niveau auf und ich möchte, ohne den Autoren dieses Heftes vorgreifen zu wollen, kurz meine Highlights vorstellen. Es wurden viele Studien vorgestellt, die uns neue Entwicklungen in der Hämatologie aufzeigen als auch die Möglichkeit geben, unsere Patientinnen und Patienten besser, d.h. mit höheren Ansprechraten oder auch weniger Nebenwirkungen effektiv zu behandeln.
1. Auf dem Gebiet der indolenten Lymphome bzw. chronisch lymphatischen Leukämie zeigt sich zum einen, dass die Kombination aus Immuntherapie (CD20 Antikörper) und gezielter Therapie wie zum Beispiel BCL2 Inhibitoren eine zeitlich begrenzte Therapie bei fitten (GAIA/CLL13 Studie) als auch sog. co-morbiden Patienten (CLL14 Studie) ermöglichen. Zudem haben wir inzwischen verschiedene Kombinationsmöglichkeiten aus CD20 spezifischem Antikörper, BTK Inhibitor (BTKi) und BCL2 Inhibitor, um ein tiefes molekulares Ansprechen mit einer zeitlich befristeten Behandlung zu erreichen.
2. Recht kontrovers wurde die SHINE Studie in der Erstlinientherapie älterer Mantelzell Lymphom (MCL) Patientinnen bzw. Patienten diskutiert. Es zeigte sich durch die Hinzunahme des BTKi Ibrutinib zur Immun-Chemotherapie aus Rituximab und Bendamustin (R-B) eine signifikante Verlängerung des Progressions-freien Überlebens (PFS) um mehr als zwei Jahre im Vergleich zum Kontrollarm (R-B). Vor Ort als auch in den Internetforen wurde intensiv darüber gestritten, ob bei Ausbleiben eines Gesamtüberleben (OS) Benefits diese Therapie nun in der vorliegenden Indikation standardmässig eingesetzt werden sollte. Ich denke, dass neben der Verfügbarkeit der Medikamente auch individuelle Charakteristika (insbesondere Komorbiditäten) der Patientinnen und Patienten Berücksichtigung finden sollten.
3. Eine ähnliche Diskussion ergab sich nach Präsentation der DETERMINATION Studie zur Erstlinientherapie fitter Myelompatientinnen bzw. -patienten. Die Studie zeigte, dass nach VRd Induktionstherapie und anschliessender konsolidierender Hochdosistherapie mit autologem Stammzellsupport gefolgt von einer zeitlich unbefristeten Lenalidomid-Erhaltungstherapie eine im Vergleich zum experimentellen Arm (d.h. ohne Hochdosistherapie mit autologem Stammzellsupport) signifikante PFS Verlängerung (auf 67 Monate) zu erzielen ist. Somit können unsere fitten Patientinnen und Patienten in erster Therapielinie im Schnitt 5,5 Jahre bis zur Progression leben. Da auch in dieser Studie kein OS Vorteil erzielt wurde, war die Diskussion ähnlich zur gerade zitierten SHINE Studie und es Bedarf m.E. einer Abwägung und ausführlichen Patientenaufklärung bzgl. eines generellen Einsatzes dieses Behandlungskonzeptes.
4. Erneut beeindruckend sind die Entwicklungen beim Multiplen Myelom und anderen B-Zell Lymphomen auf dem Gebiet der zellulären als auch Antikörper basierten Immuntherapie. So wurden Aktualisierungen zur CAR-T-Zelltherapie (z.B. ZUMA-7) präsentiert, aber auch neue Studiendaten zum Einsatz bispezifischer Antikörper wie Glofitamab bzw. Epcoritamab beim aggressiven B-Zell Lymphom oder auch Teclistamab beim Multiplen Myelom. Diese in der Regel ambulant durchzuführenden Antikörpertherapien zeigen hohe Ansprechraten mit deutlicher PFS Verlängerung bei akzeptabler Toxizität und stellen eine wesentliche Erweiterung unseres Behandlungsspektrum dar.
5. Besonders erfreut war ich zu sehen, dass es bei der akuten myeloischen Leukämie Studiengruppen gibt, die sich bei fitten Patienten ≥ 60 Jahre in der Erstlinientherapie trauen, das Standard Chemotherapieregime (sogenanntes 3+7 Regime, IC) mit einem Chemotherapie-freien Regime in Form einer hypomethylierenden Substanz (Decitabine, DEC) als Induktionstherapie vor geplanter allogener Stammzelltransplantation (HSCT) herauszufordern. Der Mut der Studiengruppe wurde belohnt, und DEC führte zu einer ähnlichen OS- und HSCT-Rate, aber im Vergleich zu IC bei einem deutlich besseren Sicherheitsprofil.
Ich hoffe, mit meiner persönlichen Stellungnahme Ihr Interesse an den nun folgenden detaillierten Studienzusammenfassungen geweckt zu haben und wünsche Ihnen viel Freude beim Lesen
Dr. med. Christoph Renner
Akute myeloische Leukämie
Granulocyte Colony-Stimulating Factor (G-CSF) im Therapiemanagement bei neu diagnostizierter AML
Akute myeloische Leukämie (AML) hat eine schlechte Prognose und tritt vor allem bei älteren Patienten auf, für die eine intensive Chemotherapie aufgrund der Nebenwirkungen oft nicht in Frage kommt [1]. Am diesjährigen Kongress der European Hematology Association (EHA) vom 9. bis12. Juni in Wien wurden neue Daten zum Management von hämatologischen Nebenwirkungen bei Venetoclax-basierter Behandlung von Patienten mit neu diagnostizierter AML gezeigt [2].
AML ist eine aggressive hämatologische Malignität mit schlechter Prognose, die vor allem ältere und komorbide Patienten betrifft, für die eine intensive Chemotherapie häufig nicht möglich ist. Mildere Behandlungsoptionen wie Azacitidin (Aza), Decitabin (Dec) oder niedrig-dosiertes Cytarabin (LDAC) sind besser verträglich, zeigen aber meist nur einen geringen Benefit [1]. Zur Behandlung von Patienten, die nicht für eine intensive Chemotherapie in Frage kommen, kann der B-Zell-Lymphom-2 (BCL2)-Inhibitor Venetoclax (Ven) angewendet werden [3]. In randomisierten, doppelblinden Phase-3-Studien erreichte dieser in Kombination mit Aza oder Dec (VIALE-A) sowie in Kombination mit LDAC (VIALE-C) ein gutes Ansprechen [1, 4]. Eine mögliche Nebenwirkung der Behandlung ist Myelosuppression mit Neutropenie, Anämie und Thrombozytopenie als Folge, was einen Therapieunterbruch auslösen kann.
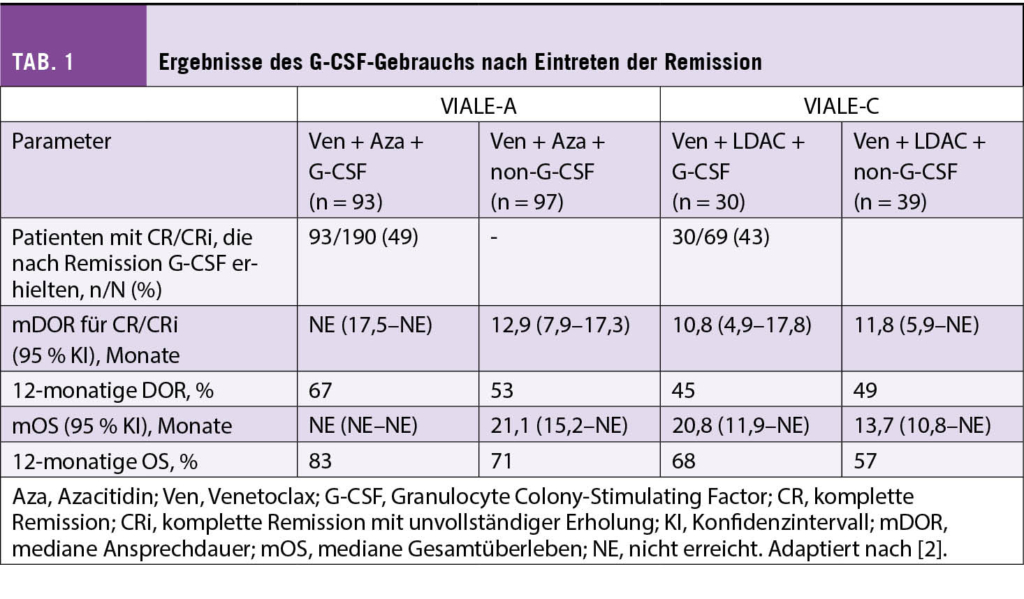
Granulocyte Colony-Stimulating Factor (G-CSF) wird nach Ermessen des behandelnden Arztes eingesetzt, diesen unerwünschten Ereignissen entgegenzuwirken [5]. Am EHA-Kongress wurden Daten zum Einfluss von G-CSF auf die AML-Behandlung vorgestellt.
G-CSF nach Remission unter Venetoclax-basierter Therapie
In der VIALE-A Studie erreichten 190 der 286 Patienten unter Ven + Aza eine komplette Remission oder eine komplette Remission mit unvollständiger Erholung (CR/CRi). Die Hälfte dieser Patienten erhielt median 36 Tage nach Eintreten der Remission G-CSF. In der VIALE-C Studie wurden 43 % der Patienten, die unter Ven + LDAC ein CR/CRi zeigten, mit G-CSF behandelt (Tabelle). Hier betrug die mediane Zeit zum ersten G-CSF Gebrauch nach Remission 30 Tage. Der Einfluss auf die Dauer des Ansprechens (DOR), das mediane Gesamtüberleben (mOS) und die Rate sowie die Dauer von Neutropenie und febriler Neutropenie ≥ 3. Schweregrades wurde untersucht [2].
Kein negativer Einfluss von G-CSF auf DOR und OS
In der Studie VIALE-A betrug die 12-monatige DOR bei Patienten unter Ven + Aza + G-CSF 67 % respektive 53 % bei Patienten unter Ven+Aza, die kein G-CSF erhalten hatten. In der In VIALE-C Studie mit Patienten unter Ven + LDAC lag dieser Wert bei 45 % respektive 49 %. Das 12-monatige OS in VIALE-A war 83 % bei Patienten, die G-CSF erhielten, und 71 % bei denen ohne diese Form des Therapiemanagements. Unter Ven + LDAC + G-CSF lag die erwartete 12-monatige OS-Rate in VIALE-C bei 68 % und ohne G-CSF bei 57 % (Tabelle).
Neutropenie und febrile Neutropenie ≥ 3. Schweregrades traten mit 33 % und 39 % respektive 29 % und 20 % bei Patienten unter Ven + Aza auf, die G-CSF respektive kein G-CSF erhielten. Die mediane Dauer der Nebenwirkungen betrug 12,5 und 8 Tage mit G-CSF respektive 16 und 10,5 Tage ohne G-CSF-Behandlung. In VIALE-C betrug die Rate von Neutropenie und febriler Neutropenie 53 % und 23 % respektive 51 % und 8 % bei Patienten mit respektive ohne G-CSF Behandlung. Die mediane Dauer der Nebenwirkungen war 15 und 6 Tage respektive 12,5 und 29 Tage [2].
Fazit
In den Phase-3-Studien VIALE-A und VIALE-C wurde G-CSF regelmässig zum Management von Neutropenie angewendet und zeigte keinen negativen Einfluss auf das Gesamtüberleben und die Ansprechdauer unter Venetoclax-basierten Kombinationstherapien. Zudem war unter G-CSF ein Trend in Richtung verkürzte Dauer der Neutropenie und der febrilen Neutropenie ≥ 3. Schweregrades nach Erreichen von Remission erkennbar [2]. Die Ergebnisse dieser Analysen können dazu beitragen, das Management Venetoclax-basierter AML-Therapien weiter zu optimieren.
red.
Literatur:
1. DiNardo CD et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med, 2020. 383(7): p. 617-629.
2. DiNardo et al., The Impact of Post-Remission Granuloyte Colony-Stimulating Factor Use in the Phase 3 Studies of Venetoclax Combination Treatments in Patients with Newly Diagnosed Acute Myeloid Leukemia. Presented at
EHA-congress in Vienna, Austria, June 2022. P510.
3. Aktuelle Fachinformation Venclyxto®. www.swissmedicinfo.ch.
4. Wei AH et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: a phase
3 randomized placebo-controlled trial. Blood, 2020. 135(24): p. 2137-2145.
5. Richard-Carpentier G et al. Venetoclax for the treatment of newly diagnosed acute myeloid leukemia in patients who are ineligible for intensive chemotherapy. Ther Adv Hematol, 2019. 10: p. 2040620719882822.
Up-Front GIV oder GV beim CLL: PFS im Vergleich zur Standard-CIT verbessert
Venetoclax mit fester Dauer plus Obinutuzumab (GV) up-Front ist zu einer der Standardbehandlungen beim CLL mit geringerem Risiko geworden. Darüber hinaus haben Dreifachkombinationen mit BTK-Inhibitoren in Phase-II-Studien vielversprechende Ergebnisse gezeigt. Die GAIA/CLL13-Studie bewertete die Wirksamkeit und Sicherheit von drei zeitlich begrenzten, auf Venetoclax basierenden Erstlinientherapien im Vergleich zu Chemoimmunotherapie (CIT) bei fitten Patienten mit CLL. Die am ASH 2021 vorgestellte MRD-Analyse als einer von zwei primären Endpunkten der GAIA/CLL13-Studie, zeigte hohe Raten nicht nachweisbarer MRD (uMRD) im peripheren Blut (PB) bei Patienten mit GV (86,5 %) oder GV+Ibrutinib (GIV) (92,2 %) im Vergleich zu CIT (52,0 %; p < 0,0001 für beide Vergleiche).
Therapie:
- sechs CIT-Zyklen (FCR für Patienten ≤65 Jahre; BR für Patienten >65 Jahre) oder
- V und Rituximab,
- V und Obinutuzumab,
- V, Obinutuzumab und Ibrutinib.
Der zweite co-primäre Endpunkt wurde erreicht, da GIV im Vergleich zu CIT ein überlegenes PFS zeigte (p < 0,0001)
- überlegenes PFS auch für GV vs. CIT (p < 0,0001),
- PFS nicht signifikant verschieden zwischen RV und CIT.
- 3-Jahres-PFS-Raten: 90,5 % (GIVe); 87,7 % (GV); 80,8 % (RV); 75,5 % (CIT).
- Weitere 3-Jahres-PFS-Raten:
- nicht mutiertes IGHV: 86,6 % (GIV), 82,9 % (GV), 76,4 % (RV) und 65,5 % (CIT) mutiertes IGHV: 96,0 % (GIV), 93,6 % (GV), 87,0 % (RV) und 89,9 % (CIT).
- In allen Behandlungsarmen wurden ähnliche OS-Raten beobachtet.
Es wurden keine größeren Unterschiede bei den hämatologischen Nebenwirkungen zwischen allen vier Armen beobachtet. Infektionen der CTC-Grade 3-4 waren häufiger bei GIV (21,2 %) oder CIT (18,5 %) versus GV (13,2 %) oder RV (10,5 %). Sekundäre Neoplasien traten häufiger bei CIT (36 Pat.) auf als bei den Armen GV, GIV, RV (23, 24, 21 Pat.). Tödliche UE schliesslich gab es bei jeweils 9 Patienten mit GV und GIV, 10 mit CIT und 8 mit RV.
Fazit
Die Autoren kommen zum Schluss, dass die zeitlich begrenzte Behandlung mit GIV oder GV das PFS im Vergleich zur Standard-CIT bei fitten, zuvor unbehandelten Patienten mit CLL verbessert.
TF
TIME-LIMITED VENETOCLAX-OBINUTUZUMAB +/- IBRUTINIB IS SUPERIOR TO CHEMOIMMUNOTHERAPY IN FRONTLINE CHRONIC LYMPHOCYTIC LEUKEMIA (CLL): PFS CO-PRIMARY ENDPOINT OF THE RANDOMIZED PHASE 3 GAIA/CLL13 TRIAL
EHA Library Eichhorst B. 06/12/22; 366209; LB2365
DA-EPOCH-R beim BL: Signifikant weniger infektiöse Komplikationen, Transfusionen und Krankenhausaufenthaltstage
Die Behandlung mit einer hochdosierten Chemotherapie mit mehreren Wirkstoffen wie R-CODOX-M/R-IVAC ist beim Hochrisiko-Burkitt-Lymphom (BL) wirksam (2-Jahres-PFS 64-71 %). Dies geht allerdings laut den Studienautoren auf Kosten einer erheblichen Toxizität und eines langen Krankenhausaufenthalts. DA-EPOCH-R hat in einer Phase-II-Studie ein günstiges 2-Jahres-PFS von 85 % und weniger Toxizität gezeigt. Hier präsentieren die Autoren die ersten Ergebnisse einer randomisierten Studie zum Vergleich von R-CODOX-M/R-IVAC mit DA-EPOCH-R (EudraCT2013-004394-27).
Die Studie war darauf ausgelegt, eine Verbesserung des 2-Jahres-PFS (primärer Endpunkt) von 70 % mit R-CODOX-M/R-IVAC (Arm A) auf 85 % mit DA-EPOCH-R (Arm B) bei Patienten mit neu aufgetretener BL diagnostiziert. Eingeschlossen wurden Patienten (18-75 Jahre) mit neu diagnostiziertem (sporadischem und HIV-assoziiertem) Hochrisiko-BL. Sie erhielten:
- 2 Zyklen R-CODOX-M/R-IVAC oder
- 6 Zyklen DA-EPOCH-R.
- Alle Patienten erhielten eine intrathekale ZNS-Prophylaxe.
In Arm A brachen 9/43 (21 %) Patienten die Behandlung ab (Grund: 4 übermäßige Toxizität, 3 Progression, 1 Verweigerung, 2 Tod (1 BL, 1 Sepsis)) vs. 4/41 (10 %, Grund: 3 Progression, 1 Tod (COVID)) in Arm B. Die häufigsten SUE waren infektiöse Komplikationen (73 %) in Arm A gegenüber (46 %) in Arm B (p = 0,04).
In Arm A erhielten die Patienten im Median 2 (0–37) Thrombozytentransfusionen und 5 (0–28) Erythrozytentransfusionen gegenüber 0 (0–6) und 1 (0–17) in Arm B (beide p < 0,01). In Arm A wurden die Patienten 46 Nächte (Mittelwert 1–99) im Vergleich zu 25 Nächten (4–78) in Arm B (p < 0,01) stationär behandelt.
Fazit
Dies ist laut den Studienautoren die erste multizentrische randomisierte Studie, die zwei verschiedene Chemotherapieschemata bei BL vergleicht. Die Studie
wurde vorzeitig beendet. Die Behandlung mit DA-EPOCH-R führte zu vergleichbaren CMR- und Überlebensraten wie R-CODOX-M/R-IVAC. Allerdings gab es signifikant weniger infektiöse Komplikationen, Transfusionen und Krankenhausaufenthaltstage.
TF
EVOLUTIONARY LANDSCAPE OF CLONAL HEMATOPOIESIS REVEALED BY LONGITUDINAL R-CODOX-M/R-IVAC VERSUS DOSE-ADJUSTED(DA)-EPOCH-R IN PATIENTS WITH NEWLY DIAGNOSED HIGH-RISK
BURKITT LYMPHOMA; FIRST RESULTS OF A MULTI-CENTER RANDOMIZED HOVON/SAKK TRIAL.
EHA Library Chamuleau M. 06/12/22; 366213; LB2370 .
Asciminib als neue CML-Therapie hat das Potenzial, die Standardbehandlung zu verändern
In der ASCEMBL-Primäranalyse hatte der BCR::ABL1-Inhibitor Asciminib eine überlegene Wirksamkeit und bessere Sicherheit/Verträglichkeit gegenüber Bosutinib (BOS) bei der CML in der chronischen Phase (CML-CP) nach ≥ 2 vorherigen Tyrosinkinase-Inhibitoren (TKIs) gezeigt. Die MMR-Rate in Woche 24 lag bei 25,5 % unter Asciminib vs. 13,2 % unter BOS; der Unterschied in den MMR-Raten nach Adjustierung für die MCyR lag zu Studienbeginn bei 12,2 %. Unter Asciminib gab es weniger unerwünschte Ereignisse (AEs) vom Grad ≥ 3 und UEs auf, die zu einem Behandlungsabbruch führten. Nach einem medianen Follow-up (FU) von 2,3 Jahren (16,5 Monate zusätzliches FU seit der Primäranalyse) berichten die Autoren nun über aktualisierte Wirksamkeits- und Sicherheitsergebnisse bei Erwachsenen mit CML-CP nach ≥ 2 vorherigen TKIs, mit Intoleranz oder fehlender Wirksamkeit gemäß den Empfehlungen des European LeukemiaNet von 2013.
Therapieschema:
- Sie wurden im Verhältnis 2:1 auf Asciminib 40 mg zweimal täglich (n=157) oder BOS 500 mg einmal täglich (n=76) randomisiert, stratifiziert nach MCyR-Ausgangsstatus (Ph+ Metaphasen ≤ 35 %).
Das wichtigste sekundäre Ziel wurde erreicht:
- MMR-Rate in Woche 96 (per ITT): Asciminib 37,6 %, BOS 15,8 %.
- MMR-Rate in Woche 96 mit Asciminib in allen demografischen und prognostischen Subgruppen, einschließlich aller vorherigen TKI-Therapielinien, und unabhängig vom Grund für das Absetzen des letzten TKI durchweg höher als BOS.
- Die mediane Zeit bis zum Therapieversagen betrug 24 Monate unter Asciminib und 6 Monate unter BOS.
Asciminib zeigte weiterhin nach über 2 Jahren FU eine klinisch und statistisch signifikante, überlegene Wirksamkeit und bessere Sicherheit/Verträglichkeit verglichen mit BOS. Das Ansprechen war dauerhaft und die MMR war unter Asciminib mehr als doppelt so hoch wie die BOS. Der Unterschied in den MMR-Raten zwischen den 2 Armen nahm von 12,2 % in Woche 24 auf 21,7 % in Woche 96 zu. Mehr Patienten hatten BCR::ABL1IS ≤ 1 %. Dies ist ein Meilenstein-Ansprechen in späteren Linien und ist mit einem verbesserten Langzeit-Überleben verbunden. Diese Ergebnisse unterstützen gemäss den Studienautoren die Verwendung von Asciminib als neue CML-Therapie mit dem Potenzial, die Standardbehandlung zu verändern.
TF
EFFICACY & SAFETY RESULTS FROM ASCEMBL, A PHASE 3 STUDY OF ASCIMINIB VS BOSUTINIB IN
PATIENTS WITH CML IN CHRONIC PHASE AFTER ≥2 PRIOR TYROSINE KINASE INHIBITORS: WK 96 UPDATE
EHA Library Rea D., et al. Jun 12, 2022; 357019; S155
Bestätigte Rolle von G-Chemo als Behandlungsstandard für die Erstlinienbehandlung beim FL Bestätigte Rolle von G-Chemo als Behandlungsstandard für die Erstlinienbehandlung beim FL
Obinutuzumab (G) verfügt über eine bessere direkte antikörperabhängige zelluläre Zytotoxizität und antikörperabhängige Phagozytose als Rituximab. Die Sicherheit und Wirksamkeit von G-Chemo gegenüber R-Chemo wurde zuvor beim unbehandelten FL im fortgeschrittenen Stadium in der randomisierten Phase-III-Studie GALLIUM (NCT01332968) untersucht. In der Primäranalyse zeigte G-Chemo eine signifikante Verbesserung des progressionsfreien Überlebens (PFS) im Vergleich zu R-Chemo mit einem überschaubaren Sicherheitsprofil (Marcus, et al. 2017); dieser Wirksamkeitsvorteil hielt nach 5 Jahren Beobachtung an (Townsend, et al. 2020).
Hier stellen die Autoren die endgültige Analyse der GALLIUM-Studie bei Patienten mit zuvor unbehandeltem histologischem FL Grad 1–3a vor.
Die Patienten wurden 1:1 randomisiert und erhielten:
- 1000 mg G intravenös (IV; Tage [D] 1, 8 und 15 von Zyklus 1 und D1 der nachfolgenden Zyklen) oder R 375 mg/m2 IV (D1 jedes Zyklus) plus Chemo für 6 oder 8 Zyklen abhängig von dem an jeder Institution ausgewählten Chemo-Grundgerüst.
- bei vollständigem oder teilweisem Ansprechen alle 2 Monate für 2 Jahre oder bis zur Krankheitsprogression (PD) Erhaltungstherapie mit demselben Antikörper.
Behandlungsergebnisse:
- 7-Jahres-PFS mit G-Chemo (63,4 %) versus R-Chemo (55,7 %; Hazard Ratio [HR] 0,77; 95 % Konfidenzintervall [KI]: 0,64–0,93; p = 0,006; Abbildung) verbessert.
- TTNLT war auch mit G-Chemo gegenüber R-Chemo verbessert (HR, 0,71; 95 % KI: 0,58–0,87; p = 0,001);
- Anteil der Patienten, die ihre nächste Behandlung nach 7 Jahren noch nicht begonnen hatten: 74,1 % bzw. 65,4 %.
- Eine Krankheitstransformation wurde bei 4,2 % der Patienten mit G-Chemo und bei 5,0 % der Patienten mit R-Chemo beobachtet.
- 7-Jahres-OS in beiden Armen ähnlich, 88,5 % mit G-Chemo versus 87,2 % mit R-Chemo (HR 0,86; 95 % KI: 0,63–1,18; p = 0,36).
- Mortalität: 75 Patienten im G-Chemo-Arm, 86 Patienten im R-Chemo-Arm, am häufigsten aufgrund von PD (4,2 % bzw. 6,0 %).
Verträglichkeit:
- Inzidenz schwerwiegender UE (SUE): 48,9 % bei G-Chemo und 43,4 % bei R-Chemo.
- Zweitmalignome: Raten zwischen den Armen sind ähnlich.
- Diese Sicherheitsergebnisse stimmen mit früheren Analysen überein.
Nach einer medianen Beobachtungszeit von 8 Jahren wurde laut den Studienautoren eine signifikante Verbesserung des PFS mit G-Chemo im Vergleich zu R-Chemo bei Patienten mit zuvor unbehandeltem FL aufrechterhalten. Dies bestätigt die Rolle von G-Chemo als Behandlungsstandard für die Erstlinienbehandlung beim FL.
TF
Obinutuzumab plus chemotherapy demonstrates long-term benefit over rituximab plus chemotherapy in patients with previously untreated follicular lymphoma, final analysis of the gallium study
EHA Library Townsend W., et al. Jun 11, 2022; 357070; S206
Tisagenlecleucel weiterhin potenziell kurative Behandlungsoption für pädiatrische Patienten und junge Erwachsene mit R/R B-ALL
R/R B-ALL ist bei pädiatrischen Patienten und junge Erwachsene mit einer abnehmenden Heilungswahrscheinlichkeit und zunehmender Morbidität gekennzeichnet. Tisagenlecleucel ist eine autologe CD19-gerichtete CAR-T-Zelltherapie, die für die Anwendung bei diesen Patienten mit B-ALL sowie Erwachsenen mit B-Zell-Lymphomen zugelassen ist. Es führte bei Kindern und jungen Erwachsenen mit R/R B-ALL in der zulassungsrelevanten, offenen, multizentrischen, globalen Phase-II-Studie ELIANA (NCT02435849) zu hohen Remissionsraten (> 80 %), wobei 62 % der Responder nach 24 Monaten rezidivfrei blieben (Grupp et al., Blood, 2018).
Hier berichten die Autoren über die abschließenden Wirksamkeits- und Sicherheitsanalysen bei 79 von 97 eingeschlossenen Patienten, die bis zu 5,9 Jahre nach der Tisagenlecleucel-Infusion nachbeobachtet wurden (64 Patienten mit FU von ≥ 5 Jahren). Das Durchschnittsalter lag bei Studieneintritt bei 11 Jahren (Bereich 3–24) mit einem Median von 3 vorherigen Therapielinien (Bereich 1-8) und in 61 % mit einer früheren Stammzelltransplantation (SCT).
Behandlungsergebnisse:
- ORR (vollständige Remission [CR] oder CR mit unvollständiger hämatologischer Erholung innerhalb von 3 Monaten nach der Infusion): 82 % (95 % KI, 72–90).
- Bei Patienten in Remission (CR/CRi): 5-Jahres-RFS-Rate 49 % (95 %-KI, 34–62),
- Median RFS nicht erreicht (46,8 Monate bei Zensierung für SCT; n = 15).
- mediane Zeit bis zur Erholung der B-Zellen: 38,6 Monate (95 % KI, 23 – nicht erreicht)
- Wahrscheinlichkeit einer B-Zell-Aplasie nach 6 Monaten und 12 Monaten: 83 % (95 % KI, 71–91) und 71 % (95 % KI, 57–82).
- Patienten mit B-Zell-Erholung (< 6 Monate, n = 10; 6–12 Monate, n = 4; > 12 Monate, n = 7) mit einer kumulativen Rückfallinzidenz von 25,2 % über 2 Jahre (wobei SCT als konkurrierendes Risiko behandelt wurde).
- Bei allen Patienten 5-Jahres-EFS- und OS-Raten 42 % (95 % KI, 29–54) bzw. 55 % (95 % KI, 43–66).
Diese >5-jährige Nachbeobachtungsstudie zeigt laut den Autoren die anhaltende dauerhafte Wirksamkeit von Tisagenlecleucel ohne späte Nebenwirkungen bei stark vorbehandelten pädiatrischen und jungen erwachsenen Patienten mit R/R B-ALL. Damit stellt Tisagenlecleucel nach Ansicht der Autoren weiterhin eine potenziell kurative Behandlungsoption für pädiatrische Patienten und junge Erwachsene mit R/R B-ALL dar.
TF
Tisagenlecleucel in pediatric and young adult patients (pts) with relapsed/refractory (r/r)
b-cell acute lymphoblastic leukemia (b-all): final analyses from the eliana study
EHA Library Rives S. et al. Jun 12, 2022; 356977; S112
1-Jahres-Ven-Obi-Therapie weiterhin wirksame Option mit fester Dauer für die CLL und Begleiterkrankungen
Venetoclax-Obinutuzumab (Ven-Obi) fest auf ein Jahr gegeben verbessert gemäss der CLL14-Studie das PFS signifikant verglichen mit Chlorambucil-Obinutuzumab (Clb-Obi) bei zuvor unbehandelter CLL. Das Ziel dieses Berichts ist es, aktualisierte Wirksamkeits- und Sicherheitsdaten aus der laufenden Nachbeobachtung der CLL14-Studie bereitzustellen, wobei alle Patienten seit ≥ 4 Jahren von der Studienbehandlung ausgeschlossen wurden.
Therapieschema und Studienziele
Von den 432 eingeschlossenen Patienten wurden 216 nach dem Zufallsprinzip Ven-Obi und 216 Clb-Obi zugeteilt. Bei einer aktuellen medianen Nachbeobachtungszeit von 65,4 Monaten (Interquartilbereich 52,6–69,4) blieb das
- PFS für Ven-Obi im Vergleich zu Clb-Obi signifikant überlegen (Median nicht erreicht vs. 36,4 Monate; Hazard Ratio [HR] 0,35 [95 % KI 0,26–0,46], p<0,0001).
- 5 Jahre nach der Randomisierung betrug die geschätzte PFS-Rate 62,6 % nach Ven-Obi und 27,0 % nach Clb-Obi.
- Insgesamt 52 Fälle von PD mit 28 erforderlichen Zweitlinienbehandlungen im Ven-Obi-Arm und 132 mit 86 Zweitlinienbehandlungen im Clb-Obi-Arm.
- TTNT nach Ven-Obi signifikant länger (5-Jahres-TTNT 72,1 % vs. 42,8 %; HR 0,42, 95 %-KI 0,31–0,57, p < 0,0001).
Vier Jahre nach Abschluss der Behandlung zeigten
- 39 (18,1 % der Intention-to-treat-Population) Patienten im Ven-Obi-Arm immer noch uMRD,
- 5 Jahre nach der Randomisierung geschätzte OS-Rate 81,9 % im Ven-Obi-Arm und 77,0 % im Clb-Obi-Arm (HR 0,72 [0,48-1,09], p = 0,12).
- Sekundäre primäre Malignome bei 44 (20,8 %) Patienten im Ven-Obi-Arm und 32 (15,0 %) im Clb-Obi-Arm.
- Es wurden keine neuen Sicherheitssignale beobachtet.
Laut den Studienautoren bestätigen diese Daten vier Jahre nach Therapieende einen Verbleib in Remission für über 60 % der Patienten, die Ven-Obi mit fester Dauer von 1 Jahr erhalten hatten. Die Mehrheit, benötigte immer noch keine Zweitlinie der CLL-Therapie. Somit ist für die Autoren die 1-Jahres-Ven-Obi-Therapie weiterhin eine wirksame Option mit fester Dauer für Patienten mit CLL und Begleiterkrankungen, auch bei Hochrisikoerkrankungen.
TF
VENETOCLAX-OBINUTUZUMAB FOR PREVIOUSLY UNTREATED CHRONIC LYMPHOCYTIC LEUKEMIA: 5-YEAR RESULTS OF THE RANDOMIZED CLL14 STUDY
EHA Library Al-Sawaf O., et al. Jun 12, 2022; 357012; S148
CTX001 hat Potenzial für erste CRISPR/Cas9-basierte Therapie zur funktionellen Heilung von Beta-Thalassämie (TDT) und schwerer Sichelzellen Anämie (SCD)
Die Autoren zitieren frühe Daten aus den zulassungsrelevanten Studien CLIMB THAL-111 (NCT03655678) und CLIMB SCD-121 (NCT03745287), die zeigten, dass eine Einzeldosis von CTX001 HbF und Gesamt-Hb ausreichend erhöhte, um Transfusionen von roten Blutkörperchen und vaso-okklusiv Krisen (VOC) zu eliminieren.
Sie präsentieren einen Bericht über Wirksamkeits- und Sicherheitsdaten der ersten 75 Patienten, denen CTX001 in den laufenden Studien CLIMB THAL-111 und CLIMB SCD-121 verabreicht wurde.
Nach der CTX001-Infusion transplantierten alle Patienten Neutrophile und Tc.
Die mediane Zeit bis zur Anreicherung von Neutrophilen und Tc lag bei 29 bzw. 43 Tagen bei Patienten mit TDT und 27 bzw. 32 Tagen bei Patienten mit SCD. 42 von 44 Patienten mit TDT beendeten die Erythrozytentransfusionen.
Patienten mit TDT und SCD mit einer Nachbeobachtungszeit von ≥ 1 Jahr wiesen stabile Anteile bearbeiteter BCL11A-Allele in CD34+-HSPCs im Knochenmark und mononukleären Zellen des peripheren Bluts auf.
Fazit
Die CTX001-Infusion führte bei fast allen Patienten mit TDT zur Eliminierung von Transfusionen und bei allen Patienten mit SCD zur Eliminierung von VOCs, mit damit verbundenen klinisch bedeutsamen Anstiegen von HbF und Gesamt-Hb, die über die Zeit aufrechterhalten wurden. Die Anteile der CRISPR/Cas9-editierten BCL11A-Allele blieben nach > 1 Jahr stabil, was laut den Autoren darauf hindeutet, dass Langzeit-HSCs erfolgreich editiert wurden. Dies bildet die Grundlage für die beobachtete signifikante, dauerhafte Wirksamkeit. Das Sicherheitsprofil ist mit der Busulfan-Myeloablation und autologer Transplantation vergleichbar. Diese Ergebnisse weisen laut den Autoren darauf hin, dass CTX001 das Potenzial hat, die erste CRISPR/Cas9-basierte Therapie zu sein, die eine einmalige funktionelle Heilung für TDT und schweren SCD bietet.
TF
EFFICACY AND SAFETY OF A SINGLE DOSE OF CTX001 FOR TRANSFUSION-DEPENDENT ΒETA-THALASSEMIA AND SEVERE SICKLE CELL DISEASE
EHA Library Locatelli F. 06/12/22; 366210; LB2367
Zanubrutinib: Potenzielle Kombinationstherapie für Patienten mit R/R FL
Das Follikuläre Lymphom (FL) ist die häufigste Form des indolenten Non-Hodgkin-Lymphoms und es gibt nur begrenzte zugelassene Behandlungsoptionen für das R/R FL. In einer Phase-1b-Studie (Blood Adv. 2020;4(19):4802-4811) erwies sich Zanubrutinib als verträglich und war mit einem frühen Signal der Wirksamkeit verbunden.
Hier präsentieren die Autoren die primäre Analyse von ROSEWOOD (BGB-3111-212; NCT03332017), einer randomisierten Phase-2-Studie zur Bewertung der Wirksamkeit und Sicherheit von Zanubrutinib und Obinutuzumab (ZO) vs. Obinutuzumab (O) bei Patienten mit R/R FL. Die Patienten mit R/R FL und ≥ 2 Therapielinien, einschließlich eines Anti-CD20-Antikörpers und eines Alkylierungsmittels, wurden im Verhältnis 2:1 randomisiert.
Die mediane Nachbeobachtungszeit der Studie betrug 12,5 Monate und das Durchschnittsalter 64 Jahre. Behandlungsergebnisse:
- Die Studie erreichte ihren primären Endpunkt:
- ORR: 68,3 % mit ZO versus 45,8 % mit O (p = 0,0017).
- CRR: 37,2 % (ZO) versus 19,4 % (O);
- 18-Monats-DOR-Rate: 70,9 % (ZO) vs. 54,6 % (O);
- medianes PFS: 27,4 Monate (ZO) vs. 11,2 Monate (O; Hazard Ratio [HR], 0,51 [95 % KI, 0,32–0,81], p = 0,0040).
- 18-Monats-OS-Wahrscheinlichkeit: 85,4 % (ZO) vs. 72,6 % (O).
Zanubrutinib zeigte eine überlegene Wirksamkeit gegenüber Obinutuzumab bei der Behandlung von Patienten mit R/R FL. Zanubrutinib hatte laut den Studienautoren ein günstiges Nutzen-Risiko-Profil und stellt ihrer Ansicht nach eine potenzielle Kombinationstherapie für Patienten mit R/R FL dar.
TF
ZANUBRUTINIB + OBINUTUZUMAB VS OBINUTUZUMAB MONOTHERAPY IN PATIENTS WITH RELAPSED OR REFRACTORY FOLLICULAR LYMPHOMA: PRIMARY ANALYSIS OF THE PHASE 2 RANDOMIZED ROSEWOOD TRIAL
EHA Library Luigi Zinzani P., et al. Jun 11, 2022; 357069; S205
Quizartinib mit klinisch bedeutsamen Verbesserungen des Gesamtüberlebens bei Erwachsenen mit neu diagnostizierter FLT3-ITD+ AML
Dies ist der erste Bericht der globalen, randomisierten, doppelblinden, Placebo-kontrollierten Phase-3-Studie QuANTUM-First (NCT02668653). Die Studie zielte darauf ab, festzustellen, ob die Hinzufügung von Quizartinib (Quiz) – einem oralen, hochwirksamen, selektiven Typ-II-FLT3-Inhibitor – zur Standardinduktion und Postremission (einschließlich allo-HCT) in erster vollständiger Remissions-Konsolidierung gefolgt von einer Mono-Fortsetzungstherapie für bis 3 Jahre das Überleben im Vergleich zur alleinigen Chemotherapie bei Patienten mit neu diagnostizierter FLT3-ITD+ AML verbessert.
Es wurden 3468 Patienten gescreent und 539 Patienten mit FLT3-ITD+ AML wurden randomisiert Quiz (n=268) oder PBO (n=271) zugeteilt. Das Durchschnittsalter betrug 56 Jahre (Bereich 20–75 Jahre) und das mediane FU: 39,2 Monate.
Behandlungsergebnisse:
- 58 Patienten blieben in der Fortsetzungstherapie.
- Das OS war im Quiz-Arm signifikant länger als im PBO-Arm (2-seitiger p = 0,0324).
- Das mediane OS betrug 31,9 Monate mit Quiz vs. 15,1 Monate mit PBO.
- Die CR/CRi-Raten betrugen 71,6 % bzw. 64,9 %.
- Allo-HCT in CR1 wurde bei 157 Patienten durchgeführt (Quiz, 31 %; PBO, 27 %).
- Bei Zensierung für allo-HCT war der OS-Trend länger bei Quiz vs. PBO (2-seitiges P = 0,055).
- Das rezidivfreie Überleben war bei Quiz länger als bei PBO(HR 0,733; 95 % KI 0,554–0,969).
Fazit
Diese zentralen Ergebnisse zeigen laut den Studienautoren, dass die Ergänzung von Quiz zur Standard-Chemotherapie und eine bis zu 3-jährige Fortsetzungstherapie zu statistisch signifikanten und klinisch bedeutsamen Verbesserungen des Gesamtüberlebens bei Erwachsenen mit neu diagnostizierter FLT3-ITD+ AML bis zu einem Alter von 75 Jahren führte. Das überschaubare Sicherheitsprofil unterstützt außerdem nach Ansicht der Autoren die Verwendung von Quiz in Kombination mit einer Standardtherapie, einschließlich allo-HCT, bei FLT3-ITD+ AML.
TF
QUIZARTINIB PROLONGED SURVIVAL VS PLACEBO + INTENSIVE INDUCTION & CONSOLIDATION THERAPY FOLLOWED BY SINGLE-AGENT CONTINUATION IN PATIENTS AGED 18-75 YEARS WITH NEWLY DIAGNOSED FLT3-ITD+ AML
EHA Library Erba H. 06/11/22; 356965; S100
MRD/risikoadaptierte erweiterte KRd-Behandlung nach ASZT: Möglicher neuer Behandlungsstandard
Die Autoren haben gezeigt, dass eine verlängerte Post-ASCT-Behandlung mit Carfilzomib, Lenalidomid und Dexamethason (KRd) nach KRd-Induktion die Tiefe und Dauer des Ansprechens verbesserte (Jasielec et al., Blood 2020). Dies deutet auf einen Nutzen der Post-ASCT-KRd-Therapie hin.
Sie berichten über die Ergebnisse von ATLAS, einer multizentrischen, internationalen, unverblindeten, randomisierten Phase-3-Studie zur Bestimmung der Wirksamkeit und Sicherheit von KRD nach ASCT im Vergleich zur Erhaltungstherapie mit Lenalidomid (R) (NCT02659293). Es wurden neu diagnostizierte MM-Patienten (R n = 87; KRd n = 93) randomisiert, die eine Induktionstherapie für bis zu 12 Monate gefolgt von einer einzelnen ASCT erhielten und innerhalb von 100 Tagen danach mindestens eine stabile Erkrankung erreichten.
Behandlungsergebnisse:
- ≥ VGPR (88 % vs. 92 %)
- HR (23 % vs. 21 %)
- Nach 6 Zyklen erreichten 47 % der Patienten im KRd-Arm und 29 % im R-Arm MRD-Negativität (p = 0,017).
- 34 KRd-Patienten, die für eine Deeskalation in Frage kamen, wurden nach C8 auf R allein umgestellt und wurden im KRd-Arm pro Intention-to-treat analysiert.
- Bei einer medianen Nachbeobachtungszeit von 33,8 Monaten hatten 23 Patienten (25 %) im KRd-Arm und 38 Patienten (44 %) im R-Arm eine Progression;
- geschätztes medianes PFS: 59,0 Monate für KRd vs. 41,4 Monate für R (Hazard Ratio 0,56, Logrank p = 0,026).
- Beim Cutoff lebten 90 % der KRd- und 87 % der R-Patienten;
Es gab keine behandlungsbedingten Todesfälle und die Toxizitäten aller Grade zwischen den Armen waren generell vergleichbar. Dies ist die erste randomisierte Phase-3-Studie mit verlängerter KRd-Therapie nach der Transplantation, die ein überlegenes PFS im Vergleich zur R-Erhaltung zeigt. Aus diesem Grund erachten die Studienautoren die MRD/risikoadaptierte erweiterte KRd-Behandlung nach ASZT als möglichen neuen Behandlungsstandard.
TF
Atlas, A Phase 3 Randomized Trial Of Carfilzomib, Lenalidomide, And Dexamethasone Versus
Lenalidomide Alone After Stem-Cell Transplant For Multiple Myeloma
EHA Library Dytfeld D. 06/10/22; 357039; S175
RVd ± ASCT und R-Meintenance beim NDMM bis zur Progression: Längstes medianes PFS
Eine Lenalidomid(R)-Erhaltungstherapie für 1 Jahr ergab beim NDMM laut den Studienautoren einen Vorteil für das PFS mit RVd plus ASCT versus RVd allein von median 47,3 vs. 35,0 Monaten, nicht jedoch für das OS mit 8-Jahres-Raten von 62 % gegenüber 60 % nach medianem FU von 89,8 Monaten. Dies steht im Zusammenhang mit mehreren wirksamen Optionen beim Rezidiv, einschließlich ASCT beim 1. Rezidiv bei 77 % der Patienten im Arm mit RVd allein (Attal M et al, N Engl J Med 2017; Perrot A et al, ASH 2020).
Hier berichten die Autoren primäre Daten aus ihrer DETERMINATION-Studie in den USA, in der Patienten bis zum Fortschreiten der Krankheit eine R-Erhaltung erhielten.
Nach einem medianem FU von 76 Monaten und 328 Ereignissen lag das mediane PFS bei 46,2 vs. 67,5 Monaten mit RVd allein vs. RVd+ASCT (p < 0,0001).
- Die beste Gesamtansprechrate war 95,0 % versus 97,5 %,
- ≥ sehr gutes partielles Ansprechen: 79,6 % versus 82,7
- ≥ vollständigem Ansprechen 42,0 % versus 46,9 %.
Vorläufige Analysen der minimalen Resterkrankung (Minimal Residual Disease, MRD) zu Beginn der Erhaltungstherapie bei 108 und 90 Patienten zeigten MRD-Negativitätsraten (10-5) von 39,8 % vs. 54,4 % (Odds Ratio 0,55).
Mit RVd allein und RVd+ASCT hatten 78,2 % und 94,2 % der Patienten Grad ≥ 3 Ereignisse,
hämatologische Ereignisse beispielsweise 60,5 % vs. 89,9 % [p < 0,0001]).
Fazit
RVd ± ASCT und R-Erhaltung bis zur Progression führten laut den Autoren zum längsten medianen PFS, das für jeden Ansatz berichtet wurde, und zu einem hochsignifikanten 21,4-monatigen Anstieg des medianen PFS-Vorteils unter Verwendung von RVd + ASCT. Einen Vorteil beim Gesamtüberleben gab es bislang nicht.
TF
PHASE 3 DETERMINATION TRIAL IN NEWLY DIAGNOSED MULTIPLE MYELOMA: LENALIDOMIDE, BORTEZOMIB & DEXAMETHASONE (RVD) ± ASCT AND LENALIDOMIDE MAINTENANCE TO PROGRESSION
EHA Library RICHARDSON P. 06/12/22; 366214; LB2366
Glofitamab: Vielversprechende neue Therapie für Patienten mit stark vorbehandeltem und/oder hochrefraktärem DLBCL
Glofitamab ist ein an T-Zellen bindender bispezifischer Antikörper (Ab) mit einer neuartigen 2:1-Konfiguration, die laut den Studienautoren Bivalenz für CD20 (B-Zellen) und Monovalenz für CD3 (T-Zellen) verleiht. In einer Phase-I/II-Studie (NCT03075696) waren ansteigende Glofitamab-Dosen bei Patienten mit rezidiviertem/refraktärem (R/R) B-Zell-Lymphom mit Obinutuzumab-Vorbehandlung (Gpt) und Zyklus (C) 1 Stufe hochwirksam und gut verträglich. Mit der schrittweisen Höherdosierung kann eine effektive Milderung des Zytokin-Freisetzungssyndroms (CRS) erreicht werden.
Hier präsentierten die Autoren zulassungsrelevante Ergebnisse der Phase-II-Expansion beim R/R diffusem großzelligen B-Zell-Lymphom (DLBCL) sowie beim hochgradigen B-Zell-Lymphom, primären mediastinalen großzelligen B-Zell-Lymphom oder transformierten follikulären Lymphom. Die Patienten hatten ≥ 2 vorherige Therapien erhalten, darunter ≥ 1 Anti-(a) CD20 Ab und ≥1 Anthracyclin.
Therapieschema:
- Obinutuzumab (1000 mg) wurde 7 Tage vor der ersten Glofitamab-Dosis intravenös (i.v.) verabreicht.
- IV Glofitamab wurde dann als Step-up-Dosen an Tag (D) 1 (2,5 mg) und D8 (10 mg) von C1 und in der Zieldosis (30 mg) an D1 von C2–12 (21-Tages-Zyklen) verabreicht.
Behandlungsergebnisse:
- Nach einer medianen Nachbeobachtungszeit von 9 Monaten (0,1–16) betrugen das Gesamtansprechen und die CR-Raten laut IRC 50,0 % bzw. 35,2 %.
- Die CR-Raten waren bei Patienten mit und ohne vorherige CAR-Ts konsistent (32 % vs. 37 %).
- mediane Zeit bis zur CR: 42 Tage (95 % KI: 41–48).
- Die Mehrheit der CRs (33/38; 87 %) dauerte zum Zeitpunkt der Datenschnitt an.
- Schätzungsweise 84 % der vollständigen Responder und 61 % der Responder sprachen nach 9 Monaten noch an.
- Bei Datenschnitt betrug die prognostizierte 12-Monats-Gesamtüberlebensrate 48 %,
- 92 % der vollständigen Responder waren am Leben
Glofitamab mit fester Dauer induziert laut Studienautoren dauerhafte vollständige Remissionen und hat eine günstige Sicherheit bei Patienten mit R/R DLBCL und ≥ 2 vorherigen Therapien. Dies betrifft auch Patienten mit vorheriger Exposition gegenüber CAR-Ts. Glofitamab ist nach Ansicht der Autoren eine vielversprechende neue Therapie für Patienten mit stark vorbehandeltem und/oder hochrefraktärem DLBCL.
TF
Glofitamab induces durable complete remissions and has favorable safety in patients with relapsed/refractory diffuse large b-cell lymphoma and ≥2 prior therapies: pivotal phase ii expansion results
EHA Library Dickinson M., et al. Jun 11, 2022; 357084; S220












