- Familiärer Brust- und Eierstockkrebs: Fallbeispiel
In der Schweiz erkranken jährlich über 6000 Frauen an einem Mammakarzinom. Es ist die häufigste Tumorerkrankung bei Frauen (1). 5-10% Prozent aller Mammakarzinome entstehen auf der Grundlage hereditärer Faktoren, darunter über die Hälfte durch Mutationen in den Genen BRCA1 oder BRCA2.
Bei jüngeren Frauen (< 45 Jahre) bestätigt sich eine genetische Prädisposition sogar bei 15% und zwar oft in hoch penetranten Genen wie BRCA1 oder BRCA2 (2). Das Wissen um eine pathogene genetische Mutation beeinflusst Präventions- und Therapieentscheidungen.
In Switzerland, more than 6000 women are diagnosed with breast carcinoma every year. It is the most common tumor disease in women (1). 5-10% percent of all breast carcinomas develop on the basis of hereditary factors, including over half due to mutations in the BRCA1 or BRCA2 genes. In younger women (< 45 years), genetic predisposition is confirmed in as many as 15% and often in highly penetrant genes such as BRCA1 or BRCA2 (2). Knowledge of a pathogenic genetic mutation influences prevention and treatment decisions.
Key Words: BRCA, hereditary breast cancer, genetic counselling, genetics
Pathogene Genmutationen im Bereich Brust- und Eierstockkrebs
Pathogene Mutationen im BRCA1 oder 2-Gen bewirken eine Funktionseinbusse bei Zellreparaturmechanismen und führen zum familiären Brust- und Eierstocksyndrom (HBOC). BRCA1 und 2 werden autosomal dominant vererbt. Frauen mit einer nachgewiesenen pathogenen Mutation in einem BRCA-Gen haben ein bis zu 80-prozentiges Lebenszeitrisiko an Brustkrebs zu erkranken, und ein bis zu 50-prozentiges Risiko für ein Ovarialkarzinom (3). Das Risiko ist stark abhängig vom Alter der Frau und der Familienanamnese.
Zudem ist auch bei bereits erkrankten Patientinnen das Risiko, an einem kontralateralen Mammakarzinom zu erkranken, mit bis zu 60% deutlich erhöht (4).
Neben BRCA1 oder 2 können auch andere, seltenere hoch- oder niedrig penetrante Genmutationen (wie z.B. ATM, CHEK 2) für ein HBOC bei betroffenen Familien verantwortlich sein. Genetische Panel-Analysen werden deshalb mittlerweile standardmässig zur Abklärung verwendet.
Aber auch ohne Nachweis einer pathogenen Mutation kann bei stark belasteter Familienanamnese das Risiko für ein Mammakarzinom deutlich erhöht zu sein. Eine sorgfältige Stammbaumbeurteilung ist auch deshalb von zentraler Bedeutung und muss in das Beratungsgespräch und die Risikoeinschätzung grundsätzlich miteinbezogen werden.
Wann kommt eine genetische Testung in Frage?
Grundsätzlich ist eine genetische Testung sinnvoll, wenn als Konsequenz eines Mutationsnachweises präventive oder prophylaktische Massnahmen infrage kommen oder therapeutische Konsequenzen daraus gezogen werden können. Dies gilt in der Folge gleichermassen auch für allfällige weitere betroffene Familienmitglieder einer getesteten Person.
Familienanamnese und genetische Beratung
Grundlage für jede Beratung ist die Erfragung der Familienanamnese. Sie gehört zum Standard bei der Behandlung von Brustpatientinnen und wird auch von den zertifizierten Brustzentren gefordert. Zur besseren Abschätzung der Wahrscheinlichkeit des Vorliegens einer genetischen Mutation stehen etablierte mathematische Risikomodelle zur Verfügung, welche routinemässig angewendet werden (z.B. CanRisk/BOADICEA oder BRCAPRO).
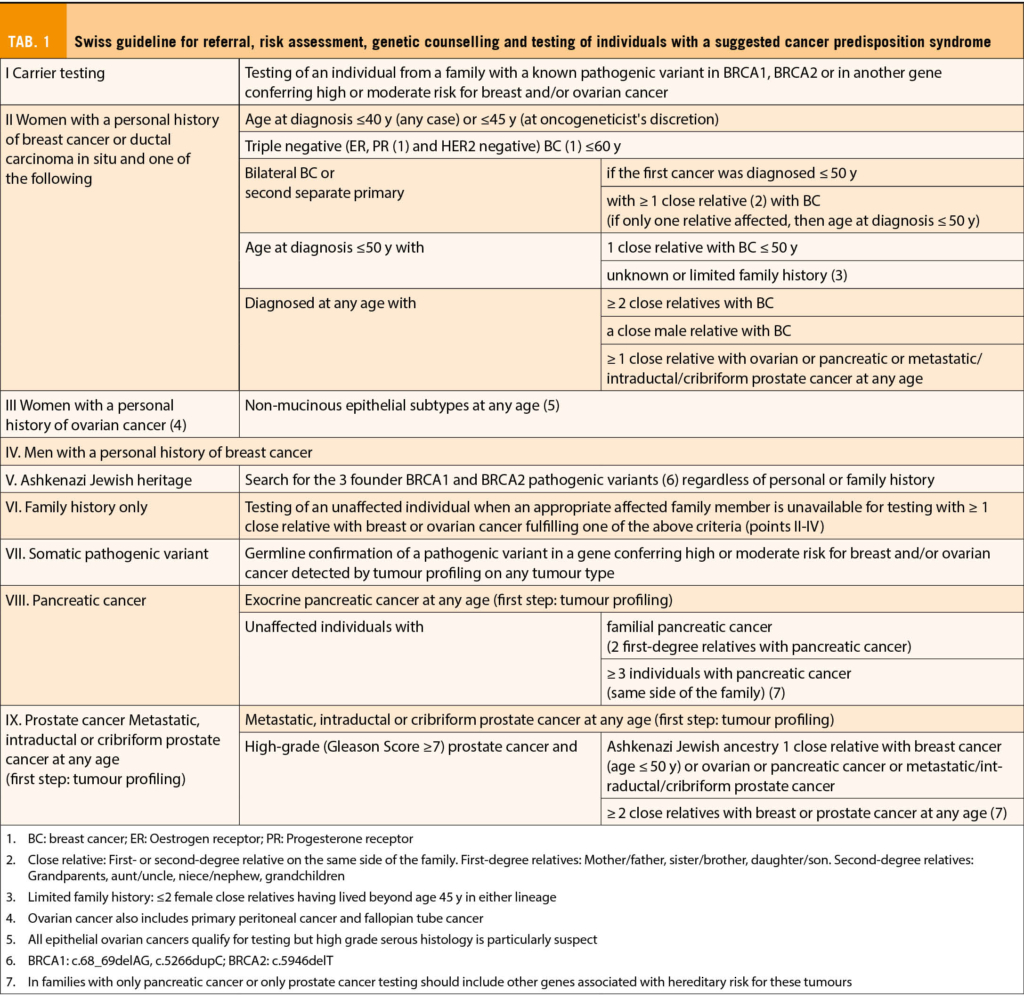
Zudem sind verschiedene Empfehlungen und Guidelines von Fachgesellschaften vorhanden. Die SAKK hat in Anlehnung an internationale Empfehlungen (z.b. NCCN) die Indikationen für genetische Testungen als Tabelle zusammengefasst (Tab. 1) (5). Diese werden von den Krankenkassen ebenso akzeptiert und die Kosten gemäss KLV vergütet.
Ein genetisches Beratungsgespräch wird vom GUMG (Bundesgesetz über genetische Untersuchungen bei Menschen) vorgeschrieben und soll sowohl vor als auch nach der Testung durch eine ausgebildete Beratungsperson erfolgen. Die genetische Beratung hilft
neben der Risikoeinschätzung den Betroffenen dabei, die Bedeutung einer erblichen Tumorerkrankung, die Testergebnisse und die Auswirkungen auf sie selbst und ihre Familienangehörigen zu verstehen. Frauen, bei welchen aufgrund ihrer Brustkrebserkrankung eine
familiäre hereditäre Genese vermutet wird, sollen möglichst frühzeitig im Rahmen der Diagnosestellung über die Möglichkeit einer genetischen Beratung informiert werden. Sie kann Konsequenzen für die geplante Operation oder die medikamentöse Therapie haben.
Genetische Analyse
Für die Abklärung verwenden wir standardmässig eine Panel-Analyse, z.B. mit den 9 häufigsten brustkrebsassoziierten Genen (BRCA1/2, ATM, CDH1, CHEK2, PALB2, PTEN, STK11, TP53). Von grossen Panel-Analysen raten wir, ausser bei speziellen Fragestellungen oder ausgeprägter familiärer Belastung, ab. Dies weil die Wahrscheinlichkeit klein ist, dass eine klinisch relevante Mutation entdeckt wird und häufiger unklare Befunde – insbesondere VUS (variant of unknown significance) – gefunden werden. Dies kann Ängste und Unsicherheiten seitens der Patientin und der Berater auslösen und birgt die Gefahr von falschen Therapieentscheidungen, insbesondere im Rahmen von neuen Karzinomdiagnosen, wenn psychischer Stress und Zeitdruck vorhanden sind.
Eine molekulargenetische Untersuchung sollte im Idealfall immer zuerst an einer Person erfolgen, die an einem Tumor aus dem BRCA1/2-Spektrum erkrankt ist (sogenannte «Indexperson»). Die Aussagekraft negativer Ergebnisse bei Nichterkrankten ist deutlich geringer, ein unauffälliges Testresultat kann in diesem Fall eine familiäre Mutation nicht ausschliessen.
Fallbericht, Teil 1
Eine 43-jährige Mutter von drei Kindern wird zugewiesen mit einem triple negativen Mammakarzinom. Aufgrund der Tumorgrösse von fast 4cm wurde bei diesem hochproliferativen Tumor eine neoadjuvante Chemotherapie empfohlen. Darunter konnte ein sehr gutes Tumoransprechen beobachtet werden.
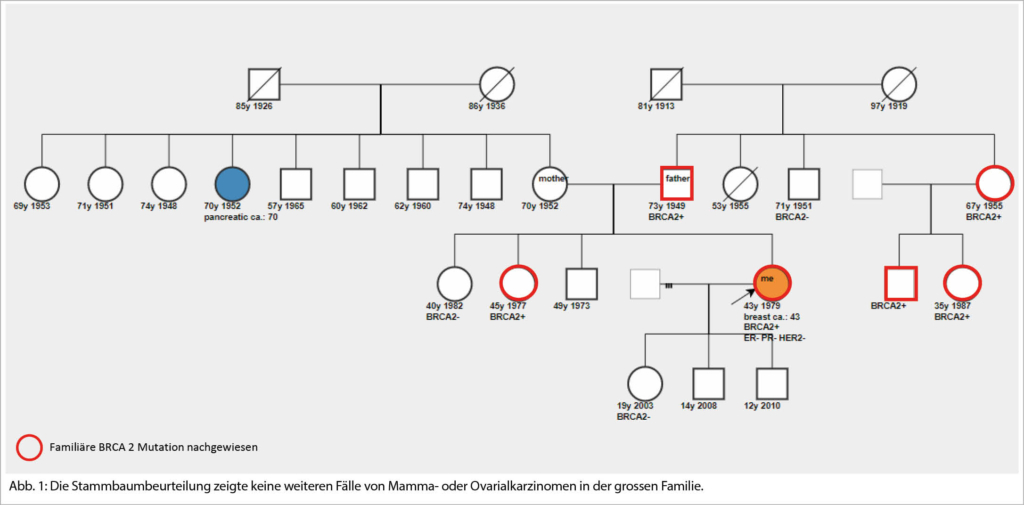
Die Stammbaumbeurteilung zeigte keine weiteren Fälle von Mamma- oder Ovarialkarzinomen in der grossen Familie (Abb. 1).
Die Wahrscheinlichkeit einer BRCA-Mutation wurde gemäss Risikomodell (CanRisk) lediglich auf 1.29% geschätzt. Dennoch war gemäss der schweizerischen Leitlinie die Indikation für eine BRCA-Mutationsanalyse gegeben (triple negative Tumorbiologie mit einem Erkrankungsalter ≤ 60 Jahre). Nachdem der Patientin im Rahmen einer genetischen Beratung die Wahrscheinlichkeit und der mögliche Umgang mit einer familiären Mutation ausführlich erklärt wurde, entschied sich diese zur Durchführung einer Mutationsanalyse. Es wurde eine pathogene BRCA2- Mutation festgestellt.
Präventive und therapeutische Konsequenzen bei Mutationsnachweis Wie hoch das Risiko einer Krebserkrankung aufgrund einer festgestellten Mutation ist, hängt stark vom Alter der Frau und der Familienanamnese ab. Deshalb müssen diese Informationen stets in die Beratung mit einbezogen werden (6). Dabei ist zudem zu unterscheiden, ob es sich um eine gesunde Person handelt oder um eine bereits z.B. an Brustkrebs erkrankte Patientin, bei welcher die zu erwartende Prognose bei der Beratung berücksichtigt werden sollte.
Bildgebende Überwachung
Intensivierte Früherkennung: Gemäss dem Referenzdokument «Überwachungsprotokoll» des BAG von 2021 wird gesunden Frauen mit BRCA-Mutationsnachweis eine intensivierte Früherkennung empfohlen. Diese beinhaltet 6-monatliche klinische Kontrollen ab dem 25. Lebensjahr und jährliche MR-Mammographien, ab 30 Jahren zusätzlich jährlich eine Mammografie. Damit kann eine Erkrankung nicht verhindert werden, da es sich jedoch insbesondere bei jungen Frauen häufig um schnell wachsende Tumore handelt, begünstigt ein frühzeitiges Entdecken die Prognose erheblich.
Risikoadaptierte Nachsorge: Bei bereits erkrankten Mutationsträgerinnen wird nach brusterhaltender Operation oder ipsilateraler Mastektomie gemäss den Leitlinien jährlich eine MR-Mammographie empfohlen.
Chemoprävention: Die Option einer präventiven, endokrinen Therapie mit Tamoxifen kann gesunden BRCA-Patientinnen angeboten werden. Die Datenlage dazu ist aber eher spärlich. Bei BRCA2-Trägerinnen konnte damit die Reduktion von Brustkrebserkrankungen nachgewiesen werden (7). Erfahrungsgemäss entscheiden sich Patientinnen jedoch nur selten für die Einnahme einer solchen langjährigen medikamentösen Prävention.
Risikoreduzierende Operationen
Mit einer beidseitigen, risikoreduzierenden Mastektomie wird das Erkrankungsrisiko um über 95% gesenkt (8). Hier sollte wenn möglich eine Nipple-Sparing Mastektomie mit Rekonstruktion mittels Implantat oder Eigengewebe angeboten werden. Obwohl die Operation zur Reduktion des Brustkrebsrisikos sehr effektiv ist, müssen Frauen präoperativ ausführlich über die zu erwartende Morbidität solcher Verfahren und über die mögliche Beeinträchtigung des Körperbildes vorbereitet werden. Die Entscheidung für oder gegen das Operationsverfahren liegt bei der Patientin selbst.
Prophylaktisch bilaterale Salpingo-Ovarektomie ist ein risikoarmer Eingriff und reduziert nicht nur das Risiko, an einem Ovarialkarzinom zu erkranken um bis zu 97%, sondern auch die Gesamt-Mortalität bei BRCA-Trägerinnen (8, 9). Weil die Früherkennung des Ovarialkarzinoms mittels Vaginalsonographie ungenügend ist, sollen Patientinnen die Vorteile dieser Operation aufgezeigt werden. Der Zeitpunkt dafür wird nach abgeschlossener Familienplanung empfohlen, bei BRCA1-Trägerinnen frühestens zwischen dem 35. und 40. Lebensjahr, bei BRCA2 etwas später zwischen 40 und 45 Jahren. Eine Hormonersatztherapie bei prämenopausalen gesunden Mutationsträgerinnen ist möglich.
Sekundärprophylaxe durch risikoreduzierende prophylaktische bilaterale Mastektomie: Um das Risiko zu minimieren, im weiteren Leben an einem kontralateralen Karzinom zu erkranken, entscheiden sich viele Brustkrebspatientinnen, anstelle der bilateralen Mastektomie, eine brusterhaltende Operation durchzuführen. Das Risiko für eine kontralaterale Brustkrebserkrankung hängt bei BRCA-Patientinnen stark vom Alter der Ersterkrankung ab (13). Es wird kontrovers diskutiert, ob damit auch ein Überlebensvorteil erzielt werden kann und ist ebenfalls abhängig vom Stadium der Ersterkrankung, respektive der damit verbundenen Prognose. Eine kürzlich publizierte Metaanalyse konnte jedoch signifikante Vorteile für das Gesamtüberleben und das brustkrebsspezifische Überleben nachweisen (10), so dass diese Option insbesondere jungen Patientinnen aufgezeigt werden sollte. Im Gegensatz ist die Indikation dazu bei Trägerinnen von niedrig-penetranten Genen (z.B. ATM, CHEK 2) sehr zurückhaltend zu stellen.
Medikamentöse Therapie
Bei gewissen Tumor-Patientinnen (Mammakarzinom, Ovarialkarzinom, Pankreaskarzinom, Prostatakarzinom) kann der Nachweis einer BRCA1- oder 2-Mutation (Keimbahn- oder somatische Mutation am Tumorgewebe) auch Einfluss auf die Wahl der medikamentösen Behandlung haben. Bei diesen Patientinnen hat der PARP-Inhibitor Olaparib (Lynparza®) einen klinischen Benefit gezeigt. PARP-Inhibitoren wirken durch die Hemmung eines für die Reparatur von DNA-Einzelstrangbrüchen wichtigen Reparatur Enzyms Poly(ADP-Ribose)-Polymerase (PARP). Sie wirken selektiv bei Krebszellen mit einer BRCA-Mutation, weil diese stärker PARP-abhängig sind als normale Zellen. Beim Mammakarzinom und BRCA-Mutation zeigte sich in Studien sowohl beim metastasierten (11), wie auch beim adjuvanten Her 2 negativen «Hochrisko»-Mammakarzinom bei der Behandlung mit Olaparib ein verlängertes Überleben (12).
Fallbericht, Teil 2
Aufgrund des jungen Erkrankungsalters gingen wir bei dieser Patientin von einem relevanten Risiko von über 50% für eine kontralaterale Erkrankung aus. Die Möglichkeiten einer intensivierten Nachsorge gegenüber einer bilateralen Mastektomie haben wir mit der Patientin offen diskutiert. Bei sehr gutem Ansprechen unter der neoadjuvanten Therapie schätzten wir die Prognose dieser Patientin als insgesamt günstig ein und sie entschloss sich für eine beidseitige Nipple-Sparing Mastektomie mit Implantat Rekonstruktion. Bei der über 40-jährigen Patientin haben wir zudem eine prophylaktische Salpingo-Ovarektomie empfohlen und im gleichen Eingriff durchgeführt.
Im Weiteren erfolgten eine systematische Beratung und Abklärung der Familienmitglieder. Falls möglich ist es sinnvoll, zuerst die genetische Beratung und Testung bei den Eltern durchzuführen. Die bekannte BRCA2-Mutation konnte beim Vater der Patientin bestätigt werden. Dieser Fall zeigt, dass aus der Stammbaumbeurteilung bei Vererbungen väterlicherseits oder vielen Männern in der Familie oft keine eindeutigen Rückschlüsse gezogen werden können. Die Wahrscheinlichkeit für ein hereditäres Gen kann damit unterschätzt werden.
Eindrücklich ist die grosse Anzahl Personen, die nach der Entdeckung dieser familiären Mutation in die Beratung involviert wurden. Interessant ist auch, wie die Konsequenzen und Entscheidungen bei den betroffenen Familienmitgliedern dennoch sehr individuell waren:
– Gesunde 19-jährige Tochter: Sie entschied sich bereits im jungen Alter für eine genetische Analyse, bei der die bekannte BRCA2-Mutation glücklicherweise nicht nachgewiesen wurde. Dies bedeutet, dass sie ein in der Normal-Bevölkerung übliches Brustkrebsrisiko aufweist und damit von Ängsten, einer intensiven Früherkennung und prophylaktischen Massnahmen entlastet werden konnte. (Kindern von Mutationsträgern wird in der Regel erst nach Erreichen der Volljährigkeit die Möglichkeit einer gezielten genetischen Abklärung angeboten, insbesondere weil sich davor auch keine klinischen Konsequenzen ergeben.)
– Gesunde 67-jährige Tante, BRCA2 Nachweis: Sie entschied sich ebenso für eine prophylaktische Salpingo-Ovarektomie aber gegen eine beidseitige Mastektomie aufgrund der Information, dass das verbleibende Lebenszeit-Risiko für ein Mammakarzinom und der zu erwartende Nutzen von einer beidseitigen Brustentfernung in fortgeschrittenem Alter deutlich kleiner ist.
– Gesunde 42-jährige Schwester, BRCA2 Nachweis: Entscheidung zur intensivierten Früherkennung der Brust und prophylaktischen Salpingo-Ovarektomie.
– Gesunde 35-jährige Cousine, BRCA2 Nachweis: Entscheid zur beidseitigen risikoreduzierenden Mastektomie, Salpingo-Ovarektomie mit ca. 40-45 Jahren geplant.
Copyright bei Aerzteverlag medinfo AG
Stv. Leiterin Brustchirurgie
FMH Gynäkologie und Gebursthilfe
Brustzentrum Ostschweiz
Schuppisstrasse 10
9016 St. Gallen
Die Autorin hat keinen Interessenskonflikt in Zusammenhang mit diesem Artikel deklariert.
◆ 5-10% Prozent aller Mammakarzinome entstehen auf der Grundlage hereditärer Faktoren, darunter über die Hälfte durch Mutationen in den Genen BRCA1 oder BRCA2.
◆ Bei jungen Brustkrebspatientinnen unter 40 Jahren findet sich
häufiger eine genetische Mutation, weshalb ihnen frühzeitig eine
genetische Beratung angeboten werden soll.
◆ Die Krebsrisiken bei Mutationsträgerinnen sind stark abhängig vom Alter und der Familienanamnese. Diese Informationen müssen
deshalb bei der Beratung und Entscheidung allfälliger präventiver
und prophylaktischer Massnahmen miteinbezogen werden.
◆ Die bilaterale, risikoreduzierende Mastektomie ist eine Option für gesunde und für an Brustkrebs erkrankte BRCA-Patientinnen nach sorgfältiger Beratung.
◆ Eine bilaterale Salpingo-Ovarektomie minimiert nicht nur das Risiko, an einem Ovarialkarzinom zu erkranken, sondern auch die Gesamt-Mortalität bei BRCA-Trägerinnen.
1. Bundesamt für Statistik 2022.
2. Gómez-Flores-Ramos, L., Castro-Sánchez, A., Peña-Curiel, O. & Mohar-Betancourt, A. Molecular Biology In Young Women With Breast Cancer: From Tumor Gene Expression To DNA Mutations. Rev Invest Clin 69, 181–192 (2017).
3. Kuchenbaecker, K. B. et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. JAMA 317, 2402–2416 (2017).
4. Rhiem, K. et al. The risk of contralateral breast cancer in patients from BRCA1/2 negative high risk families as compared to patients from BRCA1 or BRCA2 positive families: a retrospective cohort study. Breast Cancer Res 14, R156 (2012).
5. Stoll, S. et al. Update Swiss guideline for counselling and testing for predisposition to breast, ovarian, pancreatic and prostate cancer. Swiss Med Wkly 151, w30038 (2021).
6. Mavaddat, N. et al. Cancer risks for BRCA1 and BRCA2 mutation carriers: results from prospective analysis of EMBRACE. J Natl Cancer Inst 105, 812–822 (2013).
7. King, M. C. et al. Tamoxifen and breast cancer incidence among women with inherited mutations in BRCA1 and BRCA2: National Surgical Adjuvant Breast and Bowel Project (NSABP-P1) Breast Cancer Prevention Trial. JAMA 286, 2251–2256 (2001).
8. Domchek, S. M. et al. Association of risk-reducing surgery in BRCA1 or BRCA2 mutation carriers with cancer risk and mortality. JAMA 304, 967–975 (2010).
9. Marchetti, C. et al. Risk-reducing salpingo-oophorectomy: a meta-analysis on impact on ovarian cancer risk and all cause mortality in BRCA 1 and BRCA 2 mutation carriers. BMC Womens Health 14, 150 (2014).
10. Jia, Z. et al. Contralateral risk-reducing local therapy in breast cancer patients with BRCA1/2 mutations: systemic review and meta-analysis. Cancer Cell Int 21, 512 (2021).
11. Robson, M. E. et al. OlympiAD final overall survival and tolerability results: Olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer. Ann Oncol 30, 558–566 (2019).
12. Tutt, A. N. J. et al. Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med 384, 2394–2405 (2021).
13. van den Broek, A. J. et al. Impact of Age at Primary Breast Cancer on Contralateral Breast Cancer Risk in BRCA1/2 Mutation Carriers. J Clin Oncol 34, 409–418 (2016).
info@gynäkologie
- Vol. 12
- Ausgabe 4
- August 2022