- Spätdumping nach Bariatrischem Eingriff
Das Spätdumping ist eine häufige Komplikation im Langzeitverlauf nach Magenoperationen, speziell nach bariatrischem Eingriff wie beim Roux-Y-Bypass oder bei der Sleeve-Gastrektomie. Die (neuroglykämischen) Symptome fallen unterschiedlich aus und können missinterpretiert werden. Die Diagnostik dazu ist entscheidend. Die Therapie basiert heute auf diätetischen Massnahmen, der Pharmakotherapie und in seltenen Fällen der chirurgischen oder endoskopischen Reintervention. Trotz dem multimodalen therapeutischen Ansatz stellt die Spätdumpingproblematik in der haus – oder spezialärztlichen Praxis eine
Herausforderung dar.
Dumping syndrome is a common and frequent complication after gastric surgery, especially after bariatric surgery as Roux-Y-Gastric Bypass or Sleeve-Resection. The (neuroglycemic) symptoms in dumping are multiple and so different and should be suspected so physician awareness is important. Diagnostic tests afford time and may be repeated. Treatment should be primary a diet approach, followed by medication therapy and when this option fails then surgical reintervention can be considered. In spite of different therapeutical options dumping syndrome remains a challenging problem in the follow up after bariatric procedures.
Key Words: Bariatrische Chirurgie, Proximaler Magenbypass, Dumpings Syndrom, postprandiale Hypoglykämie, Neuroglykopenie, Somatostatine,
GLP-1 Analoga, Magenbanding
Fallvignette
Anlässlich der 2-Jahres-Kontrolle an unserem Adipositaszentrum nach Magenbypassanlage bei III-Adipositas (BMI präoperativ von 46 kg/m2, aktueller BMI 28 kg/m2), klagt eine 34-jährige Patientin, Nichtdiabetikerin, seit etwas mehr als einem halben Jahr über Übelkeit, Zittern, Schwitzen und «schwache» Beine. Dies tritt typischerweise wie sie angibt etwa 2 Stunden postprandial auf,
ca. 1 mal die Woche, und unabhängig was sie einnimmt. Sie isst dabei recht schnell, hat beruflichen Stress und wenig Zeit über Mittag. Sie muss sich oft nach dem Essen ein paar Minuten hinlegen. Sie nimmt dann unterwegs Traubenzucker oder Knäckers mit und kann so die Situation bei der Arbeit im Verkauf besser überbrücken. Gelegentlich muss sie wegen Erschöpfung nach Hause und macht sich berechtigterweise auch Sorgen um ihre Arbeitsstelle. Zudem stellt sie wieder eine Gewichtszunahme von 8 kg fest was sie irritiert. Die repetitiven Bestimmungen des Blutzuckers zeigen teils normale Werte, teils Werte aber unter 3.5 mmol/l. Ein halbes Jahr postinterventionell als sie damals wieder «normal» essen konnte gab sie klassische Frühdumpingprobleme mit Übelkeit und Schwindel und hypotonen Blutdruckwerten an, die aber unter Anleitung unserer Ernährungsberatung und erfolgreicher Änderung des Ess- und Trinkverhaltens deutlich besserten. Mit der Diagnose eines sog. Spätdumpings wird sie nun wiederum engmaschig durch unsere Ernährungsberatung betreut und die Kohlenhydratzufuhr optimiert. Flüssige KH-Zufuhr wie Süssgetränke, Red Bull oder alkoholische Getränke werden verneint, eher schon Süssspeisen und Snacks. Bei geringer Wirkung dieser Massnahmen erfolgt eine medikamentöse Unterstützung, doch wegen fehlender Medikamenten Compliance haben wir uns schliesslich entschieden, laparoskopisch ein Minimizer-Band im Bereich der Anastomose zu implantieren. In der Zwischenzeit, 6 Monate postoperativ, haben die Beschwerden deutlich gebessert, treten auch nicht mehr regelmässig auf und ihr Gewicht konnte sie ebenso stabilisieren. Der Langzeitverlauf auch nach operativer Korrektur bleibt aber abzuwarten.
Einleitung
Trotz den auf dem Markt angepriesenen GLP1-Analoga ist die bariatrische Chirurgie heute noch immer die wirksamste Therapie für eine nachhaltige Reduktion des Gewichtes bei morbider Adipositas. Wie eine grosse noch nicht publizierte retrospektive Kohortenstudie mit über 25’000 analysierten Patienten aus einem nationalen Register (BAG) vom Zeitraum 2012 -2018 zeigt, wird in der Schweiz zu fast 80 % als Eingriffsmethode der proximale Magenbypass (PMB) favorisiert, zu knapp 20 % noch die Magen-Sleeve-Resektion (1).
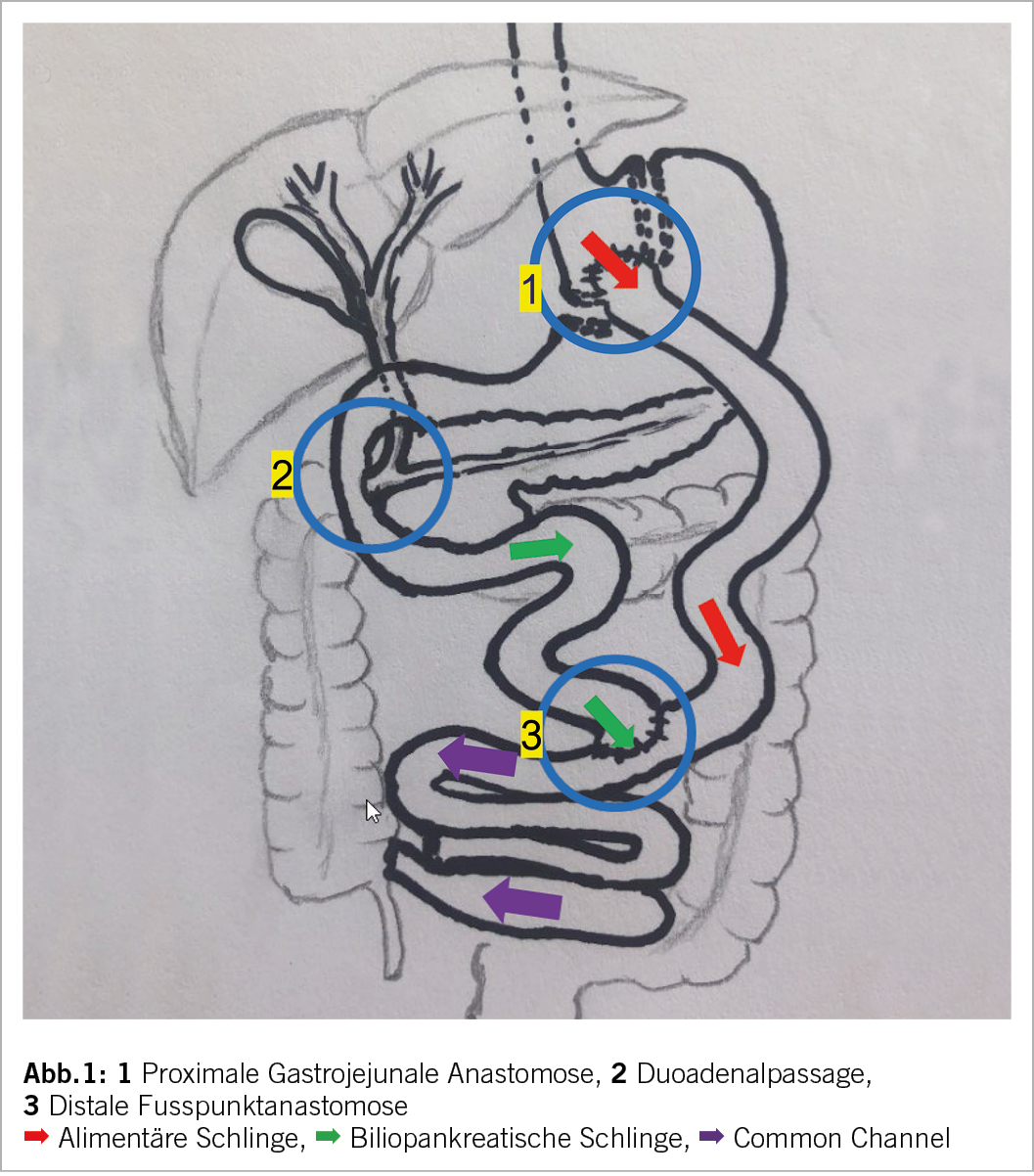
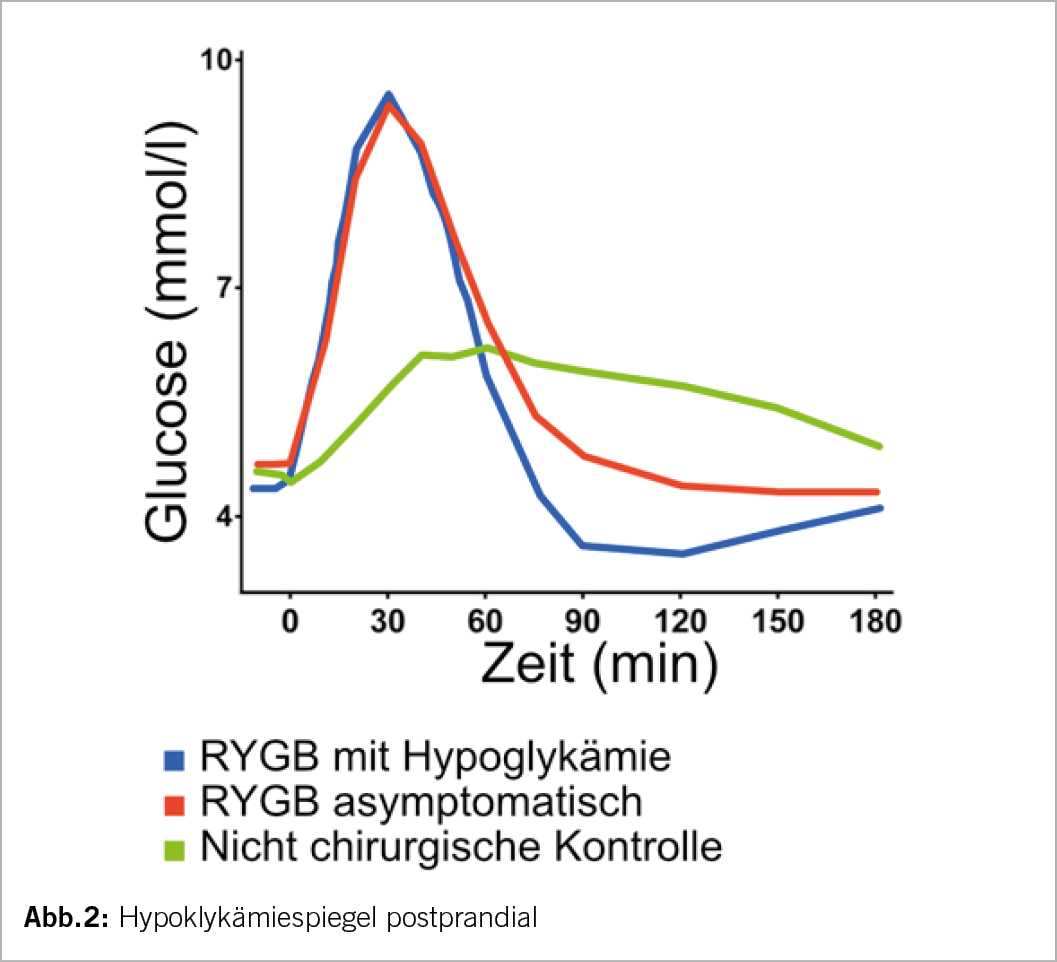
Mit der weltweiten Zunahme bariatrischer Eingriffe beobachten wir analog zur medikamentösen Therapie auch bedeutende Nebenwirkungen und Komplikationen sowohl im Früh- wie im Langzeitverlauf. Ein relevantes Problem ist die postprandiale Hypoglykämie mit unterschiedlichen Symptomen was allgemein als Dumping Syndrom (DS) bezeichnet wird (2). Wir kennen aber auch postprandiale Hypoglykämien bei Bypasspatienten die symptomfrei bleiben wie auch bei Nichtoperierten (Abb. 1). Wir unterscheiden dabei zwei Arten von Dumping, ein Früh- und ein Spätdumping. Wegen der Magenverkleinerung und dem direkten Anschluss des proximalen Jejunums mit u.a. Ausschluss der duodenalen Passage kommt es zur raschen Entleerung relevanter Nahrungsportionen v.a. Kohlenhydrate in den Dünndarm. Beim Frühdumping kommt es dadurch 30-60 Minuten nach dem Essen zu einem Shift von Flüssigkeitsvolumen in das Darmlumen sowie dem Auslösen gastrointestinaler Hormone was zu lästigen vasomotorischen und gastro-intestinalen Symptomen führt. Das Spätdumping erfolgt dagegen 2-3 Stunden später postprandial, vorwiegend nach Einnahme niedrigwertiger Kohlenhydrate und folgender meist inkretingesteuerter Hypoglykämie. In der Literatur ist der Begriff Spätdumping oft ungleich definiert, aber man ist sich einig, dass es den gleichen pathophysiologischen Hintergrund hat wie das Nichtinsulinoma Pankreatogene Hypoglykämische Syndrom (NIPHS) und die Neisidioblastose. Als pathologischer Wert wird ein BZ von<2.8mol/l definiert.
Früh- wie Spätdumping kann nach allen Formen einer Ösophagus- oder Magenresektion auftreten, speziell nach totaler Ösophagektomie und nach Roux-Y-Magenbypass. Wegen der hohen Anzahl operierter Adipositaspatienten nimmt der PMB mit seinen Komplikationen eine grosse Bedeutung in der hausärztlichen und Adipositassprechstunde ein, zumal oft fehl- oder unterdiagnostiziert, werden die Folgen davon trotz hohem Leidensdruck gelegentlich unterschätzt.
Diese Übersichtsarbeit zeigt die Problematik auf unter Analyse der aktuellen Datenlage aber auch aus der eigenen Erfahrung heraus nach über 25 Jahren bariatrischer Chirurgie.
Ursache
Gemäss neuester Literatur sind diese Insulin/Inkretin-Dysregulationen oft multifaktoriell und nicht eindeutig pathophysiologisch geklärt. Unklar auch weshalb die Hypoglykämie nach Magenbypass meistens mehr als ein Jahr postoperativ auftreten kann. Man schätzt die Häufigkeit bei 10-15 % oder mehr, zumal die Dunkelziffer höher liegt (3). Nur knapp 0,34 % der operierten Bypasspatienten in der Schweiz müssen gemäss der zitierten Kohortenstudie aus dem KS Aarau deswegen hospitalisiert werden (1).
Die Hypoglykämie ist meist charakterisiert durch eine unproportionale Insulinantwort nach Nahrungsaufnahme bei Magenoperierten, eine Art Insulinübersensitivität v.a nach starker Gewichtsreduktion sowie eine Inselzelldysfunktion nach Bypassanlage. Durch die Passage der Nahrung direkt vom Magenpouch in den proximalen Dünndarm unter Umgehung des Duodenums (Abb. 2) bewirkt der Bypass einen starken glykämischen Effekt mit der Folge überschiessender Inkretin-Sekretion, z.B. bis 10-fach erhöhter GLP-Sekretion. Zudem scheint, dass nach Bypassanlage die B-Zell-Suppression trotz Hyperinsulinämie reduziert ist (4).
Diagnostik
Eine akkurate Anamnese ist essentiell zumal differentialdiagnostisch immer auch andere Formen der Hypoglykämie in Frage kommen. Wie war die Mahlzeit vor Auftreten der Symptome, wie schnell wurde gegessen, was dabei getrunken? In welchem zeitlichen Abstand zur Mahlzeit traten die Symptome auf? Welche Medikamente werden regelmässig eingenommen?
Aber: viele Patienten nach Magenbypass klagen über Herzklopfen, Schwächegefühl, Schwindel. Dabei kann es sich wohl um Dumping-Symptome handeln allerdings ohne nachweisbare Hypoglykämie.
Treten die Beschwerden bei schwerer körperlicher Tätigkeit auf, in nüchternem Zustand (Fastentest!) oder nachts muss zwingend nach anderen Ursachen der Hypoglykämie gesucht werden, z.B. Nichtinselzelltumore, Insulinome, eine schwere Malnutrition etc.
Die Whipple-Kriterien für ein DS (Neuroglykopenische Symptome, messbarer tiefer BZ, Symptombesserung nach Kohlenhydrateinnahme) sind von zentraler Bedeutung (5). Die Symptome können mild oder eben sehr schwer sein und sind daher gefährlich: Kopfweh, Schwitzen, Schwäche, Verwirrung, Palpitationen, Sprachstörungen, Angstzustände, Tremor bis zum Bewusstseinsverlust.
Ein kontinuierliches Glukose-Monitoring kann hilfreich sein, wird aber bei uns nicht routinemässig und nur bei komplexen Fällen durchgeführt. Es gibt auch Fehlwerte, z.B. nachts, wenn der Patient auf dem Sensor liegt. Eine kapilläre BZ-Messung zum Zeitpunkt des Symptombeginns und entsprechend instruierten Patienten genügt in den meisten Fällen.
Ein verlängerter Mahlzeitentest mit Bestimmung von Glucose, Insulin und C-Peptid kann hilfreich sein; in speziellen Fällen bestimmen wir auch das Proinsulin, das GLP-1 und das Glucagon. Ein oraler Glukosebelastungstest ist problematisch bei Magenoperierten und sollte wegen den zu erwartenden schweren Nebenwirkungen nicht mehr durchgeführt werden.
Therapie
Als erste Massnahme nach Diagnose einer postprandialen Hypoglykämie bedarf es einer exakten Ess- und Trinkanalyse durch den Hausarzt oder die Ernährungsberaterinnen des Adipositaszentrums. Mittels Esstagebuch soll Portionengrösse, Nahrungszusammensetzung und Art und Zeitpunkt der aufgetretenen hypoglykämischen Symptome erfasst werden. Als Diätempfehlung macht dabei ein Verzicht auf Kohlenhydrate wenig Sinn. Vielmehr sollen einfache KH durch komplexe, hochwertige oder Fructose ersetzt werden; diese in kleineren Portionen eingenommen und am besten in Kombination mit Proteinen und essentiellem Fett (6).
Langsames und gutes Kauen der Nahrung, Trinken und Essen dabei strikt trennen gehört ebenso zu den Eckpfeilern der Essumstellung. Eine engmaschige Begleitung durch die Ernährungsberatung in dieser Phase ist selbstverständlich. Zeitgleich muss auch die Supplementation der Vitamine und anderer Nährstoffe monitorisiert werden, um eine Mikro- oder Makromalnutrition auszuschliessen.
Koffein und Alkohol sollte wenn möglich vermieden werden da es den hepatisch induzierten Glukoseabbau hemmen kann.
Wichtig ist der Einbezug von Angehörigen und Arbeitskollegen/Arbeitsgeber, damit alle die Alarmsymptome kennen um möglichst vor Eintreten gefährdender Symptome und Folgen entsprechend präventive Massnahmen zu ergreifen, z.B. Fahrverbot als Lastwagenchaffeur.
Eine weitere Behandlungsmöglichkeit parallel zur Diätumstellung ergibt sich durch Medikamente. Acarbose, durch Hemmung der intestinalen Alpha-Glucosidase, bewirkt eine verlangsamte Resorption der Glucose. Um Nebenwirkungen wie abdominale Krämpfe und Gasretention so niedrig wie möglich zu halten soll dieses eintitriert werden, beginnend z.B. mit einer Dosierung von 25 mg p.os. Somatostatinanaloga wie Octreotid, subcutan verabreicht, hemmen die Insulin- und GLP1-Sekretion. Die initiale Dosis beträgt hier etwa 50 Microgramm s.c. vor dem Essen (7), später Steigerung bis 100 Microgramm gefolgt von einem Langzeitsomatostatin i.m. verabreicht. Nebst den hohen Kosten haben Somatostatine als Nebenwirkung Durchfall, QT-Intervallverlängerung und Risiko einer Cholecystolithiasis.
Neuerdings werden vermehrt auch GLP1-Agonisten eingesetzt, meist Liraglutide, dies wurde bereits in einer Studie von 2013 empfohlen, evidenzbasierte Daten sind aber noch Inhalt laufender Studien (8).
Chirurgische Eingriffe gelten auch heute als letzte Option bei refraktärer medikamentöser Therapie oder bei Malcompliance. Bezüglich Rückwandlungen des Bypasses in die ursprüngliche Form zurück sind Einzelfälle beschrieben ebenso wie das aggressivere Vorgehen der distalen, sog. Linkspankreatektomie zur vermeintlichen Kontrolle der Hyperinsulinämie. Wegen der hohen Komplikationsrate wie auch der Rezidivrate (trotz ausgedehnter Parenchymresektion) können solche Eingriffe nicht empfohlen werden.
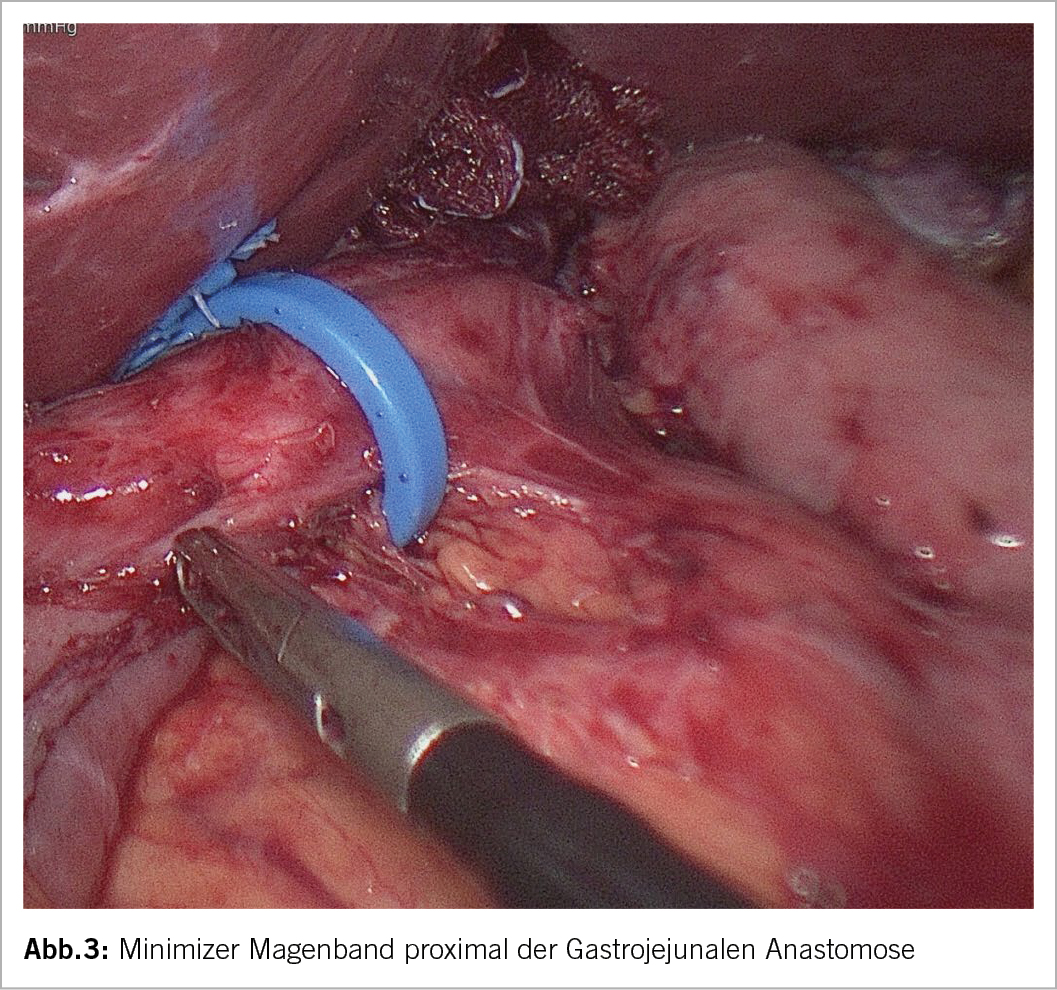
In unserem Adipositaszentrum favorisieren wir dagegen seit 7 Jahren eine sog. Magenoutletrestriktion, d.h. der Übergang vom kleinen Magenpouch in den Dünndarm wird durch ein laparoskopisch platziertes einfaches Magenband (Abb. 3) vorsichtig eingeengt (9). Im Gegensatz zur transoralen endoskopischen Anastomosenraffung mit der Gefahr der erneuten Dilatation bleibt das Band stabil an Weite. Sämtliche Verfahren ob endoskopisch oder laparoskopisch haben aber ihre Risiken wie Magenperforation, zu enge Naht mit Dysphagie, Refluxbeschwerden, Magenbandmigration und das Dumpingrezidiv.
Chefarzt Viszeralchirurgie LUKS Sursee
Co-Leiter Adipositaszentrum Zentralschweiz Standort Sursee
Spitalstrasse 38
6210 Sursee
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Nach proximalem Magenbypass kann auch Jahre nach der Operation durch eine überschiessende Insulin/Inkretin-Sekretion als Reaktion auf die hohe Glucosezufuhr im proximalen Darm eine schwere Hypoglykämie resultieren mit neuroglykämischen Symptomen und so Kompromittierung der Lebensqualität trotz zufriedenstellender Gewichtsabnahme. Diese Symptome müssen ernst genommen werden, benötigen eine umfängliche Abklärung und Therapie. Letztere besteht aus drei Säulen: Ernährungsberatung mit Änderung der Essgewohnheit, Vorstellung am Adipositaszentrum/Endokrinologen und Evaluation einer medikamentösen Therapie, bei Persistenz der Symptome Erwägung einer restriktiven Chirurgie mit Anastomoseneinengung (gastric outlet restriction).
Literatur:
1. Wildisen A., Schütz P., Rate of cardiovascular events and safety outcomes seven years following gastric bypass versus sleeve gastrectomy, Division of Endocrinology, Diabetes and Metabolism; University Department of Med-icine, Kantonsspital Aarau, Aarau, Switzerland, publication in evaluation
3. Malik S.Recognition and Management of hyperinsulinemic hypoglycemia after bariatric surgery.Obes Res Clin Pract 2016;10(1):1-14
2. Banerjee A. The role of dumping syndrome in weight loss after gastric bypass surgery.Surg Endosc 2013;27:1573-1578
4. Dirkson C. No islet cell hyperfunction but altered gut-islet regulationand postprandial hypoglycemia in glucose tolerant patients 3 years after gastric Bypass surgery. Obes Surg 2016;26(9):2263-2267
5. Salehi M. Hypoglycemia after Gastric Bypass Surgery Current Concepts and Controversies. J Clin Endocrinol Metab 2018; 103(8):2815-2826
6. Stano S. Effect of mealsize and texture on gastric pouchemptying and
glucagonlike peptide 1 after gastric bypass surgery. Surg Obes Relat Dis
2017 ;13(12):1975-1983
7. Myint KS.Prolonged successful therapy for hyperinsulinaemic hypoglycemia
after gastric bypass: the pathophysiological role of GLP-+ and its response to
a somatostatine analogue. Eur J Endocrinol. 2012; 166(5):951-955
8. Abrahamsson N. GLP-1-analogs as treatment of postprandial hypoglycemia
following gastric bypass surgery: a potential new indication?. Eur J Endocrinol 2013; 169(6):885-889
9. Z’graggen K. Severe recurrent hypoglycemia after gastric bypass surgery 2008;18(8):981-988
der informierte @rzt
- Vol. 12
- Ausgabe 9
- September 2022