- Nephroprotektion
Zahlreiche tierexperimentelle und klinische Studien zeigen, dass eine Reduktion des intraglomerulären Drucks mit Verminderung von Albuminurie/Proteinurie über die reine Senkung des systemischen Blutdrucks hinaus die Nierenfunktion bei chronischer Nephropathie länger aufrechterhält. Dies ist Folge einer verminderten Endozytose glomerulär filtrierten Albumins in den Tubuluszellen, was die toxische proinflammatorisch/profibrotische Aktivität der endozytierten Albuminmoleküle reduziert und damit dem beschleunigten Untergang von Nephronen entgegenwirkt. Nephroprotektion bedeutet demnach Nierenfunktionserhaltung über die reine systemische Blutdrucksenkung hinaus. Die dazu zwingend nötige Senkung des intraglomerulären Drucks wird klinisch durch Dilatation der efferenten glomerlulären Arteriole (ACE-Hemmer, Angiotensin II-Rezeptorantagonisten, Nicht-Dihydropyridin-Kalziumantagonisten oder Lercandipin) oder – via tubulo-glomerulären Feedback – durch Konstriktion der afferenten glomerulären Arteriole (SGLT2-Hemmer, Reduktion der Zufuhr von tierischem Eiweiss) erreicht. Die haemodynamisch vermittelte Senkung des intraglomerulären Drucks führt akut immer zu einer Reduktion der glomerulären Filtrationsrate resp. einem Anstieg des Serumkreatinins um 10-15%, stabilisiert aber längerfristig die Nierenfunktion auf höherem Niveau. Dies bedeutet für die Patienten mehr Lebensjahre ohne Nierenersatzverfahren.
Numerous animal and clinical studies show that reduction of intraglomerular pressure with reduction of albuminuria/proteinuria beyond mere reduction of systemic blood pressure maintains renal function longer in chronic nephropathy. This is a consequence of decreased endocytosis of glomerular filtered albumin in tubule cells, which reduces the toxic proinflammatory/profibrotic activity of endocytosed albumin molecules, thereby counteracting accelerated nephron demise. Nephroprotection thus means preservation of renal function beyond mere systemic blood pressure reduction. The necessary reduction of intraglomerular pressure is clinically achieved by dilatation of the efferent glomerular arteriole (ACE inhibitors, angiotensin II receptor antagonists, non-dihydropyridine calcium antagonists or lercandipine) or – via tubulo-glomerular feedback – by constriction of the afferent glomerular arteriole (SGLT2 inhibitors, reduction of animal protein intake). The hemodynamically mediated reduction of intraglomerular pressure always leads acutely to a reduction of the glomerular filtration rate or an increase in serum creatinine by 10-15%, but stabilizes renal function at a higher level in the longer term. This means more years of life for patients without renal replacement procedures.
Key Words: Erhaltung der Nierenfunktion, systemischer Blutdruck vs. intraglomerulärer Druck, tubulo-glomerulärer Feedback, Albuminurie/Proteinurie
Progression chronischer proteinurischer Nephropathien
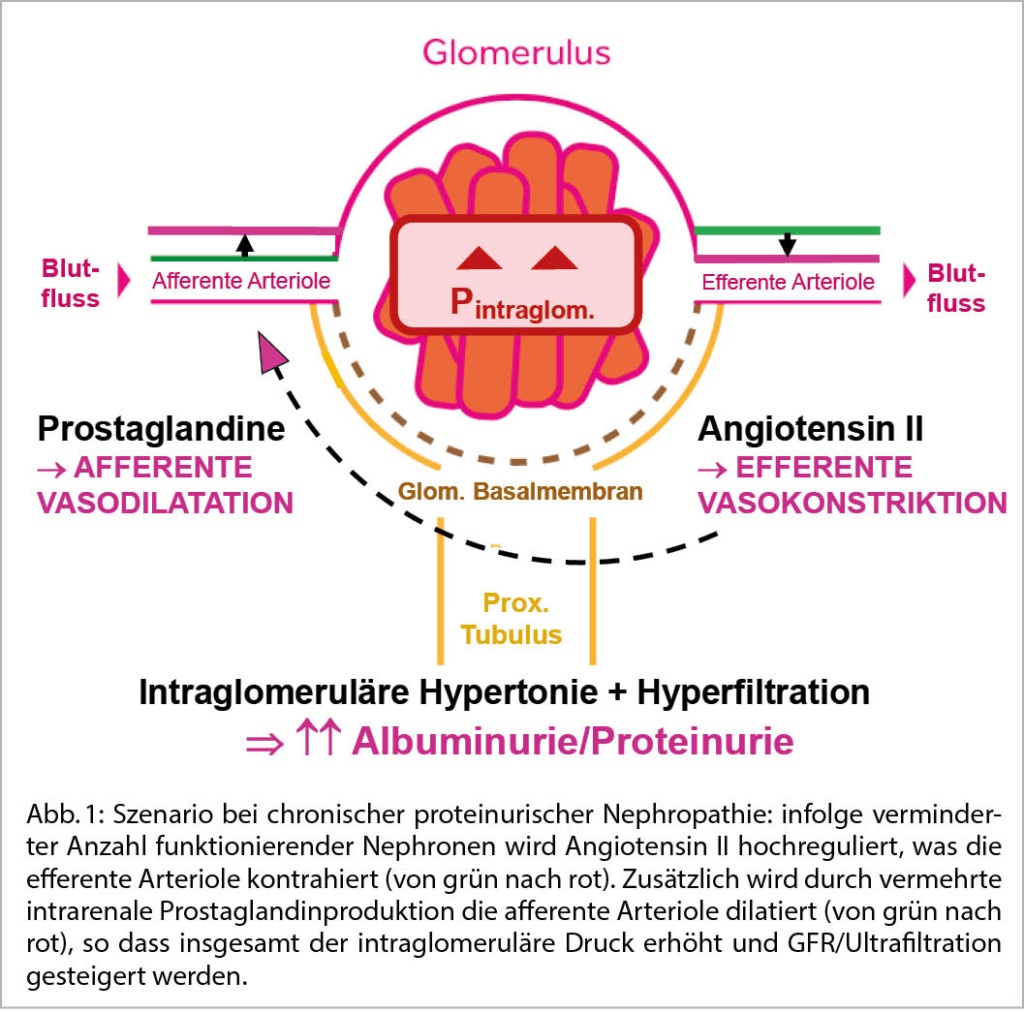
Chronische proteinurische Nephropathien gehen wegen zunehmendem Verlust intakter Glomeruli mit progredientem Funktionsverlust einher (1). Tierexperimentell zeigen die verbleibenden intakten Nephronen eine ausgeprägte Hypertrophie und eine intraglomeruläre Hypertonie/Hyperfiltration. Dadurch hält die reduzierte Anzahl funktionierender Nephronen möglichst viel Nierenfunktion aufrecht (2). Vermehrt gebildetes Angiotensin II erhöht durch Kontraktion der efferenten glomerulären Arteriole (Abb. 1) den Filtrationsdruck und erweitert die glomerulären Filterporen. Dies führt zu vermehrter Ultrafiltration von Proteinen, in erster Linie Albumin. Die vermehrte Proteinurie/Albuminurie hat sich in zahlreichen tierexperimentellen und klinischen Studien als entscheidender Progressionsfaktor einer proteinurischen Nephropathie erwiesen: Die Endozytose von deutlich vermehrt filtriertem Albumin in den nachgeschalteten Tubuluszellen induziert toxische proinflammatorische und profibrotische Signale (2, 3). Die Folge sind tubulointerstitielle Schäden und letztendlich der Untergang von Nephronen, wodurch sich die Nierenfunktion zunehmend verschlechtert (2, 3).
Wegweisende tierexperimentelle Studien konnten zeigen, dass die Normalisierung allein des systemischen Hochdrucks mit althergebrachten Antihypertensiva den fortschreitenden Nierenfunktionsverlust und die progrediente Proteinurie nicht verhindern kann, wohl aber die gleichzeitige Senkung des intraglomerulären Hochdrucks durch den ACE-Hemmer Enalapril, welcher die efferente glomeruläre Arteriole dilatiert und dadurch den intraglomerulären Druck normalisiert (4).
Blutdruckeinstellung, Proteinurie und Nieren – was ist Nephroprotektion?
Eine nicht adäquat behandelte arterielle Hypertonie begünstigt eine hypertensiv-ischaemische Nierenschädigung (5). Bei den Ziel-Blutdruckwerten muss unterschieden werden zwischen Hypertonikern ohne Zusatzpathologien und solchen mit chronischer Niereninsuffizienz und/oder Diabetes mellitus (6). Ohne Zusatzpathologien sollte ein Blutdruck von < 140/90 mmHg angestrebt werden (6). Eine zu rigorose Blutdrucksenkung auf systolisch < 120 mmHg bewirkt vermehrt Nierenfunktionsverschlechterungen, wie anhand einer Subgruppe von 3304 Patienten aus der SPRINT-Studie (7) mit einer eGFR > 60 ml/min./1.73 m2 gezeigt werden konnte (8).
Bei chronischer Nierenerkrankung mit Hypertonie und Albuminurie/Proteinurie sollte der Blutdruck gegen 130/80 gesenkt werden (7), bei chronischer Niereninsuffizienz Stadium 3 und Proteinurie > 1 g/d auch unter 130/80 mmHg (6, 9). Wie schon tierexperimentell haben auch klinische Studien gezeigt, dass die Reduktion von Albuminurie/Proteinurie infolge Senkung des intraglomerulären Drucks der wichtigste nephroprotektive Faktor zur Verlangsamung der Krankheitsprogression darstellt (3, 6, 9). Die damit verbundene Reduktion der Endozytose glomerulär filtrierten Albumins in den nachgeschalteten Tubuluszellen reduziert die proinflammatorisch/profibrotische Aktivität und damit den beschleunigten Untergang von Nephronen. Ziel ist, den Abfall der Nierenfunktion über die Zeit abzuflachen/zu stoppen und so den Patienten möglichst lang eine Nierenersatztherapie zu ersparen. Nephroprotektion ist also nicht nur simple Blutdrucksenkung!
Welches sind Nephroprotektoren?
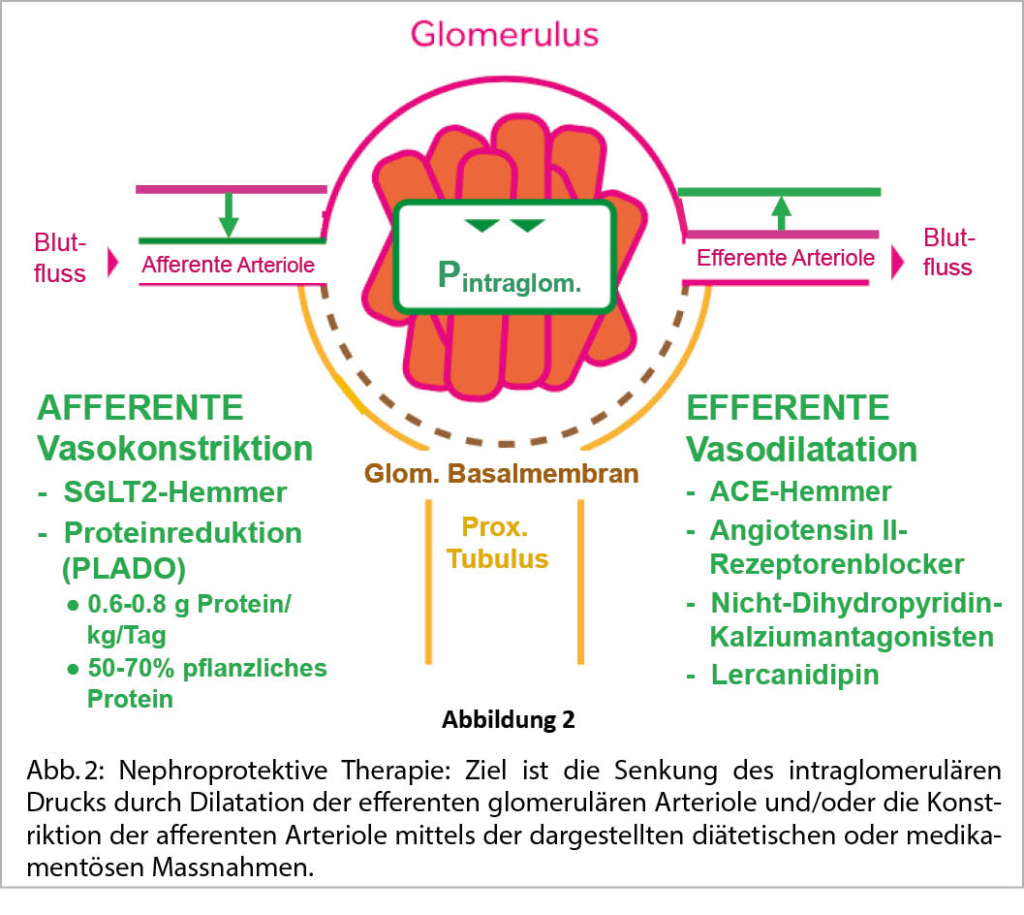
Die Senkung des Drucks in den Glomeruli kann durch Drosselung der Blutzufuhr in die Glomeruli hinein (Konstriktion der afferenten Arteriole) und durch Erhöhung des Blutabflusses aus den Glomeruli heraus (Dilatation der efferenten Arteriole) erzielt werden (Abb. 2).
Dilatation der efferenten glomerulären Arteriole
ACE-Hemmer
In einer Metaanalyse klinischer Studien mit 1610 Diabetikern mit Hypertonie und Albuminurie > 30mg/Tag zeigte sich, dass ACE-Hemmer bereits bei einer Blutdrucksenkung von Null eine Reduktion von Albuminurie/Proteinurie um 28% bewirken, während konventionelle Antihypertensiva erst ab einer Blutdrucksenkung > 5% antiproteinurisch wirken. Gleiches zeigte bei Nicht-Diabetikern mit proteinurischer Nephropathie auch die REIN-Studie (11). Dies spricht klar für eine über die Blutdrucksenkung hinaus gehende intrinsisch-renale Wirkung durch Reduktion des intraglomerulären Drucks (Abb. 2) mit geringerer Albuminurie/Proteinurie (2, 3). Die Reduktion dieses «protein traffic» ist entscheidend für die Aufrechterhaltung der Nierenfunktion durch ACE-Hemmer (2, 6).
Angiotensin II-Rezeptorenblocker
Auch für diese Stoffklasse war bereits vor Jahren eine Aufrechterhaltung der GFR bei signifikanter Reduktion der Proteinurie, wiederum wegen intraglomerulärer Drucksenkung, beschrieben worden (12).
Kalziumantagonisten
Nicht-Dihdropyridin-Kalziumantagonisten (Verapamil, Diltiazem) senken die Proteinurie bei Nephropathien um 30%, während bei vergleichbarer Blutdrucksenkung unter Dihydropyridin-Kalziumantagonisten (Nifedipin, Nicardipin, Amlodipin, Nisoldipin, Isradipin, Felodipin) die Proteinurie um 2% ansteigt (13). Dihydropryridin-Kalziumantagonisten erhöhen durch Dilatation der afferenten glomerulären Arteriole den intra-glomerulären Druck, während Nicht-Diydropyridine auch die efferente Arteriole erweitern und die Permeabilität der glomerulären Basalmembran reduzieren (13).
Bei den Dihydropyridinen scheint das Drittgenerationsmolekül Lercanidipin eine Ausnahme zu sein: tierexperimentell dilatiert Lercanidipin sowohl afferente als auch efferente Arteriolen (14). In einer Vergleichsstudie über 9-12 Monate bei hypertensiven Typ 2-Diabetikern mit Mikroalbuminurie senkte Lercanidipin bei vergleichbarer Blutdrucksenkung die Proteinurie im gleichen Umfang wie der ACE-Hemmer Ramipril (15).
Konstriktion der afferenten Arteriole
SGLT2-Hemmer
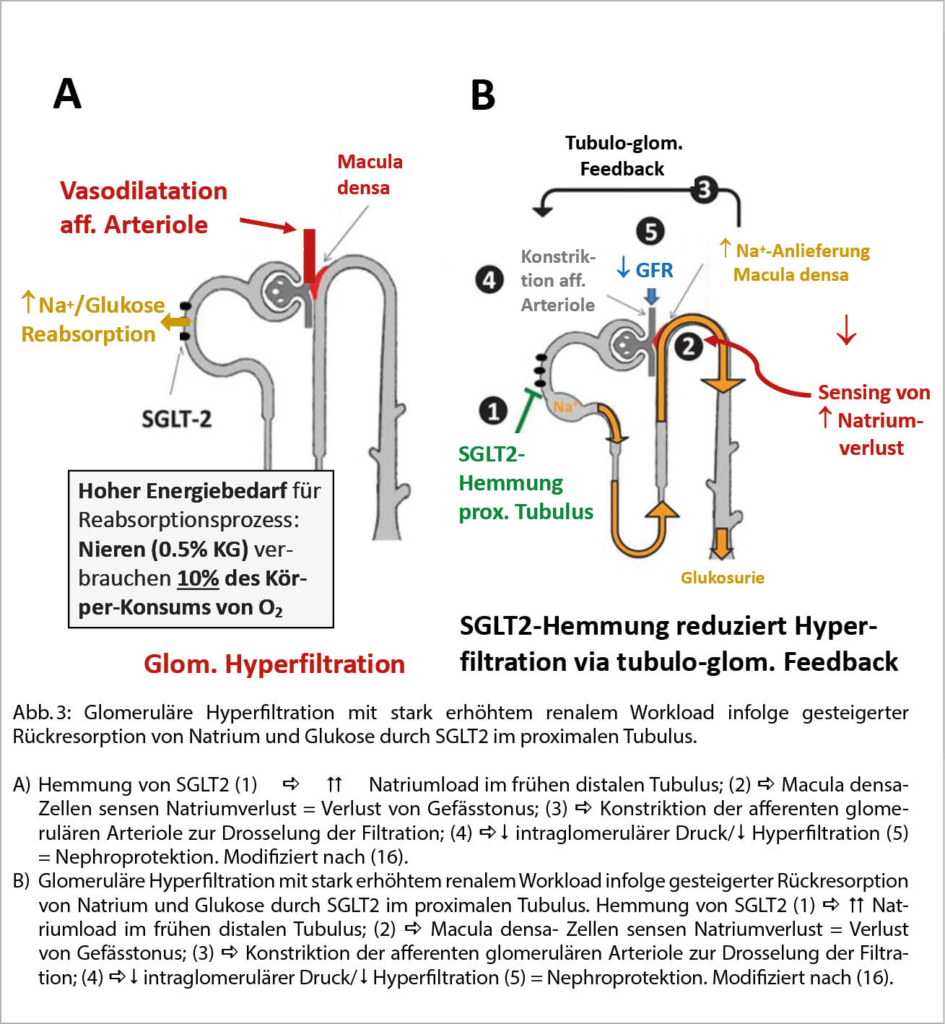
Wie in Abbildung 3A dargestellt, ist bei renaler Hyperfiltration im Rahmen z.B. einer diabetischen Nephropathie ein stark erhöhter Energieaufwand nötig, um vermehrt filtrierte Glukose und Natrium im proximalen Tubulus unter Einfluss von SGLT2 (Sodium-Glucose Transporter 2) zurückzugewinnen. Die selektive Hemmung von SGLT2 reduziert diesen Energieaufwand erheblich und hat via den sog. tubulo-glomerulären Feedback (TGF) direkte Auswirkungen auf die renale Haemodynamik (Abb. 3B). Die vermehrte Anlieferung von Natrium nach distal wird von den Zellen der Macula densa, welche im frühen distalen Tubulus direkt der afferenten glomerulären Arteriole anliegen und als Chemorezeptoren wirken, als «Natriumverlust» wahrgenommen. Via TGF wird der Tonus der afferenten Arteriole hochreguliert, so dass der intraglomeruläre Druck abgesenkt und die schädigende Wirkung der Hyperfiltration reduziert wird (16). Zusätzlich scheinen auch die Hemmung zusätzlicher tubulärer Transporter und profibrotischer Faktoren sowie die Aktivierung von protektiven Transkriptionsfaktoren nephroprotektiv (17). Insgesamt ist aber die Senkung des intraglomerulären Drucks der wichtigste Mechanismus für die nephroprotektiven Eigenschaften der SGLT2-Hemmer (17). Dapagliflozin hat denn auch als erster SGLT2-Hemmer sowohl bei Diabetikern als auch Nicht-Diabetikern mit chronischer Niereninsuffizienz und Makroalbuminurie eine 44%-ige Reduktion des Risikos für den kombinierten Endpunkt (> 50% GFR-Verlust/Endstadium-Niereninsuffizienz/Tod aus renaler Ursache) gezeigt (18).
Ernährungstechnische Massnahmen
Eine Studie mit 9226 koreanischen Probanden ohne Nierenerkrankung und einer mittleren eGFR von 94 ml/min./1.73 m2 zeigte auf, dass das Risiko für eine renale Hyperfiltration in der höchsten Quartile der täglichen Proteinzufuhr (1.7 g/kg KG) gegenüber der tiefsten Quartile (0.6 g/kg KG) 3.5-fach erhöht und die stärkste Hyperfiltration mit dem schnellsten Nierenfunktionsverlust über die Zeit assoziiert waren (19).
Bei chronischen Nephropathien resultiert, wie in Abbildung 1 gezeigt, bereits nahrungsunabhängig eine glomeruläre Hyperfiltration mit intraglomerulärem Hochdruck. Übermässiger Konsum von Protein kann diesen Effekt verstärken. Die genauen Mechanismen scheinen vielfältig und beinhalten – zumindest tierexperimentell – vermehrte Expression proinflammatorischer Gene und eine verstärkte renale Fibrose (20). Auch der tubulo-glomeruläre Feedbackmechanismus ist involviert: hohe Proteinzufuhr dilatiert die afferente Arteriole (20). Mechanistisch gesehen führt die Verdauung hoher Mengen von tierischen Proteinen zu einer vermehrten gastrointestinalen Aufnahme von Aminosäuren ins Blut. Die glomerulär vermehrt filtrierten Aminosäuren müssen tubulär wieder rückresorbiert werden. Dieser Rückresorptionsprozess co-stimuliert die proximal-tubuläre Natriumrückresorption (21), was zu einer verminderten Natriumanlieferung nach distal führt und von den Macula densa-Zellen als «Natrium-Overload» wahrgenommen wird (Abb. 4). Zur Korrektur dieses Natriumüberschusses wird die afferente Arteriole dilatiert, um vermehrt Natrium zu filtrieren (21).
In Anlehnung an viele Studien, welche den nephroprotektiven Effekt einer Reduktion der Zufuhr tierischen Eiweisses gezeigt haben, wird deshalb eine «plant-dominant low protein diet» (PLADO) zur Vermeidung der glomerulären Hyperfiltration empfohlen (22). Sie beinhaltet:
- täglich 0.6-0.8 g Protein pro KG Normalgewicht (80 kg KG: max. 64 g Protein/Tag)
- davon 50-70% pflanzliches Protein (Gemüse, Früchte), weniger tierisches Protein (v.a. rotes Fleisch)
- weniger als 10 g Salz pro Tag
- mehr als 25 g faserreiche Produkte pro Tag
Hinweise für den klinischen Alltag
Abbildung 2 fasst die dargestellten echt nephroprotektiven Strategien (Stand 2022) zusammen. Im klinischen Alltag sollte bei PatientInnen mit chronischer Nephropathie und Albuminurie/Proteinurie der Effekt nephroprotektiver Massnahmen mindestens 1x jährlich durch Bestimmung von eGFR (CKD-EPI-Formel, siehe AGLA-Risikorechner) und Albuminurie/Proteinurie evaluiert werden. Für letzteres empfiehlt sich eine standardisierte Situation, z.B. nach Fasten über Nacht im 2. Morgenurin vor dem Frühstück (Vermeidung von Nahrungsinterferenzen). Es sollte dabei nicht bloss die Konzentration von Albumin/Protein, sondern eine Albumin/Kreatinin- oder Protein/Kreatinin-Ratio bestimmt werden. Werte von Urinalbumin/Kreatinin < 3 mg/mmol gelten als normal (23).
Zeigt sich im Verlauf eine Verschlechterung dieser zwei prognostisch entscheidenden Werte, müssen die nephroprotektiven Massnahmen reevaluiert werden. Dabei ist wichtig, dass alle Massnahmen, die den intraglomerulären Druck senken, initial immer zu einem haemodynamisch bedingten Abfall der GFR um 10-15% resp. zu einem Anstieg des Serumkreatinins führen. Dieser Effekt muss nachweisbar sein und ist effektiv der Beweis, dass der intraglomeruläre Druck erfolgreich gesenkt wird – Nephroprotektion! (18).
Zweitabdruck aus «der informierte arzt» 10-2022
Copyright bei Aerzteverlag medinfo AG
Innere Medizin & Nephrologie/Hypertonie
NierensteinZentrumZürich
Klinik Im Park
Bellariastrasse 38
8038 Zürich
bernhard.hess@hirslanden.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Hayslett JP. Functional adaptation to reduction in renal mass. Physiol Rev 1979 ; 1979; 59: 137-164.
2. Perico N, Codreanu I, Schiepatti A, Remuzzi G. Pathophysiology of disease pro- gression in proteinuric nephropathies. Kidney Int 2005; 67 (Suppl 94), S79-S82.
3. Heerspink HJL, Gansevoort TRT. Albuminuria is an appropriate therapeutic target in patients with CKD: the Pro view. Clin Am J Nephrol 2015; 10: 1079-1088.
4. Anderson S, Rennke HG, Brenner BM. Therapeutic advantage of converting en- zyme inhibitors in arresting progressive renal disease associated with systemic hy- pertension in the rat. J Clin Invest 1986; 77: 1993-2000.
5. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH guidelines for the manage- ment of arterial hypertension. Eur Heart J 2018; 39: 3021-3104.
6. Khosla N, Bakris G. Lessons learned from recent hypertension trials about kidney disease. Clin J Am Soc Nephrol 2006; 1: 229-235.
7. Wright JT jr., Jeff D. Williamson JD, Paul K. Whelton PK et al. for the SPRINT Re- search Group. A randomized trial of intensive versus standard blood-pressure con- trol. N Engl J Med 2015; 373: 2103-2116.
8. Magrico R, Vieira MB, Viegas Dias C, Leitao L, Neves JS. Blood pressure reduction, kidney function decline, and cardiovascular events in patients without CKD. Clin J Am Soc Nephrol 2018; 13 : 73-80.
9. Sarafidis PA, Ruilope LM. Aggressive blood pressure reduction and renin-angio- tensin system blockade in chronic kidney disease: time for re-evaluation? Kidney Int 2014; 85: 536-546.
10. Böhlen L, de Courten M, Weidmann P. Comparative study of the effect of ACE- inhibitors and other antihypertensive agents on proteinuria in diabetic patients. Am J Hypertens 1994; 7: 84S-92S.
11. Ruggenenti P, Perna A, Gherardi G et al. Renoprotective properties of ACE-inhibi- tion in non-diabetic nephropathies with non-nephrotic proteinuria. Lancet 1999; 354: 359-364.
12. Gansevoort RT, de Zeeuw D, Shahinfar A, Redfoled A, de Jong PE. Effects of the angiotensin II antagonist losartan in hypertensive patients with renal disease. J Hy- pertens 1994; 12 (Suppl 2): S37-S42.
13. Bakris GL, Weir MR, Secic M, Campbell B, Weis-McNulty A. Differential effects of calcium antagonist subclasses on markers of nephropathy progression. Kidney Int. 2004; 65: 1991-2002.
14. Sabbatini M, Leonardi A, Testa R, Vitaioli L, Amenta F. Effect of calcium antago- nists on glomerulrar arterioles in spontaneously hypertensive rats. Hypertension 2000; 35: 775-779.
15. Dalla Vesta M, Pozza G, Mosca A et al. Effect of lercanidipine compared with ra- mipril on albumin excretion rate in hypertensive type 2 diabetic patients with microal- buminuria: DIAL study (diabete, ipertensione, albuminuria, lercanidipina). Diabetes Nutr Metab 2004; 17: 259-266.
16. Cherney DZ, Perkins BA, Soleymanlou N et al. Renal hemodynamic effects of so- dium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Cir- culation 2014; 129: 587-597.
17. Sen T, Heerspink HJL. A kidney perspective on the mechanism of action of sodium- glucose co-transporter 2 inhibitors. Cell Metab 2021; 33: 732-739.
18. Heerspink HJL, Bergur V, Stefansson et al. for the DAPA-CKD trial committees and inverstigators. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020; 383: 1436-1446.
19. Jhe JH, Kee YK, Park S et al. High-protein diet with renal hyperfiltration is asso- ciated with rapid decline of renal function: a community-based prospective cohort study. Nephrol Dial Transplant 2020; 35: 98-106.
20. Ko G-J, Rhee CM, Kalantar-Zadeh K, Joshi S. The effects of high-protein diets on kidney health and longevity. J Am Soc Nephrol 2020; 31: 1667-1679.
21. Woods LL. Mechanisms of renal hemaodynamic regulation in response to protein feeding. Kidney Int 1993; 44: 659-675.
22. Kalantar-Zadeh K, Joshi S, Schlueter R et al. Plant-dominant low-protein diet for conservative management of chronic kidney disease. Nutrients 2020; 12:1931. doi:10.3390/nu12071931
23. American Diabetes Association. 11. Microvascular Complications and Foot Care: Standards of Medical Care in Diabetes – 2021. Diabetes Care 2021;44 (Suppl 1): S15
info@herz+gefäss
- Vol. 12
- Ausgabe 5
- Oktober 2022