- Genetische Untersuchung beim fortgeschrittenen Prostatakarzinom
In der Schweiz sterben jährlich fast 1’400 Männer am fortgeschrittenen Prostatakarzinom. Wie beim lokalisierten Prostatakarzinom ist auch die fortgeschrittene Erkrankung sehr heterogen. In den letzten Jahren ist es gelungen, molekulare Subtypen zu charakterisieren, bei welchen eine zielgerichtete Therapie erfolgsversprechend sein kann. Dafür ist eine molekularpathologische Untersuchung des Tumorgewebes (somatische Testung) erforderlich. Beim fortgeschrittenen Prostatakarzinom ist diese bereits Standard. Molekularpathologische Ergebnisse der somatischen Untersuchung sind einerseits relevant für die Therapieauswahl und weisen andererseits auf eine mögliche hereditäre Komponente hin, welche auch für die erweiterte Familie hochrelevant ist.
In Switzerland, nearly 1’400 men die from advanced prostate cancer each year. As with localized prostate cancer, advanced disease is also very heterogeneous. In recent years, it has been possible to characterize molecular subtypes for which targeted therapy may be promising. This requires a molecular pathological examination of the tumor tissue (somatic testing). This is already standard practice in advanced prostate cancer. Molecular pathological results of somatic testing are on the one hand relevant for therapy selection and on the other hand indicate a possible hereditary component, which is also highly relevant for the extended family.
Key Words: Prostate cancer, Gene expression tests
Patientenbeispiel
Bei einem 54-jährigen Mann wird aufgrund von Rückenschmerzen ein synchron metastasiertes Prostatakarzinom diagnostiziert:
- PSA 583 ug/l, totales Testosteron 21nmol/l, alkalische Phosphatase 221 U/l, Hämoglobin 113 g/l
- Histologie aus der Prostata: Adenokarzinom mit teilweise cribriformem Muster, Gleason 4+5 (ISUP Gruppe 5)
- Bildgebend: disseminierte ossäre Metastasen und Nachweis von 3 Lungenmetastasen
Der Patient erhält eine Therapie aus Androgendeprivation (ADT) und einer zusätzlichen endokrinen Therapie. Elf Monate nach Start der Systemtherapie steigt der PSA-Wert im Kontext eines komplett supprimierten Testosterons im Sinne einer Kastrationsresistenz.
Eine molekularpathologische Untersuchung am Prostatakrebsgewebe wird in die Wege geleitet:
- TMPRSS2-ERG (4) Fusion
- Pathogene TP53-Mutation
- Mismatch Reparatur Proteine mittels Immunhistochemie: erhaltene Expression
- Mikrosatelliten-Instabilität: MSS
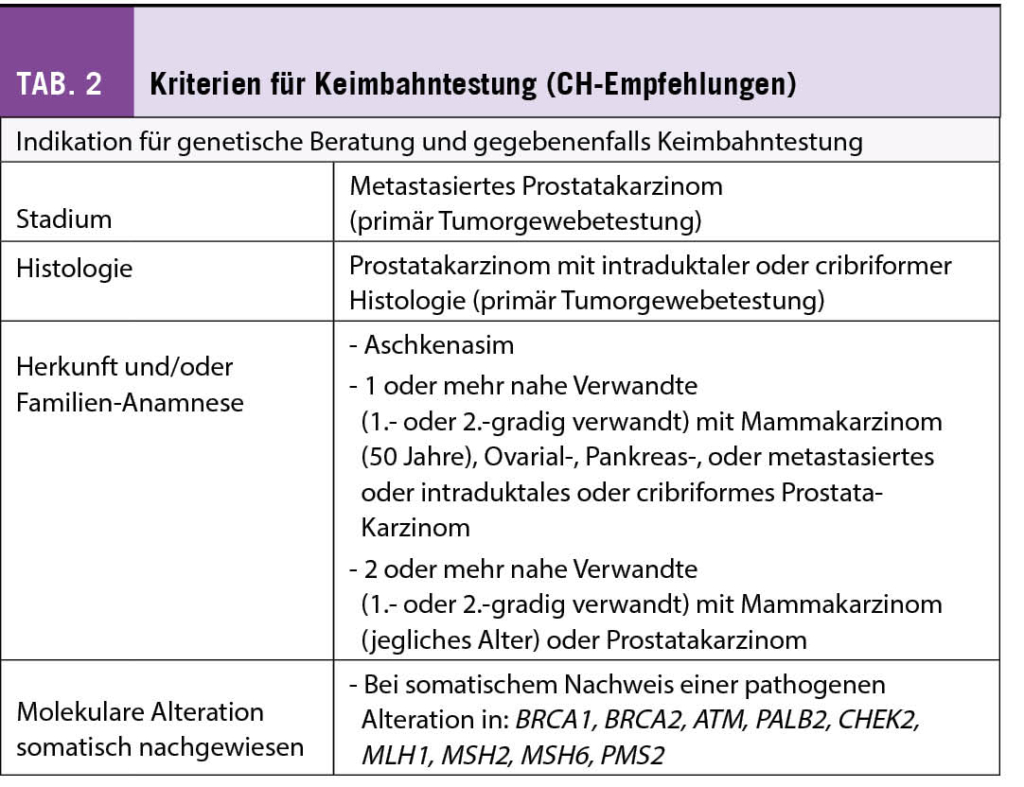
Die Familien-Anamnese ist bei diesem Patienten auffällig: Bei der Mutter wurde im Alter von 43 Jahren ein Mammakarzinom diagnostiziert. Sie ist mit 51 Jahren verstorben. Bei einer Schwester der Mutter wurde ein Pankreaskarzinom diagnostiziert. Der Patient hat keine Geschwister aber zwei Söhne und eine Tochter.
Aufgrund der sehr auffälligen Familiengeschichte wurde trotz negativer somatischer Testung eine genetische Beratung und Keimbahntestung in die Wege geleitet. In der Keimbahntestung wurde eine pathogene BRCA2 (c9097del, heterozygot) identifiziert. Eine genetische Beratung für die Kinder des Indexpatienten wurde in die Wege geleitet. Sollte sich bei den Kindern eine Keimbahnvariante bestätigen, so sind frühzeitige und spezifische Vorsorgemassnahmen notwendig.
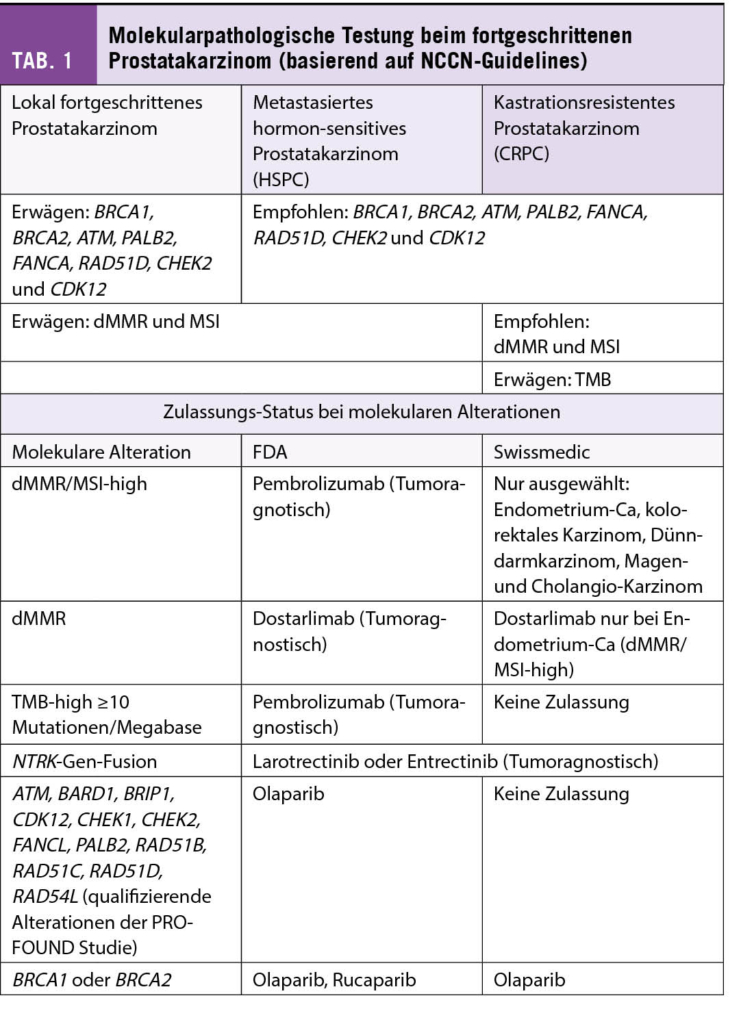
Aufgrund der nachgewiesenen BRCA2-Mutation konnte der Patient nach Versagen der ADT und einer neuen endokrinen Therapie in der 2. Therapie-Linie mit Olaparib (PARP-Inhibitor) behandelt werden (Zulassung in der Schweiz bei Nachweis einer pathogenen BRCA1/2-Variante: Keimbahnmutation und/oder somatische Mutation).
Häufigkeit der relevanten molekularen Alterationen beim fortgeschrittenen Prostatakarzinom
DNA-Reparaturgen-Defekte
In grossen Phase-III-Studien lag die Rate an pathogenen DNA-Reparaturgen-Defekten bei Patienten mit fortgeschrittenem, kastrationsresistentem Prostatakarzinom im Bereich von 25-28% (PROFOUND-Studie, PROPEL-Studie). Wenn man diese Prozentzahlen aufschlüsselt, so liegen in ca. 30-35% BRCA2- und in ca. 3-5% BRCA1-Alterationen vor. Die restlichen Prozente teilen sich auf eine Reihe von Gen-Defekten auf, insbesondere ATM, CDK12, CHEK2 und weitere.
Für die Zulassung von Olaparib durch Swissmedic in der Behandlung von Patienten mit Prostatakarzinom war die PROFOUND-Studie entscheidend. Die Therapie mit Olaparib hat in Kohorte A der Studie (Patienten mit BRCA1-, BRCA2- oder ATM-Alterationen) in der Situation nach Versagen einer endokrinen Therapie und mindestens einer taxanhaltigen Chemotherapie zu einer signifikanten Verbesserung im radiographisch-progressionsfreien (rPFS) und im Gesamt-Überleben geführt, wenn verglichen mit einer alternativen endokrinen Therapie. Die Zulassungsbehörden haben die Daten allerdings unterschiedlich interpretiert: Während die FDA eine Zulassung erteilt für Patienten mit allen eingeschlossenen Alterationen (Kohorte A und Kohorte B, siehe Tab. 1), haben die EMA und Swissmedic eine Zulassung für Olaparib nur bei Nachweis einer BRCA1 oder BRCA2 (Keimbahnmutation und/oder somatische Mutation) erteilt.
Zwei grosse Studien, welche am GU ASCO 2022 vorgestellt wurden, stellen das Konzept des Einsatzes von PARP-Inhibitoren ausschliesslich bei molekular ausgewählten Patienten mit Prostatakarzinom in Frage:
PROPEL-Studie
In der PROPEL-Studie wurden Patienten mit mCRPC eingeschlossen (ca. 20% hatten Docetaxel in der mHSPC-Situation) und randomisiert auf Olaparib 2x300mg/Tag plus Abirateron/Prednison Standarddosierung) versus Placebo plus Abirateron/Prednison. Eine molekulare Testung war für den Studieneinschluss nicht notwendig. Der primäre Endpunkt in der Studie wurde erreicht mit einer signifikanten Verbesserung im rPFS (24.8 vs 16.6 Monate, HR 0.66, 95% KI 0.54-0.81). Der rPFS-Vorteil war am ausgeprägtesten in der Biomarker-positiven Subgruppe, aber auch signifikant in der Biomarker-negativen Subgruppe. Details zu den Biomarkern (Aufschlüsselung der DNA-Reparaturgen-Defekte) liegen nicht vor.
Der rPFS Vorteil in der PROPEL-Studie ist klinisch relevant, aber bezüglich Gesamtüberleben gibt es noch zu wenig Follow-up. Auch bringt die Kombination Olaparib/Abirateron/Prednison relevante Nebenwirkungen mit sich. Wahrscheinlich werden in Zukunft wenige Patienten in der ersten Linie mCRPC naiv sein für neue endokrine Therapien, weil sie diese bereits in der hormon-sensitiven Situation erhalten haben.
MAGNITUDE-Studie
In der MAGNITUDE-Studie wurden Patienten mit mCRPC eingeschlossen (ca. 20% hatten Docetaxel in der mHSPC-Situation erhalten) und randomisiert auf Niraparib (1x200mg/Tag plus Abirateron/Prednison Standarddosierung) versus Placebo plus Abirateron/Prednison. Die Biomarker-negative Kohorte in MAGNITUDE wurde frühzeitig geschlossen bei fehlendem Nachweis eines Vorteils für die Kombination. In der Biomarker-positiven Kohorte (FoundationOne und/oder Resolution Bioscience liquid, Testung für: ATM, BRCA1/2, PRIP1, CDK12, CHEK2, FANCA, HDAC2, PALB2) zeigte sich aber ein signifikanter und eindrücklicher Vorteil im rPFS (16.6 vs 10.9 Monate, HR 0.53, 95% KI 0.36-0.79) für die Kombination Niraparib/Abirateron/Prednison. Der rPFS-Vorteil war am ausgeprägtesten in der Subgruppe der Patienten mit BRCA1- oder BRCA2-Alteration.
Aber auch in dieser Studie war die Kombination mit einer höheren Toxizität verbunden und zum Zeitpunkt der Präsentation fehlte auch hier der Nachweis eines signifikanten Gesamtüberlebensvorteils.
Die Interpretation der MAGNITUDE- und PROPEL-Studienresultate ist nicht einfach und wir dürfen auf Updates von beiden Studien gespannt sein. Die Advanced Prostate Cancer Consensus Conference (www.apccc.org) hat viele Fragen in diesem Zusammenhang diskutiert; die Resultate werden in Kürze veröffentlicht.
Defekte Mismatch-Reparaturproteine bzw. Mikrosatelliten-Instabilität
In nicht molekular selektionierten Patienten mit fortgeschrittenem Prostatakarzinom zeigten Checkpoint-Inhibitoren keine relevante Antitumor-Aktivität. In etwa 3-5% der Prostatakarzinome findet sich molekularpathologisch aber entweder ein Verlust der Mismatch-Reparaturproteine (MLH1, MSH2, MSH6, PMS2) beziehungsweise eine Mikrosatelliten-Instabilität (MSI-high). In diesen Fällen zeigte sich in kleinen Fallserien teilweise ein sehr gutes und langdauerndes Ansprechen auf eine Checkpoint-Inhibitortherapie.
Weniger gut untersucht ist die hohe Tumormutationslast (TMB-high). Basierend auf der tumoragnostischen Zulassung von Pembrolizumab bei TMB-high durch die FDA, kann diese Testung aber im Einzelfall zusätzlich evaluiert werden, falls sie nicht bereits Teil der molekularpathologischen Untersuchung darstellt.
Wann die zielgerichteten Therapien in der Therapiesequenz idealerweise eingesetzt werden sollen, bleibt offen.
Copyright bei Aerzteverlag medinfo AG
Onkozentrum Zürich
Seestrasse 259
8038 Zürich
Onkozentrum Zürich
Seestrasse 259
8038 Zürich
Zentrum für Urologie Zürich, Klinik Hirslanden
Witellikerstrasse 40
8032 Zürich
stephan.bauer@hirslanden.ch
Die Autoren haben keinen Interessenskonflikt in Zusammenhang mit diesem Artikel deklariert.
◆ Beim fortgeschrittenen Prostatakarzinom ist die molekularpathologische Untersuchung am Tumorgewebe Standard, spätestens bei Transition in die kastrations-resistente Situation und wenn der betroffene Patient als «fit» eingeschätzt wird für eine zielgerichtete Therapie.
◆ Bei Nachweis einer pathogenen Alteration in BRCA1 oder BRCA2 und nach Versagen einer neuen endokrinen Therapie ist in der Schweiz
Olaparib zugelassen.
◆ Für alle weiteren Alterationen ausser NTRK (siehe Tabelle 1) kann bei Nachweis einer pathogenen Alteration und idealerweise auf Empfehlung eines molekularen Tumorboards eine Kostengutsprache basierend auf Art. 71 bei der Krankenkasse eingereicht werden.
◆ Es bestehen seit 2021 detaillierte Empfehlungen für die genetische Beratung und Keimbahntestung von Männern mit Prostatakarzinom in der Schweiz.
info@onco-suisse
- Vol. 12
- Ausgabe 7
- Oktober 2022