- Welchen Stellenwert hat dies in der modernen Therapieära beim muskelinvasiven Urothelkarzinom?
Cisplatin hat in der Behandlung des muskelinvasiven Urothelkarzinoms (UC) sowohl im neoadjuvanten/adjuvanten Setting als auch im metastasierten Stadium der Erkrankung seit über 40 Jahren einen wichtigen Stellenwert. Basierend auf neueren Studiendaten [1] haben sich die Leitlinien im metastasierten und lokal fortgeschrittenen Stadium des UC jedoch geändert. Nun wird in der Erstevaluierung zwischen Platin- und Nicht-Platin-tauglichen Patienten unterschieden. Carboplatin hat daher einen wichtigen Stellenwert bekommen. Im perioperativen Setting ist allerdings die Cisplatin-Eligibility weiterhin Standard, da Carboplatin dem Cisplatin unterlegen ist. In diesem Artikel soll die Cisplatin-Eligibility (Kriterien, Guidelines und Gebrauch in Studien) genau beleuchtet werden und praktische Anleitungen für den klinischen Alltag gegeben werden.
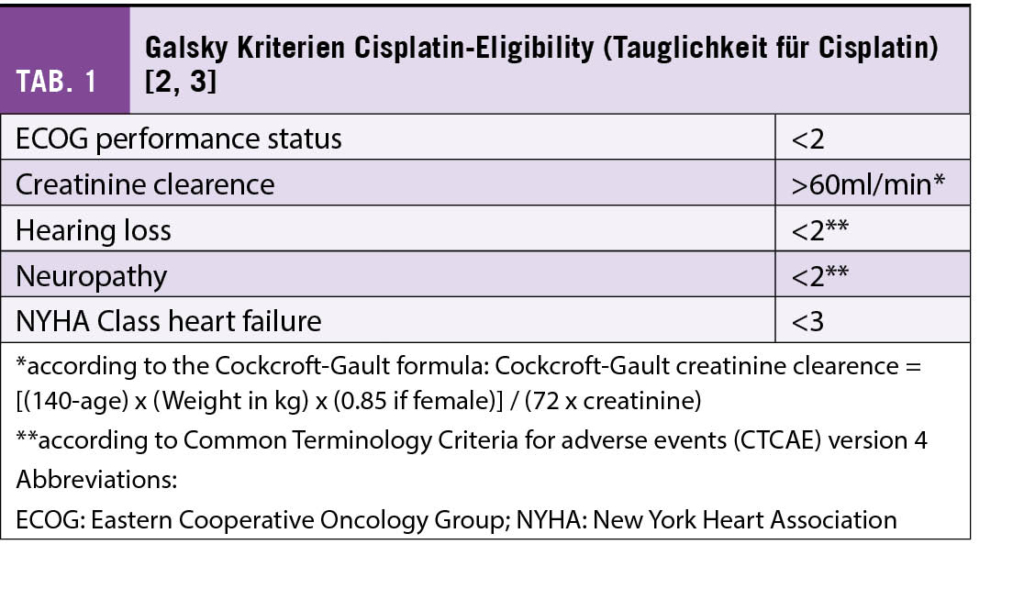
Zur initialen Einleitung und Übersicht sind die Cisplatin-Eligibility Kriterien von Galsky, M et al. dargestellt. Wenn man im metastasierten UC von Cisplatin-Eligibility sowohl in klinischen Studien wie auch im Alltag spricht, werden diese Kriterien herangezogen (Tab. 1)(2, 3). Im neoadjuvanten Setting besteht jedoch kein absoluter Konsensus, ob eine Kreatinin Clearance > 60 ml/min nach Cockcroft-Gault Formel vorliegen muss und Studieneinschlusskriterien waren hier etwas weniger streng.
1997 hat die European Organisation for Research and Treatment of Cancer (EORTC) eine Umfrage mit 40 Onkologen mit Schwerpunkt urogenitaler Tumore durchgeführt, um die “Cisplatin-Ineligibility” zu definieren [4]. 28 der Teilnehmenden haben eine erhaltene Nierenfunktion und einen WHO Performance Status von 0 or 1 als Prärequisite für eine Cisplatin-basierte Chemotherapie erachtet. Eine adäquate Nierenfunktion für Cisplatin wurde als gemessene oder berechnete [5] Kreatinin-Clearance von > 60 mL/min erachtet. Schon damals wurden circa 30-50% der Urothelkarzinompatienten als initial Cisplatin-untauglich eingestuft und entsprechende Strategien für prospektive Studien gerade in den Cisplatin-unfitten Patienten wurden versucht zu entwickeln. Eine EORTC Studie beim metastasierten UC, die den Stellenwert von einer Therapieintensivierung eines Carboplatin-basierten Schemas in Cisplatin-ineligible Patienten untersucht hat (GFR 30-60 ml/min), wurde von De Santis, M et al. 2012 publiziert [6]. Hier konnte M-CAVI (Methotrexat, Carboplatin, Vinblastin) gegenüber Carboplatin/Gemcitabine keinen Vorteil zeigen, somit blieb die «Doublette» erhalten bis zur Publikation der ersten Studien mit einem PD-1/PD-L1 Inhibitor in Cisplatin-ineligible Patienten in der Erstlinie [7, 8], jedoch alle mit geringer Evidenz aufgrund des Phase II Designs. Eine GFR > 30 ml/min ist auch heute in den Guidelines der Grenzwert für eine generelle Platin- und somit auch Carboplatin-Tauglichkeit.
Einige andere Guidelines basierend auf der Kreatinin Clearance wurden sowohl für das metastasierte UC als auch für das muskelinvasive Blasenkarzinom (MIBC) veröffentlicht.
Die EAU-Guidelines haben keine spezielle Definition für die Cisplatin-Eligibility beim MIBC. Für das metastasierte UC wird die Cisplatin-Eligibility für die Erstlinientherapie mit einer glomerulären Filtrationsrate (GFR) > 50 – 60 ml/min angegeben, basierend auf den Galsky Kriterien bzw der EORTC Empfehlung, jedoch waren die Experten der EAU-Guidelines kulanter und haben die GFR auf > 50 ml/min erweitert [9]. Dies beruht wohl auf einem weiteren Consensus Statement von 2011, wo in einem Survey 42% der Experten eine GFR von < 60 ml/min und 34% eine GFR von < 50% als adäquate Definition für Unfitness für Cisplatin gesehen haben in Bezug auf die Nierenfunktion [2].
Lokal fortgeschrittenes / metastasiertes Urothelkarzinom:
1. Cisplatin-Eligible – unbedingt Cisplatin oder ist Carboplatin genauso gut?
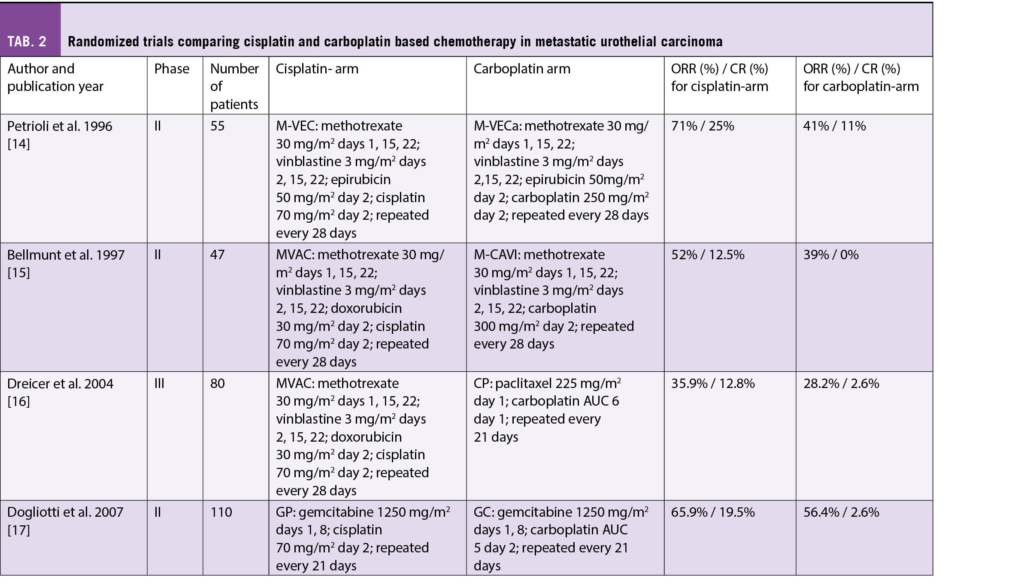
Carboplatin-haltige Schemata sind nicht als gleichwertig zu bewerten im Vergleich zu Cisplatin-haltigen. Ein Patient, der nach den Kriterien Cisplatin-fit ist, sollte dies auch bekommen. Studien mit Langzeit-Follow-up über 5 Jahre haben schon in Zeiten vor der Ära der switch Maintenance Therapie Langzeitkomplettremissionen in 10-15% der Patienten nach Cisplatin-basierter Therapie gezeigt [10, 11]. Eine Meta-Analyse von 4 randomisierten Phase II Studien, die Carboplatin- vs Cisplatin-haltige Therapien untersuchten, zeigte geringere Komplettremissionsraten (CR) und ein geringeres Gesamtüberleben (OS) für den Carboplatin Arm [12, 13] (Tab. 2). Daher sollte jeder Cisplatin-fitte Patient mit metastasiertem UC auch 2022 in der Erstlinie Cisplatin bekommen.
Jedoch haben die JAVELIN Bladder 100 Phase III Daten gezeigt, dass auch mit Carboplatin/Gemcitabine gute Ansprechraten erzielt werden können und dass Carboplatin wahrscheinlich nur gering schlechter abschneidet als Cisplatin [1]. Daher ist unserer Meinung nach im palliativen Setting von einem aggressiven Ansatz im Sinne einer Cisplatin split-dose Applikation bei einer GFR zwischen 50 und 60 ml/min eher abzusehen und eine Carboplatin-haltige Therapie bzw. ein Wechsel von Cisplatin auf Carboplatin bei Verschlechterung der Nierenfunktion zu erwägen.
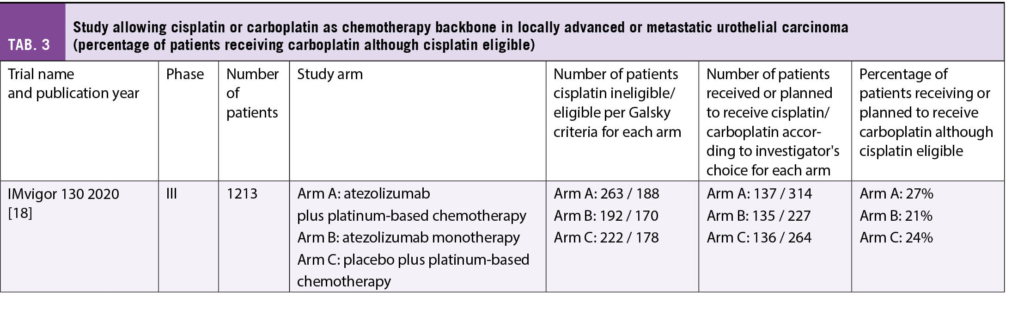
Trotz klarer Empfehlungen bei Cisplatin-Eligibility auch wirklich Cisplatin zu geben, hat man in einer Studie, die beide Platine erlaubt hat nach Investigator’s Beurteilung, gesehen, dass Onkologen dazu neigen auch bei nach Definition vorliegender Cisplatin-Tauglichkeit Carboplatin zu geben [18]. Tabelle 3 fasst die Anzahl der Patienten zusammen, die in einer bedeutenden Studie im lokal fortgeschrittenen oder metastasierten UC, Carboplatin statt Cisplatin bekommen haben, trotz Tauglichkeit.
Cisplatin neoadjuvant/adjuvant beim MIBC
1. Neue Ansätze oder ist Cisplatin immer noch ein «Must»?
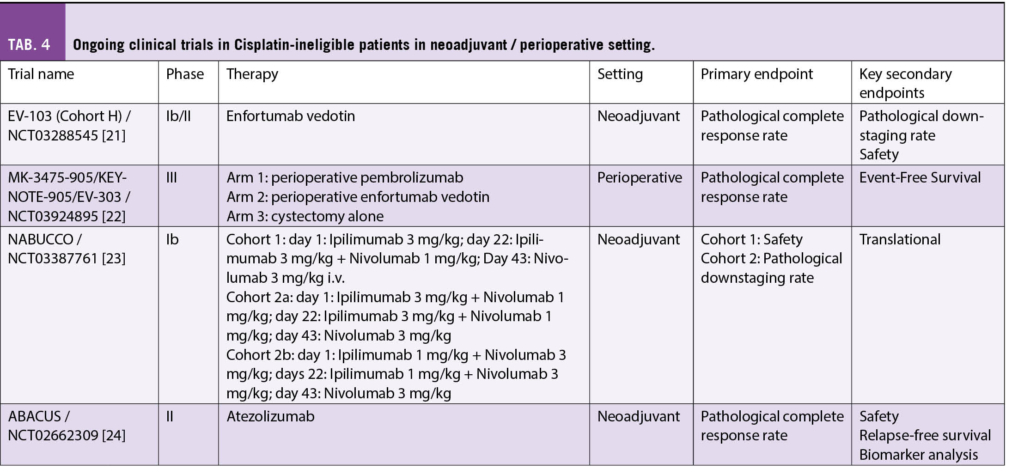
Im neoadjuvanten und adjuvanten Setting ist die Cisplatin-Eligibility auch 2022 immer noch State of the Art. Patienten, die nicht Cisplatin tauglich sind, erhalten keine neoadjuvante oder adjuvante Systemtherapie, da sich Carboplatin, ausser beim upper tract Urothelkarzinom – und auch hier ist die Evidenz für Carboplatin schwach –, nicht als effizient erwiesen hat, um das krankheitsfreie Überleben oder OS zu verlängern. Eine neoadjuvante Cisplatinbasierte Chemotherapie bringt einen OS Vorteil von etwa 5% über 5 Jahre. Die Empfehlung geht nach den Daten der VESPER phase III Studie zu einer Therapieintensivierung mit 4-6 Zyklen einer Kombinationstherapie mit ddMVAC (dose dense Methotrexat, Vinblastin, Doxorubicin, Cisplatin), da hier im Vergleich zu Cisplatin/Gemcitabine ein Vorteil im progressionsfreien Überleben gezeigt werden konnte [19]. Die Evidenz für den Benefit einer Cisplatin-haltigen Therapie im adjuvanten Setting ist geringer und beruht auf Metaanalysen, die aber doch einen Vorteil der Applikation einer adjuvanten Chemotherapie auf Basis von Cisplatin gezeigt haben [20]. Aufgrund des OS Benefits im neoadjuvanten Setting sollte versucht werden, den Patienten möglichst Cisplatin eligible zu machen (Ableitung bei Harnstau oder Cisplatin split-dose Tag 1,8 bei einer GFR zwischen 50 und 60 ml/min). In den letzten Jahren wurden einige Studien designed, die auch den Cisplatin-ineligible Patienten eine effiziente perioperative Alternative bieten. Hier kommen vor allem alternative Therapien wie Checkpointinhibitoren oder Antibody Drug Conjugates (ADC) vor. Tabelle 4 zeigt die laufenden Studien neoadjuvant/perioperativ für Cisplatin-ineligible Patienten. Im adjuvanten Setting gibt es widersprüchliche Ergebnisse zum Stellenwert der Immuntherapie. Eine adjuvante Therapie für 1 Jahr mit Nivolumab in high-risk Patienten nach Zystektomie (mit oder ohne neoadjuvanter Chemotherapie) konnte in PD-L1 > 1% positiven Patienten einen Vorteil im DFS zeigen, jedoch sind die OS Daten noch unreif [25]. Eine Phase III Studie mit sehr ähnlichem Design mit Atezolizumab war hingegen negativ [26]. Daher ist der Stellenwert der adjuvanten Immuntherapie noch zu hinterfragen und aktuelle Guidelines empfehlen diese nur mit grosser Vorsicht und genauer Aufklärung des Patienten über die vorhandenen Studienergebnisse [27]. ADCs, wie zum Beispiel anti-Nectin-4 (Enfortumab Vedotin) in der Cisplatin-ineligible Patientenpopulation, sind ebenfalls in neoadjuvanten Studien in Monotherapie oder in Kombination mit Immuntherapie am Laufen.
Fazit:
Auch in der modernen Therapieära ist die genaue Evaluierung der Cisplatin-Fitness für die Patientenbehandlung besonders im neoadjuvanten/perioperativen, aber auch im metastasierten Setting des muskelinvasiven Urothelkarzinoms essentiell für das optimale Therapieansprechen.
Oncologia medica
Ente Ospedaliero Cantonale
Viale Officina 3
6500 Bellinzona
Istitutio Oncologico della Svizzera Italiana
Via Gallino 12
6500 Bellinzona
Dieser Artikel wurde initiiert und finanziert von Pfizer AG und Merck (Schweiz) AG. Der Inhalt wurde von den Autoren unabhängig verfasst. 10/2022
1. Powles T et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial
Carcinoma. N Engl J Med. 2020 Sep 24;383(13):1218-1230.
2. Galsky MD, et al.: A consensus definition of patients with metastatic urothelial carcinoma who are unfit for cisplatin-based chemotherapy. The Lancet Oncology 2011, 12(3):211-214.
3. Galsky MD, et al.: Treatment of patients with metastatic urothelial cancer “unfit” for Cisplatin-based chemotherapy. Journal of clinical oncology : official journal of the American
Society of Clinical Oncology 2011, 29(17):2432-2438.
4. De Wit R, European Organization for Research and Treatment: Overview of bladder cancer trials in the European Organization for Research and Treatment. Cancer 97:2120-2126, 2003
5. Cockcroft DW, et al.: Prediction of creatinine clearance from serum creatinine. Nephron 1976, 16(1):31-41.
6. De Santis M, et al.: Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/vinblastine in patients with advanced urothelial cancer who are unfit for cisplatin-based chemotherapy: EORTC study 30986. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2012, 30(2):191-199.
7. Balar AV, et al.: First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol 2017, 18(11):1483-1492.
8. Balar AV, et al.: Atezolizumab as first-line treatment in cisplatin-ineligible patients with
locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet (London, England) 2017, 389(10064):67-76.
9. Cathomas R, et al.: The 2021 Updated European Association of Urology Guidelines on
Metastatic Urothelial Carcinoma. European urology 2022, 81(1):95-103.
10. von der Maase H, et al.: Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2005, 23(21):4602-4608.
11. Sternberg CN, et al.: Seven year update of an EORTC phase III trial of high-dose intensity
M-VAC chemotherapy and G-CSF versus classic M-VAC in advanced urothelial tract
tumours. European Journal of Cancer 2006, 42(1):50-54.
12. Galsky MD, et al.: Comparative effectiveness of cisplatin-based and carboplatin-based chemotherapy for treatment of advanced urothelial carcinoma. Annals of Oncology 2012, 23(2):406-410.
13. Bamias A, et al.: Impact of contemporary patterns of chemotherapy utilization on survival in patients with advanced cancer of the urinary tract: a Retrospective International Study of Invasive/Advanced Cancer of the Urothelium (RISC). Annals of Oncology 2018, 29(2):361-369.
14. Petrioli R, et al.: Comparison between a cisplatin-containing regimen and a carboplatin-containing regimen for recurrent or metastatic bladder cancer patients. A randomized
phase II study. Cancer 1996, 77(2):344-351.
15. Bellmunt J, et al.: Carboplatin-based versus cisplatin-based chemotherapy in the treatment of surgically incurable advanced bladder carcinoma. Cancer 1997, 80(10):1966-1972.
16. Dreicer R, et al.: Phase III trial of methotrexate, vinblastine, doxorubicin, and cisplatin
versus carboplatin and paclitaxel in patients with advanced carcinoma of the urothelium.
Cancer 2004, 100(8):1639-1645.
17. Dogliotti L, et al.: Gemcitabine plus cisplatin versus gemcitabine plus carboplatin as first-line chemotherapy in advanced transitional cell carcinoma of the urothelium: results of a randomized phase 2 trial. European urology 2007, 52(1):134-141.
18. Galsky MD, et al.: Atezolizumab with or without chemotherapy in metastatic urothelial
cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet (London, England) 2020, 395(10236):1547-1557.
19. Pfister C et al. Dose-Dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin or
Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients With Nonmetastatic
Muscle-Invasive Bladder Cancer: Results of the GETUG-AFU V05 VESPER Trial. J Clin
Oncol. 2022 Jun 20;40(18):2013-2022
20. Sarah Burdett et al, Adjuvant Chemotherapy for Muscle-invasive Bladder Cancer: A Systematic Review and Meta-analysis of Individual Participant Data from Randomised Controlled Trials, European Urology, Volume 81, Issue 1, 2022, Pages 50-61
21. A Study of Enfortumab Vedotin Alone or With Other Therapies for Treatment of Urothelial Cancer (EV-103), NCT03288545, clinicaltrials.gov
22. Perioperative Pembrolizumab (MK-3475) Plus Cystectomy or Perioperative Pembrolizumab Plus Enfortumab Vedotin Plus Cystectomy Versus Cystectomy Alone in Participants Who Are Cisplatin-ineligible or Decline Cisplatin With Muscle-invasive Bladder Cancer (MK-3475-905/KEYNOTE-905/EV-303), NCT03924895, clinicaltrials.gov
23. Neo-Adjuvant Bladder Urothelial Carcinoma COmbination-immunotherapy (NABUCCO), NCT03387761, clinicaltrials.gov
24. Preoperative MPDL3280A in Transitional Cell Carcinoma of the Bladder (ABACUS), NCT02662309, clinicaltrials.gov
25. Bajorin DF, et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med. 2021 Jun 3;384(22):2102-2114
26. Bellmunt J, et al. Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021 Apr;22(4):525-537
27. Witjes JA et al. European Association of Urology Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2020 Guidelines. Eur Urol. 2021 Jan;79(1):82-104.
Referenzen sind auf Anfrage erhältlich.
info@onco-suisse
- Vol. 12
- Ausgabe 7
- Oktober 2022