- 22. Zürcher Herz-Kurs (Teil 1)
Am 3. November fand im Casino Lakeside der traditionelle Zürcher Herz-Kurs unter der Leitung der Professoren Paul Mohacsi und Wolfgang Amman von der Hirslanden Klinik im Park statt. Die beiden Organisatoren hatten sich ein spannendes Programm mit ausgezeichneten Referenten und interessanten Themen für die Praxis ausgedacht. Der folgende Bericht gibt in einem ersten Teil einen kurzen Überblick über die Themen «Herz und SGLT-2-Inhibition», «Herz und Rhythmus» sowie «Herz und Niere». In einem zweiten Teil werden die Themen «Herz und Alter», «Herz und Nervensystem» und «Herz und Tier», Gedanken eines Zoodirektors, folgen.
What’s hot?
Herz und SGLT-2 Inhibition

Primär kommt es unter SGLT-2 Inhibition zu einer Rückresorption von Glucose und Natrium und der Blutdruck wird moduliert. Sekundär kommt es zu einem Stress auf das Insulin und viele metabolische Effekte, insbesondere eine Verbesserung der Gluconeogenese, eine verminderte Sekretion der Katecholamine und der Glucocorticoide, wie Prof. Dr. med. Andreas Zirlik, Graz, eingangs erwähnte.
Angefangen hat es mit der EMPA REG Studie, die als diabetologische Safety-Studie gedacht war. 99% der Patienten hatten eine atherosklerotische Erkrankung und einen Diabetes. Dabei zeigte sich, dass Empagliflozin den primären Endpunkt deutlich um 14% senkte. Aber auch die Gesamtmortalität wurde um 32% gesenkt, so auch der kardiovaskuläre Tod um 38% und die Hospitalisierung wegen Herzinsuffizienz um 35%. Im weiteren Verlauf wurde bei einem weniger stark erkrankten Kollektiv in der DECLARE Studie mit Dapagliflozin eine signifikante Senkung des kardiovaskulären Todes und der Hospitalisation wegen Herzinsuffizienz bei Patienten mit Diabetes gesehen. In einer Metaanalyse, die alle grossen Studien mit Empagliflozin (EMPA-REG OUTCOME, Dapagliflozin (DECLARE-TIMI58), Canvagliflozin (CANVAS program, CREDENCE) und Ertugliflozin (VERTIS CV) zusammenfasste, wurden SGLT2-Inhibitoren mit einem geringeren Risiko für schwerwiegende unerwünschte kardiovaskuläre Ereignisse in Verbindung gebracht; ausserdem deuteten die Ergebnisse auf eine erhebliche Heterogenität bei den Assoziationen mit kardiovaskulärem Tod hin. Der grösste Nutzen über die gesamte Klasse hinweg bestand in einer Verringerung des Risikos für Hospitalisierung wegen Herzinsuffizienz (HHF) und Nierenerkrankungen, wobei der Nutzen für das HHF-Risiko die konsistenteste Beobachtung über alle Studien hinweg war.
Weitere wichtige Erkenntnisse lieferten die DAPA-HF Studie, die zeigte, dass Patienten mit oder ohne Diabetes praktisch gleich profitierten, sowie die EMPEROR REDUCED Studie und die DELIVER Studie, in denen die SGLT2-Hemmer Empagliflozin und Dapagliflozin auch bei Herzinsuffizienz mit reduzierter Auswurffraktion (EMPAREG-PRESERVED) als auch bei Herzinsuffizienz mit mild reduzierter bis erhaltener Ejektionsfraktion (DELIVER mit Dapagliflozin) den primären Endpunkt (kardiovaskulärer Tod oder Verschlechterung der Herzinsuffizienz) senkte. Bei diesen Patienten hatten sich die bisherigen Medikamente als wenig wirksam erwiesen. In beiden Studien war insbesondere die Reduktion der Hospitalisierung für Herzinsuffizienz ein Hauptdriver.
In der in Graz durchgeführten EMMY-Studie wurde nun noch untersucht, ob Empagliflozin zusätzlich zum Standard of Care einen günstigen Effekt bei Gabe innerhalb von 72 Stunden nach erfolgreicher PCI bei Patienten mit grossem Myokardinfarkt haben würde. NT-proBNP wurde in dieser Studie um 15% signifikant gesenkt. Sekundäre Endpunkte waren die Ejektionsfraktion, die um 1.5% signifikant erhöht wurde. Ferner wurde das Verhältnis zwischen dem vom Doppler abgeleiteten E und dem vom Gewebedoppler abgeleiteten E’ (E/E’), welches erwiesenermassen ein guter Prädiktor für den mittleren linksventrikulären diastolischen Druck ist, um 6.8% signifikant gesenkt, wie der Referent zeigte.
Kardiale Effekte der SGLT2-Hemmer
SGLT2-Inhibitoren senken die Blutglucose und das Blutvolumen, erhöhen die Blutketone und senken die Inflammation. Dies führt zu einer Verminderung der Herzinsuffizienz und zu verbesserten kardiovaskulären Outcomes. Die SGLT-2 Inhibition stellt zudem das Energiegleichgewicht wieder her.
Die Natriumhypothese: Da eine erhöhte intrazelluläre Na+-Belastung die mitochondriale Ca2+-Behandlung beeinträchtigt und dadurch die Abstimmung von Energieangebot und -nachfrage sowie die mitochondrialen antioxidativen Abwehrsysteme verschlechtert, könnte Empagliflozin die Herzfunktion positiv beeinflussen, indem es die mitochondriale Funktion und den Redoxzustand im versagenden Herzen wiederherstellt, so der Referent.
SGLT-2 Inhibition und Niere
Klinische und nicht-klinische Studien legen mehrere Mechanismen nahe, die für die Vorteile bezüglich Niereninsuffizienz verantwortlich sind. Dazu gehören die kardiale und renale Energieeffizienz, der Umbau des Herzens, die Erhaltung der Nierenfunktion, die Immunmodulation, die Senkung der Inflammation, Veränderungen des Hämatokrits und die Kontrolle von Risikofaktoren. Somit haben SGLT2-Inhibitoren ein enormes Potenzial zur Verbesserung der Ergebnisse in Bevölkerungsgruppen mit Herzinsuffizienz und chronischer Nierenerkrankung. Die SGLT-2 Hemmer sind zu neuen Blockbustern geworden und haben auch bereits Eingang in die Guidelines gefunden.
Herz und Rhythmus
Kardiologie-Quiz mit Praxisfällen

Die Physiologie/Anatomie, EKGs aus der eigenen Praxis und das Management /Guidelines präsentierte PD Dr. med. Christoph Scharf von der Klinik im Park. Er erinnerte zunächst an einige physiologische Grundkenntnisse und erwähnte insbesondere das His-Bündel, welches vom Basler Wilhelm His 1893 am Anatomiekongress in Bern vorgestellt wurde.
Dr. Scharf stellte 4 Fälle vor, die von den Teilnehmern interaktiv bearbeitet wurden. Der erste Fall war ein älterer asymptomatischer Patient mit bekanntem bradykardem Vorhofflimmern. Es handelte sich um einen AV-Block Grad 3. Die Therapie gemäss Guidelines (Level C) ist ein Schrittmacher. Der Referent betonte, dass man den AV-Block beim Vorhofflimmern gerne vergisst.
Ein weiterer Fall betraf den AV-Knoten. Ist er gesund oder nicht? Der Referent erinnerte an den organischen vs. den vagotonen AV-Block 3. Beim organischen AVB 3 ist der Sympathikus aktiv, beim vagotonen AVB 3 ist der Parasympathikus aktiv. Im vorliegenden Fall handelte es sich um einen AV-Block 3 und gleichzeitig zeigte sich, dass die Sinusfrequenz deutlich langsamer wird. Es handelte sich um eine gleichzeitige Verlangsamung von AV-Knoten und Sinusknoten, also eine vagotone Pause. Ein Schrittmacher ist hier nicht unbedingt notwendig.
Der dritte Fall war ein Patient mit Belastungsdyspnoe, ein Jahr nach COVID-Infekt. Echo normal, MRI normal. Liegt eine Kammertachykardie, ein AV-Block, weder noch oder beides vor? Gemäss EKG könnte es sich um einen sog. Fusionsschlag handeln oder um einen AV-Block. Die Fragen, die sich stellten, waren Sinusrhythmus mit VBS, Sinusrhythmus mit Schenkelblock oder Sinusrhythmus mit AV Block und Schenkelblock. Der Referent erklärte, dass es sich um wechselnde Schenkelblöcke handelte. Beide Schenkel waren krank. Dies ist eine gefährliche Situation, die einen Schrittmacher benötigt.
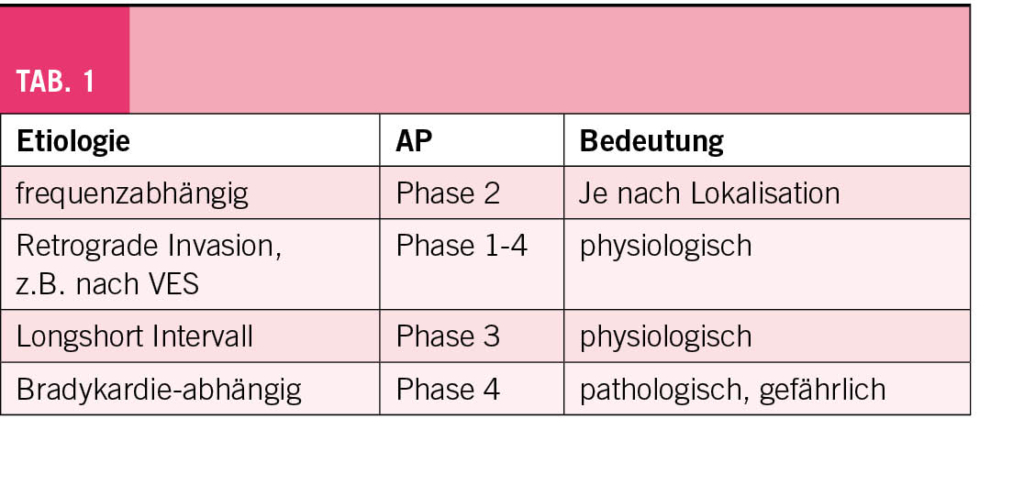
Ein weiterer Fall betraf einen Patienten, der bereits einen Schrittmacher hatte. Oberhalb von 75 gute Leitung, unterhalb hatte er einen AV-Block. Ist es vagoton oder organisch? Es war organisch, der Schrittmacher ist indiziert. In diesem Falle handelte sich um einen sogenannten Phase 4 Block, Bradykardie assoziiert. Die Situation ist nicht sehr häufig aber gefährlich.
Abschliessend präsentierte der Referent die Blockierung der Reizleitung im His-Purkiniesystem (Tab. 1) und ihre Bedeutung.
Herz und Niere
Fälle aus dem Alltag eines Internisten und Nephrologen
Das kardiorenale System umfasst
- Kardiale Typen:
Typ 1: akut kardial
Typ 2: chronisch kardial - Renale Typen
Typ 3: akut renal
Typ 4: chronisch renal - Systemischer Typ
Typ 5: Systemerkrankung mit renaler und kardialer Beteiligung
Fall 1: Herr T.M., 74-y/o

Der erste von Prof. Dr. med. Markus Mohaupt, Bern, präsentierte Fall war Herr T.M., 74-y/o. Er hatte Ödeme und die folgenden Symptome bei Eintritt: Belastungsdyspnoe NYHA II-III, Nykturie 20x (?), Schmerzen an beiden Knöcheln, Gewichtszunahme und Ödeme.
Die Untersuchungsbefunde ergaben: Blutdruck 117/33mmHg, beidseits Pleuraergüsse, gestaute Halsvenen und Malleolarödeme beidseits, NT-proBNP 2004pg/ml (<486), Nierenfunktion CKD 3A, keine Proteinurie, kein auffälliges Sediment.
Die TTE zeigt eine normale EF, aber eine erhebliche diastolische Dysfunktion, unauffällige Klappen, starre weite V. cava.
Die ergänzende Diagnostik ergab CKD 3A ohne Proteinurie, prärenale Indizes, cholestatische Hepatopathie, CRP 77mg/l, Ferritin 805 µg/l, sIL-Rezeptor 4177pg/ml (<1500), IgG 21g/l (7-16), IgG4 3.68g/l (0.03-2.01).
Die Diagnose lautete: IgG4-assoziierte Systemerkrankung mit kardialer Beteiligung, Aortitis/Periaortitis und hepatischer Beteiligung. Therapie: Prednisolon + Rituximab. Keine Ödeme mehr und Nierenfunktion CKD2.
Die Inzidenz der IgG4-assoziierte Systemerkrankung wird als 1:100’000 berichtet, wird aber wahrscheinlich unterschätzt. Die IgG4-bezogene kardiale Krankheit ist unterdiagnostiziert. Es kann eine koronare Perikarditis sein, eine ischämische dilatative Kardiopathie oder eine Perikarditis. Zusammenfassend handelte es sich um ein kardiorenales Syndrom Typ 1.
Fall 2: Frau F.K., 79-y/o.
Symptome bei Eintritt. Ruhedyspnoe NYHA III-IV, kann nur noch mit erhöhtem Oberkörper schlafen. Ausgeprägte Ödeme der Beine, Schuhe passen nicht mehr. Blutdruckselbstmessungen 140/85-90mmHg. Keine Schmerzen.
Bekannte Vorerkrankungen: Chronische Nierenfunktionseinschränkung CKD G4 hypertensiv diabetisch-vaskulär. Komplexe Pneumopathie. Dilatative Arteriopathie mit Aortenprothese nach infrarenalem Bauchaortenaneurysma, Diabetes mellitus Typ II, Hyperurikämie und hypertensive Kardiopathie mit konzentrischer Hypertrophie und HFpEF. Gewicht 07.06. 118kg,14.06 112kg, 26.07 106kg (geringe Knöchelödeme).
Medikation (07.06): ARB (Valsartan), MRA, Schleifendiuretikum (hoch dosiert), Nebivolol, ASS, Statin. 26.07: ARB (Losartan), MRA, Schleifendiuretikum (tief dosiert), Nebivolol, ASS, Statin, Dapagliflozin. Der 24h Blutdruck bewegte sich zwischen 130-140/50-60mmHg. Der Referent verwies auf die DECLARE-TIMI Studie mit Dapagliflozin, die eine signifikante 17% Senkung der Hospitalisierung wegen Herzinsuffizienz, eine nichtsignifikante Senkung von MACE und der Gesamtmortalität und eine signifikante Senkung des kompositen renalen Endpunkts ergab.
Fall 3: Herr J.M., 52-y/o – Sekundärprävention nach MI
Symptome bei Eintritt: Rückenschmerzen, Schwellung an Armen und Beinen (knöchelbetont), keine richtige Dyspnoe.
Untersuchungsbefund: Blutdruck 115/74mmHg, Adipositas 110kg, bilaterale Armödeme mit schmerzhaften subkutanen Resistenzen, Malleolarödeme beidseits, schmerzhaft.
Weitere Erkrankungen: Myokardinfarkt mit 51 Jahren, obwohl er Nieraucher war, keinen Diabetes hatte und keine therapiebedürftige Dyslipidämie. Stent, proximaler und distaler RIVA (60 und 90% Stenose) Ein Herzinfarkt ohne Risikofaktoren ausser der Adipositas ist eher ungewöhnlich. Im Verlauf entwickelte er eine Thrombozytopenie unklarer Aetiologie, und eine TVT des Unterschenkels rechts und beider Unterarme.
Medikamente: ASS Cardio, Metoprolol, Olmesartan/Amlodipin, Pantoprazol, Rosuvastatin.
Labor bei Eintritt: NT-proBNP 921 pg/ml (<486) (EF erhalten, diastolische Dysfunktion), hyperregenerative Anämie (kein Blutungs- oder Hämolysenachweis) 86g/l, Thrombozyten 71 G/L Nierenfunktion CKD 3A, Albuminurie 200mg/d. Weiteres Labor: BSR 115mm/h (<10, CRP 166mg/l (<5), Leukozyten normal, wenige Promyelozyten 0.02 G/l. Albumin 10mg/mmol Kreatinin (<2.3), sIL-2 Rezeptor 944pg/ml (<477).
Knochenmarksbiopsie: Hyperzelluläres hämatopoetisches Parenchym, leicht reifungsgestörte Megakaryopoese, vermehrter Nachweis von Blasten. Befund Myelodysplastisches Syndrom möglich.
Zwischenzeitlich: starke Schmerzen im Gesicht und am Hals. Virusdiagnostik unergiebig. MRA: Arterielle Vaskulitis der A. carotis interna und externa bds. rechts >links. Arteriitis temporalis rechts.
VEXAS Syndrom -Severe Adult Onset Autoinflammatory Disease: Vacuoles (der Myelozyten und MDS, E1 Enzym, X-linked (nur Männer), autoinflammatorisch, somatisch (UBA1-Mutation), Erstbeschreibung Beck et al NEJM 2020.
Der Verdacht des Referenten und seines Teams: Keine Arzneimittelnebenwirkung, sondern eine Erkrankung mit wechselnder Vaskulitis und MDS, Erstmanifestation mit Myokardinfarkt 2021. UBA1 Mutation wurde nachgewiesen. Schlussdiagnose VEXAS Syndrom.
Behandlung mit systemischer Glukokortikoidtherapie und Antikörpertherapie zunächst gegen TNF-α und dann gegen IL-1. Keine Ödeme mehr. Kardiale und Nierenfunktion hatte sich normalisiert ohne Proteinurie. In einer Boardbesprechung soll allenfalls eine Knochenmarkstransplantation diskutiert werden.
Zusammenfassend handelte es sich um ein systemisches kardiorenales Syndrom, wo Herz und Niere beide betroffen sind.
riesen@medinfo-verlag.ch