- Recommandations actuelles pour le dépistage du cancer de la prostate
Le dépistage précoce du cancer de la prostate a longtemps été controversé en raison des craintes justifiées de surdiagnostic et de surtraitement. Les données à long terme des études internationales les plus importantes ont pu montrer que le dépistage par dosage du PSA peut réduire efficacement la mortalité due au cancer de la prostate, si bien que la Commission européenne a recommandé récemment l’ introduction de programmes de dépistage nationaux. Grâce à l’ imagerie par résonance magnétique multiparamétrique (IRM) de la prostate permet de réduire le nombre de biopsies inutiles et d’ augmenter le taux de détection des tumeurs cliniquement significatives.
Prostate cancer screening has long been controversial due to legitimate concerns about overdiagnosis and overtreatment. Long-term data from the largest international studies have shown that PSA-guided screening can effectively reduce prostate cancer mortality, and the European Commission has recently recommended the introduction of national screening programs. The multiparametric magnetic resonance imaging (MRI) of the prostate can reduce the number of unnecessary biopsies and simultaneously increased the detection of clinically significant prostate tumours.
Key Words: PSA, Prostate Cancer, Screening, Preventive Medicine
Le cancer de la prostate est le cancer le plus fréquent chez les hommes et la deuxième cause de mortalité liée au cancer en Suisse. Depuis le début des années 1990, le dépistage du cancer de la prostate est possible grâce à la détermination de l’ antigène prostatique spécifique (PSA) dans le sérum (test PSA). Dans le même temps, la mortalité due au cancer de la prostate a diminué dans la plupart des pays occidentaux (1), mais l’ utilité du dépistage de ce cancer a longtemps été controversée en raison des risques associés au diagnostic invasif et du risque de surtraitement des cancers de la prostate non pertinents sur le plan clinique (2, 3). En 2012, le groupe de travail des services préventifs des États-Unis (US Preventive Services Task Force, USPSTF) a publié une recommandation déconseillant le dépistage par dosage du PSA (4). A la même époque, le rôle du dépistage basé sur le PSA a fait l’ objet d’ un débat tout aussi intense en Suisse, avec des recommandations divergentes du Swiss Medical Board et de la Société suisse d’ urologie (5, 6). Depuis, les données à long terme de l’ importante étude européenne « European Randomized Study of Screening for Prostate Cancer » (ERSPC) ont été publiées et ont démontré une réduction significative de la mortalité associée au cancer de la prostate grâce au dépistage par dosage du PSA (7). Ces données ont été en partie déterminantes pour le changement de la recommandation de l’ USPSTF en 2017, vers un processus de prise de décision individuel relatif au dépistage à l’ aide du PSA chez les hommes âgés de 55 à 69 ans.
L’ importance du dépistage du cancer de la prostate a été soulignée récemment (le 20 septembre 2022) par la Commission européenne, qui a recommandé de promouvoir ce dépistage chez les hommes de moins de 70 ans (8). L’ article suivant aborde plus en détail les recommandations actuelles en matière de dépistage du cancer de la prostate.
Le dépistage
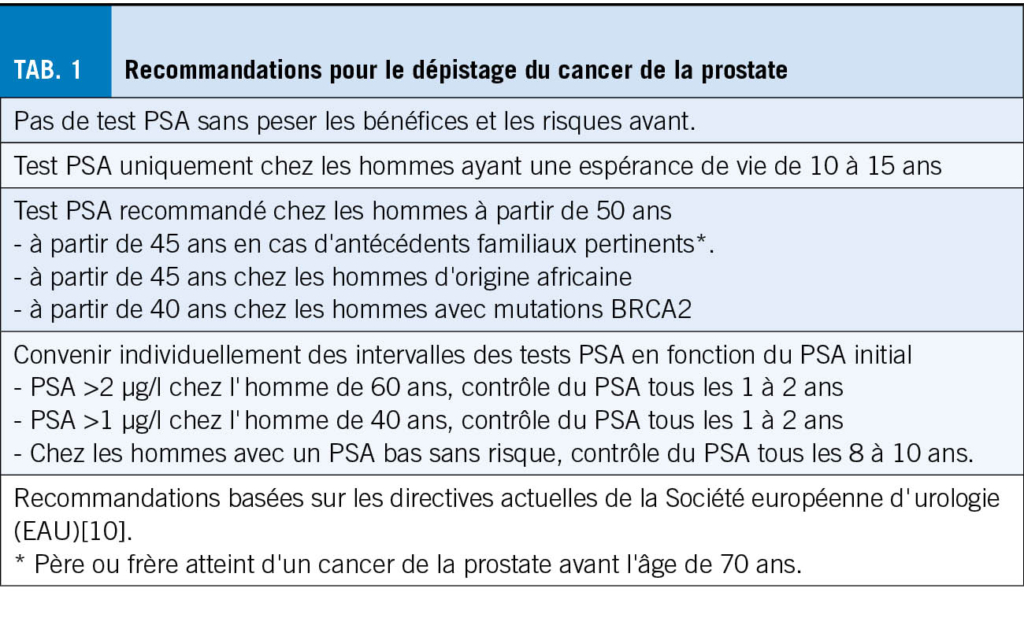
Les objectifs primaires du dépistage du cancer de la prostate sont la réduction de la mortalité ainsi que le maintien de la qualité de vie. Conformément aux recommandations de l’ Association Européenne d’ Urologie (EAU), il est recommandé de commencer le dépistage du cancer de la prostate dès l’ âge de 50 ans. En cas de risque accru, un dépistage est recommandé à partir de 45 ans, notamment pour les hommes ayant des antécédents familiaux positifs pertinents (père ou frère atteint d’ un cancer de la prostate avant l’ âge de 70 ans) et les hommes d’ origine africaine. Chez les hommes porteurs d’ une mutation BRCA2, le dépistage est recommandé dès l’ âge de 40 ans (tableau 1). Le carcinome de la prostate étant une tumeur maligne qui se développe lentement, le dépistage n’ est recommandé que si l’ espérance de vie restante est d’ au moins 10 à 15 ans. C’ est pourquoi la limite supérieure de 70 ans est souvent mentionnée dans la littérature, bien qu’ il soit judicieux de repousser le dépistage pour les patients plus jeunes d’ un point de vue biologique ou en très bonne santé. Inversement, chez les patients plus jeunes présentant des comorbidités importantes, il convient également de renoncer à un dosage du PSA après une évaluation appropriée (ce que l’ on appelle les « competing risks »). Ces réflexions devraient avoir lieu idéalement avant un dosage du PSA, afin d’ éviter des tests superflus ainsi que des traitements inutiles.
Le cancer de la prostate
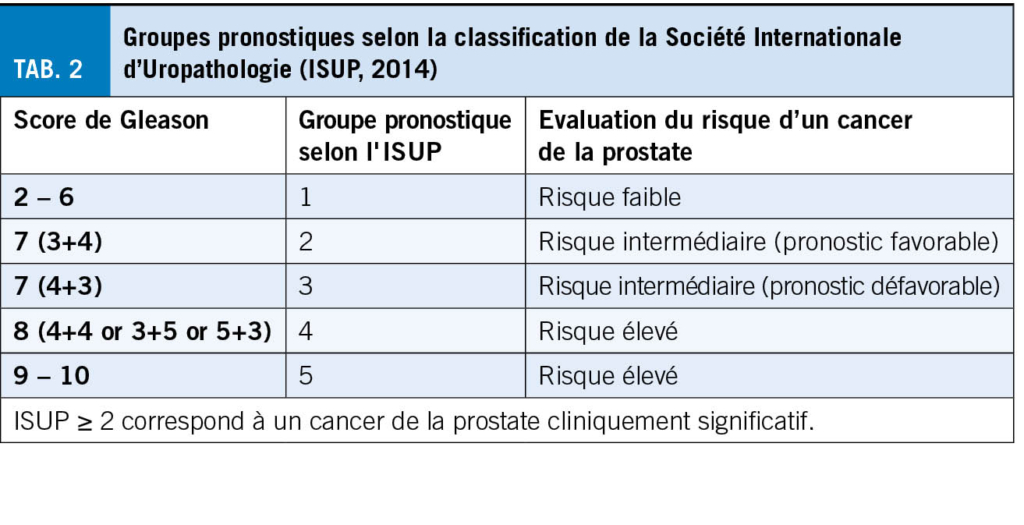
Un taux de PSA élevé, un toucher rectal (TR) suspect ou une imagerie par résonance magnétique (IRM) anormale de la prostate conditionnent une biopsie. De multiples prélèvements du tissu de la prostate sont alors effectués et envoyés pour une analyse histopathologique. En cas de détection d’ un carcinome, celui-ci est classé selon la classification de la Société Internationale d’ Uropathologie (ISUP) par grades de 1 à 5, ce qui remplace l’ ancien score de Gleason. ISUP1 correspond à un cancer de la prostate avec score de Gleason 3+3=6, classé « cancer de la prostate à faible risque » (tableau 2). Pour une grande majorité des cancers de la prostate ISUP 1, une surveillance active suffit, ce qui permet aux patients d’ éviter les effets secondaires risqués d’ un traitement curatif.
Les cancers de la prostate ISUP 2 et plus sont considérés comme des « cancers de la prostate cliniquement significatifs », pour lesquels un traitement actif est souvent indiqué. (Certes, les patients avec des tumeurs ISUP 2, strictement sélectionnés, peuvent également être pris en charge avec succès par une surveillance active (9), mais la majorité des patients doivent être traités de manière curative (10).)
Le PSA
Le PSA (l’antigène spécifique de la prostate) est une peptidase qui est produite exclusivement dans les cellules épithéliales de la prostate (cellules glandulaires). On peut le détecter en grande quantité dans l’éjaculat et, en faibles concentrations, également dans le sang. Le PSA dilue l’éjaculat et soutient la motilité des spermatozoïdes. Dans le sang, le PSA n’a aucune fonction. La première description du PSA a eu lieu en 1979 (11), et la première description pour l’utilisation dans le dépistage du cancer de la prostate a été faite en 1991 (12). Comme le PSA n’est pas spécifique de la tumeur, mais un biomarqueur spécifique à l’organe, le taux de PSA peut être élevé non seulement dans le cadre d’un cancer de la prostate, mais également en cas d’hypertrophie bénigne de la prostate (hyperplasie bénigne de la prostate [HBP]), d’une inflammation de la prostate (souvent subclinique), après une activité sexuelle, ainsi que par une pression exercée sur le périnée (par exemple en faisant du vélo). La probabilité d’un cancer de la prostate augmente avec le PSA, mais il n’existe pas de valeur standard universelle du taux de PSA (13). Il augmente avec l’âge de sorte que les valeurs de PSA considérées «normales» sont adaptées à l’âge (p. ex. taux limite de PSA de 2.5 μg/l pour les hommes âgés de 40 – 49 ans, et de 6.5 μg/l pour les hommes âgés de 70 à 79 ans) (14). En cas de taux de PSA élevé, il est toujours recommandé de procéder à un deuxième dosage de PSA. De plus, il est conseillé de s’abstenir de toute activité sexuelle et de ne pas faire du vélo pendant les 37 jours qui précèdent l’examen, afin d’exclure tout impact possible sur le taux de PSA. Dans notre clinique, nous parlons d’un “taux de PSA élevé” en cas de détection répétée d’un taux supérieur à 3,0 μg/l (pour les hommes jusqu’à 50 ans : 2,5 μg/l), et recommandons de procéder à un examen plus approfondi.
Il convient en outre de mentionner la densité du PSA (PSAD), qui se calcule sur la base du taux de PSA et du volume de la prostate. Le risque de cancer de la prostate cliniquement significatif augmente avec un taux de PSAD croissant, à l’inverse il est moindre en cas de PSAD en baisse (4% de risque de cancer de la prostate cliniquement significatif avec un PSAD <0,09 μg/l/cc) (15).
Le toucher rectal
Historiquement, 18% de tous les cancers de la prostate ont été diagnostiqués seulement sur la base du toucher rectal (TR), indépendamment de la valeur du PSA (16). La valeur prédictive positive d’un TR suspect en cas d’un taux de PSA <4 μg/l est de 5 – 30% (PSA 0 – 1,0 μg/l : 5% ; PSA 1,1 – 2,5 μg/l : 14% ; PSA 2,6 – 4,0 μg/l : 30%) (17). Les données de l’ERSPC montrent que la probabilité de détection d’un cancer est doublée chez les hommes présentant un taux de PSA élevé et un TR suspect, par rapport à un taux de PSA élevé sans TR (48,6% vs 22,4%) (18). En cas de TR suspect de la prostate, il est recommandé, indépendamment du taux de PSA, d’envoyer le patient chez un urologue pour une nouvelle évaluation clinique plus approfondie, aussi à l’aide d’une IRM multiparamétrique.
Imagerie par résonance magnétique (IRM) de la prostate
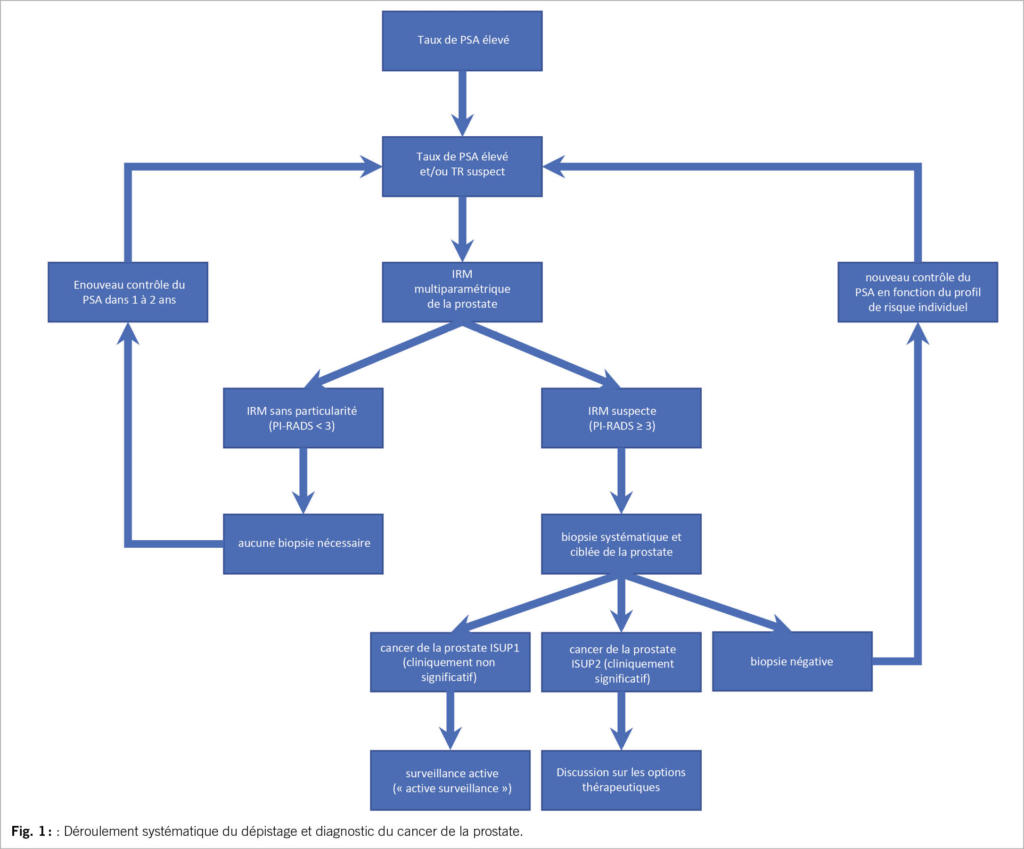
L’introduction de l’IRM multiparamétrique de la prostate a révolutionné le diagnostic du cancer de la prostate au cours de la dernière décennie. L’évaluation de différentes séquences permet de classer les lésions suspectes de la prostate selon la classification “Prostate Imaging Reporting and Data System” (PIRADS). L’échelle va de 1 (cancer de la prostate très improbable) à 5 (cancer de la prostate très probable). Dans la pratique, il est recommandé de faire une biopsie des lésions PIRADS 3 et plus. Mais en cas de PSAD faible, il est possible de renoncer à une biopsie des lésions PIRADS 3 dans certaines situations (10). Cette sélection permet de réduire le nombre de biopsies de plus de 30%, sans pour autant diminuer le taux de détection des cancers de la prostate cliniquement significatifs (19). Selon une méta-analyse Cochrane, l’IRM a démontré par rapport aux biopsies de saturation (>20 biopsies), une sensibilité en commun de 0,91 (IC à 95 % : 0,83 0,95) et une spécificité en commun de 0,37 (IC à 95 % : 0,290,46) pour les cancers de la prostate cliniquement significatifs (ISUP≥2) (20). L’IRM est moins sensible pour la détection des carcinomes de la prostate ISUP 1 (21), ce qui est en fait voulu, car ces carcinomes ne nécessitent normalement pas de traitement. Cette imagerie aide non seulement à décider si une biopsie de la prostate est nécessaire, mais également à fournir des informations sur la dimension spatiale qui aident pour la biopsie ultérieure et du traitement si nécessaire.
Biopsie de la prostate
De manière classique, la biopsie de la prostate s’effectuait par échographie transrectale (ETR) et prélèvement transrectal de 12 fragments de prostate (biopsie dite “systématique”). Cette intervention peut provoquer, entre autres, une hémospermie, une hématurie ou une rétention urinaire. En outre, malgré une désinfection locale et une antibiothérapie préventive, une infection post-interventionnelle peut se produire dans jusqu’à 3% des cas.
Des infections des voies urinaires ainsi qu’une uro-septicémie peuvent également se développer (22), ce qui constitue un problème majeur en raison de la résistance croissante d’E. coli aux antibiotiques. Pour réduire le taux d’infection, il est donc recommandé de faire les biopsies par voie transpérinéale dans la mesure du possible. La sécurité du diagnostic est la même que pour la biopsie transrectale, avec un risque nettement plus faible d’infection des voies urinaires.
Comme mentionné précédemment, l’IRM permet d’identifier des zones suspectes dans la prostate. Pour pouvoir biopsier ces lésions de manière ciblée, il existe aujourd’hui diverses possibilités de fusionner l’IRM et les images de l’ETR, par exemple avec des appareils spécialisés (p. ex. Artemis ou BiopSee), ou par fusion cognitive. Cela permet de prélever des “biopsies ciblées” des lésions suspectes, ce qui entraîne un taux de détection nettement plus élevé des cancers de la prostate cliniquement significatifs (ISUP≥2). L’EAU recommande donc la réalisation simultanée d’une biopsie systématique et ciblée de la prostate dès la première biopsie (10).
Biomarqueurs
En raison du manque de spécificité du PSA, plusieurs biomarqueurs sanguins, urinaires et tissulaires ont été développés au cours des trois dernières décennies. Ces biomarqueurs utilisent souvent des variables cliniques (par exemple le volume de la prostate ou l’âge du patient) et peuvent aider à évaluer la nécessité d’une biopsie de la prostate afin d’éviter un surdiagnostic et un surtraitement (23). Jusqu’à présent, l’utilisation de ces biomarqueurs n’est pas encore largement répandue en Suisse. Les raisons possibles sont le coût parfois élevé des tests, le manque de disponibilité ou le manque de prise en charge par les caisses d’assurance-maladie. Actuellement, l’utilisation de biomarqueurs n’est pas encore recommandée pour le dépistage de routine (10). Ils peuvent toutefois être très utiles pour certains patients, comme c’est le cas par exemple pour le SelectMDx® chez les patients qui ne peuvent pas être examinés par IRM (claustrophobie ou artefacts de prothèses de hanche) (24).
Le PSA libre est l’un des rares biomarqueurs à être largement utilisé. En combinaison avec le PSA total, il peut être utile pour évaluer le risque. En raison de l’instabilité relative du PSA libre, l’utilisation du rapport PSA libre/total n’est que partiellement recommandée (10). Une option plus récente, également disponible en Suisse, est l’utilisation du Proclarix® Risk Score. Ce test sanguin inclut non seulement l’âge du patient, le PSA et le PSA libre, mais aussi deux autres protéines. Il a été démontré qu’il permet de réduire le nombre de biopsies nécessaires (25).
Calculateurs de risque
Il existe différents calculateurs de risque qui permettent d’estimer le risque individuel de cancer de la prostate à l’aide de paramètres cliniques (notamment l’âge, le TR et le taux de PSA) basés sur de grandes cohortes (par exemple, la cohorte ERSPC (26)). Le facteur prédictif le plus fort dans les calculateurs de risque est la PSAD (10).
Les calculateurs de risque sont très utiles pour évaluer le risque individuel d’un patient et peuvent aider à éviter des biopsies inutiles (27).
Risques associés au dépistage du cancer de la prostate par PSA
Les hommes doivent être informés des risques potentiels associés au dépistage de la prostate par PSA. Les risques immédiats de la mesure du PSA (prise de sang) et du TR sont faibles, mais les examens complémentaires peuvent représenter une cause de morbidité. Une biopsie peut entraîner des complications telles qu’une infection des voies urinaires, une hémorragie ou une rétention urinaire (22). En outre, des effets secondaires peuvent survenir dans le cadre du traitement d’un cancer de la prostate diagnostiqué, tels que l’incontinence urinaire, la dysfonction érectile et les douleurs, ainsi qu’une mortalité associée au traitement (28).
Résumé
La détection précoce du cancer de la prostate par le dépistage par PSA a longtemps fait l’objet de controverses. Les données à long terme de l’étude ERSPC ont entre-temps pu montrer que le dépistage par PSA permet de réduire de manière significative la mortalité associée au cancer de la prostate. L’IRM de la prostate a permis de réduire de manière significative les biopsies inutiles de la prostate et d’améliorer simultanément la sécurité du diagnostic grâce à des biopsies ciblées. De même, le risque de surtraitement des cancers de la prostate à faible risque détectés a été réduit grâce à la surveillance active largement répandue. L’organigramme ci-joint illustre le déroulement systématique partant d’un taux élevé de PSA, sur la base des recommandations de l’EAU sur le cancer de la prostate (10) (fig. 1). Le dépistage du cancer de la prostate est basé sur des preuves, la décision de procéder à un dépistage ne doit être prise qu’après avoir pris en considération les avantages ainsi que les risques potentiels.
Cet article est une traduction de « der informierte arzt » 12_2022
Copyright Aerzteverlag medinfo AG
médecin cadre
Clinique d’urologie, Hôpital cantonal de St-Gall
Rorschacher Strasse 95
9007 St. Gall
Médecin-chef adjoint
Clinique d’urologie, Hôpital cantonal de St-Gall
Rorschacher Strasse 95
9007 St. Gall
Les auteurs n’ont pas déclaré de conflits d’ intérêt en rapport avec cet article.
◆ Un dépistage par TR et dosage du taux de PSA pour la détection précoce du cancer de la prostate est utile et fondé sur des données probantes.
◆ Le PSA est un biomarqueur spécifique à un organe, mais pas à une tumeur. Il peut donc être élevé également en raison d’ une hypertrophie bénigne de la prostate ou d’une inflammation de la prostate.
◆ De nouvelles technologies, telles que l’ IRM multiparamétrique ainsi que des calculateurs de risque, permettent d’ éviter des biopsies inutiles et ainsi de réduire la morbidité lors du dépistage précoce du cancer de la prostate.
1. Loeb S. Guideline of guidelines: prostate cancer screening. BJU Int. 2014;114:323-5.
2. Etzioni R, Gulati R, Cooperberg MR, Penson DM, Weiss NS, Thompson IM. Limitations of basing screening policies on screening trials: The US Preventive Services Task Force and Prostate Cancer Screening. Med Care. 2013;51:295-300.
3. Melnikow J, LeFevre M, Wilt TJ, Moyer VA. Counterpoint: Randomized trials provide the strongest evidence for clinical guidelines: The US Preventive Services Task Force and Prostate Cancer Screening. Med Care. 2013;51:301-3.
4. Moyer VA. Screening for prostate cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2012;157:120-34.
5. Board EdSM. PSA-Test nicht geeignet zur Früherkennung des Prostatakarzinoms. Schweiz Ärztezeitung. 2011;92(48):1857.
6. Recker F ST. Messung des prostataspezifischen A ntigens (PSA-Test) zur F rüherkennung des Prostatakarzinoms Swiss Medical Board oder: «das Kind mit dem Bade ausschütten». Schweiz Ärztezeitung. 2011;92(51):2002–4
7. Hugosson J, Roobol MJ, Månsson M, Tammela TLJ, Zappa M, Nelen V, et al. A 16-yr Follow-up of the European Randomized study of Screening for Prostate Cancer. Eur Urol. 2019;76:43-51.
8. Commission E. European Health Union: A new EU approach on cancer detection – screening more and screening better. 2022.
9. Paudel R, Madan R, Qi J, Ferrante S, Cher ML, Lane BR, et al. The Use and Short-term Outcomes of Men With National Comprehensive Cancer Network Favorable Intermediate-risk Prostate Cancer Managed With Active Surveillance: The Initial Michigan Urological Surgery Improvement Collaborative Experience. Journal of Urology.0:10.1097/JU.0000000000003012.
10. Mottet N, Cornford P, van den Bergh R, De Santis M, Gillessen S, Grummet J, et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. EAU Guidelines Office, Arnhem, The Netherlands; 2022.
11. Wang MC, Valenzuela LA, Murphy GP, Chu TM. Purification of a human prostate specific antigen. Invest Urol. 1979;17:159-63.
12. Catalona WJ, Smith DS, Ratliff TL, Dodds KM, Coplen DE, Yuan JJ, et al. Measurement of prostate-specific antigen in serum as a screening test for prostate cancer. N Engl J Med. 1991;324:1156-61.
13. Semjonow A, Brandt B, Oberpenning F, Roth S, Hertle L. Discordance of assay methods creates pitfalls for the interpretation of prostate-specific antigen values. Prostate Suppl. 1996;7:3-16.
14. Partin AW, Criley SR, Subong ENP, Zincke H, Walsh PC, Oesterling JE. Standard Versus Age-Specific Prostate Specific Antigen Reference Ranges Among Men With Clinically Localized Prostate Cancer: A Pathological Analysis. The Journal of Urology. 1996;155:1336-9.
15. Yusim I, Krenawi M, Mazor E, Novack V, Mabjeesh NJ. The use of prostate specific antigen density to predict clinically significant prostate cancer. Sci Rep. 2020;10:20015.
16. Richie JP, Catalona WJ, Ahmann FR, Hudson MA, Scardino PT, Flanigan RC, et al. Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology. 1993;42:365-74.
17. Carvalhal GF, Smith DS, Mager DE, Ramos C, Catalona WJ. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng./ml. or less. J Urol. 1999;161:835-9.
18. Gosselaar C, Roobol MJ, Roemeling S, Schröder FH. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol. 2008;54:581-8.
19. Eklund M, Jäderling F, Discacciati A, Bergman M, Annerstedt M, Aly M, et al. MRI-Targeted or Standard Biopsy in Prostate Cancer Screening. New England Journal of Medicine. 2021;385:908-20.
20. Drost FH, Osses DF, Nieboer D, Steyerberg EW, Bangma CH, Roobol MJ, et al. Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev. 2019;4:Cd012663.
21. Bratan F, Niaf E, Melodelima C, Chesnais AL, Souchon R, Mège-Lechevallier F, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol. 2013;23:2019-29.
22. Loeb S, Vellekoop A, Ahmed HU, Catto J, Emberton M, Nam R, et al. Systematic Review of Complications of Prostate Biopsy. European Urology. 2013;64:876-92.
23. Visser WCH, de Jong H, Melchers WJG, Mulders PFA, Schalken JA. Commercialized Blood-, Urinary- and Tissue-Based Biomarker Tests for Prostate Cancer Diagnosis and Prognosis. Cancers. 2020;12:3790.
24. Hendriks RJ, van der Leest MMG, Israël B, Hannink G, YantiSetiasti A, Cornel EB, et al. Clinical use of the SelectMDx urinary-biomarker test with or without mpMRI in prostate cancer diagnosis: a prospective, multicenter study in biopsy-naïve men. Prostate Cancer and Prostatic Diseases. 2021;24:1110-9.
25. Steuber T, Tennstedt P, Macagno A, Athanasiou A, Wittig A, Huber R, et al. Thrombospondin 1 and cathepsin D improve prostate cancer diagnosis by avoiding potentially unnecessary prostate biopsies. BJU Int. 2019;123:826-33.
26. http://www.prostatecancer-riskcalculator.com/seven-prostate-cancer-risk-calculators. Retrieved 23.11.2022.
27. Louie KS, Seigneurin A, Cathcart P, Sasieni P. Do prostate cancer risk models improve the predictive accuracy of PSA screening? A meta-analysis. Annals of Oncology. 2015;26:848-64.
28. Michaelson MD, Cotter SE, Gargollo PC, Zietman AL, Dahl DM, Smith MR. Management of complications of prostate cancer treatment. CA Cancer J Clin. 2008;58:196-213.
la gazette médicale
- Vol. 12
- Ausgabe 1
- Januar 2023