- Update Demenz 2022
Vieles hat sich im letzten Jahr im medikamentösen Therapiebereich der Alzheimererkrankung getan. Trotzdem: der grosse Durchbruch lässt weiter auf sich warten. Mit der ersten US-Zulassung eines krankheitsmodifizierenden Alzheimer-Medikamentes (Aduhelm® (Aducanumab), Biogen) wurde eine neue Therapie-Ära eröffnet, die erstmals wichtige Folgediskussionen zu verlangter Wirksamkeit, Finanzierbarkeit und ethischen Implikationen angestossen hat. Durch die Nichtzulassung von Aducanumab in Europa und der Schweiz ändert sich bei uns am bisherigen diagnostischen und therapeutischen Management der Alzheimer Erkrankung wenig oder nichts. Trotzdem tun wir gut daran, hier die imminente Einführung von krankheitsmodifizierenden Therapien und der damit zusammenhängenden neuen Diagnostik auf allen Ebenen und mit allen Konsequenzen zu antizipieren.
Much has been achieved in the last year in the field of drug therapy for Alzheimer’s disease. Nevertheless, the big breakthrough is still a long time coming. The first U.S. approval of a disease-modifying Alzheimer’s drug (Aduhelm® (aducanumab), Biogen) opened a new era of therapy, which for the first time triggered important follow-up discussions on required efficacy, financial feasibility and ethical implications. The non-approval of aducanumab in Europe and Switzerland changes little or nothing in the diagnostic and therapeutic management of Alzheimer’s disease. Nevertheless, we do well to anticipate here the imminent introduction of disease-modifying therapies and the associated new diagnostics at all levels and with all consequences.
Key Words: Alzheimer’s disease, dementia, antibody therapies
Heilende Therapien und die damit verbundenen Hoffnungen und Tücken
Für die rheumatoide Arthritis war es Methotrexat (1988), für Multiple Sklerose Interferon Beta-1b (1993). Für die Alzheimer Erkrankung war es Aducanumab (2021) – wirklich? Obwohl zugelassen durch die FDA in den USA, hat sich die Europäische Arzneimittel-Agentur EMA im Dezember 2021 dagegen entschieden; das bei SWISSMEDIC eingereichte und nach wie vor hängige Zulassungsgesuch hat die Firma vor kurzem zurückgezogen. Offenbar bestehen hier in der Gesamtsicht der Erwartungen an neue Therapien unterschiedliche Anforderungen. Obwohl Aducanumab die Alzheimer-typische Ablagerung von Beta-Amyloid erfolgreich entfernt, haben bei den europäischen Behörden die dabei erzielten minimalen kognitiven Effekte für eine Zulassung nicht ausgereicht. Trotzdem: bereits heute hat die FDA zwei weitere Amyloid-Antikörper Therapien aus der Forschungspipeline für eine beschleunigte Review identifiziert: Donanemab und Lecanemab. Basierend auf diesbezüglich bereits publizierten Daten kann auch hier – im besten Fall – mit bescheidenen klinischen Effekten gerechnet werden.
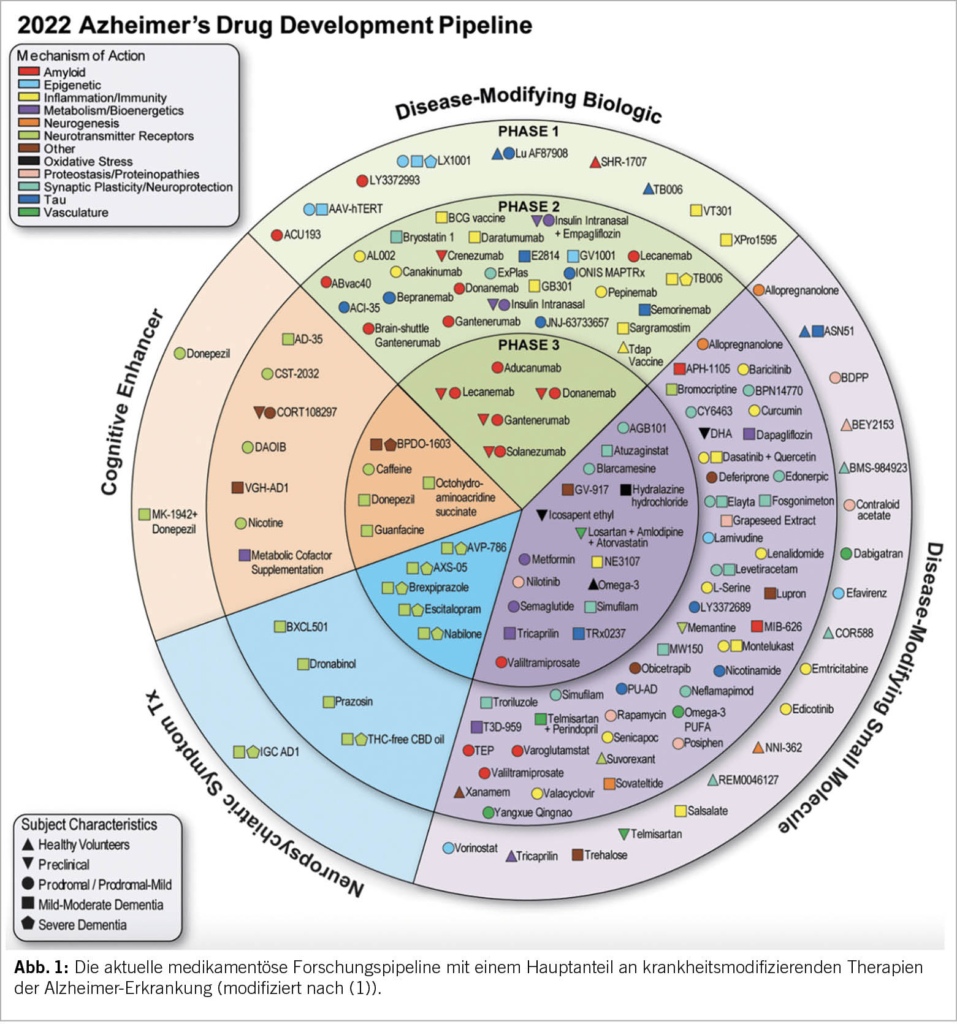
Von den aktuell 143 untersuchten Molekülen in der Alzheimer-Forschungspipeline gehört die klar überwiegende Mehrheit zu der Klasse der Krankheits-modifizierenden, d.h. kurativen Therapien (Abb. 1) (1). Experimentelle Therapien mit Zielansatz auf Tau-Proteine, Inflammation, synaptische Plastizität und Gefässveränderungen stehen hier gegenwärtig in Phase 2. Als zukünftiges Szenario werden – ähnlich wie in der Kardiologie – immer mehr kombinierte Therapieansätze denkbar. Der Trend für klinische Alzheimer-Studien ist immer mehr auch eine Interventionsverschiebung in die präklinische Krankheitsphase, die – bei fehlenden klinischen Symptomen – von der rechtzeitigen Identifizierung von krankheitsspezifischen Biomarkern abhängig ist. So wurde z.B. mit dem oben erwähnten Donanemab im August 2021 eine Präventionsstudie bei 50- bis 55-jährigen «Risiko»-Probanden mit (lediglich) erhöhtem Plasma Tau-Protein als Einschlusskriterium begonnen. Bei einer angenommenen MCI-Prävalenz von 6.7% für 60 bis 64-Jährige, 25.2% für 80 bis 84-Jährige – und einer wahrscheinlich noch höheren Rate im präklinischen Stadium – müssen bei der grossen Anzahl von potentiellen «Patienten» auch die entsprechenden Kosten erwogen werden. Neben den eigentlichen Kosten für die Moleküle braucht es aber auch eine erhebliche Anzahl spezialisierter Infrastrukturen, um die Therapien zu verabreichen. Anders als das subkutan verabreichte Gantenerumab, werden aktuell in Entwicklung stehende monoklonale Antikörper Therapien mittels monatlicher intravenöser Therapie verabreicht. Alle in dieser Klasse entwickelten Therapien gehen auch mit neurologischen Komplikationen einher (zerebrales Ödem/Blutung), die aufwändiges Monitoring (MRI) benötigen. Kein Wunder hat das amerikanische «Center for Medicare & Medicade Services (CMS)» die Versicherungsprämien für 2022 bereits um 20% erhöht.
Abgesehen von den finanziellen Aspekten hat die Einführung einer krankheitsmodifizierenden Therapie bei Alzheimer auch andere massgebende Effekte auf unser Gesundheitssystem. Der Zugang zu zeitgerechter und akkurater Diagnose wird für einen Therapieerfolg entscheidend sein. Im Wissen, dass aktuell bis 50% der Demenz-Patienten nicht als solche diagnostiziert sind, lässt bei Verfügbarwerden von krankheitsmodifizierenden Therapien den Mangel an verfügbaren Demenz-Spezialisten (Geriatern, Neurologen und Psychiatern) und –Institutionen (Memory Clinics) lediglich erahnen.
Ein möglicherweise mildernder Faktor für den Bedarf an kognitivem Hirnleistungs-Assessment ist die zunehmende Entwicklung von im Blutplasma nachweisbaren Amyloid- und Tau-Biomarkern. Sobald die diesbezügliche Sensitivität, Spezifizität sowie Verlässlichkeit feststeht, wird ein einfacher Bluttest die Identifizierung einer frühen Alzheimererkrankung in der hausärztlichen Praxis möglich machen. Eine solch frühe Diagnostik kann auch die Weiterentwicklung von präventiven Krankheitsansätzen fördern. Dabei entstehen aber auch neue ethische, legale und versicherungstechnische Herausforderungen. Nicht jeder Patient, der eine solche Testung einfordert wird deren volle Konsequenzen verstehen können, was eine entsprechende Beratung vor und nach der Testung nötig macht. Rechtlich wird auch zu klären sein, was ein positiver diagnostischer Befund versicherungstechnisch bedeutet.
Mit der in Griffweite gerückten Möglichkeit einer Alzheimer erkrankungsmodifizierenden Therapie, müssen parallel zu Fragen von Wirksamkeit, Sicherheit und Kosteneffizienz unbedingt auch die nötigen Diskussionen geführt werden, um die damit zusammenhängenden ethischen, ökonomischen, regulatorischen und legalen Implikationen zu adressieren (2).
Hirnleistungsstörungen: Aktuelle Klinische Abgrenzung von «Normal» versus «Pathologisch»
Obgleich in einer immer näher rückenden Zukunft die Demenzdiagnose primär mittels Biomarkernachweis im Blut erfolgen wird, muss im heutigen Praxisalltag immer noch auf klinische Symptome abgestützt und mit möglichst wenig Zeitaufwand entschieden werden, ob kognitive Störungen schnell weiter abgeklärt werden müssen, ob weiter beobachtet werden muss oder kein weiterer Handlungsbedarf besteht! Das frühere (zeitaufwändige) Screening von kognitiven Störungen mittels MMSE und Uhrentest wurde in den letzten Jahren vom sensitiveren und gezielten «Case Finding» abgelöst (http://www.braincheck.ch/de)! Die von den «Swiss Memory Clinics» und Schweizer Hausärzten entwickelte Testung «BrainCheck» trennt in wenigen Minuten «Normal» von «Pathologisch» mit einer Trennschärfe von 90% (3)! Dazu muss der Patient drei einfache Fragen beantworten und einen Uhrentest absolvieren. Gleichzeitig werden seinem engsten Angehörigen/Partner 7 kurze Fragen gestellt. Alle Resultate können sofort elektronisch erfasst und beurteilt werden.
Bei bestehender weiterer Abklärungsbedürftigkeit muss zusammen mit dem Patienten und seinen Angehörigen entschieden werden, wie die Diagnostik weiter vorangetrieben werden soll. Als erster Schritt ist hier sicherlich der (einfache) Ausschluss von schnellbehandelbaren Ursachen ein absolutes «Muss». Eine Schilddrüsenstörung kann mittels TSH Bestimmung ausgeschlossen werden, eine Depression mittels Geriatric Depression Scale (GDS) und eine psychosoziale Belastungssituation (Stressbelastung) mit einer sorgfältigen Anamnese erkannt und im positiven Fall mit entsprechenden Gegenmassnahmen angegangen werden. Bei anamnestisch begründbarem Verdacht, kann auch ein Vitamin B Status und eine Lues-Serologie weiterführend sein. Wird man in den genannten Bereichen fündig und entsprechend therapie-aktiv, empfiehlt es sich rund 6 Monate später die Kognition mittels BrainCheck nachzukontrollieren.
Abklärungsbedürftige Kognitive Störungen
Die Art der weiteren Abklärung von kognitiven Störungen ist sehr individuell und hängt vom Einverständnis, dem Gesundheitszustand/Lebenserwartung und den sozialen Lebensumständen des Patienten ab. Bei jüngeren und fitteren Senioren sollte immer eine spezialisierte Abklärung bei einem Demenzspezialisten oder einer Memory Clinic erfolgen. Diese umfasst neben einer medizinischen Untersuchung mit Labor und Biomarkern eine neuropsychologische Abklärung mit Hirnbildgebung (MRI). Bei sehr hochaltrigen und fragilen Patienten kann auch eine verkürzte kognitive Abklärung (z.B. mittels MoCa-Assessment (4)) erfolgen. Diese kann – mit etwas Erfahrung – in der hausärztlichen Praxis durchgeführt und diagnostisch ausgewertet werden. Dazu gehört auch hier imperativ eine Hirnbildgebung (MRI oder CT), um den wahrscheinlichsten neuropathologischen Grund der dementiellen Entwicklung festzulegen. Dies ist entscheidend für die Art der einzuleitenden Therapie.
Kognitive Störungen: Therapeutische Optionen
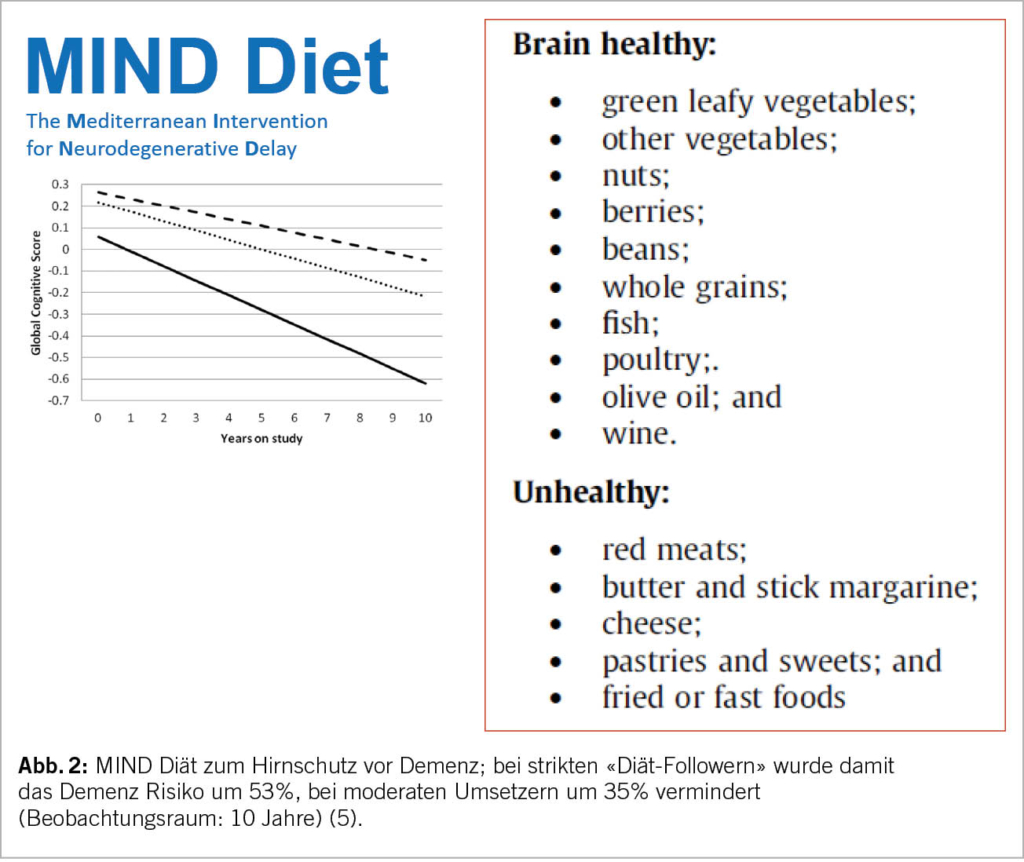
Handelt es sich gemäss DSM-5 um «milde» kognitive Störungen, befinden sich diese innerhalb von zwei Standardvariationen eines kognitiven Normalbefundes. Therapeutisch stehen hier neben medikamentösen (Ginkgo Biloba 240mg/d und Vitamin D (24’000 Einheiten pro Monat) v.a. nicht medikamentöse Massnahmen im Vordergrund: regelmässige körperliche und soziale (kognitive) Aktivität, gesunde altersgerechte Ernährung (regelmässig und genügend Protein (1.2g/kg Körpergewicht pro Tag; MIND-Diät (Abb. 2 (5)) und eine gute hausärztliche Kontrolle von vaskulären Risikofaktoren (art. Hypertonie, Diabetes, Hypercholesterinämie). In der finnischen FINGER Studie (6) konnten allein mit diesen Lebensstilmassnahmen nach 2 Jahren signifikante kognitive Verbesserungen erzielt werden!
Medikamentöse Optionen
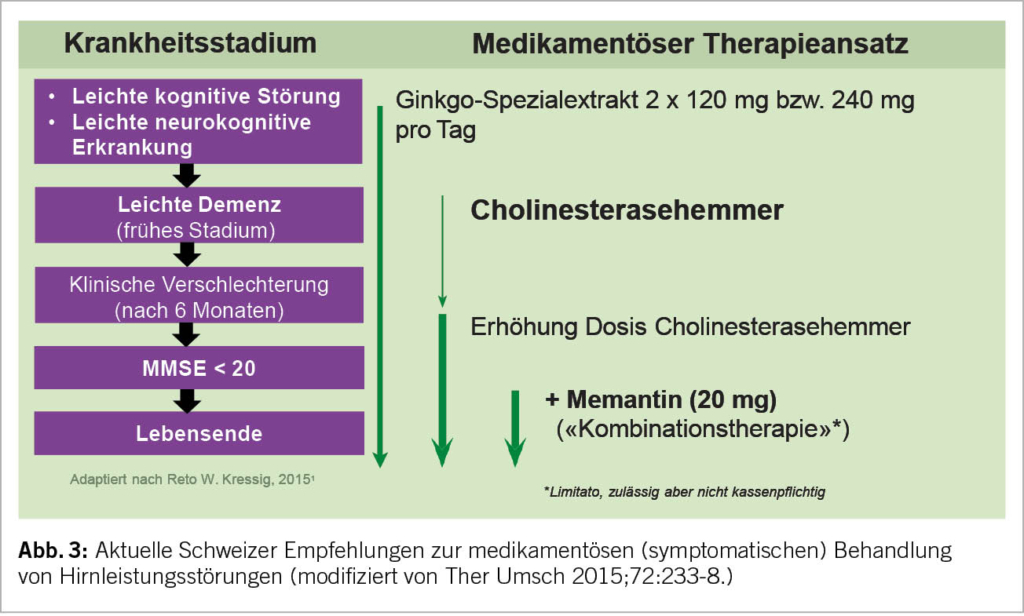
Bevor neue Medikamente zum Einsatz kommen, gilt es grundsätzlich, eine bereits vorhandene allfällige Polypharmazie auf kognitiv beeinträchtigende anticholinerge Substanzen zu überprüfen. Handelt es sich gemäss DSM-5 um «major» kognitive Störungen (Demenz) ist für die Festlegung der medikamentösen Therapie (meist mittels Bildgebung und/oder Biomarker) die dem Prozess zugrundeliegende Neuropathologie entscheidend. Handelt es sich um einen neurodegenerativen Prozess (Alzheimer Erkrankung), sind Stadium-abhängig Ginkgo, Cholinesterasehemmer und Memantine Mittel der ersten Wahl (Abb. 3). Bei dieser symptomatischen Therapie wird (bei frühzeitigem Beginn) der Verlauf der Krankheit bzgl. Funktionalitäts- und Selbständigkeitserhalt massgeblich verbessert. Diese Medikamente wirken ausgesprochen langsam, sind aber dank einer «Number Needed to Treat» (NNT) von unter 10 (für alle drei Substanzklassen!) mit einer hohen Responder-Rate versehen. Im Vergleich zu nicht-behandelten Kontrollpopulationen treten erste klinische Differenzen jedoch erst nach einem Jahr Behandlung auf; diese werden in den weiteren Jahren aber sehr relevant, da die Behandlung zu eindrücklich weniger Pflegeheimeintritten führt (7). Hier hat sich v.a. auch die Kombinationstherapie von Memantine mit Cholinesterasehemmer (bei MMSE < 20) als sehr erfolgreich erwiesen. Diese ist in der Schweiz jedoch nur off-label-mässig möglich und wegen einer Limitatio nicht voll von der Grundversicherung übernommen. Trotzdem: viele Patienten tragen (angesichts stark gefallener Antidementiva-Preise) die paar Hundert Franken pro Jahr gerne selber, wenn damit finanziell viel höhere Kosten einer Institutionalisierung gespart oder herausgeschoben werden können. Neben der durch Antidementiva länger erhaltenen Alltagsfunktionalität treten unter dieser Therapie auch signifikant weniger demenz-assoziierte Verhaltensauffälligkeiten auf (Aggression, Schreien, motorische Unruhe etc.).
Ist die der dementiellen Entwicklung zugrundeliegende Pathologie rein vaskulär, sind obige Antidementiva (ausser Ginkgo Biloba) nicht wirksam und entsprechend nicht indiziert. Hier gilt es mit allen Mitteln, mit Lebensstilmassnahmen und der Beherrschung von vaskulären Risikofaktoren das weitere Fortschreiten der Erkrankung zu verlangsamen. Bei gemischten vaskulär-neurodegenerativen Demenzformen können Antidementiva eingesetzt werden. Bei selteneren Demenz-Pathologien wie Lewis-Body Krankheit, Parkinson- oder Fronto-Temporal Demenz lohnt sich eine Rücksprache mit entsprechenden Spezialisten.
Nicht-medikamentöse Optionen
Eine 2021 neu in der Schweiz eingeführte innovative Ernährungssupplement-basierte symptomatische Therapie baut auf dem Mechanismus einer gezielt verbesserten zerebralen Energie-Hirnversorgung auf. Diese ketogene Therapie mit Zuführung von mittelkettigen Triglyzeriden ergänzt die bei Demenzerkrankungen nachgewiesen kompromittierte mitochondriale Glucoseverwertung zur verbesserten Energieproduktion (ATP), was klinisch bei frühen Hirnleistungsstörungen (MCI) zu bescheidenen, aber signifikanten Verbesserungen der Hirnleistung führte. Das Produkt (BrainXpert®, NESTLE) ist nicht kassenzulässig und muss – angesichts des hohen Keton-Gehaltes – zur Vermeidung gastrointestinaler Unverträglichkeiten sorgfältig eindosiert werden (8). Weitere Studien müssen zeigen, wo und wie genau dieser neue symptomatische Therapieansatz in den gängigen Schemen Eingang findet.
Nicht-medikamentöse Interventionen bei Demenzkranken werden von grossen Fachgesellschaften und Expertengruppen – ausser bei Notfallsituationen – in erster Linie und als primären Approach bei demenzassoziierten psychosozialen Verhaltensauffälligkeiten (BPSD) empfohlen (9). Gemäss Cohen-Mansfield sind die meisten Ärzte für die Medikamentenverschreibung bei BPSD geschult und ausgebildet, jedoch nur die wenigsten verfügen über Kenntnisse zu diesbezüglichen nichtmedikamentösen Therapiemassnahmen und deren Wirkungserfolg (10). Entsprechend häufig werden deshalb antipsychotische Medikamente eingesetzt bevor nichtmedikamentöse Interventionen versucht werden.
Im Gegensatz zu den bei Demenz bereits früh eingeschränkten oder verlorenen kognitiven Fähigkeiten sind die emotionalen und psychosozialen Kompetenzen bis in späte Demenzkrankheitsstadien weit weniger vom Abbau betroffen. Hier setzen nicht-medikamentöse Interventionen an, in dem sie – weg vom Defizit-Fokus – auf vorhandene Hirnleistungs-Ressourcen zugreifen, diese gezielt nutzen und fördern. Körperliche Aktivität, musikbasierte Aktivitäten sowie proteinreiche mit Vitamin D ergänzte Ernährung zum Erhalt der Muskelgesundheit bei Demenz haben sich am erfolgreichsten gezeigt (Abb. 4) (10). Spannend und immer wieder Gegenstand von Forschungen ist die Hirnwirkung von mit Musik kombinierten Bewegungsaktivitäten wie Tanz und Rhythmik. In der «Einstein-Aging» Kohortenstudie wurde regelmässiges Tanzen als Freizeitbeschäftigung mit einem bis zu 80% erniedrigten späteren Demenzrisiko assoziiert (12). In einer Interventionsstudie mittels Rhythmik nach Dalcroze konnte das motorisch-kognitive Dual-Task Vermögen von zuhause lebenden Senioren verbessert und das Sturzrisiko um über 50% reduziert werden (13). Bei fortgeschrittenen Demenzstadien scheint die Dalcroze Rhythmik neben der positiven Beeinflussung von BPSD-Symptomen vor allem die sprachlichen Fähigkeiten zu fördern (14).
Nichtpharmakologische Interventionen bei Demenzerkrankten sind neben den pharmakologischen, der aktiven Unterstützung/Beratung der Betreuer sowie einer sorgfältigen frühen Diagnostik, ein wesentlicher Bestandteil des modernen 4-Säulen Demenz Managements. Die zu erwartende Hauptwirkung solcher Massnahmen besteht in der positiven und nebenwirkungsfreien Beeinflussung von BPSD. Körperliche Aktivitätsprogramme zeigen zusätzliche Vorteile für die Alltags-Funktionalität, die insbesondere bei gleichzeitiger proteinreicher Ernährung und Vitamin D-Supplementation deutlich länger erhalten werden kann. Musik und musikbasierte Bewegungsprogramme wie Tanz und Rhythmik scheinen besonders geeignet, Hirnreserven zu mobilisieren und damit die Kognition signifikant zu verbessern.
Fazit für die Praxis
Mit der US-Zulassung des Anti-Amyloid Antikörpers Aducanumab ist eine erste krankheitsmodifizierende Therapie bei Alzheimer Demenz eingeführt worden, die bei klinisch (leider) nur minimen Effekten vor allem durch die erfolgreiche Tilgung des AD-Biomarkers Beta-Amyloid besticht. Durch die Zulassungsablehnung in Europa verändert sich bei uns – im Moment – nichts an den gängigen Abklärungs- und Therapieschemen von Hirnleistungsstörungen. Trotzdem: bei bereits weiteren von der FDA für eine beschleunigte Review vorgesehenen Amyloid-Antikörpertherapien und vielen neuen, in Phase 2 steckenden anderen erfolgversprechenden Therapieansätzen (z.B. Phospho-Tau Antikörper) ist die Ära der krankheitsmodifizierenden AD-Therapie auch in Europa in Sichtweite gerückt. Angesichts der demographisch bedingten hohen Prävalenz von Hirnleistungsstörungen ist damit auch die ethische Diskussion rund um Indikation und Finanzierbarkeit solcher Therapien eröffnet.
Copyright bei Aerzteverlag medinfo AG
Ärztlicher Direktor & Klinischer Professor für Geriatrie
Universitäre Altersmedizin FELIX PLATTER & Universität Basel
Burgfelderstrasse 101
4002 Basel
RetoW.Kressig@felixplatter.ch
Punktuelle Geriatrische Beratungstätigkeit auf
Anfrage bei Novartis, Roche, Takeda, Vifor, OM-Pharma, Schwabe, Biogen, Nestle, Omanda.
1. Cummings J, Lee G, Nahed P, Kambar MEZN, Zhong K, Fonseca J, Taghva K. Alzheimer’s disease drug development pipeline: 2022. Alzheimers Dement (N Y). 2022 May 4;8(1):e12295.
2. Tan ZS. The dawn of disease modification for Alzheimer’s disease: Hope and peril. J Am Geriatr Soc. 2022 Jun;70(6):1661-1663.
3. Ehrensperger MM, Taylor KI, Berres M, Foldi NS, Dellenbach M, Bopp I et al.. BrainCheck – a very brief tool to detect incipient cognitive decline: optimized case-finding combining patient- and informant-based data. Alzheimers Res Ther. 2014 Nov 24;6(9):69.
4. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005 Apr;53(4):695-9.
5. Marcason W. What Are the Components to the MIND Diet? J Acad Nutr Diet. 2015 Oct;115(10):1744.
6. Kivipelto M, Solomon A, Ahtiluoto S, Ngandu T, Lehtisalo J, Antikainen R et al.. The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): study design and progress. Alzheimers Dement. 2013 Nov;9(6):657-65.
7. Lopez OL, Becker JT, Wahed AS, Saxton J, Sweet RA, Wolk DA, Klunk W, Dekosky ST. Long-term effects of the concomitant use of memantine with cholinesterase inhibition in Alzheimer disease. J Neurol Neurosurg Psychiatry. 2009 Jun;80(6):600-7.
8. Adv Nutr 2020;00:1-20.
9. Savaskan E, et al.. Empfehlungen zur Diagnostik und Therapie der behavioralen und psychologischen Symptome der Demenz (BPSD). Praxis (Bern 1994). 2014 Jan 29;103(3):135-48.
10. Cohen-Mansfield J. Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. Am J Geriatr Psychiatry. 2001 Fall;9(4):361-81.
11. Kressig R W. Nicht-medikamentöse Behandlungsmöglichkeiten bei Demenz. internistische praxis. 2017;58(1):116–122.
12. Verghese J, Lipton RB, Katz MJ, Hall CB, Derby CA, Kuslansky G, Ambrose AF, Sliwinski M, Buschke H. Leisure activities and the risk of dementia in the elderly. N Engl J Med. 2003 Jun 19;348(25):2508-16.
13. Trombetti A, Hars M, Herrmann FR, Kressig RW, Ferrari S, Rizzoli R. Effect of music-based multitask training on gait, balance, and fall risk in elderly people: a randomized controlled trial. Arch Intern Med. 2011 Mar 28;171(6):525-33.
14. Winkelmann A, Gianadda R, Beauchet O, Kressig RW. La rythmique Jaques Dalcroze:Une activité physique novatrice pour les personnes âgées. GERIATRIE PRATIQUE. 2005;3:1-5.
der informierte @rzt
- Vol. 13
- Ausgabe 3
- März 2023