- Lungenkrebsscreening – aktuelle Entwicklungen in der Schweiz
Jedes Jahr ist Lungenkrebs für ca. 1,8 Millionen Todesfälle weltweit (1) und für etwa 3200 Todesfälle in der Schweiz verantwortlich (2). Über 20% der krebsbedingten Todesfälle in der Schweiz werden durch Lungenkrebs verursacht (2). Durch lange Symptomfreiheit bleibt das Wachstum von Lungenkrebs in der Regel bis zu fortgeschrittenen Tumorstadien unerkannt. Die Fünf-Jahres-Überlebensrate im fortgeschrittenen Krebsstadium liegt bei etwa 5%, während die Fünf-Jahres-Überlebensrate bei frühen Stadien bis zu 50% beträgt (3). Die Evidenz hinsichtlich einer Senkung der Mortalitätsrate von Lungenkrebs mittels Niedrigdosis-Computertomographie (Low-Dose-CT oder LDCT) Screening wird zunehmend grösser (4, 5). In der Schweiz gibt es bisher kein vom Bund und Kantonen getragenes Screeningprogramm – jedoch einige Bemühungen hinsichtlich einer Implementation eines solchen.
Each year, lung cancer is responsible for approximately 1.8 million deaths worldwide (1) and for about 3200 deaths in Switzerland (2). Over 20% of cancer-related deaths in Switzerland are caused by lung cancer (2). Due to long absence of symptoms, the growth of lung cancer usually remains undetected until advanced cancer stages. The five-year survival rate in advanced cancer stages is about 5%, whereas the five-year survival rate in early stages is up to 50% (3). Evidence regarding a reduction in lung cancer mortality rates using low-dose computed tomography (LDCT) screening is growing (4, 5). In Switzerland, there is no government-funded screening program yet, but there are some efforts to implement one.
Key Words: Lungenkrebs, Niedrigdosis-CT Screening, Screening-Implementierung
Aktuelle Studienlage Screening und erste Implementierungsversuche in Europa
Mit der Veröffentlichung der Resultate des US-amerikanischen National Lung Screening Trials im Jahr 2011 wurde bei einem klar definierten Hochrisikokollektiv von asymptomatischen Rauchern und Exrauchern (mindestens 30 Packungsjahre) zwischen 55 und 74 Jahren die Lungenkrebs-Mortalität um 20% und die Gesamtmortalität um 6,7% gesenkt (relative Risikoreduktion) (4). In absoluten Zahlen: In der LDCT-Gruppe starben 13 von 1000 gescreenten Rauchern an Lungenkrebs vs. 17 von 1000 in der Thorax-Röntgen-Gruppe. Aufgrund dieser vielversprechenden Daten werden seit 2015 in Amerika die Kosten für das Screening-Programm von den privaten wie auch den öffentlichen Krankenkassen erstattet.
Mit der NELSON-Studie, welche bis dato mit über 13’000 Männern und über 2500 Frauen die grösste in Europa durchgeführte Lungenkrebsscreening-Studie ist, konnten ähnliche Ergebnisse erzielt werden. Auch hier war die Lungenkrebssterblichkeit bei denjenigen, die an einem CT-Volumenscreening teilnahmen, deutlich niedriger als bei denjenigen, die kein Screening erhielten. Beim Screening entdeckte Lungenkarzinome wurden zudem wesentlich häufiger im Stadium IA oder IB diagnostiziert. Im Gegensatz dazu wurden in der Nicht-Screening Gruppe fast die Hälfte der Karzinome im Stadium IV diagnostiziert, während in der Screening-Gruppe nur 9,4% im Stadium IV diagnostiziert wurden (6).
Um Stigmatisierung von Rauchern zu vermeiden wurde in einer Pilotstudie aus Manchester das Screening-Programm auf der Grundlage des Konzepts eines «Lungengesundheitschecks» entwickelt, der ein ganzheitliches Lungengesundheitsprogramm umfasst. Mithilfe von mobilen CT-Scannern konnte die Zugänglichkeit der Dienstleistungen erhöht und die Hindernisse für die Teilnahme minimiert werden (7).
Bei der deutschen Lungenkrebs-Screening-Intervention (LUSI) handelt es sich um eine randomisierte Studie mit 4052 Langzeitrauchern im Alter von 50 bis 69 Jahren, die aus der Allgemeinbevölkerung rekrutiert wurden. Daten zur Lungenkrebsinzidenz und -mortalität sowie zum Vitalstatus wurden von Krankenhäusern oder niedergelassenen Ärzten, Krebsregistern, Bevölkerungsregistern und Gesundheitsämtern erhoben. Über einen durchschnittlichen Beobachtungszeitraum von 8,8 Jahren nach der Randomisierung konnte eine statistisch signifikante Verringerung der Lungenkrebssterblichkeit bei Frauen, nicht aber bei Männern gezeigt werden (8). Im Januar 2020 startete Kroatien als erstes europäisches Land ein nationales Lungenkrebsscreeningprogramm, welches sich an alle aktiven Raucher (oder an diejenigen, die in den letzten 15 Jahren mit dem Rauchen aufgehört haben) im Alter zwischen 50 und 70 Jahren richtet. Insgesamt bieten elf Gesundheitseinrichtungen in ganz Kroatien das Screening an. Polen hat ebenfalls im Rahmen seines vom Gesundheitsministerium finanzierten nationalen Krebsplans ein Lungenkrebs-Früherkennungsprogramm eingeführt (9). Erfahrungen und Berichte aus diesen Ländern, welche aktuell mit dem weiteren Ausbau der Einrichtungen beauftragt sind, sprechen deutlich für die Einführung eines Lungenscreenings (10). Auch das Vereinigte Königreich hat bereits regionale Programme vorgestellt und mit Hilfe eines mobilen «Screening-Trucks» konnte hier insbesondere in abgelegenen Gebieten eine sehr hohe Adhärenz geschaffen werden (11). Field et al. (2019) veröffentlichten die Ergebnisse eines Expertenpanels über die Einführung von Lungenkrebsscreening in Europa, in welchem die Autoren empfahlen, dass nationale gesundheitspolitische Gremien mit der Einführung von Niedrigdosis-CT-Screenings beginnen sollten, sobald Beweise für deren Wirksamkeit vorliegen (12). Am 9. Dezember 2022 veröffentlichte die europäische Union eine Aktualisierung zur Empfehlung von Krebsfrüherkennung (13). Die Länder sollten die Durchführbarkeit und Wirksamkeit des Lungenkrebsscreenings mit Hilfe der Niedrigdosis-Computertomographie untersuchen. Besonderes Augenmerk sollte auf die Identifizierung und gezielte Behandlung von Hochrisikoprofilen gelegt werden. Bei der Durchführung von Krebsfrüherkennungsprogrammen sollten jedoch vor allem die personellen und finanziellen Ressourcen sowie die Kapazitäten im Gesundheitswesen berücksichtigt werden (13).
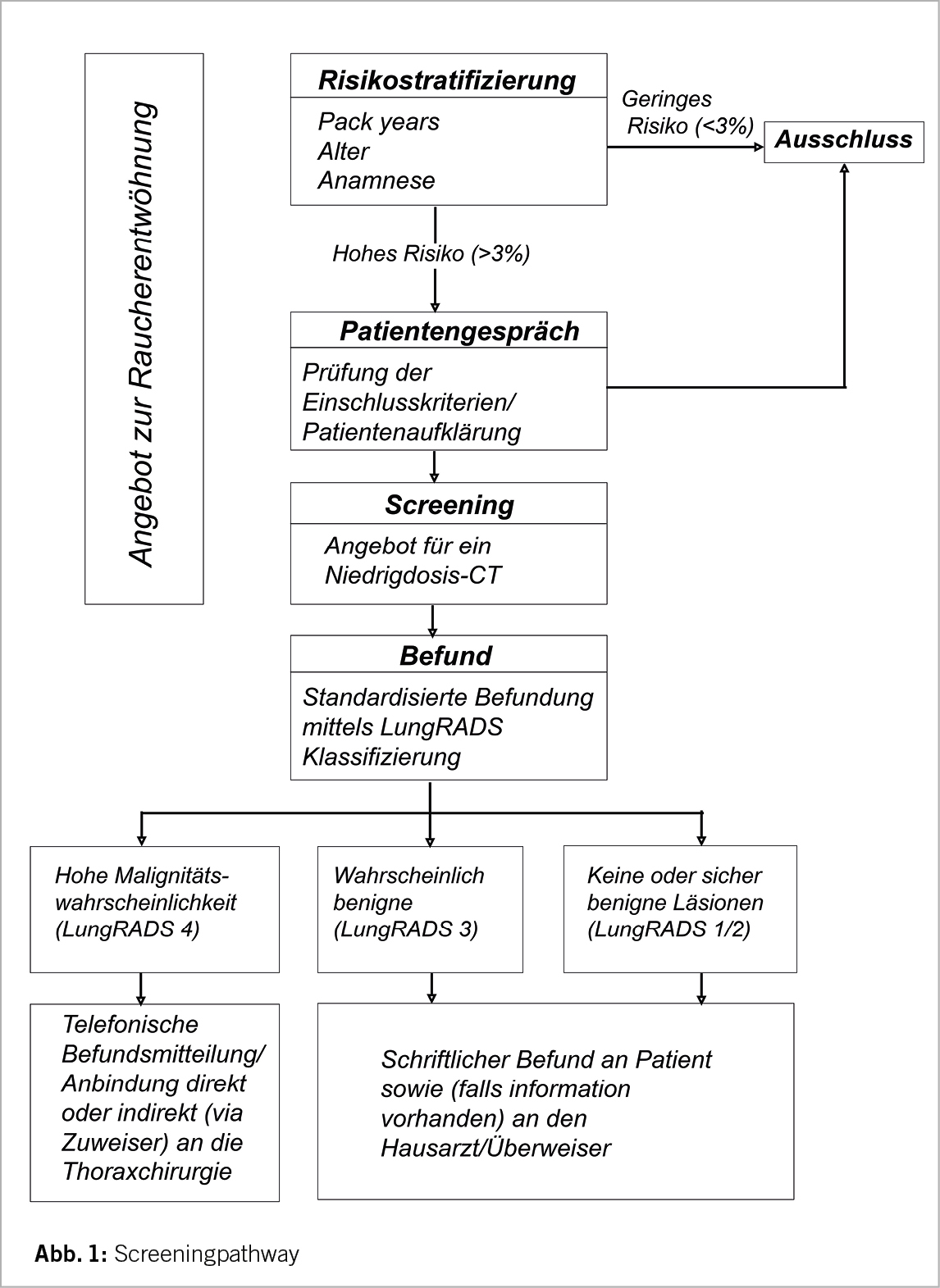
Screening-Pathway
Bevor man einen (Ex-)Raucher zum LDCT-Screening überweist, sollte ein eingehendes Beratungsgespräch erfolgen. In einem ersten Schritt muss geklärt werden, ob der Betreffende die Einschlusskriterien erfüllt (Alter 55 bis 74 Jahre, mindestens 30 py und Raucher oder weniger als 15 Jahre abstinent). Denn nur für diese Risikopopulation konnte ein Überlebensvorteil gezeigt werden. In einem zweiten Schritt muss der Betreffende über die Gefahr von falsch-negativen Befunden sowie die etwaige Erkennung von Nebenbefunden informiert werden. Zudem muss der Patient über die Abläufe, insbesondere im Falle einer möglichen Krebsdiagnose, aufgeklärt werden. Für Patienten, welche die Diagnosekriterien hinsichtlich einer Tumorerkrankung erfüllen, stehen weiterführende Abklärungen sowie die Behandlung (Operation, Strahlentherapie und/oder medikamentöse Therapie) an, welche je nach physischer sowie psychischer Verfassung des Patienten eine hohe Belastung mit sich bringen kann. Der radiologische Befund sollte einen Abschnitt mit den Bildgebungsparametern wie Dosis und verwendetes Protokoll sowie Befundbeschreibung und spezifische Behandlungsempfehlungen enthalten. Standardisierte Vorlagen werden bevorzugt, um eine einheitliche Berichterstattung und die Einhaltung von Richtlinien zu gewährleisten. Es sollten computergestützte Erkennungssysteme mit künstlicher Intelligenz verwendet werden, um die Variabilität bei der Messung zu verringern. Jeder Nodulus wird nach etablierten Klassifikationssystemen wie LungRADS 2.0 oder NELSON (6, 14) eingeteilt und dementsprechend Behandlungsempfehlungen bzw. Intervalle für die Verlaufskontrolle festgelegt. Patienten mit behandlungsrelevanten Befunden können entweder von ihrem zuweisenden Arzt über die Befunde informiert werden oder direkt an die Sprechstunde der hausinternen Thoraxchirurgie angebunden werden. Bezüglich der Screeningintervalle bei negativen Befunden liefert die Literatur kontroverse Daten; während in den bisherigen grossen Studien ein jährliches Follow-Up erfolgte hat die MILD-Studie zum ersten Mal bewiesen, dass ein zweijährliches LDCT eine vergleichbare Verringerung der Mortalität bei Personen mit einer negativen Ausgangsuntersuchung erreichen kann (15). Künftig könnten Scores, die auf individuellen Risikobewertungen beruhen, die Screening-Follow-Ups weiter stratifizieren (5). Eine Übersicht ist in Abb. 1 dargestellt.
Lungenscreening in der Schweiz
Ein Screening-Programm kann nur dann erfolgreich sein, wenn es so viele zu screenende Personen wie möglich erreicht. Da die CT-Dichte in der Schweiz als hoch eingeschätzt wird, könnte hier der Grad der Zentralisierung je nach Umfang des Vorscreenings (Prüfen der Einschlusskriterien), des Screenings und der Auswertung variieren. Ein möglicher Ansatz besteht darin, die Diagnostik dezentral durchzuführen und das Lesen und die Behandlung zentral zu organisieren. Ein Vorbild hierfür wäre die bereits erwähnten «Lungengesundheitschecks» in Manchester, welche mit einem mobilen CT-Gerät durchgeführt wurden. Auch der Ansatz eines ganzheitlichen Lungengesundheitschecks um Stigmatisierung zu vermeiden wäre ein möglicher Implementationsansatz in der Schweiz. Ein unabhängiges Qualitätsgremium (z.B. bestehend aus internationalen Experten wie Radiologen, Pneumologen und Epidemiologen) sollte alle Schritte des Screenings überwachen. Hinsichtlich der Finanzierung herrschen aktuell noch Unklarheiten. Zum aktuellen Zeitpunkt erstatten die gesetzlichen Krankenkassen keine Kosten des Screenings. Mögliche Finanzierungsquellen sind das Bundesamt für Gesundheit (BAG), Regionen (Kantone), Gesundheitsverbände, Gesundheitsförderung Schweiz und der Tabakpräventionsfonds. Darüber hinaus könnte die Erhebung von weiteren Steuern auf Tabakprodukte zur Unterstützung eines Screening-Fonds geprüft werden, um die Kosten für ein künftiges Screening-Programm zu decken. Tomonaga et al. (16) haben bereits darauf hingewiesen, dass Lungenscreening in der Schweiz, einem europäischen Land mit hohem Einkommen und hoher Raucherprävalenz, kosteneffektiv sein könnte. Sie schätzten die Kosteneffektivität des LDCT-Screenings auf Lungenkrebs auf unter 50’000 CHF pro gewonnenem Lebensjahr. Um die Nachhaltigkeit des Lungenscreenings zu gewährleisten, wäre es wichtig, dass das Screening langfristig von der obligatorischen Krankenpflegeversicherung (KVG) übernommen wird. Gemäss Art. 12d KLV deckt die obligatorische Krankenpflegeversicherung bestimmte medizinische Präventionsmassnahmen zur Früherkennung von Krankheiten in bestimmten Risikogruppen ab.
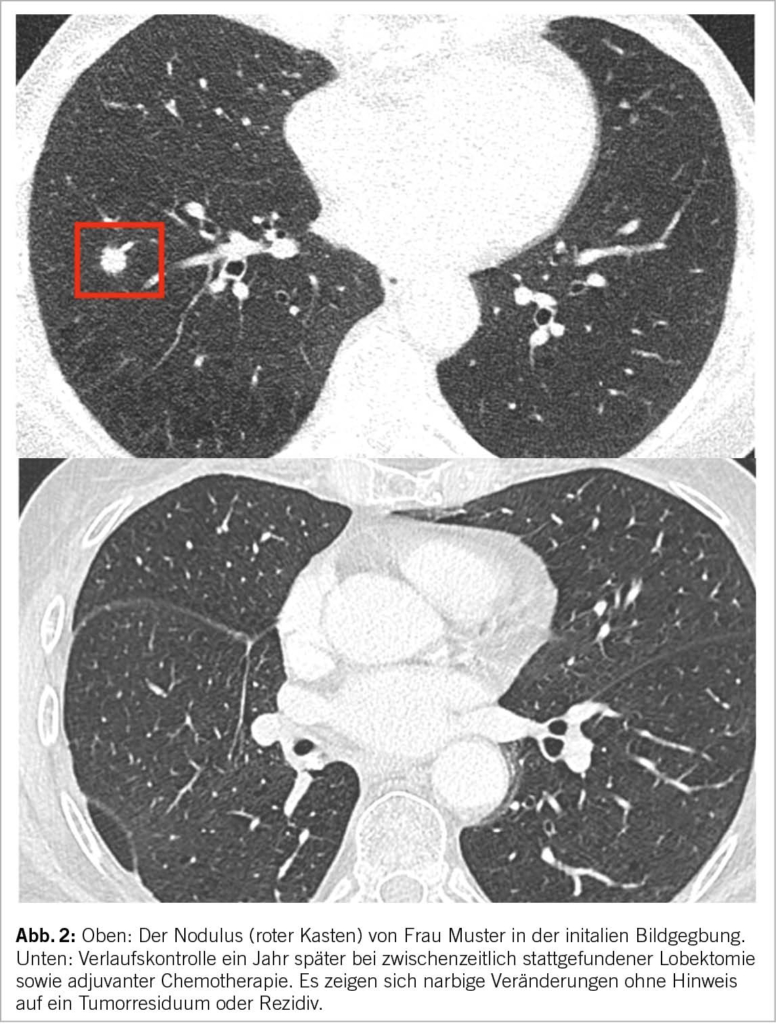
Jede neue Früherkennungsmassnahme muss vor der Übernahme durch die obligatorische Krankenpflegeversicherung auf ihre Wirksamkeit, Zweckmässigkeit und Kosteneffizienz geprüft werden. Diese Beurteilung wird von der Eidgenössischen Kommission für allgemeine Leistungen und Grundsatzfragen (ELGK) vorgenommen, nachdem die betroffenen Kreise beim BAG ein Gesuch eingereicht haben. Als Grundlage hierfür müssen konkrete handlungsleitende Empfehlungen vorliegen. Dieser Herausforderung stellen sich die involvierten Fachgesellschaften zusammen mit den Patientenorganisationen Lungenliga Schweiz und Krebsliga Schweiz. Ein HTA (Health Technology Assessment), welches Abläufe und Empfehlungen zum Screening beinhaltet, wurde im vergangenen Mai von der Kommission für Krebsfrüherkennung veröffentlicht und anschliessend mit verschiedenen Stakeholdern besprochen. Am 15. November 2022 veröffentlichte die Kommission eine offizielle Empfehlung zum Screening mittels niedrigdosierter Computertomographie für Risikogruppen (17). Die medizinische Indikation für ein Niedrigdosis-CT-Screening müsste in jedem Fall von einem Arzt gestellt werden, um von der obligatorischen Krankenpflegeversicherung übernommen zu werden. Vorläufige Studienergebnisse einer Schweizer Pilotstudie, in welche Patienten mit erhöhtem Risiko (in Anlehnung an die NELSON Kriterien oder mit einem PLCOm2012 >2.5%) eingeschlossen wurden, zeigt vielversprechende Ergebnisse. Abgesehen von einem grossen Interesse der Allgemeinbevölkerung wurden nahezu 5% der Teilnehmer mit Lungenkrebs diagnostiziert. Jedes der detektierten Lungenkarzinome konnte mit Hilfe eines kurativen Ansatzes behandelt werden (Abb. 2).
Copyright bei Aerzteverlag medinfo AG
Radiologisches Institut, Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Institut für Diagnostische und
Interventionelle Radiologie
Universitätsspital Zürich
Rämistrasse 100, 8091 Zürich
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ In der Schweiz werden jährlich über 4000 Menschen neu mit Lungenkrebs diagnostiziert. Mit mehr als 3000 Todesfällen jährlich ist der Lungenkrebs zu einer der führenden Krebs-Todesursachen in der Schweiz geworden.
◆ Im Jahr 2011 konnte im Rahmen der ersten grossen randomisierten Studie (dem US-amerikanischen National Lung Screening Trials (NLST)) bei einem klar definierten Hochrisikokollektiv von asymptomatischen Rauchern und Exrauchern (mindestens 30 pack years) zwischen 55 und 74 Jahren die Lungenkrebs-Mortalität um 20% und die Gesamtmortalität um 6,7% gesenkt werden.
◆ Ein Lungenscreening in der Schweiz, einem europäischen Land mit hohem Einkommen und hoher Raucherprävalenz, könnte nicht nur kosteneffektiv sein, es gibt bereits vorläufige Studienergebnisse einer Schweizer Pilotstudie welche vielversprechende Ergebnisse liefert. Ein HTA (Health Technology Assessment) Auf Bundesebene, welche Abläufe und Empfehlungen beinhaltet ist bereits veröffentlicht und Gespräche mit der Kommission für Krebsfrüherkennung sind bereits initiiert.
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359-86.
2. Office SFS. Specific causes of death in 2016 [Available from: wwwbfsadminch/bfs/en/home/statistics/health/state-health/mortality-causes-death/specifichtml
3. Institute NNC. Cancer Stat Facts: Lung and Bronchus Cancer https://seercancergov/statfacts/html/lungbhtml.
4. National Lung Screening Trial Research T, Aberle DR, Adams AM, Berg CD, Black WC, Clapp JD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011;365(5):395-409.
5. Oudkerk M, Liu S, Heuvelmans MA, Walter JE, Field JK. Lung cancer LDCT screening and mortality reduction – evidence, pitfalls and future perspectives. Nat Rev Clin Oncol. 2021;18(3):135-51.
6. de Koning HJ, van der Aalst CM, de Jong PA, Scholten ET, Nackaerts K, Heuvelmans MA, et al. Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial. N Engl J Med. 2020;382(6):503-13.
7. Crosbie PA, Balata H, Evison M, Atack M, Bayliss-Brideaux V, Colligan D, et al. Implementing lung cancer screening: baseline results from a community-based ‘Lung Health Check’ pilot in deprived areas of Manchester. Thorax. 2019;74(4):405-9.
8. Becker N, Motsch E, Trotter A, Heussel CP, Dienemann H, Schnabel PA, et al. Lung cancer mortality reduction by LDCT screening-Results from the randomized German LUSI trial. Int J Cancer. 2020;146(6):1503-13.
9. Rzyman W. SE, Adamek M. . Implementation of lung cancer screening at the national level: Polish example. Translational lung cancer research. Translational lung cancer research. 2019;8.
10. Breathing in a new era. A comparative analysis of lung cancer policies across Europe. The Economist, Intelligence Unit. 2020.
11. Field JK, Duffy SW, Baldwin DR, Brain KE, Devaraj A, Eisen T, et al. The UK Lung Cancer Screening Trial: a pilot randomised controlled trial of low-dose computed tomography screening for the early detection of lung cancer. Health Technol Assess. 2016;20(40):1-146.
12. Field JK, deKoning H, Oudkerk M, Anwar S, Mulshine J, Pastorino U, et al. Implementation of lung cancer screening in Europe: challenges and potential solutions: summary of a multidisciplinary roundtable discussion. ESMO Open. 2019;4(5):e000577.
13. Union CotE. Council Recommendation on strengthening prevention through early detection: A new EU approach on cancer screening replacing Council Recommendation 2003/878/EC https://data.consilium.europa.eu/doc/document/ST-14770-2022-INIT/en/pdf2022 [
14. Chelala L, Hossain R, Kazerooni EA, Christensen JD, Dyer DS, White CS. Lung-RADS Version 1.1: Challenges and a Look Ahead, From the AJR Special Series on Radiology Reporting and Data Systems. AJR Am J Roentgenol. 2021;216(6):1411-22.
15. Pastorino U, Sverzellati N, Sestini S, Silva M, Sabia F, Boeri M, et al. Ten-year results of the Multicentric Italian Lung Detection trial demonstrate the safety and efficacy of biennial lung cancer screening. Eur J Cancer. 2019;118:142-8.
16. Tomonaga Y, Ten Haaf K, Frauenfelder T, Kohler M, Kouyos RD, Shilaih M, et al. Cost-effectiveness of low-dose CT screening for lung cancer in a European country with high prevalence of smoking-A modelling study. Lung Cancer. 2018;121:61-9.
17. committee cs. Empfehlung zum Lungenkrebsscreening mittels niedrigdosierter Computertomographie (low-dose CT, LDCT) https://cancerscreeningcommittee.ch/wp-content/uploads/2022/11/medienmitteilung-lungenkrebs-screening-das-expertengremium-krebsfrueherkennung-publiziert-empfehlungen-fuer-die-schweiz-20221115-2.pdf2022
der informierte @rzt
- Vol. 13
- Ausgabe 3
- März 2023