- Estrogene zur Frakturprävention in der Peri- und Postmenopause
Vor 111 Jahren prägte der polnische Biochemiker Kazimierz Funk den Begriff «Vital-Amine» oder kurz «Vitamine» für Nahrungsmittelbestandteile, die für das Leben wichtig sind (1). Diese erhielten Buchstaben in der Reihenfolge ihrer Entdeckung; als viertes Vitamin wurde 1922 von Elmer McCollum das Vitamin D beschrieben, eine Substanz, welche die Rachitis bekämpfen konnte (2). Seit dieser ersten Publikation wird über Vitamin D geforscht und publiziert, es werden Thesen zu Wirkungen erhoben und wieder verworfen, Richtlinien aufgestellt und wieder geändert. Die Zahl der Artikel zu Vitamin D, die in PubMed gelistet sind, ist in den letzten 100 Jahren von einer einzigen Publikation im Jahr 1922 auf über 5500 im Jahr 2022 gestiegen. Im nachfolgenden Artikel wird versucht, aus der Fülle der Informationen einige in der Praxis relevante Punkte herauszugreifen.
111 years ago, the Polish biochemist Kazimierz Funk coined the term «vital amines» or «vitamins» for food components that are important for life (1). These were given letters in the order of their discovery; the fourth vitamin to be described was vitamin D, a substance that could combat rickets, by Elmer McCollum in 1922 (2). Since this first publication, vitamin D has been researched and published, theses on effects have been raised and rejected, guidelines have been established and changed again. The number of articles on vitamin D listed in PubMed has increased over the past 100 years from a single publication in 1922 to over 5500 in 2022. The following article attempts to pick out some points relevant in practice from the wealth of information.
Key Words: Vitamine D, bone health, serum concentration
Die systematische Review und Metanalyse und die daraus abgeleiteten klinischen Empfehlungen vom Februar 2023 des American College of Physicians (APF; 1) kommen zum Schluss, dass Bisphosphonate, Denosumab, Abaloparatid, Teriparatid und Romosozumab klinische Frakturen bei postmenopausalen Frauen mit Osteoporose vermindern. In diesen neuesten Guidelines zur Frakturprävention werden die Estrogene nicht erwähnt. Hingegen schliesst die North American Menopause Society (NAMS) in ihren Empfehlungen von 2021 und 2022 (2, 3) unter den von der FDA (wie auch von der Swissmedic) bei erhöhtem Frakturrisiko zugelassenen Optionen Estrogene und SERM ein. Dies deckt sich auch mit der Sicht der europäischen Menopausengesellschaften. Raloxifen ist heute primär eine Alternative zu MHT bei Frauen mit erhöhtem Brustkrebsrisiko. Es bietet zwar einen gesicherten osteoprotektiven Schutz an der Wirbelsäule, doch liegt keine direkte Evidenz für eine protektive Wirkung am Schenkelhals und am übrigen nicht-vertebralen Skelett vor. Aus Platzgründen muss hier auf eine weitere Diskussion der SERMs verzichtet werden (4).
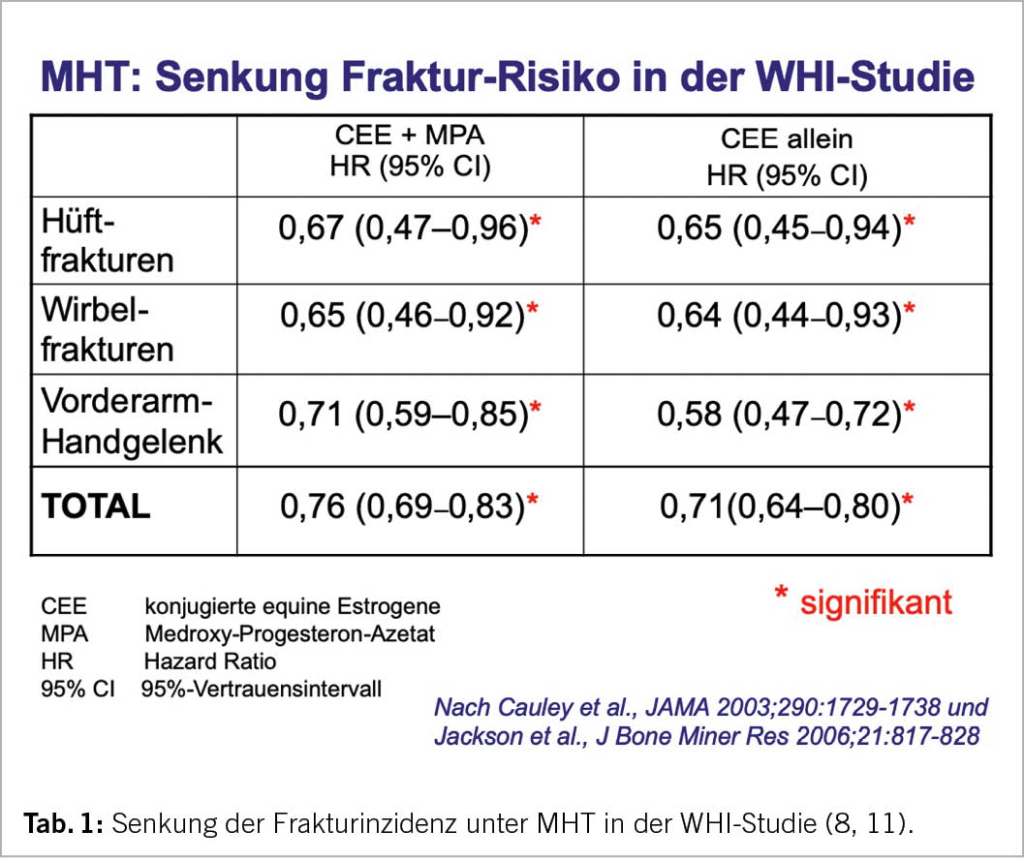
Warum werden in internistischen klinischen Empfehlungen selektive Estrogen-Modulatoren wie Raloxifen und Bazedoxifen empfohlen, wogegen natürliche Estrogene, die auch das nicht-vertebrale Frakturrisiko signifikant senken (Tab. 1), nicht erwähnt werden?
Der eine Hauptgrund dafür ist, dass Osteoporosespezialisten in der Regel erst bei der älteren postmenopausalen Frau zur Behandlung einer etablierten Osteoporose beigezogen werden, bei welcher Estrogene nicht mehr die beste Option sind.
Endokrinologen und Gynäkologen geht es dagegen meist um die Frakturprävention bei der peri- und früh postmenopausalen Frau mit noch normaler oder nur leicht verminderter Knochendichte. Genau in dieser Altersgruppe ist der Platz der natürlichen Estrogene.
Der zweite Hauptgrund dafür mag sein, dass die SERMs für die rheumatologisch orientierten Verschreiber und auch die meisten Anwenderinnen als «Medikamente» gelten, während E2 und EV als «Hormone» eingestuft werden und daher seit der Women’s Health Initiative Studie (WHI-Studie) zu Unrecht immer noch suspekt sind. Dazu werden oft mögliche Estrogen-Nebenwirkungen wie vaginale Blutungen oder Mastodynien gescheut, da hier Nicht-Gynäkologen die Erfahrung fehlt.
Die Peri- und frühe Postmenopause:
Platz der Estrogene
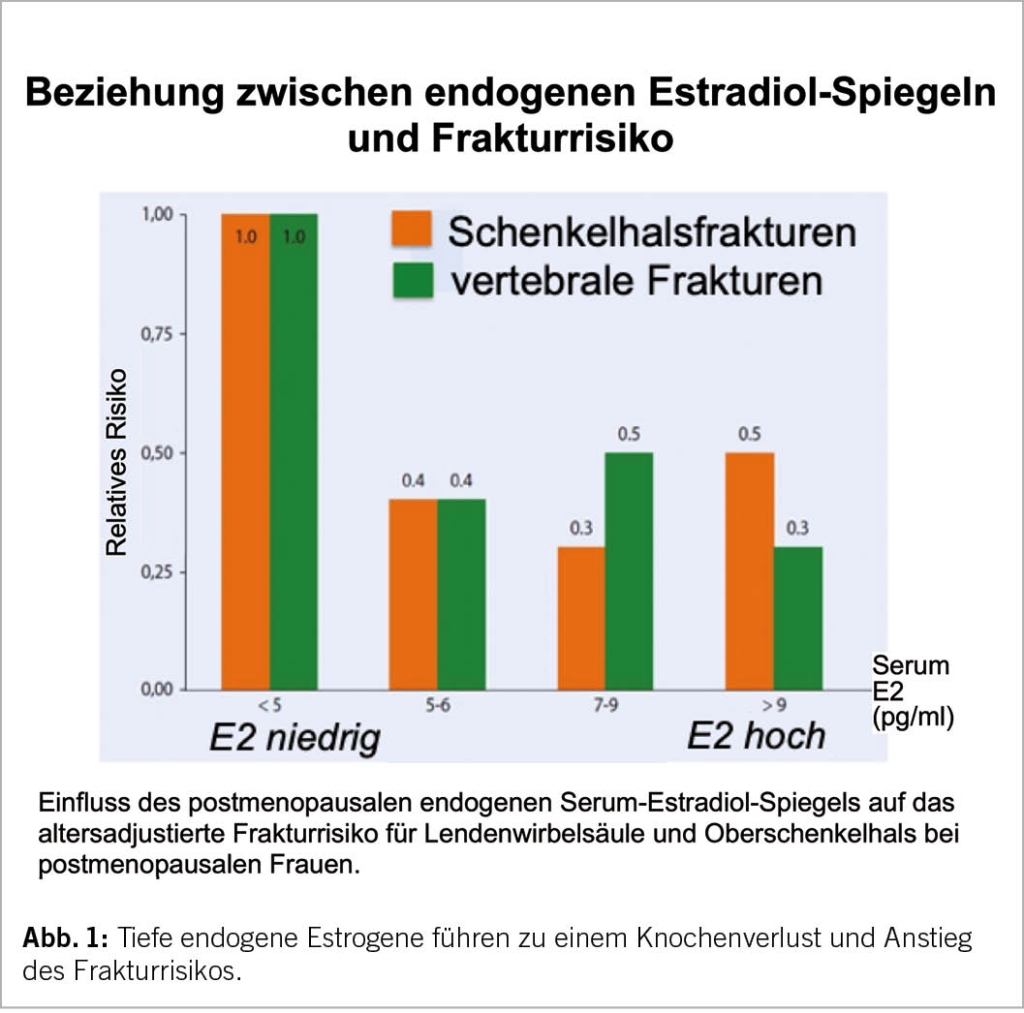
Tiefe endogene Estrogene führen zu einem Knochenverlust und einem Anstieg des Frakturrisikos (Abb. 1). In der Peri- und frühen Postmenopause ist somit der korrekte pathophysiologische Ansatz zur Frakturprävention die Gabe von natürlichen Estrogenen. Für Frauen in dieser Altersgruppe gibt es keine solide Evidenz und keine Langzeiterfahrungen zum Einsatz von medikamentös-pharmakologischen Therapieprinzipien wie Bisphosphonate oder Denosumab. Hingegen zeigen RCTs wie die Women’s Health Initiative (WHI) (Tab. 1) und die Danish Osteoporosis Prevention Study (DOPS) (5-12; weiterführende Literatur in 13), Metaanalysen und grosse Beobachtungsstudien unter Estrogenen eine signifikante Reduktion klinischer Frakturen. Darauf basieren die Empfehlungen der menopausalen Hormontherapie (MHT) als einer Methode der ersten Wahl zur Frakturprävention bei der Frau unter 60 Jahren. Sie kann seit über 30 Jahren bei der Frau als gesichert gelten. Der Begriff MHT umfasst auch eine Behandlung mit Tibolon (1,25 mg per os/Tag), einem synthetischen Steroid, dessen Metaboliten estrogene, androgene und gestagene Partialwirkungen besitzen. Tibolon senkt das Risiko von vertebralen und nicht-vertebralen Frakturen signifikant (14) (siehe Übersicht von Kloosterboer (15)).
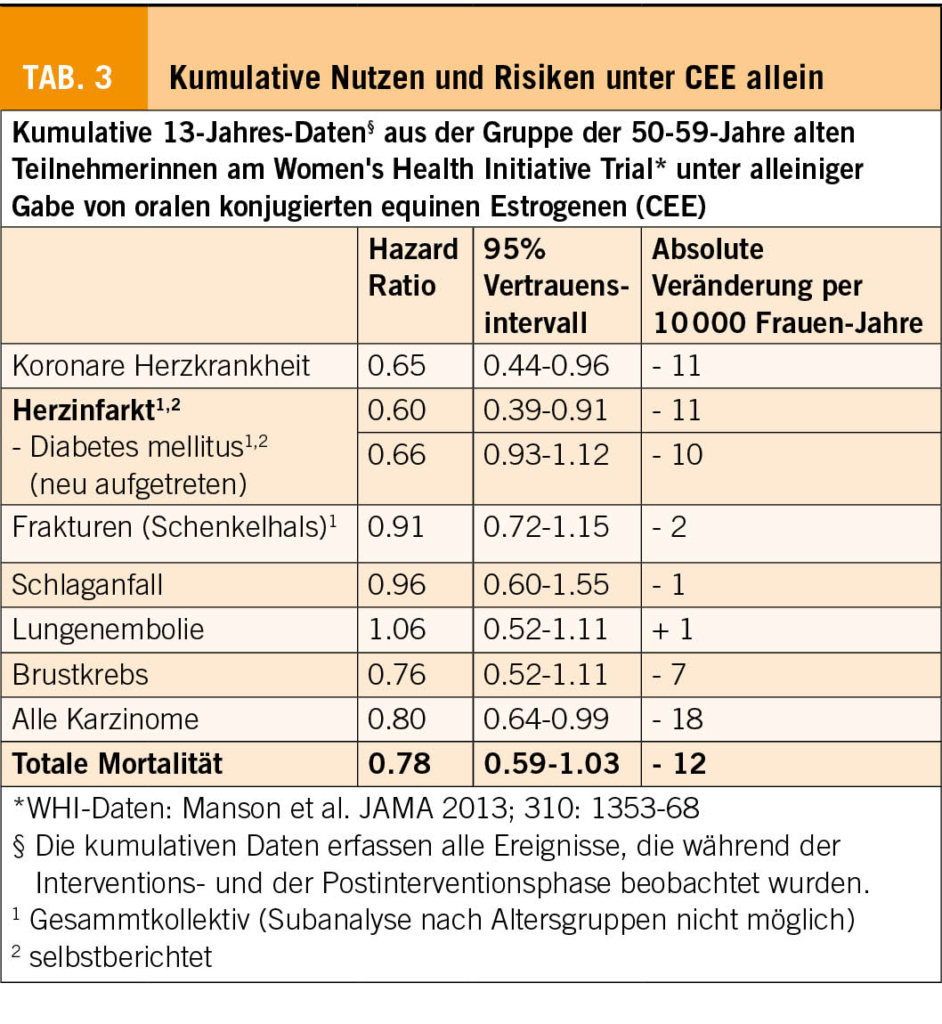
Der WHI-Trial mit konjugierten equinen Estrogenen (CEE) bleibt der einzige bisher bei einer Normalpopulation durchgeführte RCT zur Effizienz einer MHT mit CEE allein oder kombiniert mit einem Gestagen zur Senkung des Frakturrisikos. Bei Frauen ohne Frakturrisiko wird das Auftreten von Knochenbrüchen an der Wirbelsäule, am Schenkelhals und am gesamten non-vertebralen Skelett signifikant gesenkt. (Tab. 1; 8-11). Diese Resultate sind mit allen anderen älteren und neueren Daten zur Frakturprävention mit Estrogenen konsistent (12, 13). Dagegen wurden alle RCTs mit SERMs, Bisphosphonaten, Denosumab, Parathormonen oder Romosozumab bei älteren Risikopopulationen mit vorbestehender Osteoporose oder Osteopenie durchgeführt.
Im WHI-Trial kann die Wirksamkeit einer MHT als Anzahl Frauen ausgedrückt werden, deren Frakturen über eine 5-Jahres-Periode verhindert werden konnten. Unter Estrogenen allein repräsentiert dies 27,1 Frauen per 1000 über 5 Jahre, unter Estrogen+Gestagen 21,8 Frauen. In der PERF-Studie liegt die benötigte Anzahl der mit Estradiol zu behandelnden Frauen zur Verhinderung einer Fraktur bei 7 (16). Die Frakturprävention mittels MHT ist kostenwirksam. Eine MHT senkt zudem im Gegensatz zu allen nicht-hormonalen Therapieprinzipien das Frakturrisiko nicht nur über den Knochenstoffwechsel, sondern auch über eine Verbesserung der Muskelkraft und der «Stossdämpferfunktion» der Zwischenwirbelscheiben (17, 18).
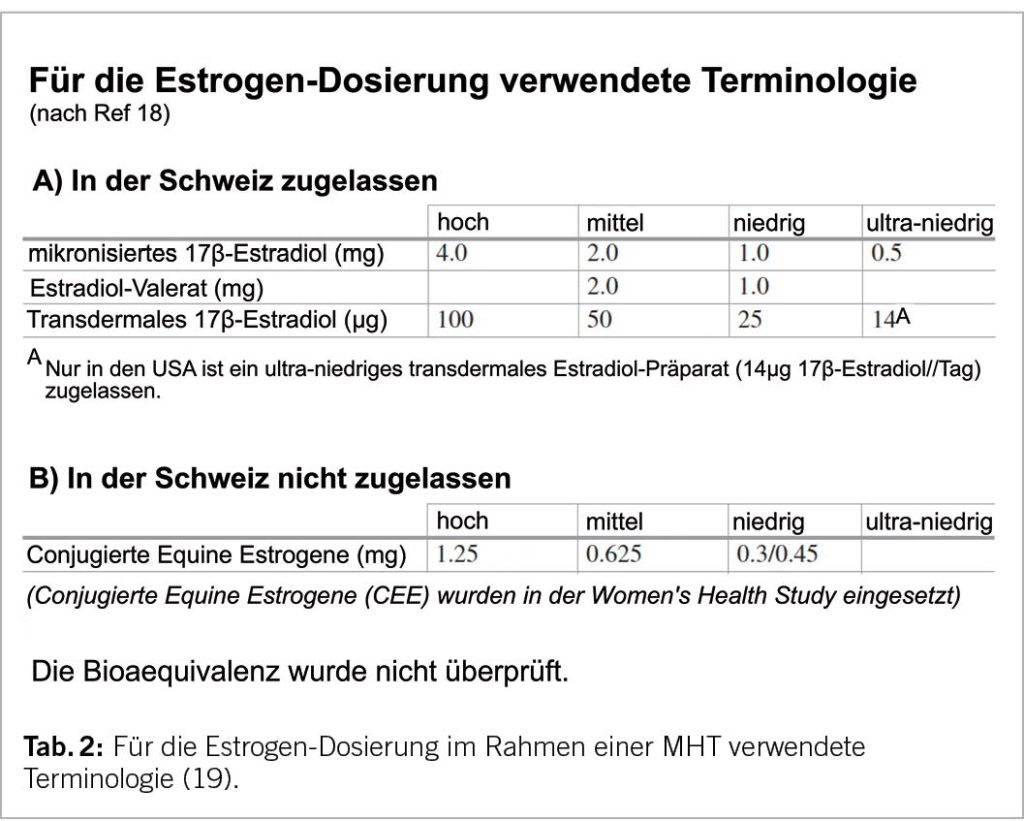
Für die systemische MHT sind in der Schweiz einzig 17-beta-Estradiol (E2) und Estradiol-Valerat (EV) zugelassen (Tab. 2). Ethinylestradiol (EE) und damit die «Pille» soll bei der postmenopausalen Frau wegen des bei EE metabolisch ungünstigen Nutzen-Risiko-Profils nicht verwendet werden.
Niedrig oder ultra-niedrig dosierte MHT zur Frakturprävention?
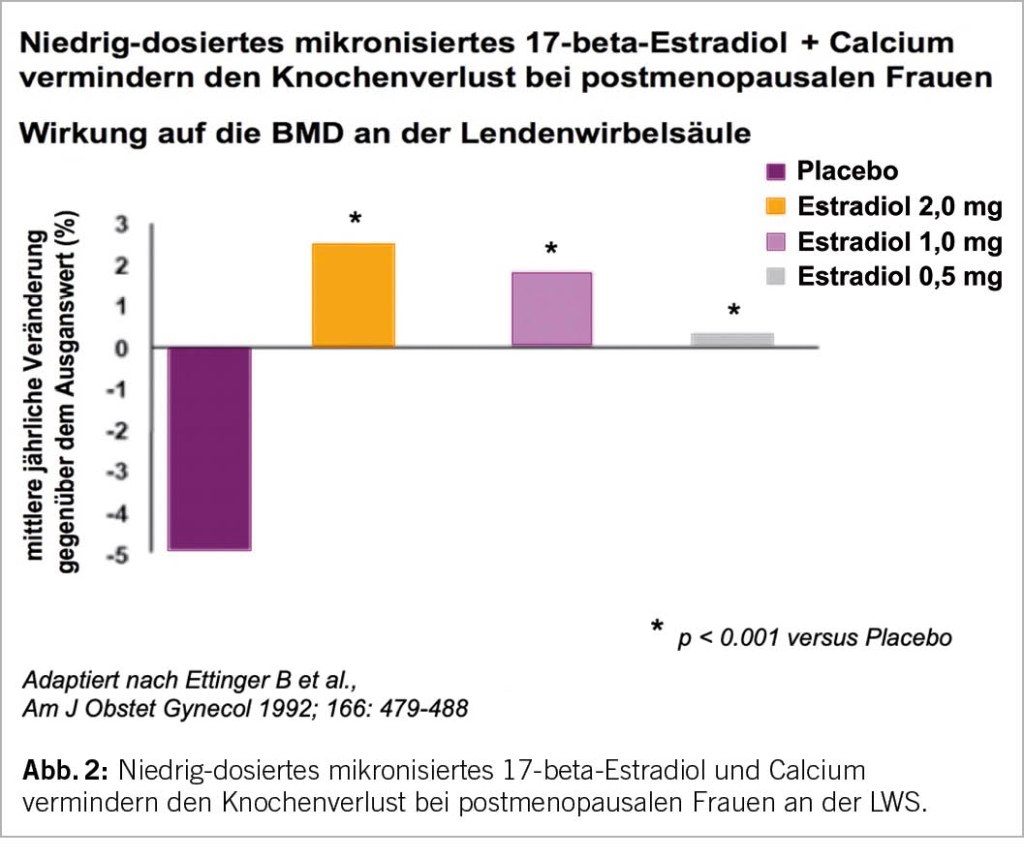
Die Standarddosis zur Behandlung des klimakterischen Syndroms beträgt pro Tag peroral 2mg E2 oder transdermal 50 µg E2 (Tab. 2; 19). Zu dessen erfolgreichen Behandlung ist oft auch eine niedrig oder ultra-niedrig dosierte Estrogengabe wirksam (Abb. 2).
Bei den meisten der so therapierten Frauen reicht diese Dosis auch zum Schutz des Knochens aus (20, 21; weiterführende Literatur in 13), doch erhöht sich mit der Senkung der Estrogene unter die Standarddosis der Prozentsatz der sogenannten Non-Responders (>2% Knochenverlust an der Wirbelsäule innert 26 Lunarmonaten trotz Therapie). Unter einer ultra-niedrigen Estradiol-Gabe (0,5 resp. 0,25 mg E2 per os/Tag) steigt die Anzahl der Non-Responders auf 13% resp. 22% an, in der Placebo-Gruppe hatten 51% einen Knochenverlust >2% (21). Es wird daher empfohlen, die Wirksamkeit einer niedriger als Standard dosierten Estrogengabe durch die Bestimmung von Knochenmarkern (nach ca. 3 Monaten) und 1-2 Jahre nach Beginn der MHT durch eine Bestimmung der Knochendichte mittels DXA zu überprüfen, wenn das Ziel der MHT die Frakturprävention ist.
Erhaltener Nutzen am Skelett nach Beendigung einer MHT?
Das Absetzen einer MHT führt zu einem jährlichen Knochenverlust, der innert 2 Jahren mit 3% bis 6% demjenigen in der frühen Menopause gleicht (22, 23). In der WHI führte das Absetzen der MHT zu einem bei Frauen in der Placebogruppe vergleichbaren Frakturrisiko (24).
Der unter der MHT erreichte präventive Gewinn bleibt deswegen erhalten, weil der wiedereinsetzende beschleunigte Knochenverlust bei einem höheren Ausgangswert einsetzt. In der PERF Studie (16) ist der erworbene Vorteil bis 15 Jahre nach dem Stopp der MHT nachweisbar, indem die Odds Ratio (OR) für Frakturen bei den früheren Estrogenanwenderinnen im Vergleich zu Placebo noch bei 0.48 (VI 0.26-0.88) liegt.
Sonderfall vorzeitige (prämature) Ovarialinsuffizienz (POI)
Bei Frauen mit POI ohne Estrogen-Kontraindikationen besteht mindestens bis zum Erreichen des normalen Menopausenalters eine Indikation für eine Substitution mit Estrogenen. Frauen mit POI benötigen für ihre klimakterischen Beschwerden meist höhere Dosierungen als ältere Frauen (≥2mg 17β-Estradiol pro Tag). Damit ist auch der Knochenbedarf abgedeckt.
Eine Indikation besteht auch für die Substitution mit E2 oder EV bei der primären Amenorrhöe und bei jeder längerdauernden sekundären Amenorrhöe (>6 Monate). Bei einer sekundären Amenorrhöe können bei Kontrazeptionsbedarf auch kombinierte hormonale Ovulationshemmer eingesetzt werden.
Nebenwirkungsprofil einer MHT
Bei der Diskussion der WHI-Studie wird heute leider oft vergessen, dass in der ersten Publikation nur zwei Resultate signifikant waren: der Anstieg des Thrombose-Risikos unter der oralen MHT als einzige ungünstige Nebenwirkung und die Reduktion des Frakturrisikos als einzigem Nutzen. Alle andern im Medien-Hype nach 2002 hochgespielten möglichen Gefahren waren nicht-signifikante Spekulationen.
Die Analyse des kumulativen Follow-Ups der WHI-Studie nach 13 Jahren (Tab. 3; 26) zeigt bei korrekt indizierter MHT für die alleinige Estrogen-Gabe einzig einen nicht-signifikanten Anstieg des Risikos für Lungenembolie (relatives Risiko (RR), 1.21; 95% CI, 1.06-1.38,). Dieses Risiko lässt sich zudem vermeiden, wenn statt oralem Estrogen transdermales Estradiol in normaler Dosierung eingesetzt wird (2, 6, 13, 25).
Alle übrigen im WHI-Trial untersuchten Todesursachen sind erniedrigt, insbesondere auch das kardiovaskuläre Risiko. Unter einer Kombination von E2/EV mit mikronisiertem Progesteron oder Dydrogesteron verschlechtert sich dieses Risikoprofil im Gegensatz zur Gabe von anderen Gestagenen nicht. Auch das Brustkrebsrisiko steigt im WHI-Trial unter CEE allein nicht an (weiterführende Literatur siehe in 2, 6, 13, 25, 26). Gemäss der Internationalen Menopausegesellschaft (IMS) ist das mögliche Risiko eines mit einer MHT assoziierten Mammakarzinoms klein und wird auf weniger als 0.1% per Jahr oder auf eine Inzidenz von <1.0 per 1000 Frauen pro Anwendungsjahr geschätzt (6).
Die vorhandene Evidenz zeigt, dass innerhalb des «günstigen Fensters» der Nutzen einer MHT die Risiken überwiegt (25-27).
Schlussfolgerung
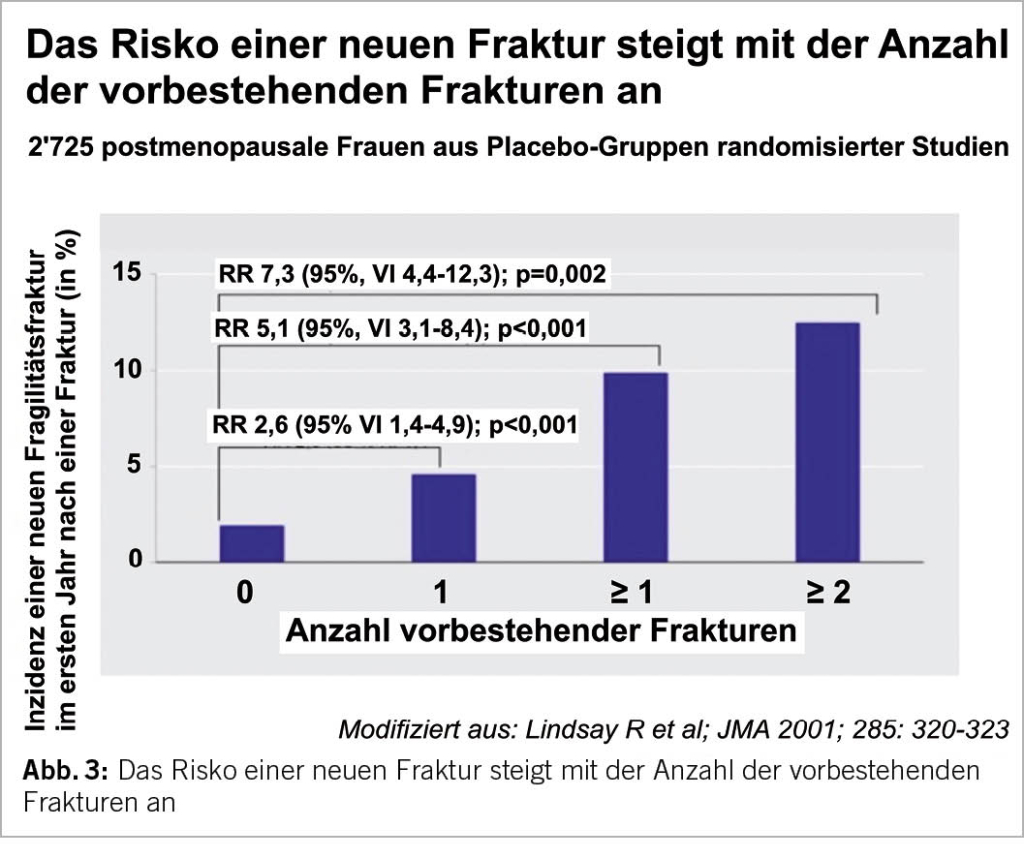
Die Verschreibung einer MHT zur primären Prävention von Fragilitätsfrakturen muss Teil einer globalen Strategie sein. Bei peri- und frühen postmenopausalen Frauen mit erhöhtem Frakturrisiko innerhalb des therapeutisch «günstigen Fensters» (<60 Jahre oder <10 Jahre von der Menopause entfernt) gehört eine MHT zu den Therapien der ersten Wahl für die Prävention und die Therapie von Fragilitätsfrakturen und eignet sich zur Prävention der ersten vertebralen Fraktur, die unbedingt vermieden werden muss (Abb. 3), da diese das Risiko für weitere Frakturen signifikant steigert. Es gibt keine arbiträre Alterslimitierung für die Fortführung einer MHT (5, 6, 13), vorausgesetzt, dass die MHT nach den Bedürfnissen und persönlichen Risikofaktoren der Patientin individualisiert ist.
Vom Beginn einer MHT nach dem Alter von 60 Jahren mit der alleinigen Indikation einer Osteoporosetherapie wird hingegen abgeraten und auf die medikamentösen Alternativen verwiesen.
Zweitabdruck aus «der informierte arzt» 03-2023
Copyright bei Aerzteverlag medinfo AG
Gartenstrasse 67
4052 Basel
martin.birkhaeuser@bluewin.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Eine MHT (inklusive Tibolon) senkt das Frakturrisiko an allen vertebralen und nicht-vertebralen Lokalisationen inklusive des Schenkelhalses signifikant um 25–40%.
◆ Im Gegensatz zu allen nicht-hormonalen Alternativen vermindert eine individualisierte MHT auch bei Frauen einer Normalpopulation ohne erhöhtes Frakturrisiko die Inzidenz aller mit einer Osteoporose im Zusammenhang stehenden Frakturen.
◆ Eine MHT senkt das Frakturrisiko nicht nur durch ihre Wirksamkeit am Knochen, sondern auch über andere Wirkungsmechanismen an der Muskulatur und an den Zwischenwirbelscheiben.
◆ Hinsichtlich Knochendichte und Frakturprävention bestehen keine Unterschiede zwischen den verschiedenen Estrogenen oder der
oralen und der transdermalen Verabreichungsform, doch besitzt transdermales Estradiol bei normaler Dosierung kein erhöhtes Thromboembolie- oder Schlaganfallrisiko.
◆ Bei gesunden peri- und postmenopausalen Frauen mit erhöhtem
Frakturrisiko unter dem Alter von 60 Jahren oder innerhalb der ersten 10 Jahre nach der Menopause darf die MHT als eine Therapie der ersten Wahl für die primäre Prävention und Behandlung Osteoporose-bezogener Frakturen an allen Skelettlokalisationen gelten. Innerhalb dieses «Window of Opportunity» überwiegt der Nutzen einer MHT die Risiken.
◆ Bei Frauen über 60 Jahren oder solchen mit einer Kontraindikation gegen MHT sind nicht-hormonale anti-resorptive Therapien wie
Bisphosphonate oder Denosumab die Therapie der ersten Wahl.
1. Quaseem A, Hicks LA, Etxeandia-Ikobaltzeta I et al. Clinical Guidelines February 2023. Pharmacologic Treatment of Primary Osteoporosis or Low Bone Mass to Prevent Fractures in Adults: A Living Clinical Guideline From the American College of Physicians. Ann Intern Med 2023 Feb;176(2):224-238. doi: 10.7326/M22-1034.
2. NAMS POSITION STATEMENT:The 2022 hormone therapy position statement of The North American Menopause Society. Menopause 29(7):767–794.
3. NAMS POSITION STATEMENT. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society Vol. 28, No. 9, pp. 973-997 DOI: 10.1097/GME.0000000000001831
4. Stute P & Birkhäuser M. Selektive Östrogenrezeptormodulatoren (SERM). Gynäkologische Endokrinologie 2015, 13:126–134 DOI 10.1007/s10304-015-0003-9
5. de Villiers TJ, Hall JE, Pinkerton JV et al. Revised Global Consensus Statement on Menopausal Hormone Therapy. CLIMACTERIC 2016 HTTP://DX.DOI.ORG/10.1080/13697137.2016.1196047.
6. Baber RJ, Panay N & Fenton A. The IMS Writing Group. IMS Recommendations on Women’s Midlife Health and Menopause Hormone Therapy. CLIMACTERIC 2016;19:2, 109-150, DOI: 10.3109/13697137.2015.1129166.
7. Compston J, Cooper A, Cooper C et al. for The National Osteoporosis Group. POSITION PAPER. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos 2017;12: 43-57.
8. Cauley JA, Robbins J, Chen Z et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Initiative randomized trial. JAMA 2003; 290:1729–1738.
9. Women’ Health Initiative Steering Committee. Effects of conjugated estrogen on postmenopausal women with hysterectomy: the Women’ Health Initiative randomized controlled trial. JAMA 2004;291:1701–1712.
10. Anderson GL, Hutchinson F, Limacher M, et al. for The Women’s Health Initiative Steering Committee. The Women’s Health Initiative Randomized Controlled Trial. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women’s Health Initiative Controlled Trial. JAMA 2004;291:1701–1712.
11. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: results from the Women’s Health Initiative randomized trial. J Bone Miner Res 2006;21:817–828.
12. Mosekilde L, Beck-Nielsen H, Sørensen OH et al. Hormonal replacement therapy reduces forearm fracture incidence in recent postmenopausal women — results of the Danish Osteoporosis Prevention Study. Maturitas 2000;36:181–193.
13. Birkhaeuser M. Healthy Bones After Menopause: What Has to Be Done? . In Pre-Menopause, Menopause and Beyond: Volume 5: Frontiers in Gynecological Endo-crinology (M. Birkhaeuser and SR Genazzani, eds), pp 165.185. International Society of Gynecological Endocrinology 2018; Springer Nature, ISBN 978-3-319-63539-2.
14. Cummings SR, Ettinger B, Delmas PD et al. The effects of tibolone in older postmenopausal women. N Engl J Med 2008;359:697–708.
15. Kloosterboer HL. Historical milestones in the development of tibolone (Livial®). Climacteric 2011;14:609–621.
16. Bagger YZ, Tanko LB, Alexandersen P et al. Two to three years of hormone replacement treatment in healthy women have long-term preventive effects on bone mass and osteoporotic fractures: the PERF study. Bone 2004;34:728–735.
17. Muscat Baron Y, Brincat M, Galea R, Calleja N. Intervertebral disc thickness in treated and untreated postmenopausal women. Hum Reprod 2005;20:3566-3370.
18. Stevenson, John. HRT and fracture prevenHon: more than just bone. Presented at the ESCEO 2021 virtual congress (abstract)
19. Birkhaeuser MH, Panay N, Archer DF et al. Updated practical recommendations for hormone replacement therapy in the peri- and postmenopause. Climacteric 2008;11:108–123.
20. Ettinger B, Genant HK, Steiger P, Madvig P. Low-dosage micronized 17 beta-estradiol prevents bone loss in postmenopausal women. Am J Obstet Gynecol 1992;166:479–488.
21. McClung MR et al (1998) Osteoporosis prevention by low-dose regimens, presented at the ASBRM, San Francisco, PDI/II/USA 1998.
22. Wasnich RD, Bagger YZ, Hosking DJ, et al. Early Postmenopausa Intervention Cohort Study Group. Changes in bone density and turn-over after alendronate or estrogen withdrawal. Menopause 2004;11: 622-630.
23. Heiss G, Wallace R, Anderson GL, et al; WHI Investigators. Health risks and benefits 3 years after stopping randomized treatment with estrogen and progestin. JAMA 2008;299:1036-1045.
24. Watts NB, Cauley JA, Jackson RD, et al. Women’s Health Initiative Investigators. No increase in fractures after stopping hormone therapy: results from the Women’s Health Initiative. J Clin Endocrinol Metab 2017;102:302-308.
25. Birkhäuser M. Menopausale Hormontherapie zur Frakturprävention. Eine Standortbestimmung. Gynäkologische Endokrinologie 2015;13:188–194.
26. Langer RD, Hodis HN, Lobo RA and M. A. Allison MA. Hormone replacement therapy – where are we now? CLIMACTERIC 2021;24(1):3–10.
27. Manson JAE, Chlebowski RT, Stefanick ML et al. Menopausal Hormone Therapy and Health Outcomes During the Intervention and Extended Poststopping Phase of the Women’s Health Initiative Randomized Trials. JAMA. 2013;310(13):1353-1368. doi:10.1001/jama.2013.278040
info@gynäkologie
- Vol. 13
- Ausgabe 3
- Juni 2023